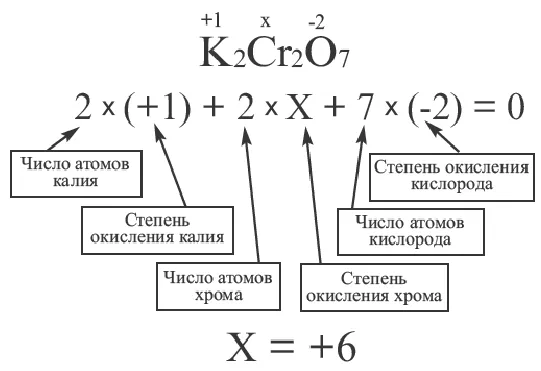
Концентрация ионов натрия в растворе хлорида натрия
Вычислите концентрацию ионов натрия (Na+) (в моль/л) в 1,17-процентном растворе хлорида натрия (NaCl), приняв плотность раствора равной 1 г/см3.
Решение задачи
Вычислим массу раствора хлорида натрия по формуле, устанавливающей связь между массой и объемом:
Получаем:
m = 1000 мл ∙ 1 г/мл = 1000 (г).
Найдем массу хлорида натрия (NaCl), содержащегося в 1 л раствора, для этого составим пропорцию:
в 100 г раствора содержится 1,17 г NaCl
в 1000 г раствора содержится г NaCl
Откуда:
Учитывая, что молярная масса хлорида натрия (NaCl) равна 58,5 г/моль, рассчитаем химическое количество хлорида натрия (NaCl), используя формулу, устанавливающую связь между химическим количеством вещества и массой:
Получаем:
Из уравнения диссоциации хлорида натрия (NaCl) (отмечу, что соли в разбавленных растворах диссоциируют полностью):
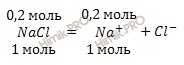
Найдем молярную концентрацию ионов натрия по формуле:
Получаем:
Ответ: концентрацию ионов натрия 0,2 моль/л.
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Содержание
- Ионная химическая связь
- Положительные и отрицательные ионы
- Степень окисления веществ
- Валентность химических элементов
- Название ионов
Ионная химическая связь
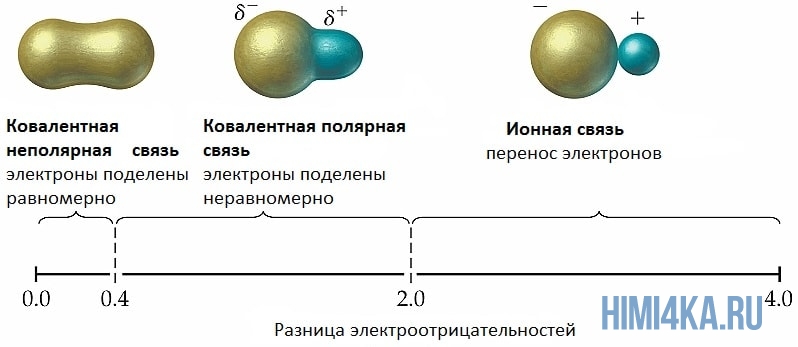
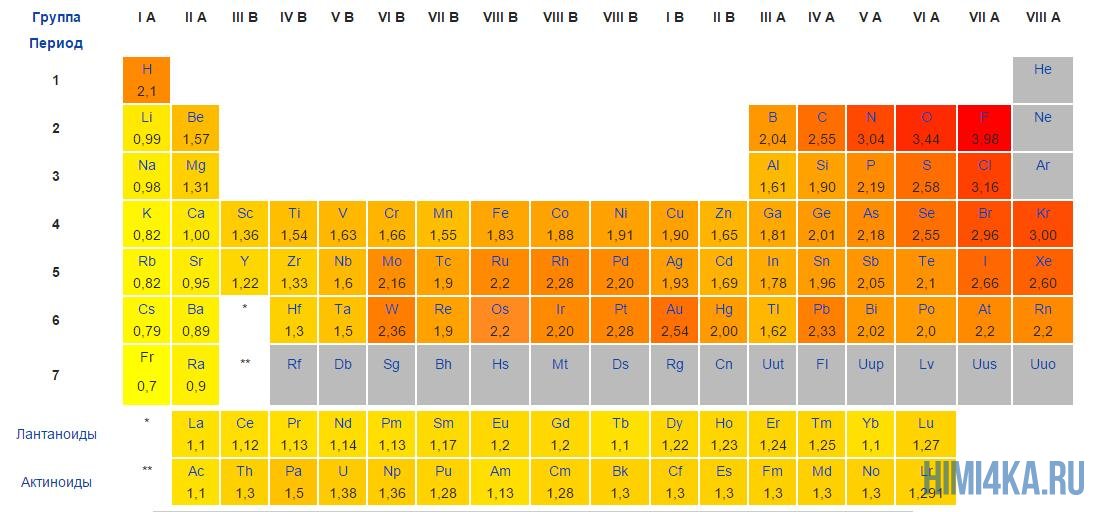
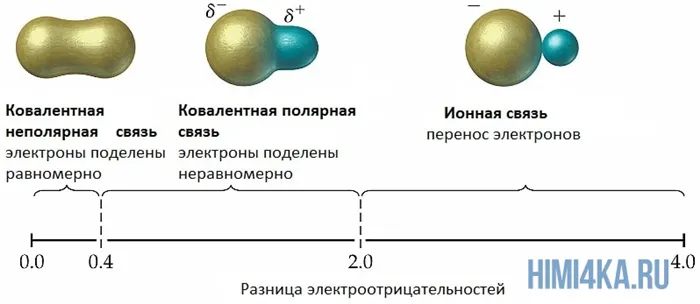
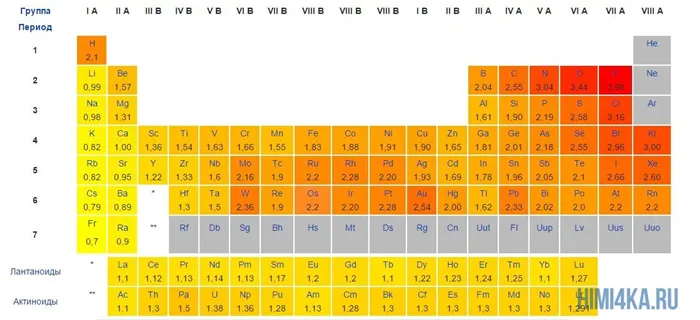
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
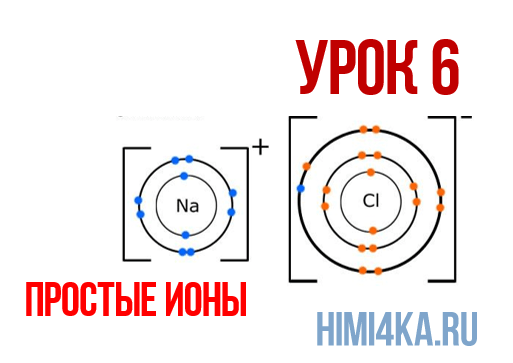
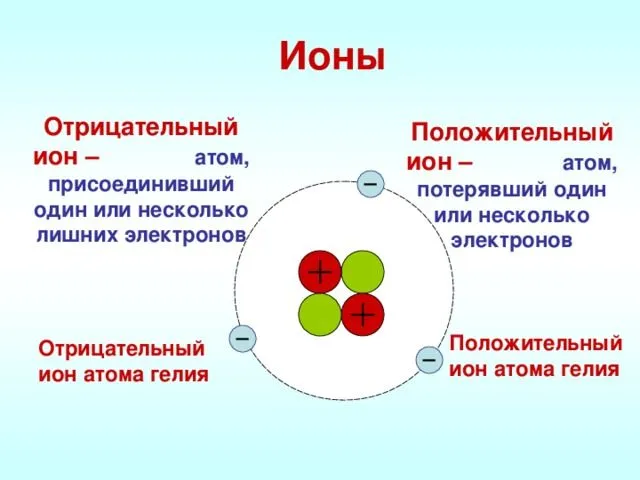
Положительные и отрицательные ионы
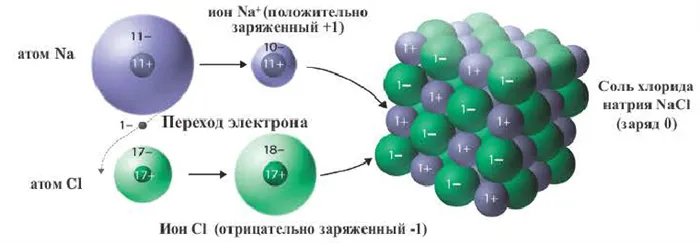
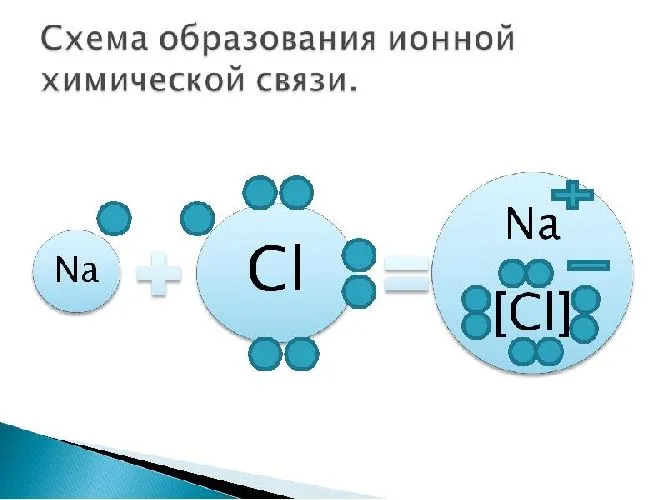
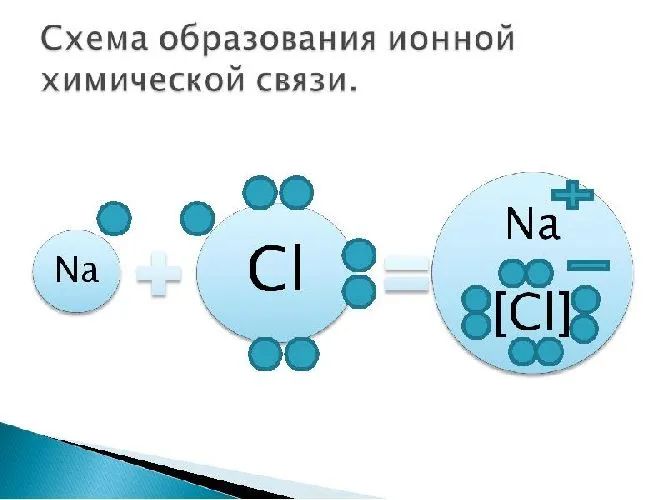
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e—), образуя положительный ион натрия Na+, а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl—. Это записывается в виде двух реакций:
- Na → Na+ + e— и ½Cl2 + e— → Cl—
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
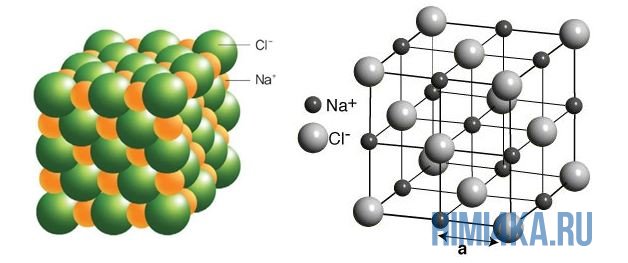
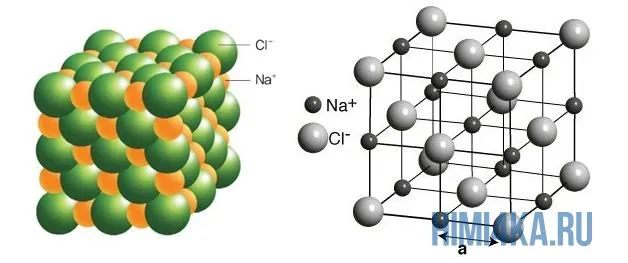
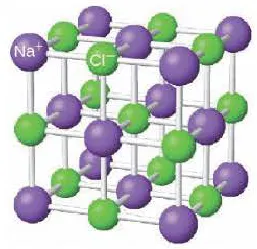
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl— окружен со всех сторон соседними положительными ионами натрия Na+; ионы натрия Na+ точно также окружены ближайшими хлорид-ионами Cl—. Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Заряд простого, одноатомного иона, например Mg2+ или F2-, называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg2+ + 2e— → Mg
- Реакция окисления: F2- → F + 2e—
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?
Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl—, имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?
Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl3+, имеет степень окисления +3.
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
| Молекулярная формула | Валентность | Степень окисления |
| H2O | H(I), O(II) | H+1, O-2 |
| CS2 | C(IV), S(II) | C+4, S-2 |
| CH4 | C(IV), H(I) | C-4, H+1 |
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe2+ железо(II) или ион двухвалентного железа
- Fe3+ железо(III) или ион трехвалентного железа
- Сu+ медь(I) или ион одновалентной меди
- Cu2+ медь (II) или ион двухвалентной меди
- Sn2+ олово(II) или двухвалентного олова
- Sn4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe3+ + e— → Fe2+. Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Схематическое изображение валентных электронов молекулы в виде линий (связи) и точек (электроны) представляет собой структуру Льюиса. Эта редакционная статья показывает глубокий взгляд на это ниже.
Структура Льюиса NaCl в основном состоит из двух элементов, т.е. металлического натрия (Na) и атома хлора (Cl). Это комбинация металла (Na) и неметалла (Cl). Это соль, состоящая всего из двух атомов. Таким образом, это двухатомная молекула. В его структуре Льюиса Na связан с Cl ионной связью.
В структуре Льюиса NaCl металлический Na отдает свой 1 электрон атому Cl для образования ионной связи. Таким образом, за счет потери электрона на атомах Na и Cl создаются положительные и отрицательные заряды. Оба этих атома Na и Cl помещены в квадратную скобку из-за присутствующих на них зарядов. Давайте кратко обсудим структуру Льюиса NaCl, ее различные характеристики и некоторые факты.
Предсказание электронов валентной оболочки молекулы в виде диаграммы с линиями, показывающими электроны, и точками, показывающими электроны, является структурой Льюиса. Подробности о нем приведены ниже.
Валентные электроны:
Подсчитайте валентные электроны структуры Льюиса NaCl, добавив валентные электроны атомов натрия и хлора. Здесь нет выбора центрального атома с наименьшей электроотрицательностью, поскольку это двухатомная молекула, содержащая только два атома.
Электроны неподеленной пары и правило октета:
Сделать связь одинарной ковалентной (σ) связью между Na и Cl, а оставшиеся валентные электроны должны перейти к атому Cl. Следовательно, из-за отдачи 1 электрона Na неподеленная пара электронов присутствует только на атоме Cl. Затем примените правило октета и проверьте, есть ли у атомов Na и Cl полные или неполные октеты.
Оценка формального заряда и формы NaCl:
Рассчитайте формальный заряд, присутствующий в структуре Льюиса NaCl, по данной формуле. Также предскажите геометрию и форму с его валентным углом и его гибридизацией.
валентные электроны NaCl
Электроны, присутствующие на самой внешней оболочке любого атома, известны как валентные электроны этого атома. Ниже приводится краткое обсуждение структуры валентного электрона Льюиса NaCl.
Структура Льюиса NaCl имеет в общей сложности восемь валентных электронов. Na имеет 1 валентный электрон, а атом Cl имеет 7 валентных электронов. И Na, и Cl принадлежат 1st А и 7th Группа в периодической таблице. Таким образом, атомы Na и Cl имеют электронную конфигурацию валентной оболочки как 3s1 (На) и 3s2, 3p5 (Кл).
Расчет для валентных электронов структуры Льюиса NaCl поясняется ниже.
- Атомы металлического натрия и хлора получают валентные электроны = 1 + 7 = 8
- Всего валентных электронов в структуре Льюиса NaCl = 08
- Разделите валентные электроны NaCl на два, чтобы узнать общее количество электронных пар на нем = 8/2 = 4.
- Поэтому в NaCl структура льюиса имеется 8 валентных электронов и 4 пары электронов.
NaCl структура Льюиса неподеленные пары
Внешние несвязывающие электроны при спаривании как 2 электрона рассматриваются как электроны неподеленной пары, доступные на любом атоме. Ниже приводится описание электронов неподеленной пары NaCl.
Четыре электрона неподеленной пары присутствуют в структуре Льюиса NaCl. Всего у него 8 валентных электронов. Из них ни один электрон не является электронами пары связи, так как он образует только ионы внутри Na и Cl (Na+Cl-). Остальные 8 электронов как бы несвязывающих электронов присутствуют на атоме Cl.
Эти 8 несвязывающих электронов представляют собой 4 неподеленные электронные пары, присутствующие в NaCl. структура льюиса. Таким образом, в структуре Льюиса NaCl присутствует 04 (EP) – 00 (I. P) = 04 (LP). (Здесь EP — электронная пара, BP — пара ионных связей, а LP — неподеленная пара)
Правило октета структуры Льюиса NaCl
Наличие восьми электронов на атоме элемента считается стабильным атомом по правилу октета. Вот подробное объяснение правила октета структуры Льюиса NaCl.
В NaCl структура льюиса только атом хлора показывает полное октет. Поскольку атом хлора содержит 8 электронов, он получает один электрон от металлического натрия. Атом натрия не подходит для применения правила октета или имеет неполный или неполный октет.
Атом хлора содержит вокруг себя 8 электронов. У него нет связывающих электронов, так как Na-Cl является ионным соединением. Итак, имеется 8 несвязывающих электронов. Таким образом, атом Cl имеет электронное облако из 8 электронов, показывающее его полный октет. Скорее металлический натрий остался с нулевыми электронами, поэтому правило октета к нему не применяется.
Формальный заряд структуры Льюиса NaCl
Формальный заряд — это заряд (положительный или отрицательный), присутствующий на любом атоме, молекуле или структура льюиса. Давайте обсудим NaCl структура льюиса формальное обвинение.
Формальный заряд NaCl структура льюиса is = (валентные электроны – несвязывающие электроны – ½ связывающих электронов)
Оценка и описание формального заряда структуры Льюиса NaCl приведены в таблице ниже.
| Атомы NaCl структуры Льюиса | Валентные электроны на Na и Cl | Несвязывающие электроны на Na и Cl | Связывание электронов на Na и Cl | Формальный заряд Na и Cl |
| Металлический натрий (Na) | 01 | 00 | 00 | ( 1 – 0 – 0 / 2 ) = +1 |
| Атом хлора (Cl) | 07 | 08 | 00 | ( 7 – 8 – 0 / 2 ) = – 1 |
Резонанс структуры Льюиса NaCl
Различные формы изомерной структуры одного и того же соединения с одинаковым атомным положением являются резонансными структурами. Ниже см. описание резонансных структур NaCl.
Структура Льюиса NaCl не имеет резонансных структур из-за отсутствия резонансных свойств. Поскольку NaCl является ионным соединением, в структуре Льюиса NaCl нет ковалентной связи или присутствуют какие-либо множественные связи. Также у него нет электронного движения, поскольку у Na нет электронов.
NaCl форма структуры Льюиса
Расположение атомов определенным образом известно как молекулярная форма или геометрия молекул. Молекулы NaCl имеют кристаллическую структуру. Давайте обсудим это.
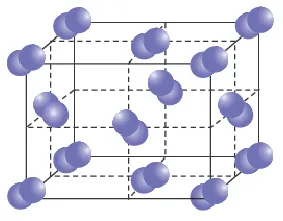
Структура Льюиса NaCl не имеет молекулярной формы. Молекула NaCl имеет гранецентрированную кубическую (ГЦК) структуру в соответствии с кристаллической теорией твердого соединения. Он показывает форму в соответствии со структурой кристаллической решетки с помощью кристаллографии.
Молекула NaCl содержит 2 иона, т.е. ионы Na+ и Cl-. 1 элементарная ячейка NaCl содержит 8 ионов, т.е. 4 иона Na+ и 4 иона Cl-. Ионы Na+ занимают объемно-центрированное и реберно-центрированное положения, а ионы Cl- занимают ГЦК и угловое положение кубической решетки. Каждый ион Na+ связан с 6 ионами Cl- и наоборот. Таким образом, он имеет координационное значение 6:6 и имеет структуру FCC.
Структурный угол Льюиса NaCl
Известно, что угол между двумя связями любой структуры или молекулярной формы является валентным углом. Ниже давайте посмотрим на NaCl структура льюиса угол связи.
Структура Льюиса NaCl показывает 900 угол связи. Поскольку кристаллическая структура соли NaCl показывает 6 ионных связей в 900 угол вокруг каждого иона Na+ и Cl- гранецентрированной кубической решетки. Так как один ион Na+ окружен 6 ионами Cl-, то ион Na+ имеет 6 связей Na-Cl.
Точно так же каждый ион Cl- окружен 6 ионами Na+, поэтому он также имеет 6 связей Na-Cl. Все эти связи Na-Cl имеют 900 угол в пределах связей C-Na-Cl и Na-Cl-Na.
гибридизация NaCl
Создание новых гибридных орбиталей путем преобразования и смешивания атомных орбиталей эквивалентной молекулы известно как гибридизация. Просто взгляните на гибридизацию NaCl.
Соль NaCl имеет sp3-гибридизацию. Потому что он имеет стерическое число 4, а молекулы, содержащие стерическое число 4, подвергаются sp3-гибридизации. 1’s’-орбиталь металлического Na перекрывается с тремя p-орбиталями атома Cl, образуя новые sp3-гибридные орбитали молекул NaCl. Итак, NaCl находится в состоянии sp3-гибридизации.
NaCl это твердое вещество?
Соединения, имеющие определенную форму и расположение атомов, а также массу и объем, являются твердыми соединениями. Давайте посмотрим на твердую природу NaCl.
NaCl представляет собой твердое кристаллическое соединение. Каждая элементарная ячейка кристалла NaCl имеет определенную форму и ионную связь в своей структуре. NaCl имеет гранецентрированную кубическую (ГЦК) структуру. В этой структуре все ионы Na+ и Cl- плотно упакованы друг с другом в определенном порядке.
Почему NaCl является твердым?
Хлорид натрия (NaCl) играет важную роль, так как это обычная соль. Ниже кратко объясняется, почему NaCl является твердым.
Ионные соединения, такие как NaCl, имеют твердую природу. Благодаря наличию электростатической силы притяжения образует прочную связь внутри ионов Na+ и Cl-. Соединение NaCl имеет два противоположно заряженных иона, т.е. ионы Na+ и Cl-. Они образуют ионные связи друг с другом, когда собираются вместе.
Эти ионные связи NaCl очень прочны и обладают высокой силой притяжения из-за присутствия положительных ионов Na+ и отрицательных ионов Cl-. Таким образом, эти ионы Na+ и Cl- с противоположным зарядом плотно упаковываются друг с другом и создают структуру кристаллической решетки NaCl, которую довольно трудно разрушить из-за ее твердости.
Как NaCl является твердым?
Сильная ионная связь является основным признаком твердой природы NaCl. Посмотрите ниже, как это.
Соединение NaCl может образовывать трехмерную структуру с противоположно заряженными ионами Na+ и Cl-. Эти ионы могут образовывать повторяющуюся структуру каждой отдельной элементарной ячейки в структуре FCC NaCl. Каждая из этих элементарных ячеек NaCl плотно скреплена повторяющимся образом, образуя прочную связь.
Растворяется ли NaCl в воде?
Способность вещества растворяться в растворителе при большом его количестве при заданной температуре называется растворимостью. Вот краткий обзор растворимости NaCl в воде.
NaCl полностью растворим в воде. NaCl представляет собой соль, имеющую противоположно заряженные ионы Na+ и Cl-, связанные друг с другом. Вода в основном растворяла все соли. NaCl при добавлении в воду диссоциирует в виде ионов в воде и, таким образом, становится полностью растворимым в воде.
Почему NaCl растворяется в воде?
Соли, такие как NaCl, будучи полярными, легко растворяются в полярных растворителях, таких как вода.
NaCl растворим в воде, потому что при добавлении NaCl в воду он разделяется в виде ионов. Здесь образование ионов Na+ и Cl- путем диссоциации. Эти ионы соли NaCl присоединяются к противоположным зарядам молекул воды.
Таким образом, ион Na+ притягивается к ОН-ионам молекулы воды, образуя основание NaOH. Точно так же ионы Cl- NaCl притягиваются к положительно заряженным ионам H+ молекул воды, образуя HCl, которая является кислотой. Следовательно, по этим причинам NaCl становится растворимым в воде.
Является ли NaCl молекулярным?
Молекулярные соединения состоят из различных небольших молекул, связанных друг с другом в своей структуре. Давайте посмотрим, является ли NaCl молекулярным или нет.
NaCl является ионным соединением, а не молекулярным. NaCl может легко образовывать ионы, поэтому это ионное соединение. В структуре NaCl не образуются ковалентные связи. Даже в его формуле нет никакого представления отдельных молекул как однородных молекулярных соединений.
Почему NaCl является ионным?
Ионные соединения содержат ионы с противоположными зарядами и не имеют в своей структуре сильных сигма-связей.
Соль NaCl имеет ионную природу, поскольку состоит из противоположно заряженных ионов Na+ и ионов Cl-. Эти положительные и отрицательные заряды образуются за счет потери и приобретения 1 электрона атомами Na и Cl. Эти ионы удерживаются друг с другом электростатической силой притяжения, образуя прочную ионную связь.
NaCl полярен или неполярен?
Полярные соединения — это те, которые имеют два полюса или электрически заряженные диполи и противоположные для неполярных соединений. Давайте кратко рассмотрим полярность NaCl.
NaCl является полярным соединением, потому что они ионные. Он имеет высокое значение разницы электроотрицательности 2.23. между атомами Na и Cl. Таким образом, электронное облако генерируется на атоме Cl. Следовательно, на Na и Cl образуются положительные и отрицательные заряды. Ионные соединения, такие как NaCl, всегда полярны.
NaCl — это кислота или основание?
Кислота — это вид, который отдает протон или ион водорода. Основание — это вид, который принимает протон или ионы водорода. Ниже обсуждается кислотно-основная природа NaCl.
NaCl не является кислотным или основным соединением, потому что это соль и нейтральная природа. Он имеет значение pH 7, что показывает его нейтральный характер. NaCl получают реакцией нейтрализации между сильной кислотой HCl и сильным основанием NaOH. Он дает H2O и NaCl. Таким образом, соль образуется из сильной кислоты, а основание нейтрально.
Является ли NaCl электролитом?
Электролиты — это вещества, которые ионизируются или диссоциируют в воду и могут проводить электричество. Давайте обсудим, является ли NaCl электролитом или нет.
NaCl является электролитом. Потому что он может полностью диссоциировать при добавлении в воду. NaCl представляет собой комбинацию металла (Na) и неметалла (Cl). Так, при добавлении NaCl в воду она полностью диссоциирует на ионы Na+ и Cl- и может проводить электричество.
NaCl это соль?
Соли – это соединения, образующиеся в результате реакции кислотных и основных соединений. Здесь мы обсуждаем, является ли NaCl солью или нет.
NaCl это соль. Потому что он образуется из-за реакции между соляной кислотой (HCl), которая является сильной кислотой, и гидроксидом натрия (NaOH), который является сильным основанием. Эта реакция представляет собой реакцию нейтрализации кислоты и основания, которая обычно дает соли. NaCl считается поваренной солью.
Вывод:
NaCl (хлорид натрия) представляет собой ионное соединение. Он имеет 8 валентных электронов и 8 неподеленных пар электронов. Он имеет +1 формальный заряд на Na из-за потери электрона и -1 заряд на атоме Cl. Это полярное кристаллическое твердое вещество, электролитическое, нейтральное и солевое по своей природе. Он имеет гранецентрированную кубическую структуру с 900 валентный угол и sp3-гибридизация.
Типичным веществом с ионной связью является натрий NaCl или поваренная соль. Его кристаллы точно соответствуют всем свойствам.
Ионная связь в химии — виды, типы, формулы и определения с примерами
Ионы образуются в результате снабжения или связывания электронов атомами. Атомы, заряженные валентными электронами, становятся положительно заряженными ионами, а атомы, принимающие электроны, становятся отрицательно заряженными ионами. Ионы — это заряженные частицы. Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы — анионами. Катионы состоят в основном из металлов и ионов аммония. Сами неметаллы не образуют катионов (кроме H + ). Из уроков физики видно, что положительно и отрицательно заряженные ионы притягиваются друг к другу. Поэтому между положительно и отрицательно заряженными ионами существует взаимное притяжение.
Химические связи, образующиеся между ионами в результате электростатического притяжения, называются ионными связями. Полученные соединения называются ионными или гетерополярными соединениями. Ионные связи образуются между металлами и неметаллами, т.е. между атомами элементов с радикально различной электроотрицательностью. Самые прочные ионные связи возникают в кислородсодержащих и бескислородных солях кислот (например, между металлами (щелочными и щелочноземельными) и галогенами) и оснований. Таким образом, молекула хлорида натрия состоит из ионов натрия (Na+) и хлорид-ионов (Cl).
Свойства ионной связи
Ионная связь имеет несколько характерных свойств.
- В соединениях с ионной связью кристаллы состоят не из молекул, а из множества ионов с противоположными зарядами.
- В обычных условиях бывают в твердом состоянии, не проводят электрический ток.
- Расплавы и водные растворы ионных соединений проводят электрический ток.
- Соединения с ионной связью хорошо растворяются в полярных растворителях, легко вступают в химические реакции.
В солях, образованных щелочными металлами с одинаковыми галогенами, по мере возрастания порядкового номера металла, ионная связь усиливается, что объясняется активностью металла (например, в ряду LiF, NaF, K.F, RbF, CsF ). В различных галогенидах одних и тех же металлов по мере возрастания порядкового номера галогена, ионная связь ослабляется (например, NaF, NaCl, NaBr, NaI). Это объясняется ослаблением окислительных способностей (неметаллических свойств) галогена. В солях аммония также между ионом аммония (NH
В ионно-связанных соединениях число ионных связей равно произведению числа валентных катионов. Соли, содержащие базовые кислородсодержащие ионы и ионы аммония, имеют как ионные, так и полярные ковалентные связи.
В основаниях число полярных ковалентных связей равно числу гидроксильных групп.
В нормальных солях число полярных ковалентных связей равно произведению прочности центральных элементов на их индекс. Однако в кислотных солях число полярных ковалентных связей равно произведению силы центрального элемента и количества H индекса кислотного остатка.
| Вещества | Число ионных связей в молекуле | Число полярных ковалентных связей в молекуле |
| 3 | 3-4=12 | |
 |
2- 3=6 | 3-6=18 |
Если в соединениях разница электроотрицательностей элементов больше 1,7, то это соединение с ионной связью, а если меньше 1,7, с ковалентной связью.
Металлическая связь
Химическая связь, образующаяся между положительно заряженным ионом металла и относительно свободным электроном в кристаллической решетке, называется металлической связью. Атомы металлов легко отдают свои валентные электроны и превращаются в положительно заряженные ионы. Свободные электроны, удаленные от атома, перемещаются между катионами металла, образуя металлические связи, и эти электроны, по-видимому, связывают катионы в металлической решетке.
Металлические связи обладают несколькими характерными свойствами.
- При образовании металлической связи валентные электроны относятся не к двум атомам, а ко всему кристаллу.
- Высокая электро- и теплопроводность металлов, их плавление при высокой температуре и способность отражать свет объясняются металлической связью.
- Металлическая связь характерна для металлов и их расплавов.
По определению, ионные химические связи — это соединения ионов с разными зарядами (положительным и отрицательным). Это особый случай ковалентной связи, т.е. экстремальной поляризации.
Ионная химическая связь
Ковалентные полярные химические связи, в которых электронные пары неравномерно распределены между атомами из-за небольших различий в электроотрицательности атомов (от 0,4 до 2,0), уже были кратко рассмотрены. Для тех, кто забыл, напомним, что электроотрицательность — это способность индивида притягивать к себе электроны.
Однако, согласно электроимпульсной панели, если электроны атома отличаются более чем на два, пара электронов будет полностью находиться на наиболее электрифицированном атоме, что приведет к образованию ионно-химической связи. Ионно-химические связи обычно образуются только между металлами (потому что внешние электроны легко теряются) и неметаллами (из-за высоких электронов).
Положительные и отрицательные ионы
Хорошим примером ионно-химической связи является обычная поваренная соль NaCl, имеющаяся на всех кухнях. Отдельный натрий (и вообще все металлы) имеет низкую плотность электронов, в то время как атомы хлора имеют очень высокую плотность электронов, т.е. высокоэлектронные.
Поэтому при образовании молекулы NaCl каждый индивид NA теряет электрон (E-) и образует положительный ион натрия Na+; наоборот, все приобретают этот потерянный электрон натрия и отрицательный хлор Cl -Cl -Cl -Cl -. Это регистрируется как две реакции.
Запись ½ кл.2 Это было необходимо потому, что газ хлор в природе состоит из двухатомных молекул, а не из отдельных индивидуумов хлора.
На диаграмме выше показана кристаллическая решетка NaCl. Здесь каждый клонированный ион хлора окружен со всех сторон соседними положительными ионами натрия, а ионы натрия Na+ окружены соседними ионами хлора Cl -Cl-. Этот ионный макет очень стабилен.
Положительно заряженные ионы называются катионами. В основном они содержат металлы, так как они в основном легко отдают от одного до трех электронов. Примерами катионов являются:.
Анионы являются неметаллами, поскольку они охотно присоединяют к себе электроны и превращаются в отрицательно заряженные ионы. Примеры анионов:.
Степень окисления веществ
Простые однопесчаные ионные нагрузки, такие как Mg 2+ или F 2-, называются состояниями окисления. Состояние окисления — это количество электронов, добавленных (повышено) или удаленных (окислено) из иона, возвращая его в нейтральное состояние.
Процесс добавления электронов к человеку, или просто их смещение к этому человеку, называется реактивной реакцией, а удаление электронов от человека, или их полное удаление, называется окислительной реакцией. Это отличный лист с простыми ситуациями ионного окисления.
Пример 12.Окисление или восстановление хлора с образованием ионов хлора? В какой степени окисления находится этот ион? Решение: каждый хлор должен иметь прикрепленный к нему электрон, чтобы образовать ион хлора, поэтому хлор прослеживается. Ион хлора, Cl-, имеет степень окисления -1.
Пример 13.Окисляются ли металлы или убывают при образовании ионов? В какой степени окисления находится ион алюминия? РЕШЕНИЕ: При образовании ионов металлов они окисляются, поскольку с атомов металла удаляются электроны. Степень окисления иона алюминия, Al 3+, равна +3.
Дополнительным способом проверки правильности результатов является оценка физических свойств вещества. Если температура кипения или плавления высока, а электричество нагнетается, то связь, скорее всего, ионная.
Характеристика ионной связи
Химические взаимодействия, возникающие в результате притяжения ионов с разными зарядами, известны как ионные взаимодействия. Это происходит, когда существует значительная разница в электроотрицательности (т.е. способности притягивать электроны) связанных атомов, и электронная пара передается более электроотрицательному элементу. Этот перенос электронов от одного атома к другому приводит к образованию заряженных частиц (ионов). Между ними возникает притяжение.
Типичные металлы имеют самую низкую электроотрицательность, а типичные неметаллы — самую высокую. Поэтому ионы образуются в результате взаимодействия между типичными металлами и типичными неметаллами.
Атомы металла становятся положительно заряженными ионами (катионами), отдавая внешние электронные уровни, в то время как неметаллы получают электроны и становятся отрицательно заряженными ионами (анионами).
Атом переходит в более стабильное энергетическое состояние и завершает электронную конфигурацию.
Поскольку электростатические взаимодействия происходят во всех направлениях, ионы могут притягивать ионы противоположного знака во всех направлениях, так как ионные связи являются ненаправленными и ненасыщенными.
Ионное расположение таково, что вокруг каждого из них находится определенное количество противоположно заряженных ионов. Термин «молекула» не имеет значения для ионных соединений.
Примеры образования
Образование связей в хлориде натрия (nacl) обусловлено переносом электронов от атома Na к атому Cl с образованием соответствующего иона.
В хлориде натрия вокруг катиона натрия находятся шесть анионов хлора, а вокруг каждого иона хлора — шесть ионов натрия.
Во время образования взаимодействий между индивидами в сульфиде бария происходит следующий процесс
Ba отдает свои два электрона сере, образуя анион серы S2- и катион бария Ba2+.
Небольшое количество электронов на внешних энергетических уровнях металла легко вытесняется из ядра. В результате такого разделения образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются в объеме металла и постоянно связываются и отрываются от атомов.
Структура металлических веществ следующая. Кристаллическая решетка является основой материала, и электроны могут свободно перемещаться между ее узлами.
Приведите следующие примеры.
Ковалентная: полярная и неполярная
Наиболее распространенным типом химического взаимодействия является ковалентная связь. Значения электроотрицательности взаимодействующих элементов существенно не различаются. В этом соединении только одна общая электронная пара смещается в сторону более электроотрицательного атома.
Ковалентные взаимодействия могут формироваться по обменному или донорно-акцепторному механизму.
Механизм обмена возникает, когда на внешнем электронном уровне каждого атома есть неспаренные электроны, а перекрытие атомных орбиталей приводит к появлению электронных пар, которые уже принадлежат обоим атомам. Если один из атомов имеет одну электронную пару на внешнем электронном уровне, а другой — свободную орбиталь, перекрывание атомных орбиталей приводит к обобщению электронных пар и взаимодействий по донорно-акцепторному механизму.
Ковалентные связи разделяются по кратности следующим образом
Дуал обеспечивает два обобщения электронной пары одновременно, триплет — три.
В соответствии с распределением электронной плотности (полярности) между связанными атомами, ковалентные связи делятся следующим образом
Неполярные связи образуются одинаковыми атомами, а полярные — атомами с разной электроотрицательностью.
Взаимодействие людей рядом с электронами называется неполярной связью. Такая общая пара электронов в молекуле не притягивается ни к одному из индивидуумов, а принадлежит обоим.
Взаимодействие между элементами с разными электронами приводит к образованию полярных связей. Общая пара электронов при таком типе взаимодействия притягивается к наиболее электризованному элементу, но не полностью к нему (т.е. образование ионов не происходит). Если вам нужна любящая, оплачиваемая фея, умеющая заниматься сексом, вы пришли по адресу. По очень доступным ценам многие работники публикуют свои интимные и эротические фотографии и реальные номера телефонов! Девушки-проститутки Пензы могут приехать к вам в гости, пригласить вас побывать в их сауне или ресторане, поразить всех отличной партнершей и закончить вечер горячим и разнообразным сексом. В результате этого смещения электронной плотности человека возникает несколько нагрузок. Наиболее электроотрицательные грузы и наименее положительные.
В индивидуальных кристаллических решетках этих веществ ковалентные связи между индивидами сильны и характеризуются тоношитой и высокой температурой плавления.
Общая характеристика ионной химической связи
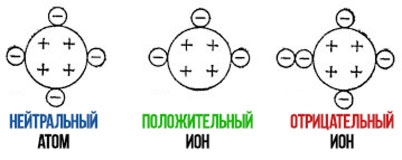
Ионы — это заряженные частицы, в которые превращаются индивиды в процессе предоставления или получения электронов. Они сильно притягиваются друг к другу, поэтому вещества с таким типом связи имеют высокие температуры кипения и плавления.
Рисунок 1.Ионы.
Ионные связи — это химические связи между противоположными ионами из-за электростатического притяжения. Разница между электронами связанных индивидов настолько велика, что при полном разделении зарядов это можно рассматривать как предельный случай ковалентной связи.
Рисунок 2. Ионная химическая связь.
Обычно говорят, что связь имеет электроотрицательность, если количество электронов в связи > 1,7.
Разница в электронах настолько велика, насколько элементы находятся друг в друге. Эта взаимосвязь характерна для металлов и неметаллов, особенно для тех, которые относятся к наиболее удаленным группам, таким как I и VII.
Примеры: поваренная соль, хлорид натрия NaCl:.
Рисунок 3. Схематическая диаграмма ионной химической связи хлорида натрия.
Ионные связи присутствуют в кристаллах, они прочные, длинные, ненасыщенные и ненаправленные. Ионная связь характерна только для сложных веществ, таких как соли, щелочи и оксиды некоторых металлов. В газообразном состоянии эти вещества существуют в виде ионных молекул.
Ионно-химические связи обычно образуются между металлами и неметаллами. Электроны вынуждены передаваться от металла к неметаллу, образуя ионы. В результате возникает электростатическое притяжение, называемое ионной связью.
На самом деле, полностью ионной связи не существует. Таким образом, ионные связи являются частично ионными и частично ковалентными. Однако сложные молекулярно-ионные связи могут рассматриваться как ионные.
Примеры образования ионной связи
Можно привести различные примеры образования ионных связей.
— Кальцию легче отдать два электрона, чем получить недостающий электрон.
— Фториду, с другой стороны, легче приобрести электрон, чем отдать семь электронов.
Найдем наименьшее общее кратное образовавшегося ионного заряда. 2. Определите количество атомов фтора, которые примут два электрона от атома кальция: 2:1 = 2. 4.
Сформулируйте тип ионно-химической связи.
Натрий относится к основной группе первой группы. Он может легко терять электроны.
-Кислород находится в главной подгруппе шестой группы. Конечно, легче получить два электрона, чем отдать шесть.
Найдем наименьшее общее кратное между образовавшимися ионными зарядами. Это 2:1 = 2. Найдите число атомов натрия, отдающих два электрона атому кислорода: 2,4.
Создайте схему образования ионной связи: 2.5.