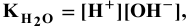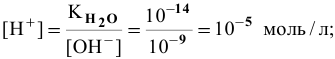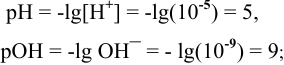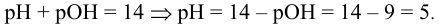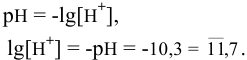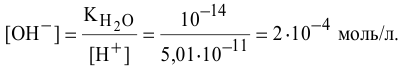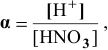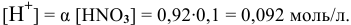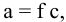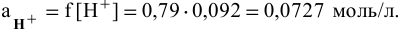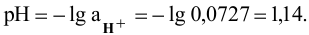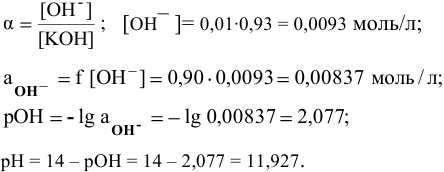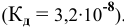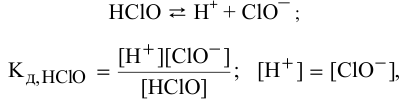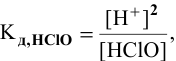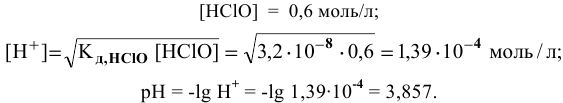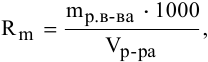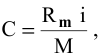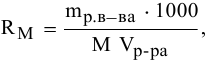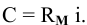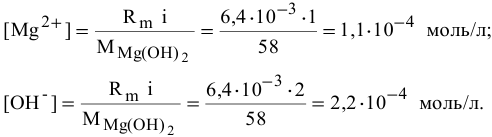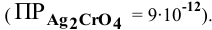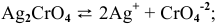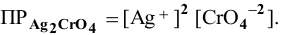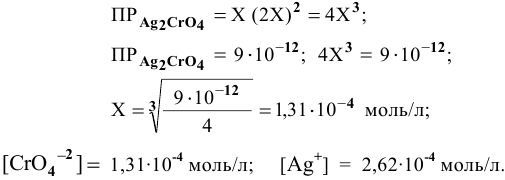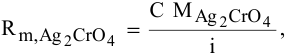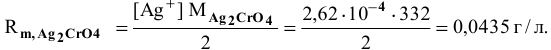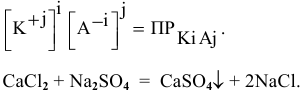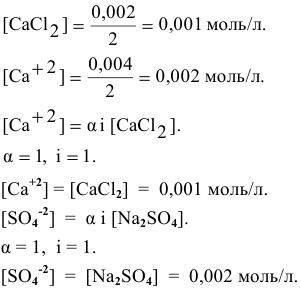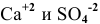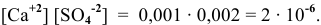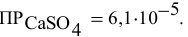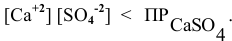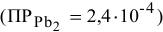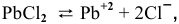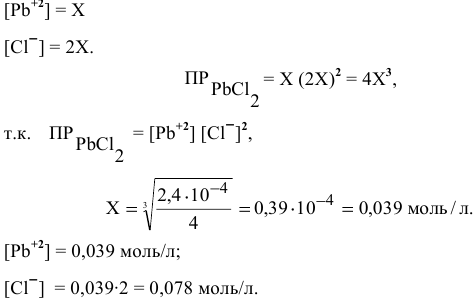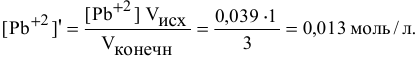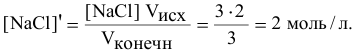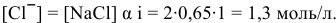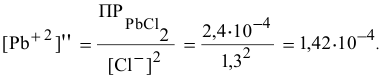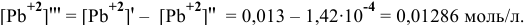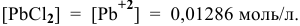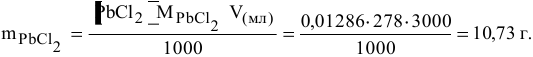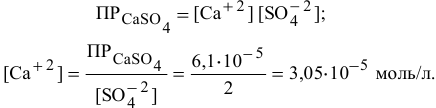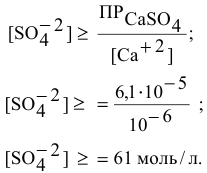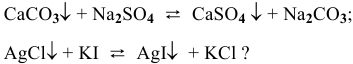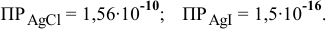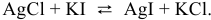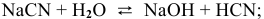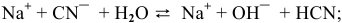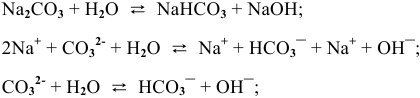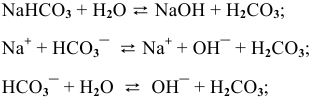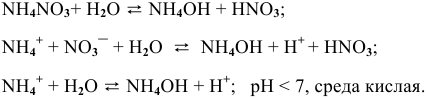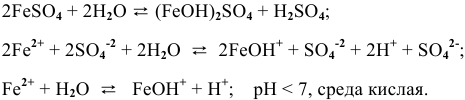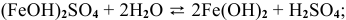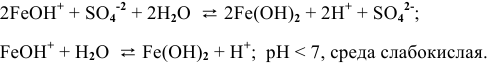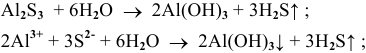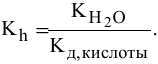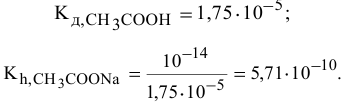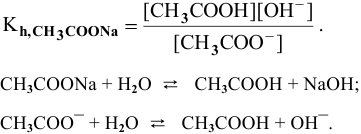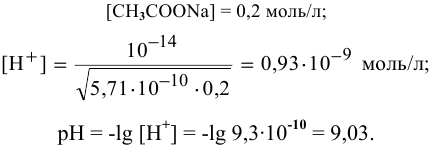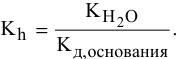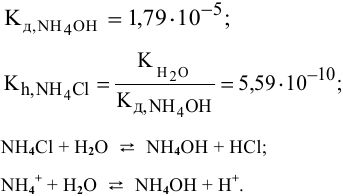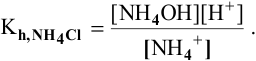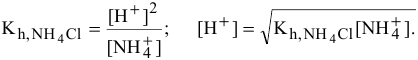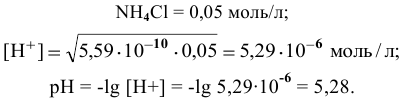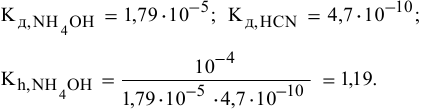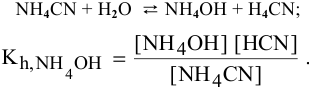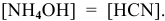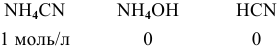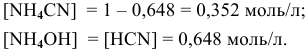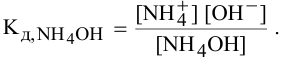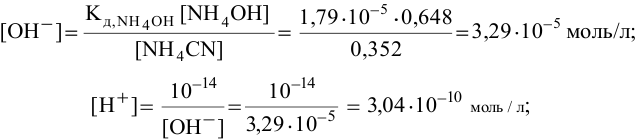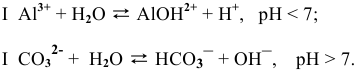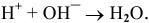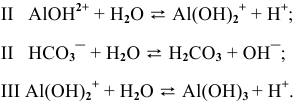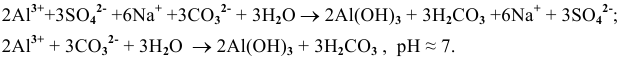Как определить число ионов
Ион – это электрически заряженная частица. Она образуется, когда атом или молекула притягивает к себе дополнительные электроны или же отдает свои. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами. Частицы образуются в растворах в ходе процесса, который называется электролитической диссоциацией. Но это может происходить и при воздействии высокой температуры, электрического тока и т.д. При диссоциации даже крохотного количества вещества образуется определенное число ионов.

Инструкция
Поставлена следующая задача: имеется 40 г поваренной соли. Ее растворили в воде. Сколько ионов при этом образовалось, если допустить, что все атомы поваренной соли подверглись диссоциации?
Напишите формулу этого вещества: NaCl. Посчитайте его молекулярную массу, сложив атомные веса натрия и хлора: 23 + 35,5 = 58,5 а.е.м. (атомных единиц массы). Поскольку молярная масса любого вещества численно равна его молекулярной массе, только выражается в другой размерности (г/моль), то 1 моль поваренной соли (хлористого натрия) будет весить приблизительно 58,5 г.
Вычислить, сколько молей хлористого натрия содержится в 40 г. Произведите деление: 40/58,5 = 0,6838 , или 0,68 моля.
Воспользуйтесь универсальным числом Авогадро, которое равно 6,022*10^23. Это количество элементарных частиц – молекул, атомов или ионов, содержащихся в одном моле любого вещества. В вашем случае до диссоциации хлористый натрий состоял из молекул. Следовательно, в 1 моле этого вещества содержится примерно 6,022*10^23 его молекул. Но у вас 0,68 моля. Произведите умножение: 0,68*6,022*10^23 = 4,095*10^23. Вот столько молекул содержится в 40 г хлористого натрия.
При диссоциации каждая молекула поваренной соли образует два иона: положительно заряженный ион натрия и отрицательно заряженный ион хлора. Поэтому, умножьте полученный результат на 2: 2*4,095*10^23 = 8,19*10^23. Вот столько ионов образовалось при диссоциации 40 г поваренной соли. Задача решена.
Полезный совет
По точно такому же алгоритму можно определить количество ионов любого вещества, принимая во внимание следующие условия:
— вещество должно быть растворимым;
— учитывайте индексы катионов и анионов. Например, при подсчете количества ионов сульфата калия – К2SO4, помните, что каждая его молекула образует три иона.
Источники:
- молекула поваренной соли
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Степень диссоциации
Классификация электролитов
Диссоциация электролитов
Константа диссоциации
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные). Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
-
-
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциатыобразуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К+, Cl— , а также возможно образование ионных пар (К+Cl— ), ионных тройников (K2Cl+, KCl2— ) и ионных квадруполей (K2Cl2, KCl32- , K3Cl2+).
- Комплексные соединения(как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4]2+, [Fe(CN)6]3+, [Cr(H2O)3Cl2]+.
-
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура
t,оС |
Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α<<1.
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H+ + Cl—
Na2SO3 = 2Na+ + SO32-
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na+ + OH—
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na+ + HSO3—
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3— → H+ + SO32-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH+ + Cl—
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH+ → Mg2+ + OH—
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3- → Fe3+ + 6CN—
Константа диссоциации
При растворении слабого электролита КА в растворе установится равновесие:
КА ↔ К+ + А—
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
Kд = [К+] · [А—] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10.
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α2·с)/(1-α) (3)
Для практических расчетов при условии, что α<<1 используется приближенное уравнение:
Кд = α2·с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
K3PO4 → 3К+ + РО43-
Следовательно, концентрации ионов К+ и РО43- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН— (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10— 5.
Решение. Уравнение диссоциации электролита:
NH3·H2О → NH4+ + OH—
Концентрации ионов: [NH4+] = αС ; [OH—] = αС , где С – исходная концентрация NH3·H2О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Поскольку α << 1, то:
Кд ≈ α 2С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH3·H2О. Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √(Кд / С) = √(1,76× 10— 5 / 0,03) = 0,024 или 2,4 %
[OH—] = αС, откуда [OH— ] = 2,4·10— 2·0,03 = 7,2·10-4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО— + Н+.
α = [Н+] / Сисх(CH3CОOH)
откуда [Н+] = 9,4·10—2·0,002 = 1,88·10-4 М.
Так как [CH3CОO—] = [Н+] и [CH3CОOH] ≈ Сисх(CH3CОOH), то:
Kд = [Н+]2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2С.
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10— 4. Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд =α 2С , откуда получаем Сисх(HNO2) = 4,6·10— 4/(5·10— 2)2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
НСООН →Н+ + СООН—
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н+ и СООН— в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н+ | СООН— |
| ΔGT0, кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT0/RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10— 4.
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3
13.2. К слабым электролитам в водных растворах относятся:
- KAl(SO4)2
- NaNO3
- HCN
- NH4Cl
- C2H5OH
- H2SO3
- H2SO4
3. Определите концентрацию ионов NH4+ в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10— 8. Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н+ в этом растворе.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10— 5.
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10— 4.
Как составлять ионные уравнения. Задача 31 на ЕГЭ по химии
Достаточно часто школьникам и студентам приходится составлять т. н. ионные уравнения реакций. В частности, именно этой теме посвящена задача 31, предлагаемая на ЕГЭ по химии. В данной статье мы подробно обсудим алгоритм написания кратких и полных ионных уравнений, разберем много примеров разного уровня сложности.
Зачем нужны ионные уравнения
Напомню, что при растворении многих веществ в воде (и не только в воде!) происходит процесс диссоциации — вещества распадаются на ионы. Например, молекулы HCl в водной среде диссоциируют на катионы водорода (H + , точнее, H 3 O + ) и анионы хлора (Cl — ). Бромид натрия (NaBr) находится в водном растворе не в виде молекул, а в виде гидратированных ионов Na + и Br — (кстати, в твердом бромиде натрия тоже присутствуют ионы).
Записывая «обычные» (молекулярные) уравнения, мы не учитываем, что в реакцию вступают не молекулы, а ионы. Вот, например, как выглядит уравнение реакции между соляной кислотой и гидроксидом натрия:
HCl + NaOH = NaCl + H 2 O. (1)
Разумеется, эта схема не совсем верно описывает процесс. Как мы уже сказали, в водном растворе практически нет молекул HCl, а есть ионы H + и Cl — . Так же обстоят дела и с NaOH. Правильнее было бы записать следующее:
H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O. (2)
Это и есть полное ионное уравнение . Вместо «виртуальных» молекул мы видим частицы, которые реально присутствуют в растворе (катионы и анионы). Не будем пока останавливаться на вопросе, почему H 2 O мы записали в молекулярной форме. Чуть позже это будет объяснено. Как видите, нет ничего сложного: мы заменили молекулы ионами, которые образуются при их диссоциации.
Впрочем, даже полное ионное уравнение не является безупречным. Действительно, присмотритесь повнимательнее: и в левой, и в правой частях уравнения (2) присутствуют одинаковые частицы — катионы Na + и анионы Cl — . В процессе реакции эти ионы не изменяются. Зачем тогда они вообще нужны? Уберем их и получим краткое ионное уравнение:
H + + OH — = H 2 O. (3)
Как видите, все сводится к взаимодействию ионов H + и OH — c образованием воды (реакция нейтрализации).
Все, полное и краткое ионные уравнения записаны. Если бы мы решали задачу 31 на ЕГЭ по химии, то получили бы за нее максимальную оценку — 2 балла.
Итак, еще раз о терминологии:
- HCl + NaOH = NaCl + H 2 O — молекулярное уравнение («обычное» уравнения, схематично отражающее суть реакции);
- H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O — полное ионное уравнение (видны реальные частицы, находящиеся в растворе);
- H + + OH — = H 2 O — краткое ионное уравнение (мы убрали весь «мусор» — частицы, которые не участвуют в процессе).
Алгоритм написания ионных уравнений
- Составляем молекулярное уравнение реакции.
- Все частицы, диссоциирующие в растворе в ощутимой степени, записываем в виде ионов; вещества, не склонные к диссоциации, оставляем «в виде молекул».
- Убираем из двух частей уравнения т. н. ионы-наблюдатели, т. е. частицы, которые не участвуют в процессе.
- Проверяем коэффициенты и получаем окончательный ответ — краткое ионное уравнение.
Пример 1 . Составьте полное и краткое ионные уравнения, описывающие взаимодействие водных растворов хлорида бария и сульфата натрия.
Решение . Будем действовать в соответствии с предложенным алгоритмом. Составим сначала молекулярное уравнение. Хлорид бария и сульфат натрия — это две соли. Заглянем в раздел справочника «Свойства неорганических соединений». Видим, что соли могут взаимодействовать друг с другом, если в ходе реакции образуется осадок. Проверим:
BaCl 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaCl.
Таблица растворимости подсказывает нам, что BaSO 4 действительно не растворяется в воде (направленная вниз стрелка, напомню, символизирует, что данное вещество выпадает в осадок). Молекулярное уравнение готово, переходим к составлению полного ионного уравнения. Обе соли, присутствующие в левой части, записываем в ионной форме, а вот в правой части оставляем BaSO 4 в «молекулярной форме» (о причинах этого — чуть позже!) Получаем следующее:
Ba 2+ + 2Cl — + 2Na + + SO 4 2- = BaSO 4 ↓ + 2Cl — + 2Na + .
Осталось избавиться от балласта: убираем ионы-наблюдатели. В данном случае в процессе не участвуют катионы Na + и анионы Cl — . Стираем их и получаем краткое ионное уравнение:
Ba 2+ + SO 4 2- = BaSO 4 ↓.
А теперь поговорим подробнее о каждом шаге нашего алгоритма и разберем еще несколько примеров.
Как составить молекулярное уравнение реакции
Должен сразу вас разочаровать. В этом пункте не будет однозначных рецептов. Действительно, вряд ли можно рассчитывать, что я смогу разобрать здесь ВСЕ возможные уравнения реакций, которые могут встретиться вам на ЕГЭ или ОГЭ по химии.
Ваш помощник — раздел «Свойства неорганических соединений». Если вы хорошо знакомы с четырьмя базовыми классами неорганических веществ (оксиды, основания, кислоты, соли), если вам известны химические свойства этих классов и методы их получения, можете на 95% быть уверены в том, что у вас не будет проблем на экзамене с написанием молекулярных уравнений.
Оставшиеся 5% — это некоторые «специфические» реакции, которые мы не сможем перечислить. Не будем лить слез по поводу этих 5%, а вспомним лучше номенклатуру и химические свойства базовых классов неорганических веществ. Три задания для самостоятельной работы:
Упражнение 1 . Напишите молекулярные формулы следующих веществ: оксид фосфора (V), нитрат цезия, сульфат хрома (III), бромоводородная кислота, карбонат аммония, гидроксид свинца (II), фосфат стронция, кремниевая кислота. Если при выполнении задания у вас возникнут проблемы, обратитесь к разделу справочника «Названия кислот и солей».
Упражнение 2 . Дополните уравнения следующих реакций:
- KOH + H 2 SO 4 =
- H 3 PO 4 + Na 2 O=
- Ba(OH) 2 + CO 2 =
- NaOH + CuBr 2 =
- K 2 S + Hg(NO 3 ) 2 =
- Zn + FeCl 2 =
Упражнение 3 . Напишите молекулярные уравнения реакций (в водном растворе) между: а) карбонатом натрия и азотной кислотой, б) хлоридом никеля (II) и гидроксидом натрия, в) ортофосфорной кислотой и гидроксидом кальция, г) нитратом серебра и хлоридом калия, д) оксидом фосфора (V) и гидроксидом калия.
Искренне надеюсь, что у вас не возникло проблем с выполнением этих трех заданий. Если это не так, необходимо вернуться к теме «Химические свойства основных классов неорганических соединений».
Как превратить молекулярное уравнение в полное ионное уравнение
Начинается самое интересное. Мы должны понять, какие вещества следует записывать в виде ионов, а какие — оставить в «молекулярной форме». Придется запомнить следующее.
В виде ионов записывают:
- растворимые соли (подчеркиваю, только соли хорошо растворимые в воде);
- щелочи (напомню, что щелочами называют растворимые в воде основания, но не NH 4 OH);
- сильные кислоты (H 2 SO 4 , HNO 3 , HCl, HBr, HI, HClO 4 , HClO 3 , H 2 SeO 4 , . ).
Как видите, запомнить этот список совсем несложно: в него входят сильные кислоты и основания и все растворимые соли. Кстати, особо бдительным юным химикам, которых может возмутить тот факт, что сильные электролиты (нерастворимые соли) не вошли в этот перечень, могу сообщить следующее: НЕвключение нерастворимых солей в данный список вовсе не отвергает того, что они являются сильными электролитами.
Все остальные вещества должны присутствовать в ионных уравнениях в виде молекул. Тем требовательным читателям, которых не устраивает расплывчатый термин «все остальные вещества», и которые, следуя примеру героя известного фильма, требуют «огласить полный список» даю следующую информацию.
В виде молекул записывают:
- все нерастворимые соли;
- все слабые основания (включая нерастворимые гидроксиды, NH 4 OH и сходные с ним вещества);
- все слабые кислоты (H 2 СO 3 , HNO 2 , H 2 S, H 2 SiO 3 , HCN, HClO, практически все органические кислоты . );
- вообще, все слабые электролиты (включая воду. );
- оксиды (всех типов);
- все газообразные соединения (в частности, H 2 , CO 2 , SO 2 , H 2 S, CO);
- простые вещества (металлы и неметаллы);
- практически все органические соединения (исключение — растворимые в воде соли органических кислот).
Уф-ф, кажется, я ничего не забыл! Хотя проще, по-моему, все же запомнить список N 1. Из принципиально важного в списке N 2 еще раз отмечу воду.
Пример 2 . Составьте полное ионное уравнение, описывающие взаимодействие гидроксида меди (II) и соляной кислоты.
Решение . Начнем, естественно, с молекулярного уравнения. Гидроксид меди (II) — нерастворимое основание. Все нерастворимые основания реагируют с сильными кислотами с образованием соли и воды:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O.
А теперь выясняем, какие вещества записывать в виде ионов, а какие — в виде молекул. Нам помогут приведенные выше списки. Гидроксид меди (II) — нерастворимое основание (см. таблицу растворимости), слабый электролит. Нерастворимые основания записывают в молекулярной форме. HCl — сильная кислота, в растворе практически полностью диссоциирует на ионы. CuCl 2 — растворимая соль. Записываем в ионной форме. Вода — только в виде молекул! Получаем полное ионное уравнение:
Сu(OH) 2 + 2H + + 2Cl — = Cu 2+ + 2Cl — + 2H 2 O.
Пример 3 . Составьте полное ионное уравнение реакции диоксида углерода с водным раствором NaOH.
Решение . Диоксид углерода — типичный кислотный оксид, NaOH — щелочь. При взаимодействии кислотных оксидов с водными растворами щелочей образуются соль и вода. Составляем молекулярное уравнение реакции (не забывайте, кстати, о коэффициентах):
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O.
CO 2 — оксид, газообразное соединение; сохраняем молекулярную форму. NaOH — сильное основание (щелочь); записываем в виде ионов. Na 2 CO 3 — растворимая соль; пишем в виде ионов. Вода — слабый электролит, практически не диссоциирует; оставляем в молекулярной форме. Получаем следующее:
СO 2 + 2Na + + 2OH — = Na 2+ + CO 3 2- + H 2 O.
Пример 4 . Сульфид натрия в водном растворе реагирует с хлоридом цинка с образованием осадка. Составьте полное ионное уравнение данной реакции.
Решение . Сульфид натрия и хлорид цинка — это соли. При взаимодействии этих солей выпадает осадок сульфида цинка:
Na 2 S + ZnCl 2 = ZnS↓ + 2NaCl.
Я сразу запишу полное ионное уравнение, а вы самостоятельно проанализируете его:
2Na + + S 2- + Zn 2+ + 2Cl — = ZnS↓ + 2Na + + 2Cl — .
Предлагаю вам несколько заданий для самостоятельной работы и небольшой тест.
Упражнение 4 . Составьте молекулярные и полные ионные уравнения следующих реакций:
- NaOH + HNO 3 =
- H 2 SO 4 + MgO =
- Ca(NO 3 ) 2 + Na 3 PO 4 =
- CoBr 2 + Ca(OH) 2 =
Упражнение 5 . Напишите полные ионные уравнения, описывающие взаимодействие: а) оксида азота (V) с водным раствором гидроксида бария, б) раствора гидроксида цезия с иодоводородной кислотой, в) водных растворов сульфата меди и сульфида калия, г) гидроксида кальция и водного раствора нитрата железа (III).
В следующей части статьи мы научимся составлять краткие ионные уравнения и разберем большое количество примеров. Кроме того, мы обсудим специфические особенности задания 31, которое вам предстоит решать на ЕГЭ по химии.
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
ru.aclevante.com

Содержание:
Есть несколько способов определить количество ионов в элементе. Периодическая таблица обеспечивает отличную отправную точку для назначения формальных зарядов, особенно для более легких элементов — следовательно, проще в электронном виде. Можно вывести формальный заряд из пропорциональных количеств элементов в молекуле. Химические названия, такие как «свинец (IV)» или «железо (III)», также показывают возможные ионные состояния. Эксперименты с растворами и масс-спектрометрами позволяют заполнить пробелы в информации об ионных зарядах.
Определяет элемент в периодической таблице. Каждый вертикальный столбец в таблице соответствует элементам со сходными химическими свойствами. Например, все галогениды существуют в виде ионов «заряд -1». Все галогениды находятся в одной колонке с фтором (F) в верхней части. Количество ионов не соответствует строго столбцу в переходных металлах («обедненная часть») таблицы. Если ионные состояния одного из элементов известны, вероятно, но не совсем так, что другие элементы столбца также имеют такую ионизацию.
Рассчитайте степень окисления формального элемента. Например, гидроксид натрия имеет формулу NaOH. Поскольку гидроксид имеет составной заряд -1, известно, что натрий (Na) должен иметь заряд +1. Копаясь более подробно, атом кислорода в О имеет формальный заряд -2. Следовательно, водород (H) должен иметь заряд +1, чтобы дать суммарный результат -1 для OH. Формальный заряд кислорода (-2) определяется его положением столбца в периодической таблице.
Для определения баланса нагрузки используется химическое название. Например, магнетит (Fe3O4) может сначала сбить с толку. Атомы кислорода имеют заряд -2 на атом. Следовательно, О4 дает нагрузку -8. Если мы постулируем железо + 2-, результатом будет только заряд +6; требуемая нагрузка +8 не получается. Аналогично, +3 на всех утюгах дает +9. Решение дано в формальном химическом названии магнетит-оксид железа (II, III). Два атома железа (Fe) имеют заряд +3, а один — +2. В результате получается 2 * 3 + 2 = 6 + 2 = 8. 8 балансирует нагрузку -8, в результате получается нейтральное соединение. Два иона (Fe +2 и Fe +3) появляются в этом примере.
Выполните эксперимент на основе химического раствора. Предположим, вы хотите найти ионную информацию в нитрате серебра (AgNO3). Используйте воду для растворения нитрата серебра и поваренной соли (хлорид натрия, NaCl) в разных контейнерах. Комбинация двух растворов дает хлорид серебра (AgCl). Поскольку у Cl есть заряд -1, мы можем заключить, что серебро (Ag) имеет заряд +1. Следовательно, нитрат серебра должен давать «нитрат» (NO3) с суммарным зарядом -1. Этот метод иногда предпочтителен, поскольку формальные атомные заряды NO3 дают заряд -2 атомами кислорода (O) и -3 атомами азота (N) — неправильный суммарный заряд -9. Чтобы получить адекватный чистый заряд, азот имеет контринтуитивный заряд +5.
Воспользуйтесь масс-спектрометром. Масс-спектрометр явно использует значения массы и заряда (м / с) для упорядочения соединений. Электрическое поле изгибает массовые компоненты, аналогичные разным расширениям, если нагрузки различны. Величина и ориентация (положительная или отрицательная) заряда показывают, какие ионы существуют при определенных условиях и в какой пропорции.
http://studarium.ru/article/159
http://ru.aclevante.com/como-encontrar-el-numero-de-iones-en-un-elemento
Как найти символ иона
На чтение 2 мин. Просмотров 22 Опубликовано 05.06.2021
Эта решенная химическая задача демонстрирует, как определить символ иона, когда задано количество протонов и электронов.
Проблема : укажите символ иона, у которого 10 e – и 7 p + .
Решение : Обозначение e – относится к электронам и p + относится к протонам. Число протонов – это атомный номер элемента. Воспользуйтесь периодической таблицей, чтобы найти элемент с атомным номером 7. Этот элемент – азот, обозначенный символом N. Задача состоит в том, что электронов больше, чем протонов, поэтому мы знаем, что ион имеет отрицательный суммарный заряд. Определите чистый заряд, посмотрев на разницу в количестве протонов и электронов: 10-7 = на 3 электрона больше, чем протонов, или на 3 – заряд.
Ответ : N3-
Условные обозначения для написания ионов
При написании символа для иона сначала записывается одно- или двухбуквенный символ элемента, за которым следует верхний индекс. В верхнем индексе указано количество зарядов иона, за которым следует + (для положительных ионов или катионов) или – (для отрицательных ионов или анионов). Нейтральные атомы имеют нулевой заряд, поэтому верхний индекс не дается. Если заряд составляет +/- один, цифра «1» опускается. Так, например, заряд иона хлора будет записан как Cl – , а не Cl 1- .
Общие рекомендации по поиску ионов
Когда даны числа протонов и электронов, легко вычислить ионный заряд. Чаще всего вам не будут сообщать эту информацию. Вы можете использовать таблицу Менделеева, чтобы предсказать множество ионов. Первая группа (щелочные металлы) обычно имеет заряд +1; вторая группа (щелочноземельные) обычно имеют заряд +2; галогены обычно имеют заряд -1; а благородные газы обычно не образуют ионы. Металлы образуют самые разные ионы, обычно с положительным зарядом.
Водородный показатель. Произведение растворимости. Гидролиз солей
Пример 79
Каково значение pH раствора, концентрация ионов 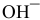
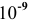
Решение:
откуда
Пример 80
Какова концентрация ионов водорода и ионов гидроксила раствора, pH которого равен 10,3?
Решение:
По таблицам логарифмов находим: 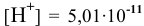
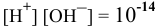
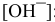
Пример 81
Определить pH растворов сильных электролитов:
а) 0,1 молярного раствора 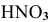
б) 0,01 молярного раствора 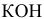
Решение:
1) Для 0,1 молярного раствора 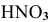
где 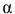
Затем определяем:
где а — активность, т.е. проявляющаяся концентрация ионов;
с — реальная концентрация;
f — коэффициент активности, для очень разбавленных растворов 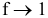
Активность ионов водорода находим по формуле
Определяем pH раствора, причем вместо реальной концентрации используем активность:
2) Для 0,01 молярного раствора КОН:
Пример 82
Определить pH 0,6 молярного раствора 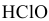
Решение:
Для слабого электролита расчет pH производится по величине константы дисоциации 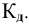
тогда
где 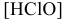
Задача № 2. Расчеты по произведению растворимости.
Пример 83
Рассчитать произведение растворимости 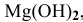
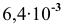
Решение:
Для выражения растворимости малорастворимых веществ чаще всего используются два способа ее выражения.
1. Растворимость в граммах на литр раствора
где 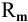
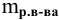
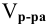
Тогда концентрация какого-либо иона растворенного вещества определяется по формуле
где М — молярная масса растворенного вещества;
i — индекс иона в формуле.
2. Растворимость в молях молекул растворенного вещества на литр раствора
где 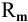
Тогда концентрация какого-либо иона растворенного вещества определяется по формуле
В настоящей задаче растворимость 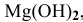
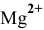
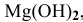
Найдем произведение растворимости 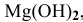
Пример 84
Определить концентрацию ионов 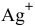
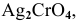
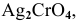
Решение:
Примем концентрацию 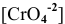
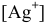
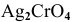
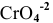
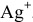
Определим растворимость соли в граммах на литр:
где С — концентрация какого-либо иона;
i — его индекс.
Пример 85
Будет ли наблюдаться осаждение сульфата кальция при смешивании одинаковых объемов 0,002 молярного раствора 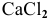
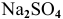
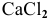
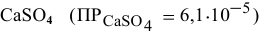
Решение:
Условие осаждения осадков следующее:
Определяем концентрации ионов 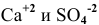
Для упрощения расчетов принимаем 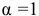
Произведение концентраций ионов
Произведение растворимости
Произведение концентраций ионов ниже, чем произведение растворимости 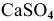
Чтобы наблюдалось осаждение должно выполняться следующее условие:
Таким образом, концентрация ионов кальция должна быть выше 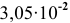
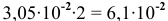
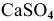
Пример 86
Что произойдет, если в 1 л насыщенного раствора 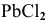
добавить 2 л 3-молярного раствора 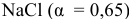
Решение:
Определяем, прежде всего, концентрацию ионов 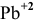
После добавления в исходный раствор 2 л 3-молярного раствора 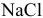
Концентрация 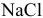
Определяем концентрацию образующихся от диссоциации молекул 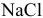
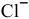
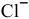
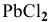
Произведение концентраций 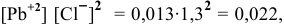
чем произведение растворимости 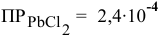
Таким образом, будет наблюдаться осаждение 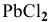
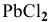
Для этого определим концентрацию ионов свинца в насыщенном растворе после осаждения 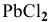
Так как концентрация ионов 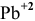
Это соответствует следующей концентрации РЬ, дающей осадок:
Определяем массу осадка:
Пример 87
Можно ли полностью осадить ионы 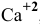
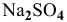
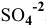
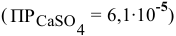
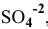
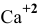
Решение:
В аналитической химии принято считать полным осаждение ионов при их концентрации ниже 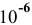
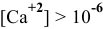
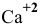
Для полного осаждения ионов 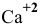
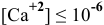
Практически такую концентрацию достичь невозможно.
Таким образом, полностью осадить ионы 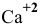
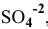
Пример 88
В каком направлении смещено равновесие следующих ионообменных реакций:
Решение:
Рассмотрим на примере последней реакции.
Равновесие ионообменных реакций с участием малорастворимых веществ смещено в сторону образования вещества с меньшим произведением растворимости.
Равновесие данной реакции смещено в сторону образования 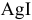
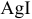
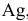
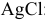
Задача 76.85
Написать молекулярные и ионные уравнения гидролиза следующих солей: 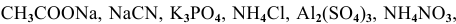
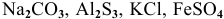
Решение:
Вначале определяется природа соли.
Соли, образованные слабым основанием и сильной кислотой и, наоборот, сильным основанием и слабой кислотой, подвергаются частичному гидролизу, в большинстве случаев преимущественно по I ступени, при этом в уравнении гидролиза ставятся две стрелки в противоположных направлениях 
Соль, образованная сильным основанием и сильной кислотой, гидролизу не подвергается.
Для написания ионного уравнения гидролиза применяют те же правила, что и при написании ионных уравнений любых ионообменных реакций: мало-диссоциируемые молекулы или ионы записывают в неизменном виде, тогда как молекулы сильных электролитов записывают в виде ионов.
1. 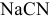
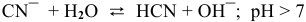
2. 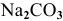
Гидролиз протекает преимущественно по I ступени:
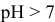
По II ступени гидролиз практически не протекает, равновесие сильно смещено влево:
pH > 7, среда слабощелочная.
3. 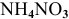
4. 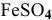
Гидролиз протекает преимущественно по I ступени:
По II ступени гидролиз практически не протекает, равновесие сильно смещено влево:
5. 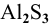
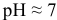
6. 
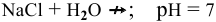
Задача 64
Рассчитать константу гидролиза и pH водных растворов следующих солей:
Решение:
1) Для соли, образованной слабой кислотой и сильным основанием,
Находим в справочнике:
Выражение константы гидролиза:
Так как 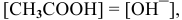
Предположив, что соль 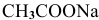
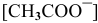
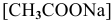
2) Для соли, образованной сильной кислотой и слабым основанием,
Находим в справочнике:
Выражение константы гидролиза имеет вид
Так как 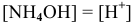
Предположив, что соль 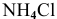
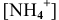
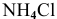
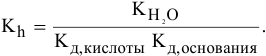
3) Для соли, образованной слабым основанием и слабой кислотой,
Находим в справочнике:
Химическое равновесие смещено в сторону продуктов гидролиза.
Характер среды слабощелочной, так как 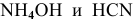
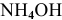
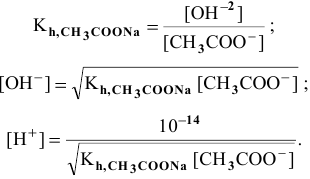
Рассчитаем концентрацию 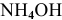
В начальный момент концентрации следующие:
В состоянии равновесия:
В состоянии равновесия концентрации следующие:
Производим расчет pH, используя выражение константы диссоциации
Предположив, что 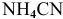
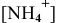
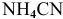
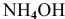
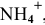
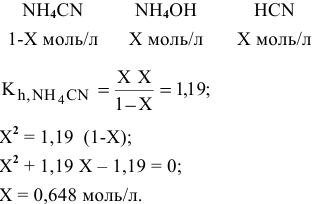
полученных при диссоциации 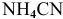
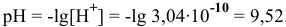
Задача 65
Написать уравнение совместного гидролиза двух солей: 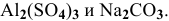
Решение:
Так как данные соли противоположного типа — 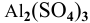
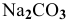
При сливании растворов происходит взаимная нейтрализация:
Это смещает оба равновесия вправо, и становятся возможными следующие стадии гидролиза:
В итоге происходит полный гидролиз:
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны: