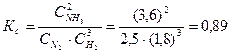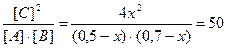На чтение 4 мин Просмотров 4.6к. Опубликовано 04.07.2019
Пример 1: Вычисление константы равновесия реакции по равновесным концентрациям реагирующих веществ и определение их исходных концентраций.
При синтезе аммиака N2 +3H2 = 2NH3 равновесие установилось при следующих концентрациях реагирующих веществ (моль/л): 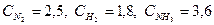
Определяем константу равновесия Кс этой реакции:
Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование 2 моль NH3, расходуется 1 моль азота, а на образование 3,6 моль аммиака потребовалось 3,6/2 = 1,8 моль азота. Учитывая равновесную концентрацию азота, находим его первоначальную концентрацию:
На образование 2 моль NH3 необходимо израсходовать 3 моль водорода, а для получения 3,6 моль аммиака требуется 3∙3,6/2 = 5,4 моль; учитывая равновесную концентрацию водорода, находим его исходную концентрацию:
Таким образом, реакция начиналась при концентрациях (моль/л): С(N2) = 4,3; С(H2) = 7,2.
Пример 2: Вычисление равновесных концентраций реагирующих веществ.
Реакция протекает по уравнению А+В = 2C. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции Кс =50.
К моменту равновесия концентрации веществ А и В понизятся, а концентрация вещества С увеличится. На каждый моль веществ А и В образуется 2 моль вещества С; поэтому, если понижение концентрации веществ А и В обозначить через x моль, то увеличение концентрации вещества С будет равно 2x моль.
Равновесные концентрации реагирующих веществ будут: [A] = (0,5-х) моль/л; [B] = (0,7-х) моль/л; [С] = 2х моль/л.
Кс =
Решая это уравнение, получаем: x1 = 0,86; x2 = 0,44. По условию задачи справедливо значение х2. Отсюда равновесные концентрации реагирующих веществ равны: [A] = (0,5-0,44) = 0,06 моль/л; [B] = (0,7-0,44) = 0,26 моль/л; [С] = 0,44∙2 = 0,88 моль/л.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8447 — 

78.85.5.224 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
В ходе протекания реакций одни вещества превращаются в другие, меняя при этом свой состав. Таким образом, «исходные концентрации» — это концентрации веществ до начала протекания химической реакции, то есть превращения их в другие вещества. Разумеется, такое преобразование сопровождается уменьшением их количества. Соответственно, снижаются и концентрации исходных веществ, вплоть до нулевых значений – если реакция протекла до конца, необратимо, а компоненты были взяты в эквивалентных количествах.
Предположим, перед вами поставлена следующая задача. Протекала некая химическая реакция, в ходе которой исходные вещества, принятые как А и Б, превращались в продукты, например, условно В и Г. То есть реакция проходила по следующей схеме: А + Б = В + Г.При концентрациях вещества Б равным 0,05 моль/л, а вещества Г — 0,02 моль/л, установилось некое химическое равновесие. Необходимо определить, какова начальная концентрация веществ А0 и Б0, если константа равновесия Кр равна показателю 0,04?
Для решения поставленной задачи примите равновесную концентрацию вещества А за величину «x», а концентрацию вещества В за «y». А также вспомните, что константа равновесия Кр исчисляется по следующей формуле: [В][Г]/[А][Б].
В ходе решения получите следующие вычисления: 0,04 = 0,02y /0,05x. То есть путем простейших вычислений вы получите, что y = 0,1x.
Теперь еще раз внимательно посмотрите на вышеуказанное уравнение химической реакции. Из него следует, что из одного моля веществ А и Б образовывалось по одному молю веществ В и Г. Исходя их этого, начальную молярную концентрацию вещества А можно представить следующим образом:А0 = x + 0,02А0 = x + y
Вспомните, что величина «y», как вы только что определили, равна некому показателю 0,1x. Преобразуя эти уравнения в дальнейшем, вы получите: x + 0,02 = 1,1 x. Из этого следует, что x = 0,2 моль/л, и тогда начальная концентрация [A0] равна 0,2 + 0,02 = 0,22 моль/л.
А как быть с веществом Б? Его начальная концентрация Б0 находится гораздо проще. Для определения к равновесной концентрации этого вещества надо прибавить равновесную концентрацию продукта-вещества Г. То есть [Б0] = 0,05 + 0,02 = 0,07 моль/л.Ответ будет таковым: [A0] = 0,22 моль/л., [Б0] = 0,07 моль/л. Поставленная задача решена.
В системе A(г)+2В(г)С(г) равновесие концентрации равны:
[A]=0,6 моль/л, [В]=1,2 моль/л, [С]=2,16 моль/л.
Найдите константу равновесия реакции и исходные концентрации веществ А и В.
Из уравнения видны, что 1 моль вещества А образует 1 моль вещества С, значит 2,16 моля образуется на 2,16 моль А.
Рассчитайть константу равновесия
При синтезе аммиака (NH3) равновесие установилось при следующих концентрациях реагирующих веществ: [N2] = 2,5 моль/л, [H2] = 1,8 моль/л, [NH3] = 3,6 моль/л. Рассчитайте константу равновесия этой реакции и исходные концентрации азота (N2) и водорода (H2).
Решение задачи
Запишем уравнение реакции синтеза аммиака (NH3):
Константа химического равновесия (K) – отношение констант скоростей прямой и обратной реакций.
Определяем константу равновесия этой реакции по формуле:
Где:
K – константа химического равновесия;
[N2], [H2], [NH3] – равновесные концентрации соответственно азота, водорода, аммиака, моль/л.
Рассчитаем константу равновесия, получаем:
K = (3,6)2 /2,5 ⋅ (1,8)3 = 0,89.
Исходные концентрации азота (N2) и водорода (H2) находим на основе уравнения реакции. На образование 2 моль аммиака (NH3) расходуется 1 моль азота (N2), а на образование 3,6 моль аммиака (NH3) потребовалось 3,6 /2 = 1,8 моль азота (N2).
Учитывая равновесную концентрацию азота (N2), находим его первоначальную концентрацию:
С (N2) = 2,5 + 1,8 = 4,3 (моль/л).
На образование 2 моль аммиака (NH3) необходимо израсходовать 3 моль водорода (H2), а для получения 3,6 моль аммиака (NH3) требуется 3 ⋅ 3,6 /2 = 5,4 моль.
Учитывая равновесную концентрацию водорода (H2), находим его первоначальную концентрацию:
С (H2) = 1,8 + 5,4 = 7,2 (моль/л).
Таким образом, реакция начиналась при концентрациях : С (N2) = 4,3 (моль/л), С (H2) = 7,2 (моль/л).
Ответ:
исходная концентрация азота (N2) равна 4,3 моль/л;
исходная концентрация водорода (H2) равна 7,2 моль/л.
Похожие задачи
Чтобы поделиться, нажимайте
Химическое равновесие. Расчёты концентраций. Часть 1
Предлагаем вам сборку заданий 23 (новое задание ЕГЭ 2022) по теме Химическое равновесие. Расчёты концентраций. Ответы вы найдёте внизу страницы.
- В реактор постоянного объёма поместили некоторое количество оксида серы (IV) и кислорода. В результате протекания обратимой реакции
2SO2 (г) + O2 (г) ↔ 2SO3 (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите равновесную концентрацию SO2 (Х) и исходную концентрацию O2 (Y).
| Реагент | SO2 | O2 | SO3 |
| Исходная концентрация (моль/л) | 1,2 | ||
| Равновесная концентрация (моль/л) | 0,6 | 0,8 |
Выберите из списка номера правильных ответов.
1) 0,2 моль/л
2) 0,4 моль/л
3) 0,6 моль/л
4) 0,8 моль/л
5) 1,0 моль/л
6) 1,2 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
- В реактор постоянного объёма поместили пары иода и водорода. В результате протекания обратимой реакции
I2 (г) + H2 (г) ↔ 2HI (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите равновесную концентрацию H2 (Х) и исходную концентрацию I2 (Y).
| Реагент | I2 | H2 | HI |
| Исходная концентрация (моль/л) | 5 | ||
| Равновесная концентрация (моль/л) | 3,5 | 1 |
Выберите из списка номера правильных ответов.
1) 0,5 моль/л
2) 1,0 моль/л
3) 2,5 моль/л
4) 3,0 моль/л
5) 4,0 моль/л
6) 4,5 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
- В реактор постоянного объёма поместили некоторое количество оксида серы (IV) и кислорода и катализатор. В результате протекания обратимой реакции
2SO2 (г) + O2 (г) ↔ 2SO3 (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите исходную концентрацию SO2 (Х) и равновесную концентрацию O2 (Y).
| Реагент | SO2 | O2 | SO3 |
| Исходная концентрация (моль/л) | 1,2 | ||
| Равновесная концентрация (моль/л) | 0,4 | 0,2 |
Выберите из списка номера правильных ответов.
1) 0,2 моль/л
2) 0,4 моль/л
3) 0,6 моль/л
4) 0,9 моль/л
5) 1,0 моль/л
6) 1,1 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
- В реактор постоянного объёма поместили некоторое количество оксида азота (II) и кислорода. В результате протекания обратимой реакции
2NO (г) + O2 (г) ↔ 2NO2 (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите равновесные концентрации NO (Х) и O2 (Y).
| Реагент | NO | O2 | NO2 |
| Исходная концентрация (моль/л) | 0,25 | 0,4 | |
| Равновесная концентрация (моль/л) | 0,1 |
Выберите из списка номера правильных ответов.
1) 0,05 моль/л
2) 0,15 моль/л
3) 0,3 моль/л
4) 0,35 моль/л
5) 0,5 моль/л
6) 0,55 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
- В реактор постоянного объёма поместили некоторое количество аммиака с катализатором и нагрели. В результате протекания обратимой реакции
2NH3 (г) ↔ 3H2 (г) + N2 (г)
в реакционной системе установилось химическое равновесие.
Используя данные, приведённые в таблице, определите исходную концентрацию аммиака (Х) и равновесную концентрацию водорода (Y).
| Реагент | NH3 | N2 | H2 |
| Исходная концентрация (моль/л) | |||
| Равновесная концентрация (моль/л) | 7 | 1,5 |
Выберите из списка номера правильных ответов.
1) 1,5 моль/л
2) 3 моль/л
3) 4,5 моль/л
4) 6 моль/л
5) 7,5 моль/л
6) 10 моль/л
Запишите выбранные номера в таблицу под соответствующими буквами.
Ответы:
- 25
- 65
- 36
- 24
- 63
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
Также:
- Посмотреть реальные, досрочные и пробные варианты ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
Задачи
Вычислите равновесную и исходные концентрации азота.
Константа равновесия реакции N2 (г) + 3 H2 (г) ↔ 2 NH3 (г) равна 0,1. Равновесные концентрации водорода и аммиака равны 0,6 и 0,18 моль/л соответственно. Вычислите равновесную и исходные концентрации азота.
Решение:
1. Константа равновесия определяется по уравнению:
Кр = [NH3]2 /[ N2]*[ H2]3 = 0,1
Отсюда, равновесная концентрация азота:
[N2] = 0,182 / 0,63 *0,1 = 1,5 моль/л
2. Из 1 моль азота образуется 2 моль аммиака, следовательно, на 0,18 моль/л аммиака было затрачено ½ концентрации азота,т.е. 0,09 моль/л азота.
Исходная концентрация азота составит:
0,09 + 1,5 = 1,59 моль/л
Ответ:
Исходная концентрация водорода X = 3,75 моль/л. Ответ: X — 4).
Исходная концентрация азота Y = 2,05 моль/л. Ответ: Y — 2).
Объяснение:
В реактор постоянного объема поместили некоторое количество водорода и азота. в результате протекания обратимой реакции в реакционной системе установилось химическое равновесие.
Используя данные, приведенные в таблице, определить исходные концентрации водорода (X) и азота (Y), если к моменту наступления равновесия прореагировало 24% водорода.
Выбрать из списка номера правильных ответов.
Дано:
прореагировало 24% H₂;
по таблице:
равновесная концентрация водорода C(H₂) = 2,85 моль/л;
равновесная концентрация азота С(N₂) = 1,75 моль/л.
Найти: исходные концентрации водорода (X), азота (Y).
Варианты ответов:
1) 1,25 моль/л; 2) 2,05 моль/л; 3) 3,50 моль/л;
4) 3,75 моль/л; 5) 4,10 моль/л; 6) 5,70 моль/л.
Решение.
3H₂(г) + N₂(г) ⇄ 2NH₃(г)
- Состояние системы реагирующих веществ, при котором скорость прямой реакции равна скорости обратной реакции называют динамическим химическим равновесием.
- Равновесные концентрации — это концентрации веществ в смеси, которые устанавливаются при наступлении состояния равновесия.
1) По условию задачи равновесная концентрация водорода равна 2,85 моль/л.
При этом прореагировало 24% водорода и в системе наступило равновесие.
Это значит, что 24% водорода связано в аммиак,
а 100% — 24% = 76% процентов водорода находится реакционной смеси в несвязанном состоянии.
То есть, в каждом литре объема смеси 2,85 моль (H₂) — это 76% исходного количества водорода.
На каждый литр:
2,85 моль (H₂) — это 76%
X моль — это 100%
моль/л
Исходная концентрация водорода X = 3,75 моль/л. Ответ 4).
2) Найдем, сколько водорода связано в аммиак.
24% — это 0,24
На каждый литр
3,75 моль · 0,24 = 0,9 моль водорода израсходовано.
3) По уравнению реакции на 3 моль водорода требуется 1 моль азота
n(H₂) : n(N₂) = 3 : 1.
Тогда, на каждый литр объема израсходовано азота (связано в аммиак)
0,9 : 3 = 0,3 моль азота.
4) Равновесная концентрация азота равна 1,75 моль/л, вступили в реакцию 0,3 моль/л азота,
следовательно исходная концентрация азота Y равна:
1,75 моль/л + 0,3 моль/л = 2,05 моль/л.
Исходная концентрация азота Y = 2,05 моль/л. Ответ 2).
5) Если требуется заполнить таблицу.
Исходная концентрация аммиака равна 0 моль/л (перед началом реакции его еще нет).
Равновесная концентрация аммиака равна 0,6 моль/л.
По уравнению реакции
n(H₂) : n(NH₃) = 3 : 2.
моль/л
или
n(N₂) : n(NH₃) = 1 : 2.
моль/л