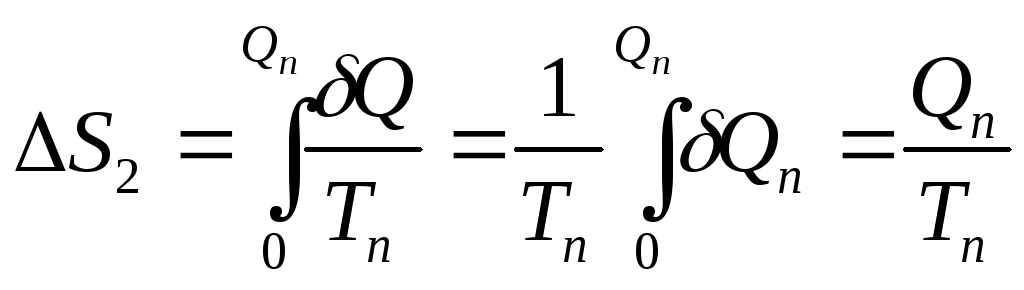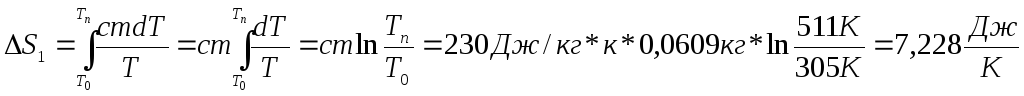Лабораторная
работа № 128
Определение изменения энтропии
твердого тела при его нагревании и
плавлении
1. Цель работы
Определение
изменения энтропии твердого тела при
его нагревании и фазовом переходе
первого раза на примере нагревания и
плавления олова.
2. Теоретическая часть
В формулировке Клаузиуса
энтропия термодинамической системы
является функцией ее состояния,
дифференциал которой в обратимом
процессе равен отношению элементарного
количества теплоты
,
полученного системой, к ее абсолютной
температуре Т:
(2.1)
Обратимым называют такой процесс, при
котором система может быть возвращена
в исходное состояние и при этом все
окружающие ее тела будут в том же
состоянии, что и в первоначальном.
Процессы, не удовлетворяющие этому
условию, называются необратимыми.
Второй закон термодинамики утверждает,
что энтропия изолированной системы не
может убывать при любых происходящих
в ней процессах. В случае обратимых
процессов она остается неизменной, а в
случае необратимых она увеличивается.
Энтропия системы является количественной
мерой ее разупорядоченности. Наибольшее
значение энтропии соответствует
наибольшей степени беспорядка системы
и такое состояние системы, предоставленной
самой себе является наиболее вероятным.
Больцман показал, что в соответствии с
определением Клаузиуса (2.1) энтропия
системы в данном состоянии может быть
представлена как
(2.2)
где k
— постоянная Больцмана,
а W
— термодинамическая вероятность (или
статистический вес) системы, равная
числу микросостояний, которыми может
быть реализовано данное макросостояние
системы.
Изменение энтропии
твердого тела при его нагревании и
плавлении можно, определить, используя
зависимость температуры тела Т
от времени / в процессе
его нагревания, которая при постоянной
мощности нагрева имеет характерный вид
ломаной линии (рис. 2.1). Участок I
графика соответствует нагреванию тела
от начальной температуры Т0
до температуры
плавления Тп
,после достижения
которой тело начинает плавиться (участок
II).
Процесс плавления относится к фазовым
переходам первого рода. Такими являются
фазовые превращения вещества,
сопровождающиеся поглощением или
выделением некоторого количества
теплоты и изменением удельного объема
вещества. При неизменном давлении
фазовые переходы первого рода происходят
при определенной постоянной температуре,
т.е. являются изотермическими.
Рис 2.1
При нагревании тела массой
т на
dT
градусов оно получает
количество теплоты
(2.3)
где с — удельная теплоемкость вещества
тела.
При этом энтропия тела изменяется на
величину
(2.4)
Полное изменение энтропии
тела при нагревании от начальной
температуры Т0
до температуры
плавления Тп
найдется интегрированием
(2.4):
(2.5)
Плавление происходит
при постоянной температуре Tп
поэтому за время плавления энтропия
тела изменится на величину
(2.6)
где (
— количество теплоты, полученное телом
в процессе плавления. Его можно определить
через удельную теплоту плавления
:
(2.7)
Таким образом, суммарное
приращение энтропии тела при его
нагревании от температуры
и последующим плавлением оказывается
равным
(2.8)
3. Экспериментальная установка
Д
определения изменения энтропии при
нагревании и плавлении
твердого тела предназначена
экспериментальная установка
ФПТ 1-11,
общий вид которой показан на рис. 3. 1 .
7
6
Рис. 3.1. Общий вид
экспериментальной установки ФПТ
1 — стойка; 2 — кронштейн;
3 — нагреватель; 4 — датчик температуры;
5 — тигель с исследуемым материалом;
6 — блок рабочего элемента; 7 — блок приборов
Рис. 3.1. Общий вид
экспериментальной установки ФПТ 1-11
Нагревание тела происходит в тигле с
помощью электрического нагревателя
3, источник питания которого размещен
в блоке приборов
7, при этом режим нагрева регулируется
ручкой «нагрев». Температура
тела измеряется цифровым термометром,
расположенным
в блоке рабочего элемента 6 под кронштейном.
Время
нагрева измеряется цифровым секундомером,
расположенным в
блоке приборов. Секундомер приводится
в действие при включении питания
блоков приборов.
4. Экспериментальная
часть
Таблица с результатами измерений:
Нагревание
|
T,0C |
32 |
45 |
64 |
81 |
98 |
115 |
128 |
140 |
150 |
160 |
168 |
175 |
182 |
187 |
193 |
198 |
202 |
206 |
209 |
212 |
215 |
|
t,мин |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
T,0C |
217 |
219 |
220 |
221 |
222 |
223 |
225 |
226 |
227 |
228 |
229 |
230 |
231 |
232 |
234 |
235 |
236 |
238 |
238 |
238 |
238 |
|
t,мин |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
39 |
40 |
41 |
Охлаждение
|
T,0C |
231 |
218 |
205 |
193 |
184 |
177 |
168 |
164 |
159 |
150 |
146 |
139 |
132 |
127 |
122 |
116 |
111 |
107 |
103 |
99 |
|
t,мин |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
T,0C |
95 |
92 |
89 |
86 |
83 |
80 |
78 |
76 |
73 |
70 |
68 |
|
t,мин |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
График. Зависимость температуры от
времени
Увеличенный участок графика в интервале
времени от 36 до 43 минут.
5. Расчеты
1)
;
;
с=230 Дж/кг*К ; m=0,0609 кг
2)
;
m=0,0609 кг
3)
6. Вывод
Провели экспериментальный
опыт, записали данные и выполнив расчеты
получили следующие значения:
Соседние файлы в предмете Физика
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Третье начало термодинамики. Расчеты изменения энтропии при различных процессах.
I.Формулировка третьего начала термодинамики.
В 1912 году М.Планк высказал постулат: При абсолютном нуле энтропия правильно образованного кристалла чистого вещества равна нулю.
Справедливость постуата планка, называемого третьим началом термодинаики, следует из эспериментальных данных о зависимости теплоемкости кристаллических веществ от температуры, а также из статистического характера второго начала термодинамики. При абсолютном нуле данное макросостояние кристалла чистого вещества, кристаллическая решетка, которого не имеет каких-либо дефектов, предельно упорядоченно и может быть реализовано единственным способм. Следователно, термодинамическая вероятность при абсолютном нуле равно I.
S = klnI (45) S = 0
На основании постулата Планка можно вычислить абсолютное значение энтропии. Зная, что dS = dQ/ T, a dQ = CdT, то dS = CdT/T, где С – молярная теплоемкость данного вещества.
Интегрируя последнее уравнение в пределах от абсолютного нуля до Т, получим ST T
0ò dS = 0ò CdT/T
T
или ST = 0ò CdT/T (46)
4.2. Абсолютные и стандартные энтропии.
Энтропию ST называют абсолютной энтропией. Она численно равна изменению энтропии при равновесном переходе 1 моля кристал-лического вещества от абсолютного нуля до данной температуры.
Вычисление абсолютной энтропии по уравнению 46 возможно лишь в том случае, если известна зависимость теплоемкости даннго вещества от температуры.
Абсолютную энтропию тела в стандартном состоянии при данном Т называют стандартной энтропией и обозначают через SoT; чаще всего Т = 298,15оК и ее обозначают через So298; So298 = oò 298 CdT/ T (47)
Зная стандартную энтропию, можно вычислить значение абсолютной энтропии данного вещества при любой температуре Т:
CdT
ST = So298 + 298ò T ¾¾¾ (48)
T
Таблицы стандартных значений энтропий играют существенную роль при расчетах констант химических реакционных равновесий и определении направления протекания химических реакций и других процессов.
Неоходимо подчеркнуть, что третье начало термодинамики дает возможность вычислить абсолютное значение энтропий различного рода веществ при данном состоянии, тогда как для других термодинамических функций (U, Н) могут быть определены только их изменения при перходе данной системы из одного состояния в другое.
4.3. Расчеты изменения энтропии в различных процессах.
Методов непосредственного измерения энтропии не существует, но можно рассчитать изменение этой функции при различного рода процессах, пользуясь математическим выражением второго начала термодинамики для обратимых процессов. Так как энтропия является функцией состояния, то ее изменения при переходе системы из начального состояния в конечное будет одним и тем же независимо от того, совершается ли этот переход обратимым или необратимым путем.
а) Расчеты изменения энтропии при изотермических процессах.
Примерами изотермических процессов могут служить такие процессы, как плавление, испарение, возгонка, превращение одной полиморфной модификации в другую. При обратимом (равновесном) проведении этих процессов давление сохранять постоянным.
При изотермическом процессе, проводимым обратимо, изменение энтропии расчитывается следующим образом: изменение энтропии при плавлении двух молей бензола если известна его удельная теплота плавления (125,52 Дж) и температура плавления (5,53оС), будет равно:
DНoпл 2 × 78,11 × 125,52
DSoпл = ¾¾¾ = ¾¾¾¾¾¾¾¾¾ = 73,5 Дж× моль –1 К-1
Тпл 5,53 + 273,15
б) Расчет изменения энтропии в неизотермических процессах.
Если процесс протекает неизотермически, то расчет изменения энтропии проводят, исходя из следующего:
DQ CdT
dS = ¾¾¾ , но dS = CdT и, следовательно, dS = ¾¾¾
T T
T2 CdT T2
Для конечных изменений DS = T1ò ¾¾ или DS = Сln ¾¾ (49)
T T1
Уравнение справедливо для тех случаев, когда теплоемкость в данном температурном интервале практически не зависит от температуры. Например, изменение энтропии при обратимом нагревани 100 г Н2О от 20о С до 50оС, считаем, что в указанном температурном интервале удельная теплоемкость воды равна 4,18 Дж × г-1к-1 и не зависит от температуры. Тогда:
323,15
DS = 4,18 ×100 × 2,303 lg ¾¾¾ = 43,6 Дж/г×к
293,15
в) Расчет изменения энтропии сложного процесса. Изменение энтропии сложного процесса, состоящего из нескольких стадий, равняется сумме изменений энтропий каждой отдельной стаии этого процесса.
DS сл. = DS1 + DS 2 + … + DS n (50)
Например изменение энтропии при обратим превращении 10,0г льда, находящегося при – 10оС, в пар при 120оС, если
С(Н2О,тв) = 2,03 Дж × г—1×к-1 DНпл.льда = 331,89 Дж× г-1
С(Н2О,ж) = 4,18 Дж × г—1×к-1
С(Н2О,г) = 1,93 Дж × г—1×к-1 DНисп. Н2О = 2253,4 Дж× г-1
Вычисляют следующим образом.
Данный процесс представим из пяти стадий:
1 Нагревание льда от – 10оС до 0оС, DS1
2. Плавление льда, DS2
3.Нагревание жидкой воды от 0оС до 100оС, DS3
4. Испарение воды, DS4
5.Нагревание пара от 100 оС до 120оС, DS5
Изменение энтропии в 1,3,5стадиях расчитывают по уравнению
T2
DS = С ln ¾¾
T1
В стадиях 2,4 по уравнению DS = DН/Т
Общее уравнение энтропии составит:Sсл = DS1 + DS 2 + DS3 + DS4 + DS 5
4.4.Расчет изменения энтропии при протекании химического процесса.
Изменение энтропии химического процесса равно алгебраической сумме стандартных энтропий участников реаций с учетом их стехиометрических коэффициентов, причем энтропия продуктов реакции берутся со знаком плюс, а энтропия исходных веществ – со знаком минус.
Для реакции, протекающей по ледующему уравнению:
аА + вВ ® mM +nN
DS = (mSom + nSoN) — (aSoA + bSoB) (51)
В общем виде: DSр-ции = SSoпр-в — SSoисх.в-в (с учетом стехиометрических коэффициентов).
Например: изменение энтропии реакции:
H2(г) + Cl2(г) = 2HCl(г)
Если Soн2(г) = 130,6 Дж × г—1×к-1
SoCl2(г) = 36,69 Дж × г—1×к-1
Soнcl(г) = 186,7 Дж × г—1×к-1
В соответствии с уравнением 51 получим, что DS = 2× 186,70 – 130,6 – 36,69 = =206,11 Дж × г—1×к-1
4.5. Энергия Гиббса.
По изменению энтропии можно судить о направлении и пределах протекания процессов только в изолированных система. В случае закрытых и открытых систем необходимо также учитывать изменение энтропии окружающей среды. Решение пследней задачи крайне сложно или невозможно. Поэтому в термодинамике для изучения открытых или закрытых систем используют другие термодинамические функции, так называемые термодинамические потенциалы, изменение которых позволяет определять направление процессов и пределы их протекания без учета изменений в окружающей среде. В частности, к термодинамическим потенциалам относится функция состояни, называемые энергией Гиббса, которую обозначают через G.
Понятие об энергии Гиббса было введено на основе объединенного уравнения первого и второго начал термодинамики. Это уравнение может быть введено следующим образом. Из первого начала термодинамики следует:
W = Q — DU; Q = W + DU (52)
Из второго начала термодинамики для обратимого процесса получаем:
Q = TDS (53)
Для необратимого процесса: Q < TDS (54)
Подставляя значение Q из уравнения 53 и уравнений 54 в 52, находим
Для обратимого процесса Wобр. = TDS + DU (55)
Для необратимого процесса Wнеобр. < TDS + DU (56)
Уравнение 55 называют объединенным уравнением первого и второго начал термодинамики для обратимы процессов. Так как внутренняя энергия и энтропия являются функциями состояния, то их изменения не зависят от того, как протекает данный процесс, обратимо или необратимо, следовательно:
TDSобр. — DUобр = T DSнеобр. — DUнеобр. и Wобр > Wнеобр.
т.е. работа, совершаемая при обратимом процессе, при условии, сто начальное и конечное состояния системы одинаковы в обоих случаях.
Имея в виду, что работа, производимая системой, при обратимом процессе является максимальной для данного изменения состояния системы, преобразуем уравнение 55:
Wmax = T(S2 – S1) — (U2 – U1)
Группируя величины с одинаковыми индексами, получим
Wmax = (U1 – TS1) — (U2 – TS2) (57)
Т.к. U u S – функции состояния, то величина (U – TS) должна быть также функцией состояния.
Если система кроме полезной работы совершает работу против силы внешнего давления (p = const), то для обратимого процесса
Wmax = W’max + p DV
Или W ‘max = W max — p DV, где W’max – максимальная полезная работа, совершаемая системой в обратимом изобарно-изотермическом процессе. Из уравнения 57 получаем для обратимого процесса:
W’max = T DS — DU — p DV
Для необратимого процесса:
W’max < T DS — DU — p DV (59)
Учитывая, что DV = V2 – V1, получим
W’max = U1 – U2 + TS2 – TS1 — pV2 + pV1
Группируя величины с одинаковыми индексами, находим:
W’max = (U1 – TS1 + pV1) — (U2 – TS2 + pV2) (60)
Величину (U – TS + pV), которая является функцией состояния, т.к. U, S, V есть функции состояния, называют энергией Гиббса и обозначают G.
Раньше эту функцию состояния называли изобарно-изотермическим потенциалом.
Таким образом, G = U – TS + pV (61)
Имея ввиду последнее уравнение, можно записать:
W’max = G1 – G2, или, т.к. DG = G2 – G1
W’max = — DG (62)
Из уравнения 62 следует, что максимальная полезная работа, совершаемая системой в обратимом изобарно-изотермическом процессе, равна уменьшению энергии Гиббса.
Для необратимого процесса, путем аналогичного преобразования справедливо:
W’необр. < —DG (63)
Т.е. Уменьшение энергии Гиббса в необратимом процессе больше производимой системой работы (полезной).
Зная, что U + pV = H, уравнение 61 запишем следующим образом
G = H – TS (64)
Или DG =DH — TDS (65)
Последнее уравнение может быть представлено следующим образом: DG = DU + pDV — TDS или
DU = DG — pDV + TDS
Из чего следует, что изменение внутренней энергии системы можно представить как сумму трех слагаемых:
DG – часть внутренней энергии, способная при изобарно-изотермических условиях превращаться в работу.
pDV – часть внутренней энергии, затрачиваемая системой на совершение работы против сил внешнего давления,
TDS – “связанная энергия” , представыляющая собой часть внутренней энергии, которая в указанных условиях не может быть превращена в работу.
“Связанная энергия” тем больше, чем бльше энтропия данной системы. Таким образом, энтропию можно рассматривать как меру “связанной энергии”.
Определим изменение энергии Гиббса при протекании обратимого и необратимого процессов. Для этого продифференцируем уравнение 64, помня при этом, что дифференциал произведения двух функций равен сумме производных, взятых в предположении, что в данных условиях изменяется только одна из функций, а другая остается постоянной. В результате дифференцирования получим:
dG = dH — TDS — SDT (66)
Из соотношения 55,56 следует:
TDS ³ dU + dW
Где ззнак равенства относится к обратимым, а знак неравенства — к необратимым процессам.
Предполагая, что никакой работы, кроме работы расширения, не производится получаем:
TdS ³ dU +pdV
Подставляя найденое значение TdS в уравнение 66 и зная, что Н = U + pV, следовательно dH = dU + pdV + Vdp, получаем dG £ -SdT + Vdp (67)
Из уравнения 67 следует, что для обратимых процессов при постоянных р и Т и при условии, что из всех видов работы может производиться толко работа расширения dG = 0, т.к. dT и dp = 0 (68).
Поскольку обратимые процессы являются равновесными, т.е. такими, когда система в каждый момент времени находится в состоянии равновесия, то уравнение 68 является критерием равновесия.
Протекание необратимых процессов, к которым относятся все самопроизвольные процессы, сопровождается уменьшением энергии Гиббса (р и Т постоянны), т.к. при этом dG < 0 (69)
Поэтому неравенство 69 является критерием направления самопроизвольных поцессов.
Из неравенства 69 следует, что переход системы из неравновесного состояния в равновесное G уменьшается и в момент равновесия достигает минимального значения
Gравн. = Gmin (70)
G=H –
TS,
(198)
где Н –
энтальпия;
S – энтропия системы.
Если система может
находиться в нескольких состояниях, то устойчивым будет то из них, для которого
свободная энергия минимальна. Таким образом, фазовое превращение происходит,
если оно сопровождается уменьшением свободной энергии системы
ΔG=ΔH—TΔS<0.
(199)
Изменение энтальпии ΔH
системы в результате превращения равно тепловому эффекту с обратным знаком:
если превращение идет с выделением тепла, то ΔH<0, и
наоборот. Так, при затвердевании жидкости всегда выделяется так называемая
скрытая теплота плавления λ. В этом случае величина ΔH
численно равна λ и отрицательна. Напротив, при плавлении ΔH>0
тепло поглощается. Аллотропические превращения также сопровождаются тепловыми
эффектами. Например, превращение белого олова (тетрагональная решетка) в серое
(решетка алмаза) при 130 С сопровождается выделением теплоты ΔH=-2,1
кдж/г-атом (-500 кал/г-атом).
В свою очередь
ΔG=ΔU+PΔV, (200)
где ΔU –
изменение внутренней энергии системы.
Для конденсированных систем ΔHΔU.
Изменение внутренней энергии системы включает изменение кинетической и
потенциальной энергии. Так, отрицательное значение ΔH при
переходе белого олова в серое, очевидно, означает, что внутренняя энергия
последнего ниже и, следовательно, атомы в нем связаны прочнее. Выяснение причин
этого требует рассмотрения большого числа различных факторов.
Второй
член в правой части выражения (199) – это изменение энтропии системы. В
термодинамике энтропия вводится формально через «приведенное тепло»:
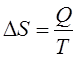
где – тепло, полученное системой при обратимом изменении ее
состояния).
Для
изотермического превращения изменение энтропии равно изменению теплосодержания ΔH, деленному на температуру:
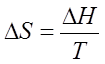
(202)
Так,
изменение энтропии при плавлении
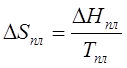
(203)
Поскольку
при плавлении тепло поглощается, >0, энтропия
системы растет, >0. Напротив, при кристаллизации
энтропия уменьшается <0 (на ту же
величину, на какую возрастает при плавлении).
Согласно
второму принципу термодинамики, самопроизвольный процесс в изолированной
системе происходит, если энтропия возрастает. Таким образом, в этой системе
кристаллизация никогда не могла бы произойти, грубо говоря, потому, что некуда
было бы отводить тепло. Однако в реальных условиях плавящееся тело не является
изолированным (тепло можно отводить и подводить) и истинным критерием процесса
является не энтропия, а свободная энергия. Процесс происходит, если < 0. При
изменение
свободной энергии
. (203)
Поскольку
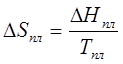
=
0. Соответственно и =0.
Таким образом, при жидкая
и твердая фазы находятся в равновесии. Однако достаточно небольшого
переохлаждения, чтобы кристаллизация произошла (если не учитывать необходимости
создания зародыша критического размера). Действительно, если , а
, то
можно считать, что и
практически
не меняются, поэтому
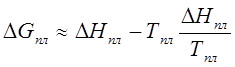
> 0). (204)
При кристаллизации
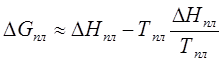
0, , (205)
но <0 (
),
т. е. устойчивым становится твердое состояние. Поскольку его свободная энергия
меньше.
Аналогично можно
рассчитать при аллотропическом
превращении. Превращение α-железа (о.ц.к.) в γ-железо (г.ц.к.) при 910 0С
сопровождается поглощением тепла 0,9 кдж/г-атом (215 кал/г-атом).
Следовательно, молярная энтропия γ-железа больше, чем α-железа на
величину 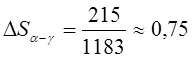
меньше чем белого 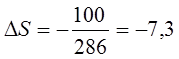
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание — внизу страницы.
Тема: Определить изменение энтропии при плавлении (Прочитано 11878 раз)
0 Пользователей и 1 Гость просматривают эту тему.
Определить изменение энтропии при плавлении m = 1 кг льда, находящегося при температуре нуль градусов Цельсия, и последующем нагревании воды до температуры 57 градусов Цельсия. Удельная теплота плавления льда – λ = 3,35∙105 Дж/кг, удельная теплоёмкость воды –с = 4190 Дж/∙кг. Сделать рисунок.
« Последнее редактирование: 03 Марта 2015, 20:54 от Сергей »
Записан
Решение.
Общее изменение энтропии складывается из изменения энтропии при плавления льда и изменение энтропии при нагревании воды.
∆S = ∆S1 + ∆S2 (1).
Плавление льда происходит при изотермическом процессе.
[ Delta {{S}_{1}}=int{frac{d{{Q}_{n}}}{{{T}_{1}}}}=frac{{{Q}_{n}}}{{{T}_{1}}}=frac{lambda cdot m}{{{T}_{1}}} (2). ]
Определим изменение энтропии при нагревании воды.
[ Delta {{S}_{2}}=int{frac{d{{Q}_{H}}}{T}}=intlimits_{{{T}_{1}}}^{{{T}_{2}}}{frac{ccdot mcdot dT}{T}}=ccdot mcdot ln frac{{{T}_{2}}}{{{T}_{1}}} (3). ]
Подставим (3) в (2) определим изменение энтропии.
[ Delta S=frac{lambda cdot m}{{{T}_{1}}}+ccdot mcdot ln frac{{{T}_{2}}}{{{T}_{1}}} (4). ]
Т1 = 273 К, Т2 = 330 К.
∆S = 1227,1 Дж/К + 794,5 Дж/К = 2021,6 Дж/к.
« Последнее редактирование: 16 Марта 2015, 06:34 от alsak »
Записан