МОСКОВСКИЙ АВТОМОБИЛЬНО-ДОРОЖНЫЙ ИНСТИТУТ
(ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ)
ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ
Москва 2007
МОСКОВСКИЙ АВТОМОБИЛЬНО-ДОРОЖНЫЙ ИНСТИТУТ (ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ)
Кафедра химии
ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ
УЧЕБНОЕ ПОСОБИЕ
Утверждено редсоветом МАДИ(ГТУ)
Москва 2007
УДК 544.4 ББК 24.1
Болячевская К. И., Литманович А. А., Остаева Г. Ю., Панасенко А.А., Полякова Е.В.
Основы химической кинетики: Учебное пособие / Под ред. И. М. Паписова. – М.: МАДИ (ГТУ), 2007. – 80 с.
В пособии рассмотрены кинетические закономерности протекания химических реакций. Изложены основные понятия катализа.
Пособие содержит теоретический материал, экспериментальную часть,
примеры решения типовых задач, предлагаемых студентам МАДИ (ГТУ) на контрольных и экзаменационных работах, вопросы для самоконтроля. Приведены варианты домашних заданий по теме «Химическая кинетика» общего курса химии, изучаемого студентами МАДИ (ГТУ).
Пособие предназначено для студентов всех специальностей дневного отделения МАДИ (ГТУ), изучающих тему «Химическая кинетика» в общем курсе химии на кафедре химии МАДИ (ГТУ).
© Московский автомобильно-дорожный институт (государственный технический университет), 2007
Введение
Любая химическая реакция протекает во времени. Некоторые реакции заканчиваются за малые доли секунды, другие осуществляются за минуты, часы, дни; известны реакции, требующие для своего протекания нескольких лет, десятилетий и большего времени. Кроме того, одна и та же реакция может в одних условиях, например при повышенных температурах, протекать быстро, а в других – например, при охлаждении, — медленно.
Интенсивность протекания процесса характеризует скорость химической реакции, которая зависит от многих факторов.
На скорость реакции влияют:
•природа реагирующих веществ;
•реакционная среда;
•концентрации реагентов;
•давление;
•температура;
•присутствие в системе катализаторов;
•размер поверхности раздела (гетерогенные системы);
•внешние воздействия, например, излучения и др.
Весьма важно не только знать, с какой скоростью будет протекать реакция в тех или иных условиях, но и как нужно изменить эти условия для того, чтобы реакция протекала с требуемой скоростью.
Раздел химии, изучающий скорости и механизмы химических реакций, называется химической кинетикой.
1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ
Различают гомогенные и гетерогенные химические реакции. Гомогенной называется реакция, протекающая в одной фазе. Гомо-
генная реакция осуществляется во всем объеме системы (в газовой фазе или жидком растворе), например:
H2 (г) + I2 (г) → 2 HI (г)
3
HCl (р-р) + NaOH (р-р) → NaCl (р-р) + H2O (ж).
Гетерогенной называется реакция, протекающая на границе раздела фаз (твердой и жидкой, твердой и газообразной), например:
|
Fe (тв) + 2 HCl (р-р) → Fe Cl2 (р-р) + H2 (г) |
|
|
t,оС |
Fe (тв) + H2O (г). |
|
FeO (тв) + H2 (г) → |
Все реакции подразделяют на простые и сложные.
Простой (элементарной) называется реакция, протекающая в одну стадию (элементарный акт).
Количество частиц (молекул, атомов, ионов), принимающих участие в элементарной реакции, определяет ее молекулярность.
Мономолекулярная реакция — реакция с участием одной частицы. Например, реакция, связанная с распадом молекулы:
H2 → 2H SO2Cl2 → SO2 + Cl2.
Бимолекулярная реакция – реакция, протекающая в результате взаимодействия в элементарном акте двух молекул:
H2 + I 2 → 2HI
2NO → N2O2.
Тримолекулярные реакции – реакции, требующие одновременного столкновения трех частиц:
2NO + H2 → N2O + H2O.
Чаще всего встречаются мономолекулярные и бимолекулярные реакции. Реакции с молекулярностью больше трех неизвестны, что связано с крайне малой вероятностью одновременного столкновения четырех и более частиц.
Большинство химических реакций являются сложными.
Сложные реакции – это многостадийные реакции, протекающие через ряд элементарных (простых) реакций.
К сложным реакциям относятся последовательные, параллель-
ные, цепные, фотохимические и некоторые другие реакции.
4
В последовательных реакциях
A →B →C
продукт, образованный в предыдущей стадии, является одновременно исходным веществом для последующей стадии. Общая скорость процесса определяется скоростью наиболее медленной стадии, которая называется лимитирующей.
В параллельных реакциях исходные вещества претерпевают превращение одновременно в двух или нескольких направлениях по следующей схеме:
В
A
D
Общая скорость процесса определяется скоростью наиболее быстрой стадии.
Совокупность элементарных реакций, из которых складывается сложная химическая реакция, называется механизмом реакции.
2. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Существуют различные химические и физические методы определения скорости реакции. За ходом химической реакции можно наблюдать по изменению какого-нибудь свойства вещества: вязкости раствора, его оптической плотности, потенциала электрода, теплопроводности, объема выделяющегося газа и др. Но все способы выражения скорости реакции в конечном итоге сводятся к изменению количества вещества.
Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространст-
ва. Для гомогенных процессов реакционное пространство представляет собой объем, заполненный реагентами, для гетерогенных процессов — поверхность раздела фаз.
5
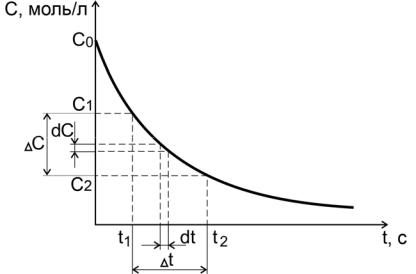
2.1.Гомогенные химические реакции
Взамкнутой системе, в которой объем не меняется, отношение количества вещества к объему системы представляет собой молярную концентрацию.
Скорость гомогенной реакции равна изменению концентрации какого-либо из веществ, вступающих в реакцию, или образующихся
врезультате ее, в единицу времени.
Зависимости концентраций исходных веществ или продуктов реакции от времени называются кинетическими кривыми.
Пусть за промежуток времени от t1 до t2 молярная концентрация некоторого реагирующего исходного вещества уменьшилась от С1 до
С2 (рис. 1).
Рис. 1. Средняя и истинная скорости реакции для исходного вещества
Скорость реакции в данный промежуток времени будет равна
|
υ = − |
С2 − |
С1 |
. |
|
t2 − |
|||
|
t1 |
В ходе реакции количества исходных веществ во времени убывают, количества продуктов реакции увеличиваются. Скорость является положительной величиной, поэтому перед отношением в правой
6
части уравнения ставят знак «минус», если ее определяют по расходу исходного вещества, и знак «плюс», если ее определяют по увеличению концентрации продукта реакции.
В общем случае
|
υ = ± |
С2 −С1 |
= ± |
C . |
||||
|
(2.1) |
|||||||
|
t2 − t1 |
t |
||||||
|
Отношение изменения концентрации одного из реагирующих |
|||||||
|
веществ к промежутку времени |
C2 − C1 |
выражает среднюю ско- |
|||||
|
t2 − t1 |
|||||||
|
рость реакции. |
Входе реакции изменяются концентрации реагирующих веществ
исоответственно скорость реакции. Средняя скорость реакции тем
ближе к истинной скорости, чем меньше промежуток времени t. За бесконечно малый промежуток времени dt концентрация изменится на бесконечно малое значение dC.
Скорость реакции в данный момент времени или, мгновенная (истинная) скорость реакции, представляет собой первую производ-
|
ную концентрации реагирующего вещества по времени |
|
|
υ = ± dC . |
(2.2) |
|
dt |
Производные концентрации по времени, входящие в выражение для мгновенной скорости реакции, находятся как тангенсы углов наклона касательных к кинетическим кривым в точках, соответствующих различным моментам времени от начала химической реакции (рис.2).
Из определения скорости и анализа уравнения (2.1) следует, что скорость реакции имеет единицу измерения [моль·л-1·с-1] (иногда [моль·м-3·с-1], [моль·л-1·ч-1] и т.п.).
7
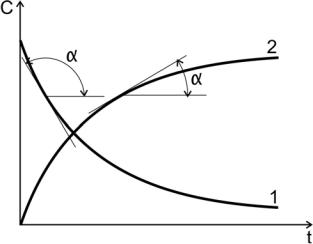
Рис. 2. Кинетические кривые:
1 — для исходного вещества; tgα< 0 ; 2 – для продукта реакции; tgα> 0
При описании кинетического процесса необходимо указывать вещество, по отношению к которому была измерена скорость («скорость по веществу»). Рассмотрим в качестве примера следующую реакцию:
N2 + 3H2 = 2NH3.
Из уравнения реакции видно, что если за какой-то период времени t в реакцию вступит n молей N2, то за это же время прореагирует 3n молей Н2 и образуется 2n молей NH3. Следовательно, скорости реакции по каждому из веществ различны, однако, разделив эти скорости на стехиометрический коэффициент, соответствующий этому ве-
|
ществу в уравнении реакции, |
получим одну и ту же величину — просто |
|||||||
|
«скорость реакции» |
||||||||
|
υ = − |
dCN2 |
= − |
1 |
dCH2 |
= |
1 |
dCNH3 |
. |
|
dt |
3 dt |
2 dt |
8
2.2. Зависимость скорости гомогенной химической реакции от концентрации реагирующих веществ
Чтобы произошло химическое взаимодействие, необходимо столкновение реагирующих частиц. При одной и той же температуре количество столкновений растет с увеличением количества реагирующих частиц в единице объема, т.е. с возрастанием концентрации реагентов. Соответственно, скорость реакции повышается с увеличением концентрации реагирующих веществ.
Выведенное на основе экспериментальных данных уравнение, выражающее зависимость скорости от концентраций реагирующих веществ, показывает, что скорость химической реакции пропорциональна произведению концентраций реагентов в степенях, называемых порядками реакции по реагентам и определяемых опытным путем.
Уравнение, устанавливающее зависимость скорости от концентрации реагирующих веществ, называется дифференциальным кинетическим уравнением реакции.
Например, для реакции аА + bB = cC + dD выражение для скорости реакции будет иметь следующий вид:
где k – коэффициент пропорциональности, называемый константой скорости реакции; [A] и [B] — молярные концентрации реагирующих веществ; n и m — показатели степеней при концентрациях реагентов
(порядки реакции по веществам А и B).
Общим порядком, или просто порядком реакции, называется ве-
личина, равная сумме показателей степеней при концентрациях реагентов в кинетическом уравнении реакции (n+m). Порядок реакции равен сумме порядков по реагирующим веществам.
Константа скорости k – постоянная величина (при T = const) и не зависит от концентрации реагентов. Она определяется природой реагирующих веществ и зависит от температуры.
9
Из уравнения (2.3) следует, что при единичных концентрациях реагирующих веществ (например, [A] = [B] = 1 моль/л) константа скорости реакции численно равна скорости реакции.
Из этого же уравнения видно, что размерность константы скорости реакции зависит от порядка реакции, поскольку размерность скорости реакции для всех гомогенных реакций одинакова. Единицу измерения константы скорости реакции определяют из анализа размерностей.
Порядок реакции зависит от ее сложности.
Для простой (элементарной) реакции стехиометрическое уравнение передает механизм процесса, стехиометрические коэффициенты уравнения реакции совпадают с порядками по реагентам, молекулярность совпадает с общим кинетическим порядком.
Для необратимой элементарной реакции зависимость скорости от концентрации реагентов выражается законом действующих масс.
При постоянной температуре скорость элементарной химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам.
Рассмотрим необратимые элементарные реакции разного вида и применим к ним закон действующих масс.
1. Скорость реакции первого порядка А → продукты, характеризуется кинетическим уравнением
υ = k [A].
Константа скорости реакции первого порядка имеет размерность
[с-1].
Например, для термораспада диметилового эфира
CH3OCH3 → CH4 + H2 + CO, υ = k [CH3OCH3]
10
2. Скорость реакции второго порядка в соответствии с законом действующих масс равна:
2А → продукты, υ = k [А]2;
А + В → продукты, υ = k [А] [В]. Размерность константы скорости реакции второго порядка
[л· моль-1·с-1].
Например, для реакции разложения иодида водорода
2 HI → H2 + I2 υ = k [ HI]2.
Или, для реакции этерификации уксусной кислоты этанолом
CH3COOH + C2H5OH → CH3COOC2H5 + H2O,
υ= k [CH3COOH] [C2H5OH].
3.Скорость реакции третьего порядка
|
A + B + C → продукты, |
υ = k [А] [В] [C], |
|
2A + B → продукты, |
υ = k [А]2 [B]; |
|
3A → продукты, |
υ = k [А]3. |
Размерность константы скорости третьего порядка [л²· моль-2·с-1]. Например, реакция взаимодействия оксида азота с хлором
2NO + Cl 2 → 2NOCl, υ = k [NO]2 [Cl 2].
Закон действующих масс справедлив только для элементарных реакций.
В большинстве случаев реакции многостадийны.
Для сложных (многостадийных) реакций порядки реакции по реагентам не совпадают со стехиометрическими коэффициентами, общий порядок реакции не равен сумме стехиометрических коэффициентов.
Порядок сложной реакции может быть целым, дробным числом и даже равным нулю.
Порядок сложной реакции определяют экспериментально.
11
Например, реакция: 2N2O5 = 2N2O4 + O2 является сложной и протекает по стадиям:
|
N2O5 = N2O3 + O2 |
(а) |
|
N2O3 = NO2 + NO |
(б) |
|
NO + N2O5 = 3NO2 |
(в) |
|
2NO2 = N2O4. |
(г) |
|
Наиболее медленно протекает стадия (а), т.е. эта стадия явля- |
|
|
ется лимитирующей. Скорость стадии (а) и соответственно |
всей |
|
сложной реакции будет равна |
|
|
υ ≈ υa = ka [N2O5]. |
Так, приведенная выше сложная реакция имеет первый порядок по оксиду азота (V) и общий первый порядок.
2.3. Графический метод определения констант дифференциального кинетического уравнения
Определим константы дифференциального кинетического уравнения для следующей реакции:
аА + bB → продукты.
Зависимость скорости от концентраций выражается уравнением
(2.3)
υ = k[A]n [B]m .
Прологарифмируем это выражение
lnυ= lnk + nln[A]+ mln[B]. (2.4)
Так как величины k, n и m для рассматриваемой реакции (при T = const) являются постоянными и не зависят от концентрации реагентов, то для их нахождения достаточно определить зависимость скорости реакции от концентрации одного из реагентов при фиксированной концентрации другого реагента.
Пусть в трех опытах концентрация вещества А будет постоянной и равной [A]0, тогда в уравнении (2.4) сумма (lnk + nln[A]0 ) будет тоже
величиной постоянной, обозначим ее
12
|
lnk + nln[A]0 = D . |
|
|
Тогда уравнение (2.4) можно переписать как |
|
|
lnυ= mln[B]+D . |
(2.5) |
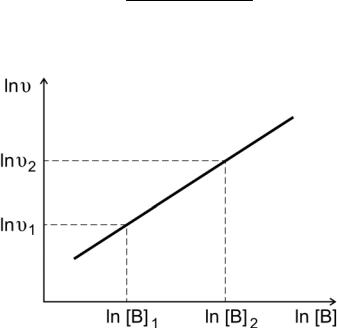
Зависимость (2.5) представляет собой в координатах ln[B] — lnυ уравнение прямой линии, тангенс угла наклона которой к оси абсцисс численно равен порядку реакции по веществу В.
По экспериментальным данным строят график зависимости lnυ от ln[B] (рис. 3) и находят порядок реакции по веществу B
m = lnυ2 − lnυ1 . ln[B]2 − ln[B]1
Рис.3. Определение порядка реакции по веществу В
В последующих опытах определяют скорость реакции при различных исходных концентрациях вещества А и постоянной концентрации [B]0. Находят порядок реакции по веществу А
|
n = |
ln υ2 − |
ln υ1 |
||
|
. |
||||
|
ln[A] |
2 |
− |
ln[A] |
|
|
1 |
Из уравнения (2.3) с учетом найденных порядков реакции по веществам А и В рассчитывают константу скорости
13

ki = [A]i nυ[iB]i m ,
где υi , [A]i, [B]i — экспериментальные данные, относящиеся к одному опыту.
2.4. Зависимость концентрации реагирующих веществ от времени для реакции первого порядка. Интегральное кинетическое уравнение
На практике чаще всего интересует не само значение скорости химической реакции, а то, сколько вещества израсходовано или образовалось к определенному моменту времени после начала реакции.
Рассмотрим эту задачу на примере реакции первого порядка
А → продукты.
Скорость такой реакции выражается следующим уравнением:
|
υ= k[A] . |
(2.6) |
||
|
В дифференциальном виде |
|||
|
− |
d[A] |
= k[A]. |
(2.7) |
|
dt |
|||
Перепишем это уравнение в следующем виде:
−d[[AA]] =kdt ,
ивозьмем определенный интеграл от обеих частей уравнения от исходного состояния ([A]0, t0 = 0) до текущего момента ([A]t, t):
|
− |
[A]t d[A] |
t |
|
|
∫ |
=k ∫dt . |
||
|
[A] |
|||
|
[A]0 |
0 |
Решение этого уравнения приводит к следующей зависимости:
|
[A] |
t |
= [A] |
0 |
• e− kt |
(2.8) |
или
(2.9)
14

ln[A]t = ln[A]0 − kt .
Соотношения (2.8) и (2.9) являются интегральными кинетиче-
скими уравнениями реакции первого порядка.
Зная исходную концентрацию вещества [A]0 и константу скорости реакции k, можно рассчитать концентрацию [A]t через любое время t после начала реакции.
Если же известны исходная концентрация [A]0 и концентрация реагирующего вещества [A]t через какое-то время t после начала ре-
|
акции, то можно рассчитать константу скорости этой реакции |
|||
|
1 |
[A]0 |
||
|
k = t ln |
. |
||
|
[A]t |
(2.10) |
Часто для характеристики скорости реакции пользуются временем полупревращения t1/2 (для реакции первого порядка чаще говорят «период полураспада»). t1/2 — это время, за которое прореагирует по-
ловина исходного вещества [A]t = [A2]0 . Тогда, исходя из уравнения
(2.10), получим следующие зависимости:
|
k = |
1 |
ln |
[A]0 |
= ln2 = |
0,693 ; |
||
|
[A]0 / 2 |
(2.11) |
||||||
|
t1/ 2 |
t1/ 2 |
t1/ 2 |
|||||
|
t |
= 0,693 . |
(2.12) |
|||||
|
1/ 2 |
k |
15
2.5.Скорость гетерогенной химической реакции
Вгетерогенной химической реакции взаимодействие реагентов происходит на поверхности раздела фаз.
Скорость гетерогенной реакции измеряется изменением количества какого-либо из веществ, вступающих в реакцию или образующихся в результате ее, за единицу времени на единице поверхности раздела фаз
|
υ = ± dn |
1 |
, |
(2.13) |
|
|
S |
||||
|
dt |
где n – количество вещества какого-либо компонента реакционной системы, моль; t – время, с; S – площадь поверхности раздела фаз, м2.
Из уравнения (2.13) следует, что скорость гетерогенной химической реакции имеет единицу измерения [моль· м -2 ·с -1]. Гетерогенные химические реакции являются сложными, многостадийными процессами. В ходе гетерогенной реакции можно выделить три характерные стадии.
1.Подвод реагирующих веществ к поверхности раздела фаз.
2.Химическая реакция на поверхности раздела фаз.
3.Отвод продуктов реакции из реакционной зоны.
Скорость суммарного гетерогенного процесса определяется наиболее медленной (лимитирующей) стадией.
Если наиболее медленно протекающими являются первая или третья стадии, связанные с переносом вещества, то скорость такого процесса определяется конвекцией (переносом массы газа или жидкости) или диффузией (самопроизвольным выравниванием концентраций) и практически не зависит от скорости протекания самой химической реакции.
При усилении конвекции скорость возрастает. Так, реакция горения угля протекает тем быстрее, чем интенсивнее подается к углю кислород
C (тв) + O2 (г) = CO2 (г).
16
При отсутствии конвекционного потока процесс может лимитироваться диффузией. Толщина диффузионного слоя уменьшается при перемешивании. Интенсивное перемешивание увеличивает скорость общего процесса. Например, растворение солей в водных растворах кислот
MgCO3 (тв) + 2 HNO3 (ж) = Mg(NO3)2 (р-р) + H2O (ж) + CO2 (г).
Если скорость переноса веществ больше, чем скорость химического превращения, т.е. наиболее медленной стадией является вторая стадия, то скорость протекания всего процесса определяется собственно химической реакцией и можно применить закон действующих масс.
При этом надо иметь в виду, что реакция протекает на поверхно-
сти раздела фаз, поэтому общая скорость химической реакции будет зависеть от концентрации жидкого или газообразного вещества, а также от площади соприкосновения фаз. Концентрация твердого вещества не входит в выражение для скорости реакции.
При измельчении твердого вещества скорость реакции будет возрастать из-за увеличения площади поверхности. Например, скорость реакции
CaCO3 (тв) + 2HCl (р-р) = CaCl2 (р-р) + H2O (ж) + CO2 (г)
зависит от концентрации соляной кислоты и площади поверхности раздела фаз. Скорость реакции порошкообразного карбоната кальция с кислотой выше скорости взаимодействия мраморной крошки с кислотой из-за увеличения площади контакта. Уравнение скорости в общем виде
υ= k [HCl]m ·S,
где m – порядок реакции по кислоте; S – площадь поверхности, м2. Порядок реакции m может совпадать со значением стехиометри-
ческого коэффициента, если лимитирующей стадией процесса является собственно простая химическая реакция.
17
2.6. Зависимость скорости химической реакции от температуры
2.6.1.Уравнение Аррениуса
Вбольшинстве случаев скорость химической реакции увеличивается при повышении температуры.
Зависимость константы скорости реакции от температуры выражается уравнением Аррениуса
|
− |
Ea |
(2.14) |
||
|
RT |
, |
|||
|
k = A e |
||||
|
где k — константа скорости реакции; |
||||
|
A — константа, называемая |
предэкспоненциальным |
|||
|
множителем; |
e — основание натурального логарифма; Еa — энергия активации, Дж/моль;
Т — температура, К;
R — газовая постоянная, 8,31 Дж/моль К.
2.6.2. Энергия активации
Для того чтобы произошла реакция, необходимо преодолеть отталкивание электронных оболочек молекул и разорвать или ослабить связи между атомами. На это надо затратить определенную энергию.
Энергия активации в элементарных реакциях – минимальная энергия реагентов (атомов, молекул и др. частиц), достаточная для того, чтобы они вступили в химическую реакцию, т. е. для пре-
одоления барьера на поверхности потенциальной энергии, отделяющего реагенты от продуктов реакции.
Потенциальный барьер – максимум потенциальной энергии, через который должна пройти система в ходе элементарного акта химического превращения.
18
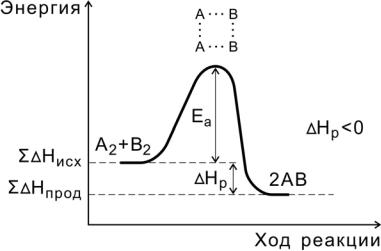
В ходе реакции вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом или переходным состоянием. Именно для его образования необходима энергия активации (рис. 4, 5).
Число частиц, входящих в активированный комплекс, определяет молекулярность данной стадии реакции.
Неустойчивый активированный комплекс существует очень короткое время (10−15 с). Он распадается с образованием исходных веществ или продуктов реакции.
Рис. 4. Энергетическая диаграмма экзотермической реакции
Переходное состояние возникает в ходе как прямой, так и обратной реакций (рис. 6). Разность энергий активации прямой и обратной реакций равна изменению внутренней энергии (тепловому эффекту) реакции
Нр = Еа(пр) — Еа (обр).
В макроскопической химической кинетике энергия активации – параметр Еa, входящий в уравнение Аррениуса (2.14). В общем случае сложных реакций параметр Еa является функцией энергий активации отдельных стадий, и определяемая энергия активации называется эффективной (эмпирической, кажущейся).
19
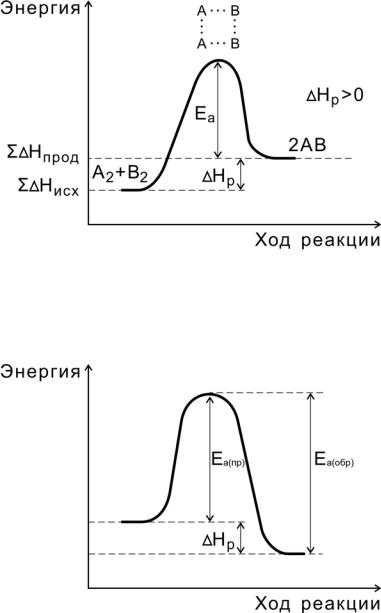
Рис. 5. Энергетическая диаграмма эндотермической реакции
Рис.6. Соотношение между энергиями активации прямой
иобратной реакций и теплового эффекта
2.6.3.Распределение молекул по энергиям
Элементарный акт химической реакции происходит не при любом столкновении молекул, а только при столкновении молекул, которые обладают повышенным запасом кинетической энергии. Молеку-
20
лы, обладающие такой энергией, называются активными молекулами.
Если сталкивающиеся молекулы не обладают такой энергией, то столкновение будет неэффективным – не приведет к образованию новой молекулы. Если же кинетическая энергия сталкивающихся молекул достаточна, то столкновение может привести к перестройке атомов и образованию молекулы нового вещества.
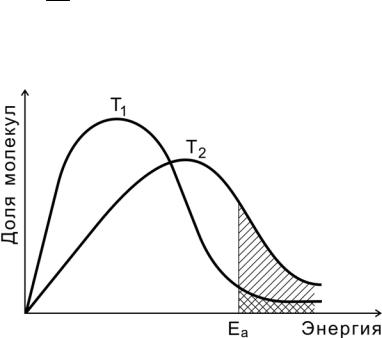
На рис. 7 показано распределение молекул идеального газа по кинетической энергии согласно статистическому закону МаксвеллаБольцмана при двух разных температурах.
Доля молекул с энергией, превышающей энергию активации Еа (доля активных молекул), с повышением температуры резко возрастает (площадь заштрихованной области).
− Ea
Величина e RT в уравнении Аррениуса (2.14) численно равна доле активных молекул.
Рис. 7. Распределение молекул по энергиям при двух разных температурах (Т2 > Т1)
Чем выше температура, тем больше в системе активных молекул, тем выше скорость реакции.
21

2.6.4. Энтропия активации. Стерический фактор
Кроме энергии активации важным условием осуществления химической реакции является ориентация молекул в момент столкновения. Большую роль играют размеры и форма молекул, место расположения реакционно-способных атомов или групп атомов в молекуле.
Вероятность необходимой для взаимодействия ориентации молекул при столкновении
W = nвзаим ,
nобщ
где, nвзаим — число способов ориентации, приводящих к взаимодействию; nобщ — общее число возможных способов ориентации.
Энтропия активации (в расчете на 1 моль) по уравнению Больц-
мана
Sa = R lnW .
Вероятность необходимой ориентации
Sa
W = e R .
Чем больше вероятность необходимой для реакции ориентации, т.е. чем больше значение энтропии активации и чем меньше значение энергии активации, тем выше скорость реакции и, соответственно, константа скорости
|
Sa |
− |
Ea |
(2.15) |
||
|
k = Z • e R |
RT , |
||||
|
• e |
где Z – коэффициент пропорциональности.
Для бимолекулярных реакций Z – это число столкновений частиц в единице объема за единицу времени (1с, 1 см3).
Уравнение (2.15) называют основным уравнением химической кинетики. Энергия активации и энтропия активации являются теми факторами, посредством которых сказывается влияние природы реагирующих веществ на скорость реакции.
22

Sa
Множитель e R называется стерическим фактором (или стерическим множителем, или фактором вероятности).
Sa
Стерический фактор e R ются в уравнении Аррениуса множитель А.
и частота столкновений Z учитыва- (2.14) через предэкспоненциальный
2.6.4. Применение уравнения Аррениуса
Энергию активации можно рассчитать по экспериментальным данным графическим или аналитическим способами, используя уравнение Аррениуса
− Ea
k = A e RT ,
|
представив его в логарифмическом виде |
|||
|
ln k = ln A − |
Еa |
. |
(2.16) |
|
RT |
Графический способ
Рис. 8. Зависимость константы скорости реакции от температуры
23

По экспериментальным значениям константы скорости реакции
1
при различных температурах строят график зависимости lnk = f (T )
(рис. 8).
По тангенсу угла наклона прямой к оси абсцисс вычисляют энергию активации
Ea = −R tgα.
Аналитический способ
Если предположить, что для выбранной реакции величины А и Еа постоянны в небольших пределах температур от Т1 до Т2, то уравнение Аррениуса (2.16) можно применить для двух различных темпе-
|
ратур (Т2> Т1; k (Т2) = k2; k (Т1) = k1) |
||||||||||||||||
|
ln k |
= ln A − |
Еa |
; |
|||||||||||||
|
1 |
RT1 |
|||||||||||||||
|
ln k |
2 |
= ln A − |
Еa |
. |
||||||||||||
|
RT2 |
||||||||||||||||
|
В результате вычитания первого уравнения из второго получим |
||||||||||||||||
|
В результате вычитания первого уравнения из второ- |
(2.17) |
|||||||||||||||
|
го получим |
||||||||||||||||
|
ln |
k2 |
= |
Ea |
T2 −T1 |
, |
|||||||||||
|
k |
T T |
|||||||||||||||
|
R |
||||||||||||||||
|
1 |
1 |
2 |
||||||||||||||
|
следовательно, |
||||||||||||||||
|
Ea = R |
T1T2 |
ln |
k2 |
. |
||||||||||||
|
(2.18) |
||||||||||||||||
|
T2 −T1 |
k1 |
Под символом логарифма находится отношение констант скоростей реакции при двух температурах, поэтому константы можно заменить любыми пропорциональными им величинами при тех же температурах. Например, вместо констант скоростей можно подставить скорости реакции, если исходные концентрации реагирующих веществ при измерении скоростей в обоих опытах были одинаковы и скорость
24
изменилась только под влиянием изменения температуры. Тогда получим следующие выражения:
|
ln |
υ2 |
= |
Ea |
T2 −T1 |
; |
(2.19) |
|||
|
T T |
|||||||||
|
υ |
R |
||||||||
|
1 |
1 |
2 |
|||||||
|
Ea = R |
T1T2 |
ln |
υ2 . |
(2.20) |
|||||
|
T2 −T1 |
υ1 |
3.КАТАЛИТИЧЕСКИЕ РЕАКЦИИ
3.1.Основные понятия
Катализаторы — вещества, изменяющие скорость реакции и остающиеся к концу реакции химически неизменными.
Явление изменения скорости реакции под действием таких веществ называется катализом.
Реакции, протекающие под действием катализаторов, называют-
ся каталитическими реакциями.
Реакции, в которых катализатором является продукт реакции,
называются автокаталитическими.
Важным свойством катализаторов является селективность (избирательность) их действия, проявляющаяся в увеличении скорости только определенной из нескольких возможных реакций.
Вещества, малые примеси которых могут сильно снижать или полностью подавлять активность катализатора, называются катали-
тическими ядами.
Промоторы – вещества, которые увеличивают активность катализаторов, хотя сами таковыми не являются.
По фазовому принципу различают гомогенный и гетерогенный катализ.
25
3.2. Сущность каталитического действия
Катализ обусловлен промежуточным химическим взаимодействием реагирующих веществ с катализатором, в результате которого открывается новый реакционный путь. Ускорение процессов с помощью катализаторов достигается за счет того, что появляются новые механизмы, при которых медленные стадии заменяются более быстрыми.
Реакция превращения веществ А и В в вещество АВ с участием катализатора К осуществляется по следующей схеме:
A + K → AK
АК + В → АВ + К
————————————-
А + В → АВ.
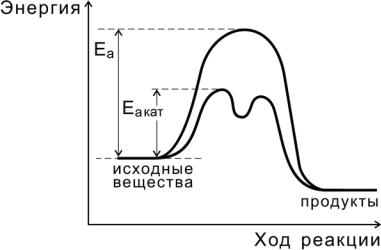
Независимо от механизма действия роль катализатора с точки зрения энергетики реакции сводится, как показано на рис. 9, к снижению энергии активации (Еакат < Еа ), за счет чего увеличивается константа скорости реакции.
Рис.9. Реакция с участием катализатора
26
Катализатор может также способствовать необходимой для взаимодействия молекул ориентации.
Катализатор не влияет на константу химического равновесия и не смещает положение химического равновесия.
Энергия активации прямой и обратной реакций при введении катализатора уменьшается на одинаковую величину.
Катализатор ускоряет прямую и обратную реакции, т.е. сокращает время достижения равновесия при подходе к нему как со стороны исходных веществ, так и со стороны продуктов.
3.3. Гомогенный катализ
Гомогенным называют катализ, при котором катализатор и реагирующие вещества находятся в одной фазе (газовой или жидкой).
Примером гомогенного газофазного каталитического процесса может служить окисление диоксида серы SO2 до триоксида SO3. Без катализатора диоксид серы очень медленно окисляется кислородом. При производстве серной кислоты камерным способом процесс окисления диоксида серы до триоксида катализируется оксидом азота (II), который открывает для реакции новый путь, не включающий медленной стадии взаимодействия диоксида серы с молекулярным кислородом
2 SO2 (г) + О2 (г) NO( Г ) →2 SO3 (г).
Катализатор NO вступает в реакцию с кислородом О2 , образуя промежуточный продукт NO2,
2NO (г) + O2 (г) = 2NO2(г) .
NO2 затем реагирует с SO2 по реакции
2SO2 (г) + 2NO2 (г) = 2SO3 (г) + 2NO (г),
27
в результате которой получается конечный продукт и выделяется катализатор в химически неизменном виде и первоначальном количестве.
К преимуществам гомогенного катализа можно отнести высокую эффективность действия катализаторов, так как реакция идет во всем объеме сосуда. Но практическое выделение продуктов из реакционной смеси может быть затруднено.
3.4. Гетерогенный катализ
Гетерогенным называют катализ, при котором катализатор и реагирующие вещества находятся в разных фазах.
Процесс идет на границе раздела фаз. Обычно катализатор представляет собой твердое вещество, а реагенты находятся в газе или жидкости.
Механизмы действия гетерогенных катализаторов включают в себя следующие основные стадии:
1)движение реагирующих веществ к поверхности катализатора;
2)адсорбцию реагентов поверхностью катализатора;
3)взаимодействие реагентов на поверхности;
4)десорбцию продуктов реакции с освобождением поверхности катализатора;
5)отвод продуктов реакции из реакционной зоны.
Взависимости от условий проведения процесса и его особенностей лимитирующей может оказаться любая из этих стадий.
Адсорбция может способствовать разрыхлению и поляризации определенных химических связей, активировать реагирующие молекулы, обеспечивая на поверхности катализатора их благоприятную взаимную ориентацию в течение времени, необходимого для взаимодействия.
Активность гетерогенного катализатора зависит от величины и свойств его поверхности. Количество активных центров (участков, на которых обеспечиваются оптимальные условия реакции) определяет-
28
ся составом поверхностного слоя, способом приготовления катализатора и обработки его поверхности. Обычно применяют тонко измельченные порошки, пористые структуры с высокоразвитой поверхностью, в том числе пористые носители с нанесенным слоем катализатора.
Во многих случаях гетерогенный катализ протекает с помощью переходных металлов и их соединений (Pt, Pd, Rh, Fe, Ni, CuO, V2O5, NiO, Fe2O3, Cr2O3 и др.).
Примерами гетерогенного катализа являются вышерассмотренная реакция окисления диоксида серы SO2 до триоксида SO3, но уже в присутствии твердого катализатора V2O5 или Pt
|
2SO2(г) + O2(г) |
V O , Pt |
|
|
2 5 → 2SO3(г) |
||
|
или реакция синтеза аммиака |
||
|
N2 (г) + 3H2 (г) |
Fe, V |
2 NH3 (г). |
|
→ |
Гетерогенный катализ удобен тем, что катализатор не смешивается с реагентами, поэтому не возникает проблемы отделения его от продуктов реакции. Но с течением времени активная поверхность твердых катализаторов может измениться.
4.ХИМИЧЕСКОЕ РАВНОВЕСИЕ
4.1.Состояние равновесия
Реакции, протекающие при одних и тех же условиях одновременно в противоположных направлениях, называются обратимыми.
Рассмотрим простую обратимую реакцию, которая протекает в закрытой системе
A + B ↔ C + D.
Скорость прямой реакции описывается уравнением
υпр = kпр [A][B] ,
29
где υпр – скорость прямой реакции; kпр – константа скорости прямой
реакции.
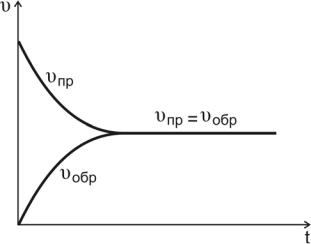
С течением времени концентрации реагентов А и В уменьша-
ются, скорость реакции снижается (рис.10, кривая υпр ).
Рис.10. Изменение скоростей прямой и обратной реакций во времени
Реакция между А и В приводит к образованию веществ C и D, молекулы которых при столкновениях могут вновь дать вещества А и В.
Скорость обратной реакции описывается уравнением
υобр = kобр[C][D],
где υобр – скорость обратной реакции; kобр – константа скорости об-
ратной реакции.
По мере того как концентрации веществ C и D возрастают, скорость обратной реакции увеличивается (рис.10, кривая υобр ).
В какой-то момент времени скорости прямой и обратной реакций становятся равными
30

υпр = υобр.
Такое состояние системы называется состоянием равновесия.
В состоянии равновесия концентрации всех его участников перестают меняться во времени. Такие концентрации называются
равновесными.
Химическое равновесие – это динамическое равновесие. Неизменность концентраций веществ, присутствующих в закрытой системе, есть следствие непрерывно идущих химических процессов. Скорости прямой и обратной реакций не равны нулю, а нулю равна наблюдаемая скорость процесса.
Равенство скоростей прямой и обратной реакций – это кинетическое условие химического равновесия.
4.2. Константа равновесия
При равенстве скоростей прямой и обратной реакций
υпр = υобр
справедливо равенство
kпр[A][B] = kобр[C][D],
где [A], [B], [С], [D] – равновесные концентрации веществ.
Поскольку константы скоростей не зависят от концентраций, равенство можно записать иначе:
kпр = [C][D] . kобр [A][B]
Отношение констант скоростей прямой и обратной реакций (kпр/kобр ) называют константой химического равновесия:
|
kпр |
[C][D] |
(4.1) |
||||
|
Kc |
= |
= |
[A][B] |
. |
||
|
kобр |
||||||
|
31 |
[CO]
Рассмотрим сложную реакцию
aA + bB ↔ cC + dD
Любую сложную химическую реакцию можно представить в виде ряда простых реакций. Для каждой из простых реакций можно записать кинетическое уравнение прямой и обратной реакций и соответствующие им выражения для констант равновесия. Константа равновесия сложной реакции равна произведению констант равновесия простых реакций, описывающих ее механизм
Kc = K1 K2 K3 KKi .
Поэтому в суммарное выражение для константы равновесия равновесные концентрации войдут в степенях их стехиометрических коэффициентов
|
с |
d |
(4.2) |
||
|
Kc |
= |
[C]a |
[D]b . |
|
|
[A] |
[B] |
В выражение константы равновесия гетерогенной реакции входят только концентрации веществ, находящихся в жидкой или газообразной фазе.
Концентрации твердых веществ не входят в выражение константы равновесия гетерогенной реакции.
Например, выражение для константы равновесия следующей реакции
СО2 (г) + С(тв) ↔ 2СО(г)
записывается так:
2
Kc = [CO2 ] .
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Численное значение константы равновесия определяет, каким должно быть соотношение концентраций всех реагирующих веществ при равновесии.
32
Изменение концентрации любого из этих веществ влечет за собой изменение концентраций всех остальных веществ. В итоге устанавливаются новые равновесные концентрации, но соотношение между ними вновь соответствует константе равновесия.
Величина константы равновесия зависит от природы реагирующих веществ и температуры.
Константа равновесия, выраженная через молярные концентрации реагирующих веществ Kc и константа равновесия, выраженная
через равновесные парциальные давления Kp (см. «Основы химиче-
ской термодинамики»), связаны между собой соотношениями
K p = Kc (RT ) ν ;
|
Kc = |
K p |
, |
||
|
(RT ) |
ν |
|||
где Δν — изменение числа газообразных молей в реакции. Стандартное изменение энергии Гиббса равно
GTo = −RT lnKp ,
а также
GTo = Ho −T So.
После приравнивания правых частей уравнений
− RT lnKp = Ho −T So
или
|
Ho |
So |
(4.3) |
|||||
|
lnK |
p |
= − |
+ |
. |
|||
|
RT |
R |
||||||
Уравнение (4.3) не только устанавливает вид зависимости константы от температуры, но и показывает, что константа определяется природой реагирующих веществ.
Константа равновесия не зависит от концентраций реагентов (как и константа скорости реакции), механизма реакции, энергии акти-
вации, от присутствия катализаторов. Смена механизма, например,
33
при введении катализатора не влияет на численное значение константы равновесия, но может изменить скорость достижения равновесного состояния.
4.3. Расчет равновесного состава продуктов химической реакции
Зная величины констант равновесия при данных условиях и используя стехиометрические соотношения реакции (закон сохранения массы), рассчитывают равновесный состав продуктов по следующей схеме.
1.Пишут уравнение реакции.
2.Пишут под формулами уравнения начальные концентрации исходных веществ (в моль/л). Если начальные концентрации продуктов реакции не оговариваются в условии задачи, они обычно принимаются равными нулю.
А + b В ↔ c С + D
|
Начальное |
[А]0 |
[В]0 |
[С]0 |
0 |
|
состояние |
||||
|
Число молей |
1 |
b |
c |
1 |
|
по уравнению |
||||
|
Изменение |
x |
b x |
c x |
x |
|
концентраций |
||||
|
Равновесное |
[А]0 — x |
[В]0 – bx |
[С]0 + c x |
x |
|
состояние |
3. Принимают, что в ходе реакции до состояния равновесия прореагировало x моль/л какого-либо вещества. Обычно за x принимают изменение концентрации того реагента, стехиометрический коэффициент при котором в уравнении реакции наименьший, чтобы из-
34

бежать дробных коэффициентов при неизвестном x. Например, прореагировало x моль/л вещества А.
4.По уравнению реакции определяют изменение концентраций других веществ.
5.Определяют равновесные концентрации веществ. При протекании реакции в прямом направлении до состояния равновесия происходит уменьшение концентраций исходных веществ и увеличение концентраций продуктов реакции.
6.Пишут выражение закона действующих масс. Подставляют в него найденные значения равновесных концентраций.
[C]с[D] Kc = [A][B]b ,
Kc = ([C]0 + cx)c • (x) b . ([A]0 — x) • ([B]0 — bx)
7. Решают уравнение с одним неизвестным. При этом учитывают, что отрицательный корень не имеет физического смысла, и убыль концентрации исходного вещества не может быть больше величины самой концентрации (начальная концентрация исходного вещества не может быть меньше его остаточной равновесной концентрации).
8. Находят равновесные концентрации.
[А] = [А]0— x; [B] = [B]0 — b x; [C] = [С]0 + cx; [D] = x.
Приведенная схема расчета может быть применена также для определения исходных (начальных) молярных концентраций, если известны равновесные концентрации реагентов.
35

4.4. Смещение химического равновесия. Принцип Ле Шателье
Истинное химическое равновесие является динамическим и подвижным: изменение внешних условий (температуры, давления, концентраций реагирующих веществ) ведет к смещению равновесия в сторону прямой или обратной реакции. Характер влияния внешних факторов на равновесные системы выражает принцип Ле Шателье.
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то смещение равновесия происходит в сторону той реакции (прямой или обратной), которая ослабляет эффект внешнего воздействия.
Равновесное состояние в системе
H2 (г) + I2 (г) → 2 HI (г)
характеризуется (для одной и той же температуры) константой равновесия
Kc = [H[H]I][2 ] .
2 I2
Если, например, в систему добавить водород, т.е. увеличить его концентрацию, то скорость прямой реакции увеличится (в соответствии с законом действующих масс)
υпр = kпр [H2] [I 2], υпр > υобр ,
равновесие сместится вправо. Концентрация йодоводорода будет увеличиваться, а концентрация водорода и йода будет уменьшаться. Процесс будет протекать до тех пор, пока не установится новое равновесие. Новые равновесные концентрации всех компонентов будут другими, но соотношение между ними, определяемое константой равновесия, останется постоянным.
36
Если в систему ввести дополнительное количество йодоводорода, то скорость обратной реакции увеличится
υобр = kобр [HI] 2 , υобр > υпр ,
равновесие сместится влево.
Удаление из системы продуктов (или продукта) реакции ведет к смещению равновесия в сторону прямой реакции, а уменьшение концентрации исходных (или исходного) веществ приводит к сдвигу равновесия в направлении обратной реакции.
4.4.2. Изменение давления
Повышение давления (уменьшение общего объема) вызывает смещение равновесия в направлении уменьшения общего количества молей газообразных веществ, т.е. в направлении, приводящем к понижению давления.
При уменьшении давления (увеличении общего объема) равновесие смещается в сторону увеличения количества молей газообразных веществ, т.е. в направлении, приводящем к возрастанию давления.
Рассмотрим, в каком направлении сместится равновесие в сис-
теме
CO (г) + Cl2 (г) ↔ COCl2 (г),
если при неизменной температуре увеличить давление путем уменьшения объема газовой смеси?
В реакцию вступают 2 моля, а образуется 1 моль газообразных веществ. Прямая реакция при постоянном объеме сопровождается уменьшением давления. Если увеличить общее давление в системе, то согласно принципу Ле Шателье равновесие сместится в сторону прямой реакции.
Это можно доказать расчетами. Скорость прямой реакции рав-
на
37
υпр = kпр [СО][Сl2],
скорость обратной реакции равна
υобр = kобр [COCl2].
При повышении давления объем системы уменьшился, например, в 3 раза. Тогда концентрации всех реагентов увеличатся в 3 раза. При этом скорость прямой реакции увеличивается в 9 раз:
|
υ |
= k |
пр |
(3 [CO]) (3 [Cl2]) = k |
пр |
32 [CO][Cl2] = 9 υ . |
|
пр |
пр |
Скорость обратной реакции увеличивается только в 3 раза:
υобр = kобр (3[СОCl2]) = 3 kобр [СОCl2] = 3 υобр .
Таким образом, равновесие этой реакции будет смещаться в сторону накопления СОCl2 в системе до тех пор, пока не установится вновь состояние химического равновесия.
Для реакций, протекающих без изменения числа молей газообразных веществ, изменение давления (или общего объема) не влияет на химическое равновесие и равновесный состав продуктов.
Для реакции
H2 (г) + I2 (г) ↔ 2 HI (г)
количество молей газообразных веществ слева и справа от знака равновесия равно. При изменении давления скорости прямой и обратной реакций изменяются одинаково, а их отношение будет оставаться неизменным. В этом случае изменение давления не влияет на положение равновесия.
Рассмотрим влияние разбавления реагирующей смеси инерт-
ным газом на химическое равновесие.
1. Если разбавление ведется при постоянных давлении и температуре (изобарно-изотермический процесс), объем системы при накачивании инертного газа увеличивается (он пропорционален количест-
38

nRT
ву вещества n газов, V = p . Следовательно, молярные концентра-
ции Ci = nVi и парциальные давления pi = nni p исходных веществ и
продуктов реакции уменьшаются (ni ,ni‘ = const ;ni – число молей i — го исходного вещества, ni‘ – число молей i — го продукта реакции). Создается эффект уменьшения общего давления, ведущий к смещению равновесия в соответствующем направлении.
2. Если разбавление осуществляется при постоянных объеме и температуре (изохорно-изотермический процесс), то при накачивании инертного газа, например, в автоклав, общее давление возрастает пропорционально увеличению количества вещества газов в системе
|
p = nRT |
. При |
n |
,n‘ = const |
молярные концентрации |
C |
i |
= |
ni |
и парци- |
|
|
V |
||||||||||
|
V |
i |
i |
||||||||
|
альные давления pi = Ci RT |
исходных веществ и продуктов сохраня- |
ются постоянными. В этом случае разбавление инертным газом не влияет на химическое равновесие.
4.4.3. Влияние температуры
|
Зависимость константы равновесия от температуры |
Kp = f (T ) |
|||||||||||||||||
|
выражается уравнением |
||||||||||||||||||
|
lnK |
p |
= |
− |
Ho 1 |
+ |
So |
, или |
lnK |
p |
= |
A |
+ B , |
(4.4) |
|||||
|
T |
||||||||||||||||||
|
R Т |
R |
|||||||||||||||||
|
где A = − |
Ho |
; B = |
So |
. |
||||||||||||||
|
R |
||||||||||||||||||
|
R |
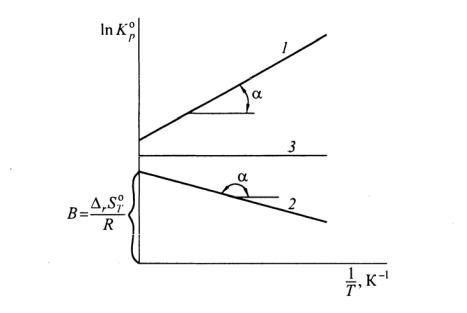
Выражение (4.4) представляет собой уравнение прямой в коорди-
натах T1 —ln Kp , тангенс угла наклона которой к оси абсцисс
39
|
tgα = A = − |
Ho |
, а отрезок, отсекаемый на оси ординат, |
B = |
So |
|
|
R |
|||||
|
R |
|||||
|
(рис. 11). |
|||||
Рис. 11. Зависимость логарифма константы равновесия от обратной абсолютной температуры для разных типов реакции:
1 – экзотермическая ( H o< 0); 2 – эндотермическая ( Ho> 0); 3 – реакция с нулевым тепловым эффектом ( Ho= 0)
Для экзотермической реакции ( Ho< 0, tgα> 0) угол наклона прямой к оси абсцисс положителен, для эндотермических процессов
|
( Ho> 0, |
tgα < 0) отрицателен, для реакций с нулевым тепловым эф- |
|
фектом ( |
Ho= 0, tgα= 0) равен 0 (рис. 11, прямые 1, 2, 3 соответст- |
|
венно). |
1. Для экзотермических процессов Ho< 0 при увеличении тем-
пературы значения Kp уменьшаются, что соответствует смещению
равновесия в сторону обратной (эндотермической) реакции. Например, для реакции синтеза аммиака из азота и водорода,
N2(г) + 3H2 (г) ↔ 2NH3(г),
40
которая является экзотермической ( Ho< 0), первое слагаемое в уравнении (4.4) будет положительным. С повышением температуры его абсолютная величина будет уменьшаться. Это приведет к умень-
|
шению K |
p |
независимо от знака So . |
Уменьшение Kp означает, что в выражении константы равнове-
сия числитель (концентрации продуктов реакции) уменьшается, а знаменатель (концентрации исходных веществ) увеличивается.
Равновесие смещается в сторону обратного эндотермического процесса разложения аммиака.
2. Для эндотермических процессов Ho> 0 при увеличении тем-
пературы значения Kp увеличиваются, что соответствует смещению равновесия в сторону прямой (экзотермической) реакции.
|
Например, в реакции |
|
|
N2O4 (г) ↔ 2 NO2 (г), |
H o = 57,4 кДж. |
Ho> 0, т.е. прямая реакция — эндотермическая. Следовательно, первое слагаемое в уравнении (4.4) отрицательно. При увеличении температуры его абсолютная величина уменьшается и независимо от знака So константа увеличивается.
Увеличение Kp означает, что в выражении константы равнове-
сия числитель (концентрации продуктов реакции) увеличивается, а знаменатель (концентрации исходных веществ) уменьшается. Равновесие смещается в сторону прямой реакции.
Зная знак Ho, можно сказать, в каком направлении будет изменяться константа равновесия при изменении температуры.
Повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты и охлаждением системы, т.е. в сторону эндотермической реакции.
При понижении температуры равновесие смещается в сторону экзотермической реакции.
41
Зная формулу основного уравнения мкт р 1 3 определить как изменится концентрация молекул газа
Идеальный газ — это просто!
Идеальный газ
Идеальный газ — это физическая модель газа, взаимодействие между молекулами которого пренебрежительно мало.
Понятие «идеальный газ» вводится для математического описания поведения газов.
Реальные разреженные газы ведут себя как идеальный газ!
Свойства идеального газа:
— взаимодействие между молекулами пренебрежительно мало
— расстояние между молекулами много больше размеров молекул
— молекулы — это упругие шары
— отталкивание молекул возможно только при соударении
— движение молекул — по законам Ньютона
— давление газа на стенки сосуда — за счет ударов молекул газа
Скорость молекул газа
В теории газов скорость молекул принято определять через среднее значение квадрата скорости молекул.
Хотя скорости различных молекул сильно отличаются друг от друга, но среднее значение квадрата скорости молекул есть величина постоянная.
Формула для расчета среднего значения квадрата скорости молекул газа:
где
n — число молекул в газе
v — модули скоростей отдельных молекул в газе
В теории газов часто используется понятие кинетической энергии молекул.
Используя среднее значение квадрата скорости молекул, получаем формулу для определения средней кинетической энергии молекул:
Основное уравнение МКТ газа
Основное уравнение МКТ связывает микропараметры частиц (массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р — давление, V — объем, Т — температура).
Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Ниже приведены различные выражения для основного уравнения МКТ:
где
р — давление газа на стенки сосуда(Па)
n — концентрация молекул, т.е. число молекул в единице объема ( 1/м 3 )
— масса молекулы (кг)
— средний квадрат скорости молекул (м 2 /с 2 )
ρ — плотность газа (кг/м 3 )
— средняя кинетическая энергия молекул (Дж)
Давление идеального газа на стенки сосуда зависит от концентрации молекул и пропорционально средней кинетической энергии молекул.
Дополнительные расчетные формулы по теме
Формула для расчета концентрации молекул:
где
N — число молекул газа
V — объем газа (м 3 )
Формула для расчета плотности газа:
где
mo — масса молекулы (кг)
n — концентрация молекул (1/м 3 )
Молекулярная физика. Термодинамика — Класс!ная физика
Концентрация молекул идеального газа. Формулы и пример задачи
Газ обладает высокой реакционной способностью по сравнению с жидкими и твердыми телами ввиду большой площади его активной поверхности и высокой кинетической энергии образующих систему частиц. При этом химическая активность газа, его давление и некоторые другие параметры зависят от концентрации молекул. Рассмотрим в данной статье, что это за величина и как ее можно вычислить.
О каком газе пойдет речь?
В данной статье будут рассмотрены так называемые идеальные газы. В них пренебрегают размерами частиц и взаимодействием между ними. Единственным процессом, который происходит в идеальных газах, являются упругие столкновения между частицами и стенками сосуда. Результатом этих столкновений является возникновение абсолютного давления.
Любой реальный газ приближается по своим свойствам к идеальному, если уменьшать его давление или плотность и увеличивать абсолютную температуру. Тем не менее существуют химические вещества, которые даже при низких плотностях и высоких температурах далеки от идеального газа. Ярким и всем известным примером такого вещества является водяной пар. Дело в том, что его молекулы (H2O) являются сильно полярными (кислород оттягивает на себя электронную плотность от атомов водорода). Полярность приводит к появлению существенного электростатического взаимодействия между ними, что является грубым нарушением концепции идеального газа.
Универсальный закон Клапейрона-Менделеева
Чтобы уметь рассчитывать концентрацию молекул идеального газа, следует познакомиться с законом, который описывает состояние любой идеальной газовой системы независимо от ее химического состава. Этот закон носит фамилии француза Эмиля Клапейрона и русского ученого Дмитрия Менделеева. Соответствующее уравнение имеет вид:
Равенство говорит о том, что произведение давления P на объем V всегда для идеального газа должно быть прямо пропорционально произведению температуры абсолютной T на количество вещества n. Здесь R — это коэффициент пропорциональности, который получил название универсальной газовой постоянной. Она показывает величину работы, которую 1 моль газа выполняет в результате расширения, если его на 1 К нагреть (R=8,314 Дж/(моль*К)).
Концентрация молекул и ее вычисление
Согласно определению под концентрацией атомов или молекул понимают количество частиц в системе, которое приходится на единицу объема. Математически можно записать:
Где N — общее число частиц в системе.
Прежде чем записать формулу для определения концентрации молекул газа, вспомним определение количества вещества n и выражение, которое связывает величину R с постоянной Больцмана kB:
Используя эти равенства, выразим отношение N/V из универсального уравнения состояния:
Таким образом мы получили формулу для определения концентрации частиц в газе. Как видно, она прямо пропорционально зависит от давления в системе и обратно пропорционально от абсолютной температуры.
Поскольку количество частиц в системе велико, то концентрацией cN пользоваться неудобно при выполнении практических расчетов. Вместо нее чаще используют молярную концентрацию cn. Она для идеального газа определяется так:
Пример задачи
Необходимо рассчитать молярную концентрацию молекул кислорода в воздухе при нормальных условиях.
Для решения этой задачи вспомним, что в воздухе находится 21 % кислорода. В соответствии с законом Дальтона кислород создает парциальное давление 0,21*P0, где P0 = 101325 Па (одна атмосфера). Нормальные условия также предполагают температуру 0 o C (273,15 К).
Мы знаем все необходимые параметры для вычисления молярной концентрации кислорода в воздухе. Получаем:
Если эту концентрацию привести к объему 1 литр, то мы получим значение 0,009 моль/л.
Чтобы понять, сколько молекул O2 содержится в 1 литре воздуха, следует умножить рассчитанную концентрацию на число NA. Выполнив эту процедуру, получим огромное значение: N(O2) = 5,64*10 21 молекул.
Основное уравнение молекулярно-кинетической теории (МКТ) с выводом
В статье рассмотрена модель идеального газа, приведено основное уравнение молекулярно-кинетической теории и его вывод.
Чтобы объяснить свойства материи в газообразном состоянии, в физике применяется модель идеального газа. Идеальный газ — разреженный, состоящий из одного типа атомов газ, частицы которого не взаимодействуют между собой. Помимо основных положений МКТ эта модель предполагает, что:
- молекулы имеют пренебрежимо малый объем в сравнении с объемом емкости
- при сближении частиц друг с другом и с границами емкости имеют место силы отталкивания
Основное уравнение молекулярно-кинетической теории
Физический смысл основного уравнения МКТ заключается в том, что давление идеального газа — это совокупность всех ударов молекул о стенки сосуда. Это уравнение можно выразить через концентрацию частиц, их среднюю скорость и массу одной частицы:
p – давление молекул газа на границы емкости,
m0 – масса одной молекулы,
n — концентрация молекул, число частиц N в единице объема V;
v 2 — средне квадратичная скорость молекул.
Вывод основного уравнения МКТ
Частицы идеального газа при соударениях с границами емкости ведут себя как упругие тела. Такое взаимодействие описывается согласно законам механики. При соприкосновении частицы с границей емкости проекция vx скоростного вектора на ось ОХ, проходящую под прямым углом к границе сосуда, меняет свой знак на противоположный, но сохраняется неизменной по модулю:
Поэтому после соударения частицы с границей емкости проекция импульса молекулы на ось ОХ меняется с mv1x = –mvx на mv2x = mvx.
Изменение импульса молекулы ΔP равняется удвоенному произведению массы молекулы на ее скорость:
Поскольку в каждом из шести основных направлений декартовой системы координат (вверх, вниз, вперед, назад, вправо, влево) движется одна шестая часть частиц N/6. Тогда число частиц, которые сталкиваются с каждой стенкой за время Δt равно:
S – площадь этой стенки
n — концентрация частиц
Давление p равно отношению силы F к площади S, на которую действует эта сила:
Суммарная сила, с которой частицы давят на стенку равна отношению произведения числа этих частиц N и изменения импульса ΔP ко времени, в течение которого происходит давление:
Исходя из вышенаписанного получаем:
Если заменить среднее значение кинетической энергии поступательного движения молекул — E:
и подставить эту формулу в основное уравнение МКТ, получим давление идеального газа:
Давление идеального газа равняется двум третям средней кинетической энергии поступательного движения молекул на единицу объема. При решении задач реальный газ можно считать идеальным газом, если он одноатомный и можно пренебречь взаимодействием между частицами.
Понравилась статья, расскажите о ней друзьям:
Идеальный газ. Формула концентрации молекул газа. Пример задачи
В физике текучих субстанций большое внимание уделяется изучению газов, которое осуществляют при помощи использования модели идеального газа. В этой области было открыто много законов. В приведенной ниже статье изучим формулу концентрации молекул газа (идеального) и покажем, как ее следует применять при решении практической проблемы.
Идеальный газ
Что же это такое? Прежде чем записать формулу концентрации молекул газа, расскажем, что собой представляет модель идеального газа. В соответствии с кинетической теорией текучих субстанций, в таких веществах молекулы и атомы движутся хаотически по прямым траекториям. Расстояния между ними намного больше, чем их собственные линейные размеры, поэтому последними пренебрегают при выполнении вычислений. Кроме того, считают, что взаимодействий между молекулами не существует, поскольку их кинетическая энергия слишком велика по сравнению со слабыми потенциальными взаимодействиями.
Любые реальные газы, которые находятся при низких давлениях и достаточно высоких абсолютных температурах, по своему поведению приближаются к описанной модели. Тем не менее существуют текучие субстанции, у которых помимо ван-дер-ваальсовых взаимодействий между частицами действуют взаимодействия более сильного характера. Примером является водяной пар, у которого молекулы друг с другом связаны водородными (полярными) связями. Для описания поведения таких субстанций нельзя использовать модель идеального газа.
Универсальное уравнение
Модель идеального газа удобна при выполнении практических расчетов тем, что уравнение состояния вещества, полученное на ее основе, связывает три термодинамических параметра: температуру T, объем системы V и абсолютное давление P. Это уравнение записано ниже:
Где R — постоянная, равная 8,314 Дж/(моль*К), n — количество вещества.
Современная молекулярно-кинетическая теория газов позволяет путем несложных рассуждений и математических выкладок получить теоретически это уравнение. Впервые же оно было записано в результате анализа многочисленных экспериментов, которые в течение двух веков выполняли европейские ученые, начиная от Роберта Бойля (вторая половина XVII века) и заканчивая Амедео Авогадро (начало XIX века).
Считается, что уравнение состояния идеального газа первым получил Эмиль Клапейрон, а к современной форме его привел русский химик Дмитрий Менделеев, поэтому его часто называют законом Клапейрона-Менделеева.
Понятие о концентрации молекул: виды концентраций
Когда изучают текучие субстанции, то знать концентрации компонентов, которые их образуют, является важным при решении многих практических задач. Например, от этого показателя и размеров молекул зависит общая площадь поверхности активного вещества, а значит, его реакционная способность. Другой пример, концентрация некоторых веществ в воздухе определяет допустимые их пределы для нормального протекания жизненно необходимых процессов в организме человека.
В случае газов, как правило, пользуются тремя следующими концентрациями:
- Атомная. Она определяется, как процентное содержание количества атомов или молекул компонента по отношению к объему всей системы.
- Массовая. Показывает отношение массы компонента к объему газа.
- Молярная. Она равна отношению количества вещества изучаемого компонента к объему системы.
Заметим, что все виды концентраций вычисляются по отношению к объему системы. Справедливость этих величин действительна, поскольку каждый компонент системы полностью заполняет ее объем.
Среди всех типов концентраций наиболее удобной на практике является молярная. Ниже в статье приведем формулу именно для нее.
Формула концентрации молекул газа
В соответствии с приведенным в предыдущем пункте определением, молярная концентрация i-го компонента системы cn(i) вычисляется так:
Предположим, что мы имеем однокомпонентный (чистый) газ. Это может быть кислород, азот, гелий и так далее. В этом случае можно применить формулу Клапейрона-Менделеева и выразить из нее молярную концентрацию молекул. Имеем:
cn = n / V = P / (R * T).
Из записанной формулы концентрации молекул газа легко получить атомную (молекулярную) концентрацию. Покажем, как это делается:
Здесь NA и kB — число Авогадро и постоянная Больцмана. Соответственно, N — число молекул в системе. Поскольку величина kB имеет маленькое значение (1,38 * 10 -23 ), то cN принимает огромные значения, что неудобно для ее практического использования.
Пример задачи
В результате изобарного нагрева закрытой системы с идеальным газом его температура увеличилась на 100 К и стала равной 400 К. Как изменится концентрация молекул газа, если давление в системе составляет 1,5 атмосферы.
Поскольку давление в процессе нагрева не изменилось, а температура была равна 300 К согласно условию задачи, то молярная концентрацию молекул до нагрева системы составляла:
cn1 = 1,5 * 101 325 / (8,314 * 300) = 60,9 моль/м 3 .
Число молекул в системе не изменилось при нагреве, так как система является закрытой. После нагрева газа его концентрация составила:
cn2 = 1,5 * 101 325 / (8,314 * 400) = 45,7 моль/м 3 .
Изменение концентрации составило:
Отрицательный знак говорит, что концентрация уменьшилась, что является очевидным, поскольку увеличился объем системы после нагрева, а число частиц в ней осталось прежним.
http://fb.ru/article/458827/kontsentratsiya-molekul-idealnogo-gaza-formulyi-i-primer-zadachi
http://people-ask.ru/nauki/fizika/osnovnoe-uravnenie-molekulyarno-kineticheskoj-teorii-mkt-s-vivodom
http://www.syl.ru/article/459392/idealnyiy-gaz-formula-kontsentratsii-molekul-gaza-primer-zadachi
В статье рассмотрена модель идеального газа, приведено основное уравнение молекулярно-кинетической теории и его вывод.
Чтобы объяснить свойства материи в газообразном состоянии, в физике применяется модель идеального газа. Идеальный газ — разреженный, состоящий из одного типа атомов газ, частицы которого не взаимодействуют между собой. Помимо основных положений МКТ эта модель предполагает, что:
- молекулы имеют пренебрежимо малый объем в сравнении с объемом емкости
- при сближении частиц друг с другом и с границами емкости имеют место силы отталкивания
Основное уравнение молекулярно-кинетической теории
Физический смысл основного уравнения МКТ заключается в том, что давление идеального газа — это совокупность всех ударов молекул о стенки сосуда. Это уравнение можно выразить через концентрацию частиц, их среднюю скорость и массу одной частицы:

- p – давление молекул газа на границы емкости,
- m0 – масса одной молекулы,
- n — концентрация молекул, число частиц N в единице объема V;
- v2 — средне квадратичная скорость молекул.
Вывод основного уравнения МКТ

Частицы идеального газа при соударениях с границами емкости ведут себя как упругие тела. Такое взаимодействие описывается согласно законам механики. При соприкосновении частицы с границей емкости проекция vx скоростного вектора на ось ОХ, проходящую под прямым углом к границе сосуда, меняет свой знак на противоположный, но сохраняется неизменной по модулю:
Поэтому после соударения частицы с границей емкости проекция импульса молекулы на ось ОХ меняется с mv1x = –mvx на mv2x = mvx.
Изменение импульса молекулы ΔP равняется удвоенному произведению массы молекулы на ее скорость:
Поскольку в каждом из шести основных направлений декартовой системы координат (вверх, вниз, вперед, назад, вправо, влево) движется одна шестая часть частиц N/6. Тогда число частиц, которые сталкиваются с каждой стенкой за время Δt равно:

- S – площадь этой стенки
- n — концентрация частиц
- Давление p равно отношению силы F к площади S, на которую действует эта сила:

Суммарная сила, с которой частицы давят на стенку равна отношению произведения числа этих частиц N и изменения импульса ΔP ко времени, в течение которого происходит давление:

Исходя из вышенаписанного получаем:

Тогда

Если заменить среднее значение кинетической энергии поступательного движения молекул — E:

и подставить эту формулу в основное уравнение МКТ, получим давление идеального газа:

Давление идеального газа равняется двум третям средней кинетической энергии поступательного движения молекул на единицу объема. При решении задач реальный газ можно считать идеальным газом, если он одноатомный и можно пренебречь взаимодействием между частицами.
Источник: https://people-ask.ru/nauki/fizika/osnovnoe-uravnenie-molekulyarno-kineticheskoj-teorii-mkt-s-vivodom
II. Молекулярная физика
Вещество состоит из частиц.
Молекула — это самая маленькая частица вещества, которая обладает его основными химическими свойствами.
Молекула состоит из атомов. Атом — наименьшая частица вещества, которая не делится при химических реакциях.

Многие молекулы состоят из двух или больше атомов, удерживаемых вместе химическими связями. Некоторые молекулы состоят из сотен тысяч атомов.
Второе положение молекулярно-кинетической теории
Молекулы находятся в непрерывном хаотическом движении. Это движение не зависит от внешних воздействий. Движение происходит в непредсказуемом направлении из-за столкновения молекул. Доказательством является броуновское движение частиц (открыто Р.Броуном 1827г). Частицы помещают в жидкость или газ и наблюдают их непредсказуемое движение из-за соударений с молекулами вещества.
Броуновское движение
Доказательством хаотического движения является диффузия — проникновение молекул одного вещества в промежутки между молекулами другого вещества. Например, запах освежителя воздуха мы ощущаем не только в том месте, где его распылили, но он постепенно перемешивается с молекулами воздуха во всей комнате.
Агрегатное состояние вещества
В газах среднее расстояние между молекулами в сотни раз превышает их размеры. В основном молекулы движутся поступательно и равномерно. После столкновений начинают вращаться.

В жидкостях расстояние между молекулами значительно меньше. Молекулы совершают колебательное и поступательное движения. Молекулы через малые промежутки времени скачкообразно переходят в новые положения равновесия (мы наблюдаем текучесть жидкости).

В твердых телах молекулы колеблются и очень редко перемещаются (только при увеличении температуры).

Третье положение молекулярно-кинетической теории
Между молекулами существуют силы взаимодействия, которые имеют электромагнитную природу. Эти силы позволяют объяснить возникновение сил упругости. Когда вещество сжимают, молекулы сближаются, между ними возникает сила отталкивания, когда внешние силы отдаляют молекулы друг от друга (растягивают вещество), между ними возникает сила притяжения.
Плотность вещества
Это скалярная величина, которая определяется по формуле


Плотность веществ — известные табличные значения
Химические характеристики вещества
Постоянная Авогадро NA — число атомов, содержащихся в 12г изотопа углерода

Количество вещества — это отношение числа элементов этого вещества к постоянной Авогадро

- 1 моль любого вещества содержит одинаковое число частиц, это число равно постоянной Авогадро.
- Молярная масса M — это масса одного моля вещества
- Если тело состоит из N молекул массой m0, то масса тела
- Концентрация частиц — это количество частиц в объеме
- Можно вывести формулы
Источник: http://fizmat.by/kursy/molekuljarnaja/polozhenija_mkt
Молекулярно-кинетическая теория идеального газа. Основные положения
Молекулы в идеальном газе движутся хаотически. Движение одной молекулы характеризуют микроскопические параметры (масса молекулы, ее скорость, импульс, кинетическая энергия).
Свойства газа как целого описываются с помощью макроскопических параметров (масса газа, давление, объем, температура).
Молекулярно-кинетическая теория устанавливает взаимосвязь между микроскопическими и макроскопическими параметрами.
Число молекул в идеальном газе столь велико, что закономерности их поведения можно выяснить только с помощью статистического метода. Равномерное распределение в пространстве молекул идеального газа является наиболее вероятным состоянием газа, т. е. наиболее часто встречающимся.
Распределение молекул идеального газа по скоростям при определенной температуре является статистической закономерностью.
Наиболее вероятная скорость молекул — скорость, которой обладает максимальное число молекул. Стационарное равновесное состояние газа — состояние, в котором число молекул в заданном интервале скоростей остается постоянным.
Температура тела — мера средней кинетической энергии поступательного движения его молекул:

- где черта сверху — знак усреднения по скоростям, k = 1,38 • 10-23 Дж/К — постоянная Больцмана.
- Единица термодинамической температуры — кельвин (К).
- При абсолютном нуле температуры средняя кинетическая энергия молекул равна нулю.
- Средняя квадратичная (тепловая) скорость молекул газа

где М — молярная масса, R = 8,31 Дж/(К • моль) — молярная газовая постоянная.
Давление газа — следствие ударов движущихся молекул:

где n — концентрация молекул (число молекул в единице объема), Ek — средняя кинетическая энергия молекулы.
Давление газа пропорционально его температуре:

Постоянная Лошмидта — концентрация идеального газа при нормальных условиях (атмосферное давление р= 1,01 • 105 Па и температура Т = 273 К):

Уравнение Клапейрона—Менделеева — уравнение состояния идеального газа, связывающее три макроскопических параметра (давление, объем, температуру) данной массы газа.

Изопроцесс — процесс, при котором один из макроскопических параметров состояния данной массы газа остается постоянным. Изотермический процесс — процесс изменения состояния определенной массы газа при постоянной температуре.
Закон Бойля—Мариотта: для газа данной массы при постоянной температуре:

где р1, р2, V1, V2 — давление и объем газа в начальном и конечном состояниях
Изотерма — график изменения макроскопических параметров газа при изотермическом процессе. Изобарный процесс — процесс изменения состояния определенной массы газа при постоянном давлении.
Закон Гей-Люссака: для газа данной массы при постоянном давлении

- где V1, V2, T1, Т2— объем и температура газа в начальном и конечном состояниях.
- Изобара — график изменения макроскопических параметров газа при изобарном процессе.
- Изохорный процесс — процесс изменения состояния определенной массы газа при постоянном объеме. Закон Шарля: для газа данной массы при постоянном объеме

где p1, р2, T1, Т2 — давление и температура газа в начальном и конечном состояниях.
Изохора — график изменения макроскопических параметров газа при изохорном процессе.
Источник: https://5terka.com/molekulyarno-kineticheskaya-teoriya-idealnogo-gaza-osnovnye-polozheniya
Идеальный газ. Формула концентрации молекул газа. Пример задачи :
В физике текучих субстанций большое внимание уделяется изучению газов, которое осуществляют при помощи использования модели идеального газа. В этой области было открыто много законов. В приведенной ниже статье изучим формулу концентрации молекул газа (идеального) и покажем, как ее следует применять при решении практической проблемы.
Идеальный газ

Что же это такое? Прежде чем записать формулу концентрации молекул газа, расскажем, что собой представляет модель идеального газа. В соответствии с кинетической теорией текучих субстанций, в таких веществах молекулы и атомы движутся хаотически по прямым траекториям. Расстояния между ними намного больше, чем их собственные линейные размеры, поэтому последними пренебрегают при выполнении вычислений. Кроме того, считают, что взаимодействий между молекулами не существует, поскольку их кинетическая энергия слишком велика по сравнению со слабыми потенциальными взаимодействиями.
Любые реальные газы, которые находятся при низких давлениях и достаточно высоких абсолютных температурах, по своему поведению приближаются к описанной модели.
Тем не менее существуют текучие субстанции, у которых помимо ван-дер-ваальсовых взаимодействий между частицами действуют взаимодействия более сильного характера.
Примером является водяной пар, у которого молекулы друг с другом связаны водородными (полярными) связями. Для описания поведения таких субстанций нельзя использовать модель идеального газа.

Универсальное уравнение
- Модель идеального газа удобна при выполнении практических расчетов тем, что уравнение состояния вещества, полученное на ее основе, связывает три термодинамических параметра: температуру T, объем системы V и абсолютное давление P. Это уравнение записано ниже:
- P * V = n * R * T.
- Где R — постоянная, равная 8,314 Дж/(моль*К), n — количество вещества.
Современная молекулярно-кинетическая теория газов позволяет путем несложных рассуждений и математических выкладок получить теоретически это уравнение.
Впервые же оно было записано в результате анализа многочисленных экспериментов, которые в течение двух веков выполняли европейские ученые, начиная от Роберта Бойля (вторая половина XVII века) и заканчивая Амедео Авогадро (начало XIX века).
Считается, что уравнение состояния идеального газа первым получил Эмиль Клапейрон, а к современной форме его привел русский химик Дмитрий Менделеев, поэтому его часто называют законом Клапейрона-Менделеева.

Понятие о концентрации молекул: виды концентраций
Когда изучают текучие субстанции, то знать концентрации компонентов, которые их образуют, является важным при решении многих практических задач.
Например, от этого показателя и размеров молекул зависит общая площадь поверхности активного вещества, а значит, его реакционная способность.
Другой пример, концентрация некоторых веществ в воздухе определяет допустимые их пределы для нормального протекания жизненно необходимых процессов в организме человека.
В случае газов, как правило, пользуются тремя следующими концентрациями:
- Атомная. Она определяется, как процентное содержание количества атомов или молекул компонента по отношению к объему всей системы.
- Массовая. Показывает отношение массы компонента к объему газа.
- Молярная. Она равна отношению количества вещества изучаемого компонента к объему системы.
Заметим, что все виды концентраций вычисляются по отношению к объему системы. Справедливость этих величин действительна, поскольку каждый компонент системы полностью заполняет ее объем.
Среди всех типов концентраций наиболее удобной на практике является молярная. Ниже в статье приведем формулу именно для нее.
Формула концентрации молекул газа
В соответствии с приведенным в предыдущем пункте определением, молярная концентрация i-го компонента системы cn(i) вычисляется так:
cn(i) = ni / V.
Предположим, что мы имеем однокомпонентный (чистый) газ. Это может быть кислород, азот, гелий и так далее. В этом случае можно применить формулу Клапейрона-Менделеева и выразить из нее молярную концентрацию молекул. Имеем:
- P * V = n * R * T =>
- cn = n / V = P / (R * T).
- Из записанной формулы концентрации молекул газа легко получить атомную (молекулярную) концентрацию. Покажем, как это делается:
- cn = n / V = N / (NA * V) = cN / NA =>
- cN = cn * NA = NA * P / (R * T) = P / (kB * T).
Здесь NA и kB — число Авогадро и постоянная Больцмана. Соответственно, N — число молекул в системе. Поскольку величина kB имеет маленькое значение (1,38 * 10-23), то cN принимает огромные значения, что неудобно для ее практического использования.
Пример задачи
В результате изобарного нагрева закрытой системы с идеальным газом его температура увеличилась на 100 К и стала равной 400 К. Как изменится концентрация молекул газа, если давление в системе составляет 1,5 атмосферы.

- Поскольку давление в процессе нагрева не изменилось, а температура была равна 300 К согласно условию задачи, то молярная концентрацию молекул до нагрева системы составляла:
- cn1 = 1,5 * 101 325 / (8,314 * 300) = 60,9 моль/м3.
- Число молекул в системе не изменилось при нагреве, так как система является закрытой. После нагрева газа его концентрация составила:
- cn2 = 1,5 * 101 325 / (8,314 * 400) = 45,7 моль/м3.
- Изменение концентрации составило:
- Δcn = cn2 — cn1 = 45,7 — 60,9 = -15,2 моль/м3.
- Отрицательный знак говорит, что концентрация уменьшилась, что является очевидным, поскольку увеличился объем системы после нагрева, а число частиц в ней осталось прежним.
Источник: https://www.syl.ru/article/459392/idealnyiy-gaz-formula-kontsentratsii-molekul-gaza-primer-zadachi
Урок 15. Моляльность и молярность – HIMI4KA
Архив уроков › Основные законы химии
В уроке 15 «Моляльность и молярность» из курса «Химия для чайников» рассмотрим понятия растворитель и растворенное вещество научимся выполнять расчет молярной и моляльной концентрации, а также разбавлять растворы. Невозможно объяснить что такое моляльность и молярность, если вы не знакомы с понятием моль вещества, поэтому не поленитесь и прочитайте предыдущие уроки. Кстати, в прошлом уроке мы разбирали задачи на выход реакции, посмотрите если вам интересно.
Химикам нередко приходится работать с жидкими растворами, так как это благоприятная среда для протекания химических реакций. Жидкости легко смешивать, в отличие от кристаллических тел, а также жидкость занимает меньший объем, по сравнению с газом.
Благодаря этим достоинствам, химические реакции могут осуществляться гораздо быстрее, так как исходные реагенты в жидкой среде часто сближаются и сталкиваются друг с другом.
В прошлых уроках мы отмечали, что вода относится к полярным жидкостям, и потому является неплохим растворителем для проведения химических реакций.
Молекулы H2O, а также ионы H+ и OH—, на которых вода диссоциирована в небольшой степени, могут способствовать запуску химические реакций, благодаря поляризации связей в других молекулах или ослаблению связи между атомами. Вот почему жизнь на Земле зародилась не на суше или в атмосфере, а именно в воде.
Растворитель и растворенное вещество
Раствор может быть образован путем растворения газа в жидкости или твердого тела в жидкости.
В обоих случаях жидкость является растворителем, а другой компонент — растворенное вещество.
Когда раствор образован путем смешивания двух жидкостей, растворителем считается та жидкость, которая находится в большем количестве, иначе говоря имеет бОльшую концентрацию.
Расчет концентрации раствора
Молярная концентрация
Концентрацию можно выражать по разному, но наиболее распространенный способ — указание его молярности. Молярная концентрация (молярность) — это число молей растворенного вещества в 1 литре раствора.
Единица молярности обозначается символом M. Например два моля соляной кислоты на 1 литр раствора обозначается 2 М HCl. Кстати, если на 1 литр раствора приходится 1 моль растворенного вещества, тогда раствор называется одномолярным.
Молярная концентрация раствора обозначается различными символами:
- cx, Смx, [x], где x — растворенное вещество
Формула для вычисления молярной концентрации (молярности):
где n — количество растворенного вещества в молях, V — объем раствора в литрах.
Пару слов о технике приготовления растворов нужной молярности. Очевидно, что если добавить к одному литру растворителя 1 моль вещества, общий объем раствора будет чуть больше одного литра, и потому будет ошибкой считать полученный раствор одномолярным.
Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л.
Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Пример 1. Химичка дала задание растворить в литре воды 264 г сульфата аммония (NH4)2SO4, а затем вычислить молярность полученного раствора и его объем, основываясь на предположении об аддитивности объемов. Плотность сульфата аммония равна 1,76 г/мл.
Решение:
Определим объем (NH4)2SO4 до растворения:
- 264 г / 1,76 г/мл = 150 мл = 0,150 л
Пользуясь правилом аддитивности объемов, найдем окончательный объем раствора:
- 1,000 л + 0,150 л = 1,150 л
Число молей растворенного сульфата аммония равно:
- 264 г / 132 г/моль = 2,00 моля (NH4)2SO4
Завершающий шаг! Молярность раствора равна:
- 2,000 / 1,150 л = 1,74 моль/л, т.е 1,74 М (NH4)2SO4
Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности раствора. Например, в примере 1, объем полученного раствора на самом деле имеет молярную концентрацию равную 1,8 М, т.е погрешность наших расчетов составляет 3,3%.
Моляльная концентрация
Наряду с молярностью, химики используют моляльность, или моляльную концентрацию, в основе которой учитывается количество использованного растворителя, а не количество образующегося раствора.
Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя (а не раствора!). Моляльность выражается в моль/кг и обозначается маленькой буквой m.
Формула для вычисления моляльной концентрации:
где n — количество растворенного вещества в молях, m — масса растворителя в кг
Для справки отметим, что 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.
Пример 2. Химичка попросила определить моляльность раствора, полученного при растворении 5 г уксусной кислоты C2H4O2 в 1 л этанола. Плотность этанола равна 0,789 г/мл.
Решение:
Число молей уксусной кислоты в 5 г равно:
- 5,00 г / 60,05 г/моль = 0,833 моля C2H4O2
Масса 1 л этанола равна:
- 1,000 л × 0,789 кг/л = 0,789 кг этанола
Последний этап. Найдем моляльность полученного раствора:
- 0,833 моля / 0,789 кг растворителя = 0,106 моль/кг
Единица моляльности обозначается Мл, поэтому ответ также можно записать 0,106 Мл.
Разбавление растворов
В химической практике часто занимаются разбавлением растворов, т.е добавлением растворителя. Просто нужно запомнить, что число молей растворенного вещества при разбавлении раствора остается неизменным. И еще запомните формулу правильного разбавления раствора:
- Число молей растворенного вещества = c1V1 = c2V2
где с1 и V1 — молярная концентрация и объем раствора до разбавления, с2 и V2 — молярная концентрация и объем раствора после разбавления. Рассмотрите задачи на разбавление растворов:
Пример 3. Определите молярность раствора, полученного разбавлением 175 мл 2,00 М раствора до 1,00 л.
Решение:
В условие задача указаны значения с1, V1 и V2, поэтому пользуясь формулой разбавления растворов, выразим молярную концентрацию полученного раствора с2
- с2 = c1V1 / V2 = (2,00 М × 175 мл) / 1000 мл = 0,350 М
Пример 4 самостоятельно. До какого объема следует разбавить 5,00 мл 6,00 М раствора HCl, чтобы его молярность стала 0,1 М?
Ответ: V2 = 300 мл
Без сомнения, вы и сами догадались, что урок 15 «Моляльность и молярность» очень важный, ведь 90% все лабораторных по химии связаны с приготовлением растворов нужной концентрации. Поэтому проштудируйте материал от корки до корки. Если у вас возникли вопросы, пишите их в комментарии.
Источник: https://himi4ka.ru/arhiv-urokov/urok-15-moljalnost-i-moljarnost.html
ФизМат
Основные положения молекулярно-кинетической теории и их экспериментальное обоснование.
Молекулярно-кинетическая теория — это раздел физики, изучающий свойства различных состояний вещества, основывающийся на представлениях о существовании молекул и атомов как мельчайших частиц вещества. В основе МКТ лежат три основных положения:
1. Все вещества состоят из мельчайших частиц: молекул, атомов или ионов.
2. Эти частицы находятся в непрерывном хаотическом движении, скорость которого определяет температуру вещества.
3. Между частицами существуют силы притяжения и отталкивания, характер которых зависит от расстояния между ними.
Основные положения МКТ подтверждаются многими опытными фактами. Существование молекул, атомов и ионов доказано экспериментально, молекулы достаточно изучены и даже сфотографированы с помощью электронных микроскопов. Способность газов неограниченно расширяться и занимать весь предоставленный им объем объясняется непрерывным хаотическим движением молекул. Упругость газов, твердых и жидких тел, способность жидкостей смачивать некоторые твердые тела, процессы окрашивания, склеивания, сохранения формы твердыми телами и многое другое говорят о существовании сил притяжения и отталкивания между молекулами. Явление диффузии — способность молекул одного вещества проникать в промежутки между молекулами другого — тоже подтверждает основные положения МКТ. Явлением диффузии объясняется, например, распространение запахов, смешивание разнородных жидкостей, процесс растворения твердых тел в жидкостях, сварка металлов путем их расплавления или путем давления. Подтверждением непрерывного хаотического движения молекул является также и броуновское движение — непрерывное хаотическое движение микроскопических частиц, нерастворимых в жидкости.
Движение броуновских частиц объясняется хаотическим движением частиц жидкости, которые сталкиваются с микроскопическими частицами и приводят их в движение. Опытным путем было доказано, что скорость броуновских частиц зависит от температуры жидкости. Теорию броуновского движения разработал А. Эйнштейн. Законы движения частиц носят статистический, вероятностный характер. Известен только один способ уменьшения интенсивности броуновского движения — уменьшение температуры. Существование броуновского движения убедительно подтверждает движение молекул.
Любое вещество состоит из частиц, поэтому количество вещества v принято считать пропорциональным числу частиц, т. е. структурных элементов, содержащихся в теле.
Размеры и массы молекул.
Средняя масса молекул обычно определяется химическими методами, постоянная Авогадро с высокой точностью определена несколькими физическими методами. Массы молекул и атомов со значительной степенью точности определяются с помощью масс-спектрографа.
Массы молекул очень малы. Например, масса молекулы воды:
Молярная масса связана с относительной молекулярной массой Мг. Относительная молекулярная масса — это величина, равная отношению массы молекулы данного вещества к 1/12 массы атома углерода С12. Если известна химическая формула вещества, то с помощью таблицы Менделеева может быть определена его относительная масса, которая, будучи выражена в килограммах, показывает величину молярной массы этого вещества.
Диаметром молекулы принято считать минимальное расстояние, на которое им позволяют сблизиться силы отталкивания. Однако понятие размера молекулы является условным. Средний размер молекул порядка 10^-10м.
Моль.
Единицей количества вещества является моль. Моль — это количество вещества, содержащее столько же структурных элементов любого вещества, сколько содержится атомов в 12 г углерода С12.
Число Авогадро.
Отношение числа молекул вещества к количеству вещества называют постоянной Авогадро:
Постоянная Авогадро показывает, сколько атомов и молекул содержится в одном моле вещества. Молярная масса — масса одного моля вещества, равная отношению массы вещества к количеству вещества:
М = m/v.
Молярная масса выражается в кг/моль. Зная молярную массу, можно вычислить массу одной молекулы:
Опыт Штерна.
Опыт Штерна — опыт, впервые проведённый немецким физиком Отто Штерном в 1920 году. Опыт являлся одним из первых практических доказательств состоятельности молекулярно-кинетической теории строения вещества. В нём были непосредственно измерены скорости теплового движения молекул и подтверждено наличие распределения молекул газов по скоростям.
Для проведения опыта Штерном был подготовлен прибор, состоящий из двух цилиндров разного радиуса, ось которых совпадала и на ней располагалась платиновая проволока с нанесённым слоем серебра. В пространстве внутри цилиндров посредством непрерывной откачки воздуха поддерживалось достаточно низкое давление.
При пропускании электрического тока через проволоку достигалась температура плавления серебра, из-за чего атомы начинали испаряться и летели к внутренней поверхности малого цилиндра равномерно и прямолинейно со скоростью v, соответствующей подаваемому на концы нити напряжению.
Во внутреннем цилиндре была проделана узкая щель, через которую атомы могли беспрепятственно пролетать далее. Стенки цилиндров специально охлаждались, что способствовало оседанию попадающих на них атомов.
В таком состоянии на внутренней поверхности большого цилиндра образовывалась достаточно чёткая узкая полоса серебряного налёта, расположенная прямо напротив щели малого цилиндра. Затем всю систему начинали вращать с некой достаточно большой угловой скоростью ω.
При этом полоса налёта смещалась в сторону, противоположную направлению вращения, и теряла чёткость. Измерив смещение sнаиболее тёмной части полосы от её положения, когда система покоилась, Штерн определил время полёта, через которое нашёл скорость движения молекул:
,
где s — смещение полосы, l — расстояние между цилиндрами, а u — скорость движения точек внешнего цилиндра.
Найденная таким образом скорость движения атомов серебра совпала со скоростью, рассчитанной по законам молекулярно-кинетической теории, а тот факт, что получившаяся полоска была размытой, свидетельствовал в пользу того, что скорости атомов различны и распределены по некоторому закону — закону распределения Максвелла: атомы, двигавшиеся быстрее, смещались относительно полосы, полученной в состоянии покоя, на меньшие расстояния, чем те, которые двигались медленнее.
Модель идеального газа.

Основные уравнения молекулярно-кинетической теории идеального газа.
Идеальный газ
Идеальный газ — это физическая модель газа, взаимодействие между молекулами которого пренебрежительно мало.
— вводится для математического описания поведения газов. Реальные разреженные газы ведут себя как идеальный газ!
Свойства идеального газа:
— взаимодействие между молекулами пренебрежительно мало
— расстояние между молекулами много больше размеров молекул
— молекулы — это упругие шары
— отталкивание молекул возможно только при соударении
— движение молекул — по законам Ньютона
— давление газа на стенки сосуда — за счет ударов молекул газа
Скорость молекул газа
В теории газов скорость молекул принято определять через среднее значение квадрата скорости молекул. Хотя скорости различных молекул сильно отличаются друг от друга, но среднее значение квадрата скорости молекул есть величина постоянная.
Формула для расчета среднего значения квадрата скорости молекул газа:
V^2 = (v1^2 + v2^2 +…+vn^2)/n
где
n — число молекул в газе
v — модули скоростей отдельных молекул в газе В теории газов часто используется понятие кинетической энергии молекул.
Используя среднее значение квадрата скорости молекул, получаем формулу для определения средней кинетической энергии молекул:
Основное уравнение МКТ газа
Основное уравнение МКТ связывает микропараметры частиц ( массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р — давление, V — объем, Т — температура).
Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Ниже приведены различные выражения для основного уравнения МКТ:
P=F/s=1/3 * n * m0 * V^2 = 1/3 * ρ * v^2 = 2/3*n*Ek
где P — давление газа на стенки сосуда(Па) n — концентрация молекул, т.е. число молекул в единице объема ( 1/м3) m0 — масса молекулы (кг) V^2 — средний квадрат скорости молекул ( м2/с2) ρ — плотность газа (кг/м3) Ek — средняя кинетическая энергия молекул (Дж)
Давление идеального газа на стенки сосуда зависит от концентрации молекул и пропорционально средней кинетической энергии молекул.
- Дополнительные расчетные формулы по теме
-
Формула для расчета концентрации молекул:
- n=N/V
где N — число молекул газа
V — объем газа (м3)
Формула для расчета плотности газа:
ρ = m0*n
где mo — масса молекулы (кг)
n — концентрация молекул (1/м3)
Закон Дальтона.
Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений.
При постоянной температуре растворимость в данной жидкости каждого из компонентов газовой смеси, находящейся над жидкостью, пропорциональна их парциальному давлению.
Источник: http://fizmatinf.blogspot.com/2013/05/20.html
Идеальный газ. Основное уравнение МКТ. Молекулярная физика — Класс!ная физика
Идеальный газ — это просто!
Идеальный газ
Идеальный газ — это физическая модель газа, взаимодействие между молекулами которого пренебрежительно мало. Понятие «идеальный газ» вводится для математического описания поведения газов.
Реальные разреженные газы ведут себя как идеальный газ!
- Свойства идеального газа:
- — давление газа на стенки сосуда — за счет ударов молекул газа
- Скорость молекул газа
— взаимодействие между молекулами пренебрежительно мало — расстояние между молекулами много больше размеров молекул — молекулы — это упругие шары — отталкивание молекул возможно только при соударении — движение молекул — по законам Ньютона
В теории газов скорость молекул принято определять через среднее значение квадрата скорости молекул. Хотя скорости различных молекул сильно отличаются друг от друга, но среднее значение квадрата скорости молекул есть величина постоянная.
Формула для расчета среднего значения квадрата скорости молекул газа:
- где n — число молекул в газе v — модули скоростей отдельных молекул в газе В теории газов часто используется понятие кинетической энергии молекул.
- Используя среднее значение квадрата скорости молекул, получаем формулу для определения средней кинетической энергии молекул:
Основное уравнение МКТ связывает микропараметры частиц (массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р — давление, V — объем, Т — температура). Давление газа на стенки сосуда пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
Ниже приведены различные выражения для основного уравнения МКТ:
где р — давление газа на стенки сосуда(Па)
n — концентрация молекул, т.е. число молекул в единице объема ( 1/м3)
— масса молекулы (кг) — средний квадрат скорости молекул (м2/с2) ρ — плотность газа (кг/м3) — средняя кинетическая энергия молекул (Дж)
- Давление идеального газа на стенки сосуда зависит от концентрации молекул и пропорционально средней кинетической энергии молекул.
- Дополнительные расчетные формулы по теме
- Формула для расчета концентрации молекул:
- где N — число молекул газа
- V — объем газа (м3)
- Формула для расчета плотности газа:
где mo — масса молекулы (кг) n — концентрация молекул (1/м3)
Назад в раздел «10-11 класс»
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. — Взаимодействие молекул. Строение твердых тел, жидкостей и газов. — Идеальный газ. Основное уравнение МКТ. — Температура. Тепловое равновесие.
Абсолютная шкала температур. — Уравнение состояния идеального газа. — Изопроцессы. Газовые законы. — Взаимные превращения жидкостей и газов. Влажность воздуха. — Твердые тела. Кристаллические тела. Аморфные тела.
Источник: http://class-fizika.ru/10_27.html
Урок 18. основное уравнение мкт — Физика — 10 класс — Российская электронная школа
- Физика, 10 класс
- Урок 18. Основное уравнение МКТ
- Перечень вопросов, рассматриваемых на уроке:
- 1) средняя кинетическая энергия молекулы;
- 2) давление газа;
- 3) основное уравнение МКТ;
- Глоссарий по теме:
- Давление идеального газа пропорционально произведению концентрации молекул и средней кинетической энергии поступательного движения молекул.
- Средняя кинетическая энергия молекул – усреднённая величина, равная половине произведения массы молекулы на среднюю величину квадрата её скорости.
- Концентрация – число молекул в единице объёма.
- Масса молекулы (или атома) – чрезвычайно маленькая величина в макроскопических масштабах (граммах и килограммах), вычисляется через отношение массы вещества к количеству содержащихся в ней молекул (или атомов).
Изменение импульса тела – произведение силы на время действия силы. Импульс силы всегда показывает, как изменяется импульс тела за данное время.
Основная и дополнительная литература по теме урока:
- Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика.10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. С. 188 – 192.
- Кирик Л.А., Генденштейн Л.Э., Гельфгат И.М.. Задачи по физике. 10-11 классы для профильной школы. – М.: Илекса, 2010. С. 111.
- Рымкевич А.П. Физика. Задачник. 10-11 классы. – М.: Дрофа, 2013. С. 65 – 67.
Открытые электронные ресурсы по теме урока:
Теоретический материал для самостоятельного изучения
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами — массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа.
Давление газа на стенку сосуда обусловлено ударами молекул, давление газа пропорционально концентрации молекул: чем больше молекул в единице объема, тем больше ударов молекул о стенку за единицу времени. Каждая молекула при ударе о стенку передает ей импульс, пропорциональный импульсу молекулы m0v.
- Давление пропорционально второй степени скорости, так как, чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории идеального газа имеет вид:
- , где m0 — масса одной молекулы газа,
- n- концентрация молекул,
Средняя кинетическая энергия поступательного движения
тогда уравнение примет вид:
- Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
- Примеры и разбор решения заданий.
- 1. К каждой позиции первого столбца подберите соответствующую позицию второго:
| ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ | ФОРМУЛЫ |
| 1) импульс тела | А) |
| 2) средняя кинетическая энергия молекул | Б) |
| 3) давление газа на стенку сосуда | В) |
| 4) концентрация молекул | Г) |
Правильный ответ: вспомнив формулы величин, устанавливаем соответствие:
| ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ | ФОРМУЛЫ |
| 1) импульс тела | В) |
| 2) средняя кинетическая энергия молекул | А) |
| 3) давление газа на стенку сосуда | Г) |
| 4) концентрация молекул | Б) |
2. Кислород находится при нормальных условиях. Средняя квадратичная скорость молекул кислорода в этом случае равна ___ м/с.
- Решение:
- Ответ: 460 м/с.
Источник: https://resh.edu.ru/subject/lesson/6291/conspect/
Изменение — концентрация — молекула
Cтраница 1
Изменение концентрации молекул с высотой зависит от соотношения между энергией теплового движения kT и потенциальной энергией молекул u ( z) на данной высоте.
[1]
Изменение концентрации молекул с высотой зависит от соотношения между энергией теплового движения kT и потенциальной энергией молекул и ( z) на данной высоте.
[2]
Изменение концентрации молекул с высотой зависит от соотношения между энергией теплового движения kT и потенциальной энергией молекул и ( г) на данной высоте.
[3]
Вследствие изменения концентрации молекул, вступающих во взаимодействие, меняется и скорость реакций.
[4]
Сопоставление изменения концентрации молекул ингибитора, не связанных водородной связью в зависимости от концентрации спирта ( расчет проведен на основании спектральных данных с изменением величины k yitg ( рис. 163) показывает, что величина А: / ] / / св уменьшается несколько быстрее, чем концентрация свободных молекул ингибитора. HOR, которые в свою очередь снижают скорость реакции R02 с ингибитором. Поэтому приведенные в табл. 65 величины: консгант ассоциации эффективны, их значения несколько выше истинных констант ассоциации.
[6]
Сопоставление изменения концентрации молекул ингибитора, не связанных водородной связью в зависимости от концентрации спирта ( расчет проведен на основании спектральных данных с изменением величины / y ke ( рис. 163) показывает, что величина k lVk, уменьшается несколько быстрее, чем концентрация свободных молекул ингибитора. HOR, которые в свою очередь снижают скорость реакции RO2 с ингибитором. Поэтому приведенные в табл. 65 величины констант ассоциации эффективны, их значения несколько выше истинных констант ассоциации.
[8]
Поэтому можно не учитывать изменения концентрации инертных молекул и полагать, что она равна общему числу молекул.
[9]
В некоторых ионных газоразрядных лазерах изменение концентрации молекул ( находящихся в рабочих возбужденных состояниях) по сечению разрядного канала настолько существенно, что образующаяся резонансная оптическая неоднородность может конкурировать с обычной газовой линзой.
[10]
Мы видим, что скорость изменения концентрации молекул с высотой зависит от молярной массы газа. Чем легче молекулы, тем медленнее меняется их концентрация. И действительно, атмосфера Земли с высотой обогащается более легкими газами ( см. гл.
[11]
Процесс переадаптации определяется не только изменением концентрации молекул фотореагента, но также и изменением состояния глаза и затылочного участка коры головного мозга, связанного с сетчатой оболочкой волокнами зрительного нерва.
[12]
Изменение оптической плотности этих полос приблизительно отражает изменение концентрации молекул воды, ионов аммония и гидроксильных групп в цеолите. При этой температуре количество гидроксильных групп, обусловливающих полосу поглощения при 3660 см 1, максимально.
[13]
Физическая поглотительная способность, по К. К. Гед-ройцу, представляет изменение концентрации молекул растворенного вещества на поверхности твердых частиц почвы. Одним из видов физического поглощения является молекулярная сорбция, которая может быть обусловлена ван-дер-ваальсовым или другими видами физического взаимодействия молекул с разнородной поверхностью твердой фазы почвы. В настоящее время относительно хорошо изучена сорбция почвой дипольных молекул воды, многих газов, органических соединений, в том числе пестицидов. Физическое поглощение всех перечисленных соединений играет важную роль в стабилизации свойств почвы, выполнением ею важных санитарно-защитных функций.
[14]
Давление в атмосфере меняется с высотой по мере того, как происходит изменение концентрации молекул. Для простоты предположим, что в вертикальном сечении атмосферы повсюду одинаковая температура. Пусть Р обозначает давление, р — плотность газа ( p Bec / V-PM / RT), M — молекулярный вес, g — гравитационную постоянную и h — высоту.
[15]
Страницы:
1
2
Химическое равновесие — состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно
предлагают похожий вариант, однако говорят о «равенстве концентраций исходных веществ и продуктов» — это грубая ошибка. Химическое равновесие —
равенство скоростей.

Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии
равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать
внешнее воздействие.

Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных
задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно
справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие:
равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону.
Если добавляете вещество из левой части (продуктов реакции) — смещается в сторону исходных веществ. Посмотрите на пример ниже.

Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое»
место, которые мы создали. Наглядно демонстрирую на примере:

Можно подвести итог полученным знаниям таким образом: «Куда добавляем — оттуда смещается, откуда берем — туда смещается». Воспользуйтесь
этой или придумайте свое правило для запоминания этой закономерности 
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа.
Твердые вещества и жидкости считать не нужно. Например:
CO2(г) + С(тв) ⇄ 2CO(г) — Q
В приведенном уравнении количество молекул газа в левой части — 1, в правой — 2.
Запомните правило: «При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления — в сторону больших газов».
Для нашей системы правило действует таким образом:

В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
H2(г) + I2(г) ⇄ 2HI(г) — Q
Слева — 2 газа, и справа — 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или
эндотермическая.
Следуйте следующему правилу: «При увеличении температуры равновесие смещается в сторону эндотермической реакции, при
уменьшении — в сторону экзотермической реакции». У любой обратимой реакции есть экзо- и эндотермические части:

Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:

Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.

Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа
равновесия будет записана следующим образом:

Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации
веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.

Константу равновесия для данной задачи можно представить в виде 1.64 * 10-1.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.