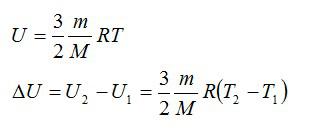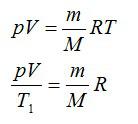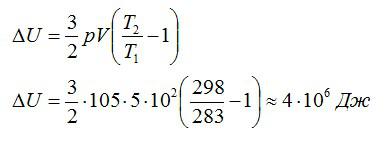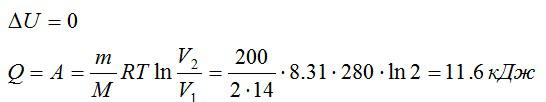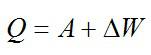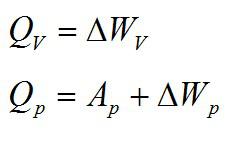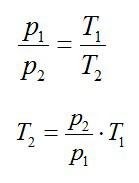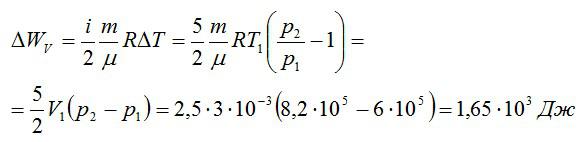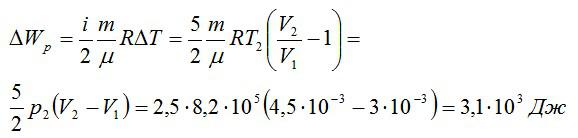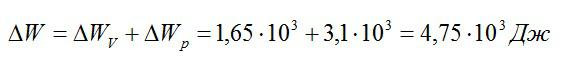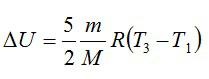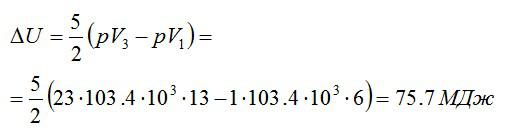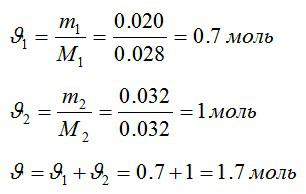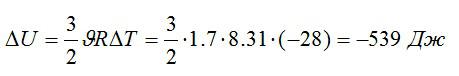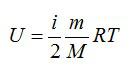Решение задач – занятие, которое любит далеко не каждый. Здесь мы стараемся сделать так, чтобы оно занимало у вас поменьше времени без ущерба для качества самого решения. Тема этой статьи — задачи на внутреннюю энергию.
Подписывайтесь на наш телеграм и читайте полезные материалы для студентов каждый день!
Решение задач: внутренняя энергия
Прежде чем приступать к задачам на внутреннюю энергию тела, посмотрите общую памятку по решению физических задач. И пусть под рукой на всякий случай всегда будут основные физические формулы.
Задача №1. Изменение внутренней энергии
Условие
Воздушный шар объёмом 500 м3 наполнен гелием под давлением 105 Па. В результате нагрева температура газа в аэростате поднялась от 10 °С до 25 °С. Как увеличилась внутренняя энергия газа?
Решение
Для решения будем использовать формулу внутренней энергии идеального газа:
Массу гелия выразим из уравнения Клапейрона-Менделеева:
Тогда можно записать:
Ответ: 4 МДж.
Задача №2. Внутренняя энергия и работа
Условие
Азот массой 200 г расширяется изотермически при температуре 280 К, причем объём газа увеличивается в 2 раза. Найти:
- Изменение ∆U внутренней энергии газа.
- Совершенную при расширении газа работу А.
- Количество теплоты Q, полученное газом.
Решение
Так как процесс изотермический, то изменение внутренней энергии равно нулю, а работа равна количеству теплоты, полученному газом:
Ответ: 0; 11,6 кДж; 11,6 кДж.
Задача №3. Изменение внутренней энергии при изобарном и изохорном процессе
Условие
Кислород занимает объём V1= 3 л при давлении p1= 820 кПа. В результате изохорного нагревания и изобарного расширения газ переведён в состояние с объёмом V2= 4,5 л и давлением p2= 600 кПа. Найти количество теплоты, полученное газом; изменение внутренней энергии газа.
Решение
Теплота, подведенная к газу, идет на совершение работы и изменение внутренней энергии:
В изохорном и изобарном процессе соответственно:
Изохорное нагревание:
Изменение внутренней энергии при изохорном процессе:
Изменение внутренней энергии при изобарном процессе:
Общее изменение внутренней энергии:
Ответ: 4,75 кДж.
Задача №4. Изменение внутренней энергии двухатомного газа
Условие
Кислород массой 2 кг занимает объём 6 м3 и находится под давлением 1 атм. Газ был нагрет сначала при постоянном давлении до объёма 13 м3, а затем при постоянном объёме – до давления 23 атм. Найти изменение внутренней энергии газа.
Решение
Изменение внутренней энергии находим по формуле:
Эту форму можно преобразовать, используя уравнение Клапейрона-Менделеева:
Ответ: 75,7 МДж.
Задача №5. Внутренняя энергия смеси газов
Условие
В закрытом сосуде находится масса m1 = 20 г азота и масса m2 = 32 г кислорода. Определить изменение ΔU внутренней энергии смеси газов при охлаждении ее на ΔТ = 28 К.
Решение
Определим количество молей азота и кислорода, а затем общее количество вещества в смеси соответственно:
Изменение внутренней энергии:
Знак «минус» означает, что внутренняя энергия уменьшается.
Ответ: -539 Дж.
Вопросы на тему «Внутренняя энергия тела»
Вопрос 1. Что такое внутренняя энергия?
Ответ. Для начала, внутренняя энергия чего? Бутылки с пивом, воздуха в шарике, тазика с водой? Все макроскопические тела обладают энергией, заключенной внутри них: атомы твердого тела колеблются в кристаллической решетке около положений равновесия, молекулы газа находятся в постоянном хаотическом движении и т.д.
По определению:
Внутренняя энергия вещества – это энергия, которая складывается из кинетической энергии всех атомов и молекул, и потенциальной энергии их взаимодействия друг с другом.
Для идеального газа с числом степеней свободы i внутренняя энергия вычисляется по формуле:
Вопрос 2. От чего зависит внутренняя энергия идеального газа?
Ответ. Эта величина не зависит от объёма и определяется только температурой.
Вопрос 3. Как изменяется внутренняя энергия тела?
Ответ. Если тело совершает работу, его внутренняя энергия уменьшается. Например, газ передвигает поршень. Если же работа совершается над телом, то внутренняя энергия увеличивается.
Вопрос 4. Что такое функция состояния?
Ответ. Функция состояния – это один из параметров, которым можно описать термодинамическую систему. Функция состояния не зависит от того, как система пришла в то или иное состояние, а определяется несколькими переменными состояния.
Внутренняя энергия – это функция состояния термодинамической системы. В общем случае она зависит от температуры и объёма.
Вопрос 5. Можно ли изменить внутреннюю энергию тела, не совершая над ним работы?
Ответ. Да, еще один способ изменения внутренней энергии – теплопередача. В процессе теплопередачи внутренняя энергия тел изменяется.
Нужна помощь в решении задач по любой теме и других студенческих заданий? Профессиональный студенческий сервис поспособствует в выполнении работы вне зависимости от ее сложности.
Решение.
V1 = 10∙10-3 м3, V2 = 2∙10-3 м3, р1 = 2∙105 Па.
При адиабатическом сжатии (Q = 0) первое начало термодинамики можно записать так:
[ delta A=-dU,delta A=-frac{m}{M}cdot {{C}_{V}}cdot dT(1). ]
Если газ адиабатически сжимается от объема V1 до V2, то его температура увеличивается от Т1 до Т2 и работа сжатия газа
[ begin{align}
& A=-frac{m}{M}cdot {{C}_{V}}cdot intlimits_{{{T}_{1}}}^{{{T}_{2}}}{dT=-}frac{m}{M}cdot {{C}_{V}}cdot ({{T}_{2}}-{{T}_{1}})(2),{{p}_{1}}cdot {{V}_{1}}=frac{m}{M}cdot Rcdot {{T}_{1}},{{T}_{1}}=frac{M}{m}cdot frac{{{p}_{1}}cdot {{V}_{1}}}{R}(3), \
& Tcdot {{V}^{gamma -1}}=const,{{T}_{1}}cdot {{V}_{1}}^{gamma -1}={{T}_{2}}cdot {{V}_{2}}^{gamma -1}, \
& {{T}_{2}}={{T}_{1}}cdot {{(frac{{{V}_{1}}}{{{V}_{2}}})}^{gamma -1}},{{T}_{2}}=frac{M}{m}cdot frac{{{p}_{1}}cdot {{V}_{1}}}{R}cdot {{(frac{{{V}_{1}}}{{{V}_{2}}})}^{gamma -1}}, \
& A=-frac{m}{M}cdot {{C}_{V}}cdot (frac{M}{m}cdot frac{{{p}_{1}}cdot {{V}_{1}}}{R}cdot {{(frac{{{V}_{1}}}{{{V}_{2}}})}^{gamma -1}}-frac{M}{m}cdot frac{{{p}_{1}}cdot {{V}_{1}}}{R}), \
& A=-frac{m}{M}cdot {{C}_{V}}cdot frac{M}{m}cdot frac{{{p}_{1}}cdot {{V}_{1}}}{R}cdot ({{(frac{{{V}_{1}}}{{{V}_{2}}})}^{gamma -1}}-1),frac{{{C}_{V}}}{R}=frac{1}{gamma -1},A=-frac{{{p}_{1}}cdot {{V}_{1}}}{gamma -1}cdot ({{(frac{{{V}_{1}}}{{{V}_{2}}})}^{gamma -1}}-1)(4). \
end{align} ]
γ – показатель адиабаты,
[ gamma =frac{{{C}_{p}}}{{{C}_{V}}} . ]
Ср и СV – теплоемкость при изобарном и изохорном процессе.
Теплоемкость газа при изобарном процессе связана с теплоемкостью газа при изохорном процессе соотношением (уравнение Майера):
[ {{C}_{p}}={{C}_{V}}+R,gamma =frac{{{C}_{V}}+R}{{{C}_{V}}},gamma =1+frac{R}{{{C}_{V}}},{{C}_{V}}=frac{i}{2}cdot R,gamma =frac{i+2}{i}.gamma =frac{7}{5}.
]
Где ι = 5, так как кислород двухатомный газ, R = 8,31 Дж/моль∙К, R – универсальная газовая постоянная, М – малярная масса кислорода, М = 32 ∙10-3 кг/моль.
[ A=-frac{2cdot {{10}^{6}}cdot 10cdot {{10}^{-3}}}{frac{7}{5}-1}cdot ({{(frac{10cdot {{10}^{-3}}}{2cdot {{10}^{-3}}})}^{frac{7}{5}-1}}-1)=-45,18cdot {{10}^{3}}. ]
Определим изменение внутренней энергии кислорода при адиабатном процессе
∆U = -А,
∆U = 45,18∙103 Дж.
Ответ: -45,18∙103 Дж, 45,18∙103 Дж.
Вася Иванов
Мореплаватель — имя существительное, употребляется в мужском роде. К нему может быть несколько синонимов.
1. Моряк. Старый моряк смотрел вдаль, думая о предстоящем опасном путешествии;
2. Аргонавт. На аргонавте были старые потертые штаны, а его рубашка пропиталась запахом моря и соли;
3. Мореход. Опытный мореход знал, что на этом месте погибло уже много кораблей, ведь под водой скрывались острые скалы;
4. Морской волк. Старый морской волк был рад, ведь ему предстояло отчалить в долгое плавание.
Объем кислорода массой 160 г, температура которого 27 °С, при изобарном нагревании увеличился вдвое. Найти работу газа при расширении, количество теплоты, которое пошло на нагревание кислорода, изменение внутренней энергии.
Спрятать решение
Решение.
При изобарном расширении применяем закон Гей-Люссака Тогда
Работа газа при изобарном расширении
Кислород —двухатомный газ, поэтому изменение внутренней энергии равно
По первому закону термодинамики
Ответ: 12,5 кДж; 43,6 кДж; 31,2 кДж.
Источник: Кирик Л. А. Самостоятельные и контрольные работы для 10 класса, Х.: «Гимназия», 2002 (№ 5 (дост.) стр. 43)

30. Определите разность молярных теплоемкостей CP и CV газа Ван-дер-Ваальса, если (∂U/∂V)T = a/V2. (В качестве примера расчета разности молярных теплоемкостей используйте пример 5 с подстановкой в уравнение величины (∂U/∂V)T , согласно условию задачи).
|
Ответ: C |
P |
− C |
= |
R |
|||
|
V |
2a(V − b)2 |
||||||
|
1 |
− |
||||||
|
RTV 3 |
|||||||
Пример 1. Рассчитайте изменение внутренней энергии гелия (одноатомный идеальный газ) при изобарном расширении от 5 до 10 л под давлением 196 кПа.
Решение. Процесс расширения газа протекает изобарно, следовательно, изменение внутренней энергии идеального газа определяется по первому закону термодинамики
∆U = Q − P∆V = nCP (T2 −T1 )− P(V2 −V1 ).
Начальная и конечная температуры в соответствии с уравнением состояния идеального газа определяются соотношениями
T1 = PVnR1 ; T2 = PVnR2 .
Молярная теплоемкость идеального газа при постоянном объеме
|
для одноатомных молекул C = |
3 |
R , а C |
P |
= C |
+ R = |
3 |
R |
+ R = |
5 |
R . |
||||||||||||
|
Тогда |
V |
2 |
V |
2 |
2 |
|||||||||||||||||
|
PV |
PV |
− P(V |
−V )= |
5 |
P(V |
−V )− P(V |
−V )= |
|||||||||||||||
|
∆U = n |
5 |
R |
2 |
− |
1 |
|||||||||||||||||
|
2 |
nR |
nR |
2 |
1 |
2 |
2 |
1 |
2 |
1 |
= 32 P(V2 −V1 ).
∆U = 32 196 103 (10 −5) 10−3 =1470 Дж.
Ответ: 1470 Дж.
Пример 2. 1 моль ксенона, находящийся при 25 °С и 202,6 кПа, расширяется адиабатически:а)обратимо до101,3 кПа, б) против давления 101,3 кПа. Какой будет конечная температура в каждом случае?
Решение. а) Исходный объем ксенона (n = 1 моль)
115
|
V = nRT1 |
= |
1 8,314 298 |
= 0,0122 м3. |
||||
|
1 |
P |
202,6 |
10 |
3 |
|||
|
1 |
Конечный объем можно найти из уравнения адиабаты (PVγ = const)
P1V1γ = P2V2γ .
Для одноатомного идеального газа CV = 32 R ,
|
C |
P |
=C |
+ R = |
3 |
R + R = |
5 |
R , тогда γ = CP |
= 5 . |
||||||||||||||
|
2 |
||||||||||||||||||||||
|
V |
2 |
CV |
3 |
|||||||||||||||||||
|
PV |
53 |
= P V 5 |
3 , следовательно, |
|||||||||||||||||||
|
1 |
1 |
2 |
2 |
|||||||||||||||||||
|
P |
35 |
2,026 |
105 35 |
= 0,0185 м3 |
||||||||||||||||||
|
V |
2 |
=V |
1 |
= 0,0122 |
||||||||||||||||||
|
5 |
||||||||||||||||||||||
|
1 |
P2 |
1,013 10 |
||||||||||||||||||||
|
Конечную температуру находим по уравнению состояния идеаль- |
||||||||||||||||||||||
|
ного газа |
||||||||||||||||||||||
|
P V |
2 |
101,3 103 0,0185 |
||||||||||||||||||||
|
T |
= |
2 |
= |
= |
225 К |
|||||||||||||||||
|
2 |
nR |
1 8,314 |
||||||||||||||||||||
б) При необратимом расширении против постоянного внешнего давления уравнение адиабаты неприменимо, поэтому надо воспользоваться первым законом термодинамики. Работа совершается за счет убыли внутренней энергии (уравнение (3.86))
A = −∆U = nCV (T1 −T2 ). (а)
Работа расширения против постоянного внешнего давления P2 равна
A = P2 (V2 −V1 )= nRT2 − P2V1 . (б)
Приравниваяправыечастивыражений(а) и(б),находим температуру T2
|
nCV T1 |
+ P2V1 |
1 |
3 |
8,314 298 +1,013 105 0,0122 |
= 238 |
||||
|
T |
= |
= |
2 |
К. |
|||||
|
1 ( |
3 |
+1) 8,314 |
|||||||
|
2 |
n(C |
+ R) |
|||||||
|
V |
2 |
В случае необратимого расширения конечная температура выше, чем в случае обратимого, т.к. при обратимом расширении совершаетсябольшаяработа,расходуетсябольшевнутреннейэнергии,и температура понижается на большую величину.
Ответ: а) 225 К; б) 238 К.
116

Пример3.1мольводяныхпаровобратимоиизотермическискон-
денсироваливжидкость при100°С.Рассчитайтеработу, теплоту,изменение внутренней энергии и энтальпии в этом процессе. Удельная
теплота испарения воды при 100 °С равна 2260 Дж/г.
Решение.РаботасжатиявпроцессеH2O (г) Н2О(ж)припостоянном давлении, учитывая, что Vп >> Vж, т.е. V1 >> V2, равна
A = P(V2 −V1 ) −PV1 = −P nRTP = −nRT =
= −1 8,314 373 = −3100 Дж = –3,1 кДж.
При испарении 1 моль воды затрачивается теплота
Qисп = 2260 Дж/г 18 г = 40680 Дж = 40,68 кДж.
При конденсации 1 моль воды эта теплота выделяется в окружающую среду, т.е.
Qконд = – Qисп = –40680 Дж.
Изменение внутренней энергии можно рассчитать по первому закону термодинамики
∆U = Q − A = −40680 −(−3100)= −37580 Дж = –37,58 кДж.
Изменение энтальпии равно теплоте, т.к. процесс происходит при постоянном давлении
∆H = Q = −40,68 кДж.
Ответ: –3,1 кДж; –40,68 кДж; –37,58 кДж; –40,68 кДж.
Пример 4. Определить количество теплоты, необходимое для нагревания 5 г азота от 15 до 25 °С, если объем газа не изменяется.
Решение. Количество теплоты, получаемое системойприизохорном процессе, может быть вычислено по уравнению (3.75)
QV = nCV (T2 −T1)= Mm CV (T2 −T1).
Молярная теплоемкость идеального газа при постоянном объеме для двухатомных молекул CV = 52 R .
Следовательно,
Q = 285 52 8,314 (298 −288)= 37,12 Дж.
Ответ: 37,12 Дж.
Пример 5. Изменение внутренней энергии при превращении 1 моль карбоната кальция в форме кальцита в арагонит составляет 0,21
117
кДж. Рассчитайте изменение энтальпии при фазовом переходе и изменение внутренней энергии, если давление равно 0,1 МПа. Плотности кальцита и арагонита равны 2,71 и 2,93 г·см-3.
Решение. Изменение энтальпии при фазовом переходе можно записать:
∆H = H (а) − H (к) = (U (а) + pV (а))−(U (к) + pV (к))=
∆U + p(V (а) −V (к))= ∆U + p∆V
Рассчитаем массу объем фаз кальцита и арагонита, соответственно:
М (CaCO3) = 100 г·моль-1
|
n = |
m |
m = n M m(r) = m(а) =1моль 100г моль−1 =100 г |
||||
|
M |
||||||
|
V (к) = m(к) |
= |
100г |
= 36,9см3 |
|||
|
2,71г см−3 |
||||||
|
ρ(к) |
||||||
|
V (а) = m(а) |
= |
100г |
= 34,1см3 |
|||
|
2,93г см−3 |
||||||
|
ρ(а) |
Следовательно,
p∆V = (105 Па (34,1−36,9) 10−6 м3 )= −0,28Дж
(1Па м3 =1Дж)
∆H − ∆U = −0,28Дж
, что составляет0,1% от величины U.
Пример 6. В политропном процессе расширения воздуха его объем увеличился в 10 раз, а давление уменьшилось в 8 раз. Определить показатель политропного процесса n, коэффициент распределения теплоты Ψ, работу и изменение внутренней энергии, если к рабочему телу подведено 10 кДж теплоты. В расчетах принимать γ = 1,4.
Решение. Из уравнения политропного процесса PVn = const для двух точек процесса можно записать
P1V1n = P2V2n
откуда
118
|
ln |
P1 |
|||||
|
P |
ln8 |
|||||
|
n = |
2 |
= |
= 0,9 |
|||
|
ln |
V2 |
ln10 |
||||
V1
Коэффициент распределения теплоты связан с показателем политропного процесса следующим уравнением
|
Ψ = |
n −1 |
= |
0,9 −1 |
= 0,2 |
|
|
n −γ |
0,9 −1,4 |
||||
Исходя из уравнения (3.43) Ψ = U/Q, следовательно,
∆U = ΨQ = 0,2 10 = 2 кДж
Работа в данном процессе определяется из выражения первого закона термодинамики
A = Q – ΔU = 10 – 2 = 8 кДж.
Ответ: 0,9; 0,2; 2 кДж; 8 кДж.
Пример 7. Используя дифференциальное уравнение первого закона термодинамики через молярные теплоемкости, получите дифференциальное уравнение политропы с теплоемкостью С в переменных T и V для произвольной однородной системы. Проинтегрируйте его в случае идеального газа.
Решение. Запишем первое начало термодинамики
|
∂T |
|||||||
|
δQ = C dT + (C |
−C |
) |
dV |
(1) |
|||
|
V |
P |
V |
∂V P |
||||
|
и |
|||||||
|
δQ = CdT |
(2) |
Подставляя выражение (2) в (1) и поделив все члены на CP — CV, получим дифференциальное уравнение политроп:
|
C −C |
∂T |
|||
|
V |
dT = |
dV |
||
|
CP −CV |
||||
|
∂V P |
В случае идеального газа
|
∂T |
= |
V |
|
|
T |
|||
|
∂V P |
119
Тогда дифференциальное уравнение имеет вид:
|
C −CV |
dT |
= |
dV |
|
|
V |
||||
|
C |
P |
−C |
T |
|
|
V |
|
В результате интегрирования получаем: |
|||
|
TVn-1 = const |
|||
|
Или в переменных P и V: pVn = const, где n = |
C −CV |
||
|
C |
P |
−C |
|
|
V |
Пример 8. Процесс расширения идеального двухатомного газа (V2>V1) происходит по политропе с показателем n=1,32. Найдите соотношение между совершенной газом работой и поглощённым им теплом.
Решение. Выражая теплоемкость С через СV, получаем соотношение:
|
C(n) |
= |
n − γ , |
|
|
C |
n −1 |
||
|
V |
Врассматриваемом случае, когда γ = 1,4 (для двухатомного газа)
иn = 1,32
С/CV = -1/4
Тогда с учетом TVn-1 = const, получаем TV0,32 = const, откуда следует, с учетом V2>V1, T1> T2, соответственно T<0.
Поэтому внутренняя энергия в данном процессе уменьшается и
∆QU = 4, A = Q − ∆U = 5Q
т.е. QA = 5
Таким образом, в данном процессе газ совершает в пять раз большую работу по сравнению с количеством поглощённого тепла. Большая часть работы совершается за счет уменьшения внутренней энергии газа.
Задачи для самостоятельного решения
Если не оговорено иного, считать все газы идеальными.
1. В сосуде с площадью поперечного сечения 50.0 см2 протекает химическаяреакция. Врезультате ее поршень выдавливается наружу на расстояние 15 см. Рассчитайте работу, совершенную системой, если внешнее давление постоянно и равно 121 кПа.
120
Ответ: 90,75 Дж.
2.В сосуде с площадью поперечного сечения 100 см2 протекает химическаяреакция. Врезультате ее поршень выдавливается наружу на расстояние 10 см. Рассчитайте работу, совершенную системой, если внешнее давление постоянно и равно 1 атм.
Ответ: 101,3 Дж.
3.Газ, расширяясь от 10 до 16 л при постоянном давлении 101,3 кПа, поглощает 126 Дж теплоты. Определите изменение внутренней энергии газа.
Ответ:- 481,8 Дж.
4. Определите изменение внутренней энергии, количество теплоты иработу, совершаемую приобратимом изотермическомрасширении азота от 0,5 до 4 м3 (начальные условия: температура 26,8 С, давление 93,2 кПа).
Ответ:0; 96,9 кДж.
5. Диоксид углерода, занимающий объем 1 л при давлении 57.4 кПа, расширяется обратимо и адиабатически до объема 2 л. Рассчитайте конечное давление, если γ = 1.4.
Ответ: 10,99 кПа.
6. Водянойпар,занимающийобъем500млпридавлении87.3мм рт.ст.,расширяетсяобратимоиадиабатическидообъема3л.Рассчитайте конечное давление, если γ = 1.3. Ответ приведите в Па.
Ответ: 890, 6 Па.
7. 1 моль идеального газа, взятого при 25°C и 101,3 105 Па, расширяется обратимо и изотермически до 506,5 кПа. Рассчитайте ра-
боту, поглощенную теплоту, ∆U и ∆H.
Ответ:7419; 0 Дж.
8. Рассчитайте изменение энтальпии кислорода (идеальный газ) приизобарномрасширенииот80до200лпринормальноматмосферном давлении.
Ответ:42,6 кДж.
9. Какое количество теплоты необходимо для повышения температуры 16 г кислорода от 300 до 500 К при давлении 101,3 кПа? Как при этом изменится внутренняя энергия?
Ответ:2909 Дж; 2078 кДж.
121
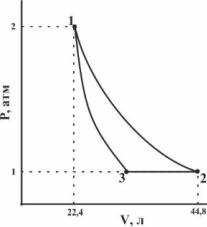
10. 1моль идеального одноатомного газа вступает в следующий цикл:
Процесс 1→2 – изотермический, 3→1 – адиабатический. Рассчитайте объемы состояний 2 и 3, температуры состояний 1, 2 и 3, считая стадии 1→2 и 3→1 обратимыми,атакжеизменение внутренней энергии и энтальпии для каждой стадии.
Ответ: V2 = 44,8 л; V3 =
34,0 л; T1 = T2 = 546 K; T3 =
414 K; ∆U 1→2= 0; ∆U 2→3= —
1645 Дж;∆U 3→1= 1645 Дж;
∆H 1→2= 0; ∆H 2→3= — 2742
Дж; ∆H 3→1= 2742 Дж.
11. Чайник, содержащий 1 кг кипящей воды, нагревают до пол-
ного испарения при нормальном давлении. Определите A, Q, ∆U, ∆H для этого процесса. Молярная теплота испарения воды 40,6 кДж/моль.
Ответ:A = 172,2; Q = ∆H = 2256 кДж; ∆U = 2084 Дж.
12. Определите конечную температуру и работу, необходимую для адиабатического сжатия азотаот 10 лдо 1 л, если начальные тем-
пература и давление равны 26,8 °С и 101,3 кПа, соответственно.
Ответ:754 К; −3829 Дж.
13. 3 моль идеального одноатомного газа, находящегося при T1 = 350 K и P1 = 506,5 кПа, обратимо и адиабатически расширяются до давления P2 = 101,3 кПа. Рассчитайте конечные температуру и объем,атакжесовершеннуюработуиизменениевнутреннейэнергии и энтальпии в этом процессе.
Ответ:184 К; 45,3 л; A = −∆U = 6254 Дж; ∆Н = −10,38 кДж.
14. Система содержит 0,5 моль идеального одноатомного газа при P1 = 1013 кПа и V1 = 1 л. Газ расширяется обратимо и адиабатически до давления P2 = 101,3 кПа. Рассчитайте начальную и конечную температуру, конечный объем, совершенную работу, а также изменение
122
внутренней энергии и энтальпии в этом процессе. Рассчитайте эти величины для соответствующего изотермического процесса.
Ответ: адиабатический процесс: 244 К; 97,6 К; 4 л; A = −∆U = = 919,2 Дж; ∆Н = −1527,5 Дж; изотермический процесс: 244 К; 10 л;
W = 2336 Дж; ∆U = ∆Н = 0.
15. Рассчитайте разницу между H и U при превращении 1 моль серого олова в белое олово, плотности которых соответственно равны 5,75 г·см-3 и 7,31 г·см-3. Фазовый переход протекает при давлении 1 МПа. При 298 К H = +2,1 кДж.
Ответ: H – U = -4,4 кДж.
16. Рассчитайтеколичествотеплоты,необходимоедлянагревания
воздуха в квартире общим объемом 600 м3 от 20 °С до 25 °С. Примите, что воздух – это идеальный двухатомный газ, а давление при
исходной температуре нормальное. Найдите ∆U и ∆H для процесса нагревания воздуха.
Ответ:Q = ∆U = 2593 кДж; ∆Н = 3630 кДж.
17. Человеческий организм в среднем выделяет 104 кДж в день благодаря метаболическим процессам. Основной механизм потери этой энергии – испарение воды. Какую массу воды должен ежедневно испарять организм для поддержания постоянной температуры? Удельная теплота испарения воды 2260 Дж/г. На сколько градусов повысилась бытемпературатела, если быорганизм был изолированной системой? Примите, что средняя масса человека 65 кг, а теплоемкость равна теплоемкости жидкой воды.
Ответ:4,4 кг; на 36,8 °.
18. 1 моль паров брома обратимо и изотермически сконденсиро-
вали в жидкость при 59 °С. Рассчитайте работу, теплоту, изменение внутренней энергии и энтальпии в этом процессе. Удельная теплота
испарения брома при 59 °С равна 184,1 Дж/г.
Ответ:A = −2,76 кДж; Q = ∆Н = −2946 кДж; ∆U = −26,7 кДж.
19. 5 л криптона, взятого при нормальных условиях, нагреваются
до 600 °С при постоянном объеме. Каково конечное давление газа и количество тепла, затраченного на нагревание?
Ответ:310 кПа; 1683 Дж.
20. В резервуаре емкостью 50 л при 10 °С и избыточном давлении 506,5 кПа содержится азот. Определите максимальное количество
123
теплоты, которое можно сообщить газу, если стенки резервуара выдерживают давление, не превышающее 2026 кПа.
Ответ:179,2 кДж.
21. 10 г кислорода, взятого при 17 °С, сжимаются адиабатически от 8 до 5 л. Определите конечную температуру, затраченную работу, изменение внутренней энергии и изменение энтальпии.
Ответ:78,4 °С; −456 Дж; 638,4 кДж.
22. В резервуаре при 25 °С находится неизвестный газ. Предполагается, что это азот или аргон. При внезапном расширении 5 л этого
газа до объема 6 л его температура падает примерно на 15 °. Какой газ содержится в резервуаре?
Ответ:азот.
23. Определите количество теплоты, необходимое для нагревания
25 г О2 при 350 °С, если начальное давление газа равно 101,3 кПа, а конечное – 506,5 кПа.
Ответ:−6,5 кДж.
24. Определите работу адиабатического сжатия моля двухатомного идеального газа при повышении температуры от –15 до 25 °С.
Ответ: –831,4 Дж.
25. Определите количество теплоты, которое нужно затратить для нагревания 10 г водорода от 30 до 100 °С при постоянном объеме.
Ответ:7275 Дж.
26. Вычислите работу, производимую 1 моль азота при нагрева-
нии от 300 до 500 °С и определить конечный объем газа, если при начальном состоянии объем составлял 24,63 л; начальное давление 103,3 кПа, а конечное 506,5 кПа.
Ответ:−4157 Дж; 7,8 л.
27. Компрессор должен подавать 25 л/мин воздуха под давлением
1013 кПа при 25 °С. Какой объем воздуха при этой температуре и давлении 202,6 кПа должен он засасывать в течение 1 мин? Какова
величина работы, совершаемой газом, если γ = 1,3?
Ответ:86,22 л; 26189 Дж.
28. Какое количество теплоты потребуется для нагревания 1 м3 воздуха от 0 до 1 °С при постоянном объеме и начальном давленииР
= 1,013 105 Па? Плотность воздуха при нормальных условиях 1,29
124
кг/м3, удельная теплоемкость при постоянном давлении СР = 1,01 Дж/(г К).
Ответ:928 Дж.
29. Смешано 4,03 г водорода и 32 г кислорода. Их удельные теп-
лоемкости СР соответственно равны 14,3 и 0,912 Дж/(г К). Определите потерю теплоты при охлаждении этой смеси на 20 ° при постоянном объеме.
Ответ:−1,24 кДж.
30. Найдите изменение внутренней энергии гелия, изобарно расширяющегося от 0,005 до 0,01 м3 под давлением 1,96 105 Па.
Ответ:1,47 кДж.
31. Вычислите работу расширения при нагревании 2 г воздуха от 0 до1°Спридавлении1013 гПа.Плотность воздухапринормальных условиях 1,29 кг/м3.
Ответ:0,574 Дж.
32. При 25 °С и 1013 гПа в сосуде находится 1 кг азота. Вычислите
Q, ∆U иA:а)приизохорномувеличениидавлениядо2026гПа;б)при изобарном расширении до трехкратного объема.
Ответ:а) Q = ∆U =221,1кДж, A = 0; б)Q = 619,1 кДж,∆U = 442,25 кДж, A = 176,9 кДж.
33. При100°С6гкислородазанимаютобъем0,004м3.Вычислите работу при изотермном расширении до объема 0,0045 м3.
Ответ:68,8 Дж.
34. Найдите изменение внутренней энергии при испарении 20 г этилового спирта в точке кипения, если известно, что теплота испарения при этой температуре равна 205 ккал/кг. Удельный объем пара 0,607 м3/кг, удельным объемом жидкости можно пренебречь. Давление 101,3 кПа.
Ответ: ∆U≈1,6 ·104 Дж
35. В цилиндре при 18 °С и 1013 гПа находится гремучая смесь.
При изменении объема от 3,77 10-4 до 0,302 10-4 м3 произошел взрыв. Определите температуру и давление в момент взрыва, если сжатие происходит без обмена теплоты с окружающей средой.
Ответ:527 °С; 3460 кПа.
125
36. 25 л воздуха под давлением 101,3 кПа расширяются до 100 л при 15 °С. Определите работу и конечное давление газа.
Ответ:3,52 кДж; 25,3 кПа.
37. Вычислите работу адиабатического расширения 1 моль одноатомного идеального газа при понижении температуры от 100 до
25 °С.Начальноедавлениегазаравно1013кПа,конечное– 202,6 кПа. Ответ: 935 Дж.
38. В процессе политропического сжатия двухатомный идеальный газ отдает 6 ккал тепла. Найдите изменение внутренней энергии и совершенную над газом работу, если объем газа уменьшился в 5 раз, а давление возросло в 4 раза.
Ответ: A = –18,6 ·103 Дж, U = –6,54·103 Дж.
39. Сжатие газа происходит по политропе с показателем n = 0,9. Как при этом будет изменяться внутренняя энергия газа?
Ответ: Внутренняя энергия уменьшается, т.е. U < 0.
40. В процессе политропного расширения газ получает 10 ккал тепла. Вычислите показатель политропы и изменение внутренней энергии, если объем газа увеличивается в 10 раз, а давление уменьшается в 8 раз (γ = 1,4).
Ответ: n = 0,9, U ≈ 2 ккал = 8,4·103 Дж.
41. В процессе политропного сжатия над газом совершается работа в 1,96·105 Дж и отводится 60 ккал тепла. Вычислите показатель политропного сжатия (γ = 1,4).
Ответ: n = 0,9.
42. Воздух расширяется политропно с показателем n = 1,25, имея начальные параметры p1 = 4,3 МПа и T1 = 500 К, до температуры T2 = 300 K.Определитедавлениеp2 иудельныйобъемv2 воздухавконце процессарасширения,изменениевнутреннейэнергии,удельнуютеплоту, работу, коэффициент распределения тепла. В расчетах принять
γ = 1,4; Ṙ = 287,1 Дж/(кг·К); сp = 1 кДж/(кг·К).
Ответ: p2 = 0,3344 МПа; v2 =0,2575 м2/кг; cv = 0,713 кДж/(кг·K); Ψ = -1,667; u = -142,6 кДж/кг; q = 85,54 кДж/кг; l = 228,14 кДж/кг.
126
6.2.3. Тепловой эффект процесса. Закон Гесса Пример 1. Определить стандартный тепловой эффект реакции, про-
текающей по уравнению СН4 + СО2 = 2 СО + 2 Н2, если стандартные теплоты образования метана, диоксида углерода и оксида углерода при 298 К соответственно равны:
−74,85; −393,51 и –110,5 кДж/моль.
Решение. Исходя из первого следствия закона Гесса (3.34), имеем
∆r H298 = [2∆f H298,CO +2∆f H298,H2 ]−[∆f H298,CH4 +∆f H298,CO2 ]=
= [2 (−110,5)+ 2 0]−[−74,85 +(−393,51)]= 247,36 кДж/моль.
Ответ: 247,36 кДж/моль.
Пример 2. Определите тепловой эффект реакции, протекающей по уравнению
СН3СООН (ж) + С2Н5ОН (ж) = СН3СООС2Н5 (ж) + Н2О (ж), если теплоты сгорания уксусной кислоты, этанола, этилового эфира
уксусной кислоты и воды при 298 К соответственно равны −873,79;
−1366,91; −2254,21; 0 кДж/моль.
Решение. Исходя из второго следствия закона Гесса (3.35), имеем
∆r H298 = [∆cH298,CH3COOH +∆cH298,C2H5OH ]−[∆cH298,CH3COOC2H5 +
+∆c H298,H2O ]= [−873,79 +(−1366,91)]−[− 2254,21+0]=
=13,51 кДж/моль.
Ответ: 13,51 кДж/моль.
Пример 3. Пользуясь справочными данными, рассчитайте тепловой эффект реакции
3 Cu (т) + 8 HNO3 (aq) = 3 Cu(NO3)2 (aq) + 2 NO (г) + 4 H2O (ж)
при 298 К.
Решение. Сокращенное ионное уравнение реакции имеет вид
3 Cu (т) + 8 H+ (aq) + 2 NO3– (aq) = 3 Cu2+ (aq) + 2 NO (г) + 4 H2O (ж).
По закону Гесса (3.34), тепловой эффект реакции равен
∆r H298 = [3∆f H298,Cu2+ (aq) +2∆f H298,NO(г) +4∆f H298,H2O(ж)]−
−[3∆ f H 298,Cu(т)+8∆ f H 298,Н+ (aq) +2∆ f H 298,NO3− (aq)].
∆ f H 298,Cu(т) = 0 ; ∆ f H 298,Н+ (aq) = 0 по определению. Пользуясь таблицами термодинамических величин, находим
127

|
∆f H298 |
,Cu2+ (aq) = 64,77 ; |
∆f H298,NO(г) = 90,25 ; |
|
∆f H298,H2O(ж) = −285,8 |
; ∆ f H 298 |
,NO3− (aq) = −205,0 кДж/моль. |
Подставляя значения теплот образования, находим
∆r H298 = [3 64,77 + 2 90,25 + 4 (− 285,8)]−[3 0 +8 0 + 2 (− 205,0)]=
=−358,4 кДж.
Ответ: −358,4 кДж.
Пример 4. Рассчитайте теплоту образования N2O5 (г) при 298 К на основании следующих данных:
|
2 NO (г) + O2 (г) = 2 NO2 (г), |
∆r Н298,1 = −114,2 |
кДж; |
|
|
4 NO2 (г) + O2 (г) = 2 N2O5 (г), |
∆r Н298,2 |
= −110,2 |
кДж; |
|
N2 (г) + O2 (г) = 2 NO (г), |
∆r Н298,3 |
= 182,6 кДж. |
Решение. По определению теплота образования N2O5 (г) определяется уравнением N2 (г) + 5 2 O2 (г) = N2O5 (г), ∆f Н298,x .
Воспользуемся свойством термохимических уравнений (если тепловые эффекты приведены при одних и тех же условиях, то можно с термохимическими уравнениями оперировать точно так же, как с алгебраическими):
умножим второе уравнение на 12 и затем сложим первое, второе и
третье уравнения, получим
N2 (г) + 5 2 O2 (г) = N2O5 (г),
∆f Н298,x = ∆r Н298,1 + 12 ∆r Н298,2 +∆r Н298,3 ,
т.е. тепловой эффект образования 1 моль N2O5 (г) из молекулярных азота и кислорода.
Следовательно,
∆f Н298,x = −114,2 + 12 (−110,2)+182,6 =13,3 кДж/моль.
Ответ: 13,3 кДж/моль.
128

Задачи для самостоятельного решения
1. Рассчитайте, сколько тепла выделится при полном окислении 1 т метана, полученного из биомассы, экологически чистого «топлива», в результате жизнедеятельности анаэробных бактерий. Укажите, какие данные необходимы для проведения этого расчета.
Ответ: −55,6 ГДж.
2. Определите энтальпию образования диборана B2H6 (г) при 298 К из следующих данных:
B2H6 (г) + 3 O2 (г) = B2O3 (т) + 3 H2O (г), ∆r H1 = −2035,6 кДж; 2 B (т) + 3 2 O2 (г) = B2O3 (т), ∆r H2 = −1273,5 кДж;
H2 (г) + 12 O2 (г) = H2O (г), ∆r H3 = −241,8 кДж.
Ответ: 36,7 кДж/моль.
3. Рассчитайте теплоту образования сульфата цинка из простых веществ при 298 К на основании следующих данных:
ZnS = Zn + S, ∆r H1 = 200,5 кДж;
2 ZnS + 3 O2 = 2 ZnO + 2 SO2, ∆r H2 = −893,5 кДж;
2 SO2 + O2 = 2 SO3, ∆r H3 = −198,2 кДж; ZnSO4 = ZnO + SO3, ∆r H4 = 235,0 кДж.
Ответ: –981,4 кДж/моль.
4. Найдите ∆r Н298 для реакции CH4 + Cl2 = CH3Cl (г) + HCl (г), если известны теплоты сгорания метана (∆cН298, CH4 = −890,6
|
кДж/моль), хлорметана (∆c Н298, CH3Cl |
= −689,8 кДж/моль), водорода |
|
|
( ∆c Н298, H2 |
= –285,8 кДж/моль) и |
теплота образования HCl ( |
|
∆f Н298, HCl |
= –92,3 кДж/моль). |
Ответ: –99,6 кДж/моль.
5. Рассчитайте тепловой эффект реакции
NH3 + 5 4 O2 = NO + 3 2 H2O (г)
при 298 K, если известны следующие данные:
H2O (г) = H2O (ж), ∆r H1 = −44 кДж/моль;
12 N2 + 3 2 H2 = NH3, ∆r H2 = −46,2 кДж/моль;
129

H2 + 12 O2 = H2O (ж), ∆r H3 = −285,8 кДж/моль;
NO = 12 N2 + 12 O2, ∆r H4 = −91,3 кДж/моль.
Ответ: –225,2 кДж/моль.
6. При взаимодействии 10 г металлического натрия с водой ∆H298 = −79,91 кДж, а при взаимодействии 20 г оксида натрия с водой ∆H298 = −76,76 кДж. Вода берется в большом избытке. Рассчитайте
|
теплоту |
образования оксида натрия ∆f Н298, Na2O , если |
|
∆f Н298 |
, H2O(ж) = −285,8 кДж/моль. |
Ответ: –415,4 кДж/моль.
7. Теплоты растворения SrCl2 и SrCl2 10H2O составляют соответственно –47,7 и 31,0 кДж/моль. Вычислите изменение энтальпии реакции
SrCl2 + 10 Н2O = SrCl2 10H2O.
Ответ: −78,7 кДж/моль.
8. Теплота растворения CuSO4 составляет –66,5 кДж/моль, а теплота перевода CuSO4 в CuSO4 5H2O равна –78,2 кДж/моль. Вычислите теплоту растворения CuSО4 5H2О.
Ответ: 11,7 кДж/моль.
9. Вычислите теплоту образования С3Н8, если известно, что при сгорании 11 г его выделилось 552 кДж.
Ответ: −115,85 кДж/моль.
10. Вычислите теплоту сгорания этилена С2Н4, если известно, что теплота его образования 52,3 кДж/моль. Каков тепловой эффект сгорания 10 л С2Н4 (27 °С и 98,4 кПа)?
Ответ: −1411 кДж/моль; −558 кДж.
11. При сгоранииодного литраацетилена (0°С и 101,3 кПа) выделяется 58,2 кДж. Вычислите ∆ f HT ацетилена.
Ответ: 230 кДж/моль.
12. Теплоты сгорания этана С2Н6 и этилена С2Н4 соответственно
составляют –1560 и –1411 кДж/моль. Вычислите ∆rΗ° реакции гидрирования этилена С2Н4 + Н2 = С2Н6.
Ответ: −137 кДж/моль.
130
13. Теплоты образования жидкой воды и газообразного диоксида углерода соответственно равны –285,8 и –393,5 кДж/моль, теплота сгорания метана при тех же условиях –890,3 кДж/моль. Рассчитайте теплоту образования метана из элементов при условиях: 1) p = const; 2) V = const, Т = 298 К.
Ответ: −74,8 кДж/моль; −72,3 кДж/моль.
14. Теплота сгорания жидкого бензола равна –3267,7 кДж/моль. Теплота сгорания газообразного метилена при тех же условиях равна
–1299,6кДж/моль.Вычислитетеплотыобразованияжидкогобензола и газообразного ацетилена, а также теплоту образования бензола из ацетилена при условиях: а) p = const; б) V = const, если теплоты образования СО2 (г) и Н2О (ж) соответственно равны –393,5 и –285,8 кДж/моль.
Ответ: а) 49,3; 226,2; −631,1 кДж/моль; б) 56,7; 226,8; –623,7
кДж/моль.
15. Тепловые эффекты реакций при 0 °С и постоянном давлении
1013 гПа:
С + О2 = СО2, ∆Н1 = –405,8 кДж; СО + ½ О2 = СО2, ∆Н2 = –284,5 кДж;
Н2 + ½ О2 = Н2О (г), ∆Н3 = –246,8 кДж.
рассчитайте при тех же условиях тепловые эффекты следующих реакций:
С(графит) + ½ О2 = СО;
С+ 2 Н2О (г) = СО2 + 2 Н2;
С+ Н2О (г) = СО + Н2;
2 СО = СО2 + С.
Ответ: –121,3; 87,8; 125,5; –163,2 кДж.
16. Теплота образования этилена С2Н4 (г) равна 52,3 кДж/моль. Какова теплота сгорания этилена при: 1) p = const; 2) V = const, если теплоты образования СО2 (г) и Н2О (ж) соответственно равны –393,5 и –285,8 кДж/моль?
Ответ: –1411; –1406 кДж/моль.
17. Рассчитайте теплоту образования жидкого сероуглерода по следующим данным:
S (мон) + O2 (г) = SO2 (г), ∆rН1 = –296,9 кДж;
CS2 (ж) + 3 О2 (г) = СО2 (г) + 2 SО2 (г), ∆rН2 = –1109,0 кДж; С (графит) + O2 (г) = СО2 (г), ∆rН3 = –393,5 кДж.
131
Ответ: 121,7 кДж/моль.
18. Теплота образования Fе2О3 (т) −821,3 кДж/моль, а теплота об-
разования Al2O3 −1675,0 кДж/моль. Рассчитайте тепловой эффект реакции восстановления 1 моль Fе2О3 металлическим алюминием.
Ответ: –853,7 кДж/моль.
19. Теплота нейтрализации соляной кислоты раствором едкого натра –55,9 кДж, а монохлоруксусной кислоты СН2С1СООН тем же растворомедкогонатра–59,75кДж.Приприбавлениикраствору,со- держащему 1 моль монохлоруксуснокислого натрия, 1 моль НС1 поглощается 1,904 кДж теплоты. Какая часть взятой соли при этом разлагается?
Ответ: 0,49.
20. Теплоты нейтрализации NaOH иNH4ОH солянойкислотой соответственно равны –55,9 и –51,34 кДж/моль. Какова теплота диссоциации NH4ОH, если он в растворе практически не диссоциирует?
Ответ: 4,56 кДж/моль.
21. Вычислите тепловой эффект реакции
С2Н4 (г) + Н2О (г) = C2H5OH (г),
если теплоты образования этилена, водяного пара и газообразного этанола соответственно равны 52,28; –241,8; –235,3 кДж/моль.
Ответ: –45,78 кДж/моль.
22. Теплота сгорания паров пропанола –2064,0 кДж/моль. Вычислите теплоту сгорания жидкого пропанола, если теплота его испарения составляетот41,84до48,12кДж/моль. Рассчитайтерасхождение между вычисленным и табличным значением –2016,7 кДж/моль.
Ответ: –2019,02 кДж/моль; 0,11 %.
23. Теплота образования раствора хлорида цинка –478,2 кДж/моль, а теплота образования раствора хлорида меди (II) –262,3 кДж/моль. Вычислите теплоту реакции
CuCl2 (aq) + Zn = ZnCl2 (aq) + Сu.
Ответ: –215,9 кДж/моль.
24. Рассчитайте теплоту образования газообразного аммиака на основании следующих данных:
4 NH3 (г) + 3 О2 (г) = 2 N2 (г) + 6 Н2О (г), ∆r H1 = −1266,9 кДж; 2 Н2 (г) + O2 (г) = 2 Н2O (г), ∆r H2 = −483,7 кДж.
Ответ: –46,05 кДж/моль.
132
25.В топке сгорает каменный уголь, содержащий 65 % углерода.
Втопочных газах содержится 13 % (об.) СО2 и 1 % (об.) СО; остальное азот и кислород. Определите теплоту сгорания 1 кг угля, если
теплота образования СО2 (г) –393,5 кДж/моль, а теплота образования СО (г) –110,5 кДж/моль.
Ответ: –20219,6 кДж.
26–33. Вычислите тепловые эффекты приведенных химических реакций при стандартных условиях по стандартным теплотам образования:
|
№ |
Уравнения реакций |
|
26. |
4 NH3 (г) + 5 O2 (г) = 6 Н2O (г) + 4 NO (г) |
|
27. |
2 Mg(NO3)2 (т) = 2 MgO (т) + 4 NO2 (г) + О2 (г) |
|
28. |
4 НС1 (г) + О2 (г) = 2 Н2O (г) + 2 С12 (г) |
|
29. |
2 NаНСО3 (т) = Na2CO3 (т) + Н2О (г) + СО2 (г) |
|
30. |
2 H2S (г)+ СO2 (г) = 2 Н2O (г) + СS2 (г) |
|
31. |
2 NO2 (г) + О3 (г) = O2 (г) + N2O5 (г) |
|
32. |
2 AgNO3 (т) = 2 Ag (т) + 2 NO2 (г) + О2 (г) |
|
33. |
4 H2S (г) + 2 SО2 (г) = 3 S2 (г) + 4 Н2О (г) |
Ответы:
26. –901,06 кДж. 27. 515,18 кДж. 28. –114,38 кДж. 29. 129,28 кДж. 30. 66,37 кДж. 31. –197,34 кДж. 32. 317,42 кДж. 33. 94,07 кДж.
34–37.Вычислите тепловые эффекты приведенных химических реакций при стандартных условиях по стандартным теплотам сгорания:
|
№ |
Уравнения реакций |
|
34. |
С2H4 (г) + Н2 (г) = С2Н6 (г) |
|
35. |
С6Н6 (ж) + 3 Н2 (г) = С6Н12 (ж) |
|
36. |
C2H5OH (ж) = С2Н4 (г) + Н2О (ж) |
|
37. |
СН4 (г) + СО2 (г) = 2 СО (г) + 2 Н2 (г) |
Ответы:
34. –136,92 кДж. 35. –205,16 кДж. 36. 40,29 кДж. 37. 247,19 кДж.
38–45.Вычислите тепловые эффекты приведенных химических
реакцийврастворахпри25°Спостандартнымтеплотамобразования химических соединений и ионов:
|
№ |
Уравнения реакций |
|
38. |
MnO2 (т) + 4 HCl (aq) = MnCl2 (aq) + Cl2 (г) + 2 Н2O (ж) |
|
39. |
А12(SO4)3 (т) + 6 NaCl (aq) = 2 AlCl3 (aq) + 3 Na2SO4 (aq) |
|
133 |