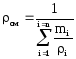В
инженерной практике часто приходится
иметь дело не с однородными газами, а
со смесями химически не связанных между
собой газов. Примерами газовых смесей
могут служить: атмосферный воздух,
природный газ, газообразные продукты
сгорания топлив и т.д.
Для
газовых смесей справедливы следующие
положения.
1.
Каждый газ, входящий в смесь, имеет
температуру, равную температуре смеси.
2.
Любой из газов, входящих в смесь,
распространяется по всему объему смеси
и поэтому объем каждого газа равен
объему всей смеси.
3.
Каждый из газов, входящих в смесь,
подчиняется своему уравнению состояния.
4.
Смесь в целом является как бы новым
газом и подчиняется своему уравнению
состояния.
В
основе изучения газовых смесей лежит
закон Дальтона, согласно которому при
постоянной температуре давление смеси
равно сумме парциальных давлений газов,
входящих в смесь:
(1.8)
где
pсм
— давление смеси;
pi
— парциальное давление i-го газа, входящего
в смесь;
n
— число газов, входящих в смесь.
Парциальным
называют давление, которое окажет газ,
входящий в смесь, если он один будет
занимать весь объем смеси при той же
температуре.
Способы
задания газовых смесей
Состав
газовой смеси может быть задан массовыми,
объемными и мольными долями.
Массовые
доли.
Массовой долей любого газа, входящего
в смесь, называется отношение массы
этого газа к массе смеси.
m1
= M1
/
Mсм;
m2
= M2
/
Mсм;
……….; mn
= Mn
/
Mсм,
где
m1,
m2,
…, mn
— массовые доли газов;
М1,
М2,
…, Мn
— массы отдельных газов;
Мсм
— масса смеси.
Нетрудно
видеть, что
и
(100%).
Объемные
доли.
Объемной долей любого газа, входящего
в смесь, называется отношение приведенного
(парциального) объема этого газа к объему
смеси.
r1
= V1
/
Vсм;
r2
= V2
/
Vсм;
………, rn
= Vn
/
Vсм;
где
V1,
V2,
…, Vn
— приведенные объемы газов;
Vсм
—
объем смеси;
r1,
r2,
…, rn
— объемные доли газов.
Приведенный
объем — это объем газа при условиях смеси
(при температуре и давлении смеси).
Приведенный
объем можно представить следующим
образом: если из сосуда, где находится
смесь, удалить все газы, кроме одного,
и оставшийся газ сжать до давления
смеси, сохранив температуру, то его
объем и будет приведенным или парциальным.
Можно
доказать, что объем смеси будет равен
сумме приведенных объемов газов.
Тогда
(100%).
Мольные
доли. Мольной
долей любого газа, входящего в смесь,
называется отношение числа киломолей
этого газа к числу киломолей смеси.
r1
= n1
/
nсм;
r2
= n2
/
nсм;
………, rn
= nn
/
nсм,
где
r1,
r2,
…, rn
— мольные доли газов;
nсм
—
число киломолей смеси;
n1,
n2,
…, nn
— число киломолей газов.
Задание
смеси мольными долями тождественно
заданию смеси объемными долями, т.е.
мольные и объемные доли имеют для каждого
газа, входящего в смесь, одинаковые
численные значения.
Газовая
постоянная и кажущаяся (средняя)
молекулярная масса смеси.
Для вычисления газовой постоянной
смеси, заданной массовыми долями, запишем
уравнения состояния:
для
смеси
pсм
×
Vсм
= МсмRсмТ;
(1.9)
для
газов

(1.10)
Суммируем
левые и правые части уравнений (1.10)
(p1
+ p2
+ …. + pn)
Vсм
= (M1R1
+ M2R2
+
….. + MnRn)
T.
Так
как
,
то
pсмVсм
= (M1R1
+ M2R2
+
….. + MnRn)
T.
(1.11)
Из
уравнений (1.9) и ( 1.11) следует, что
МсмRсмТ
= (M1R1
+ M2R2
+
….. + MnRn)
T.
Отсюда
Rсм
=
М1
/ Мсм
R1
+ М2
/ Мсм
R2
+ …… + Мn
/ Мсм
Rn
=
=
m1R1
+ m2R2
+ …… + mnRn
или
,
(1.12)
где
Rсм
— газовая постоянная смеси.
Так
как газовая постоянная i-го газа
Ri
= 8314 / mi,
то
уравнение (1.12) перепишется следующим
образом:

(1.13)
Определяя
параметры газовой смеси, удобно
пользоваться некоторой условной
величиной, называемой кажущейся (средней)
молекулярной массой газовой смеси.
Понятие кажущейся молекулярной массы
смеси позволяет условно рассматривать
смесь как однородный газ, что существенно
упрощает расчеты.
Для
отдельного газа справедливо выражение
mi
Ri
= 8314.
По
аналогии для смеси можно записать
mсм
Rсм
= 8314,
(1.14)
где
mсм
— кажущаяся молекулярная масса смеси.
Из
уравнения (1.14), используя выражения
(1.12) и (1.13), получим

(1.15)

(1.16)
Рассуждая
подобным образом, можно получить формулы
для расчета Rсм
и mсм
через объемные доли , формулы для
пересчета массовых долей в объемные
доли и, наоборот, объемных долей в
массовые, формулы для расчета удельного
объема смеси uсм
и плотности смеси rсм
через массовые и объемные доли и, наконец,
формулы для расчета парциальных давлений
газов, входящих в смесь, через объемные
и массовые доли. Приведем эти формулы
без вывода в таблице.
Формулы
для расчета газовых смесей
|
Задание |
Перевод |
Плотность |
Кажущаяся |
Газовая |
Парциаль-ное |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Массо-выми |
|
|
|
|
|
|
Объем-ными |
|
|
|
|
|
Теплоемкость
газов
Теплоемкостью
тела называют количество теплоты,
необходимое для нагревания или охлаждения
тела на 1 К. Теплоемкость единицы
количества вещества называют удельной
теплоемкостью.
Итак,
удельной теплоемкостью вещества называют
количество теплоты, которое необходимо
сообщить или отнять от единицы вещества,
чтобы изменить его температуру на 1 К в
данном процессе.
Поскольку
в дальнейшем будут рассматриваться
только удельные теплоемкости, то будем
называть удельную теплоемкость просто
теплоемкостью.
Количество
газа может быть задано массой, объемом
и числом киломолей. Следует оговориться,
что при задании газа объемом этот объем
приводят к нормальным условиям и измеряют
нормальными метрами кубическими (нм3).
В
зависимости от способа задания количества
газа различают следующие теплоемкости:
с
— массовую теплоемкость, Дж/ (кг×К);
с¢
— объемную теплоемкость, Дж/ (нм3
×К);
сm
— мольную теплоемкость, Дж/(кмоль ×К).
Между
названными теплоемкостями существуют
следующие зависимости:
с
= сm
/
m;
сm
= с ×
m;
с¢
= сm
/
22,4; сm
= с¢
×
22,4,
отсюда
;
с¢
= с ×
rн,
где
uн
и rн
— удельный объем и плотность при нормальных
условиях.
Изохорная
и изобарная теплоемкости
Количество
теплоты, сообщаемое рабочему телу
зависит от особенностей термодинамического
процесса. Практическое значение имеют
два вида теплоемкости в зависимости от
термодинамического процесса: изохорная
и изобарная.
Теплоемкость
при u
= const — изохорная.
cu
— массовая изохорная теплоемкость,
c¢u
— объемная изохорная теплоемкость,
cmu
— мольная изохорная теплоемкость.
Теплоемкость
при p = const — изобарная.
cр
— массовая изобарная теплоемкость,
c¢р
— объемная изобарная теплоемкость,
cmр
— мольная изобарная теплоемкость.
При
одинаковом изменении температуры в
процессе, осуществляемом при
p
= const, расходуется теплоты больше, чем в
процессе при u
= const. Это объясняется тем, что при u
= const теплота, сообщаемая телу, расходуется
лишь на
изменение
его внутренней энергии, тогда как при
p = const теплота расходуется и на увеличение
внутренней энергии, и на совершение
работы расширения. Разность между
массовой изобарной и массовой изохорной
теплоемкостями по уравнению Майера
cр
— cu
=R.
(1.17)
Если
левую и правую части уравнения (1.17)
умножить на массу киломоля m,
то получим
cmр
— cmu
=
8314 Дж/(кмоль×К)
(1.18)
В
термодинамике и ее приложениях большое
значение имеет отношение изобарных и
изохорных теплоемкостей:
,
(1.19)
где
к — показатель адиабаты.
Расчеты
показывают, что приближенно можно
принять для одноатомных газов к »
1,67, двухатомных к »
1,4, трехатомных к »
1,29.
Нетрудно
видеть, что значение к
зависит от температуры. Действительно,
из уравнений (1.17) и (1.19) следует, что
,
(1.20)
а
из уравнений (1.18) и (1.19)
.
(1.21)
Так
как с увеличением температуры газа
теплоемкости увеличиваются, то значение
к уменьшается, приближаясь к единице,
но всегда остается больше нее.
Зная
величину к, можно определить значение
соответствующей теплоемкости. Так,
например, из уравнения (1.20) имеем
,
(1.22)
а
т.к. ср
= к ×
сu,
то получим
.
(1.23)
Аналогично
для мольных теплоемкостей из уравнения
(1.21) получим
.
(1.24)
.
(1.25)
Средняя
и истинная теплоемкость
Теплоемкость
газов зависит от температуры и в некоторой
степени от давления. Зависимость
теплоемкости от давления невелика и ею
в большинстве расчетов пренебрегают.
Зависимость же теплоемкости от температуры
значительна и ее необходимо учитывать.
Эта зависимость достаточно точно
выражается уравнением
с
= а + вt
+ еt2,
(1.26)
где
а, в
и е — величины, постоянные для данного
газа.
Часто
в теплотехнических расчетах нелинейную
зависимость (1.26) заменяют линейной:
с
= а + вt.
(1.27)
|
Если |
|
|
|
Следовательно,
Из
dq
В количество |
температуры.
Очевидно, что количество теплоты q,
которое сообщают единице количества
вещества при нагревании его от t1
до t2,
можно найти, проинтегрировав (1.29) от t1
до t2.

(1.30)
Графически
интеграл (1.30) выражается площадью
4-1-2-3. Если в выражение (1.30) подставить
значение истинной теплоемкости по
линейной зависимости (1.27), то получим

где
—
средняя теплоемкость в интервале
температур от t1
до t2.
,
(1.32)
Следовательно,
средняя теплоемкость представляет
собой отношение конечного количества
теплоты q к конечному изменению температуры
t2
— t1:
.
(1.33)
Если
на основании 4-3 (рис.1.4) построить
прямоугольник 4-1¢-2¢-3,
равновеликий фигуре 4-1-2-3, то высота
этого прямоугольника будет равна средней
теплоемкости, где
находится в интервале температур t1
— t2.
Обычно
значения средних теплоемкостей приводятся
в таблицах термодинамических свойств
веществ. Однако для сокращения объема
этих таблиц в них приводятся значения
средних теплоемкостей, определенных в
диапазоне изменения температуры от 0
оС
до t оС.
Если
необходимо вычислить значение средней
теплоемкости в заданном интервале
температур t1
— t2,
то это можно сделать следующим образом.
Площадь
0а14 под кривой с = f(t) (рис.1.4) соответствует
количеству теплоты q1,
необходимому для повышения температуры
газа от 0 оС
до t1
оС.
Аналогично
площадь 0а23 соответствует q2
при повышении температуры от 0 оС
до t2
оС:
Таким
образом, q = q2
— q1
(площадь 4123) может быть представлено в
виде
(1.34)
Подставляя
значение q по (1.34) в выражение (1.33), получим
формулу для средней теплоемкости в
любом диапазоне температур:
.
(1.35)
Таким
образом, среднюю теплоемкость можно
вычислить по табличным средним
теплоемкостям по уравнению (1.35). Причем
получим нелинейную зависимость с = f(t).
Можно также найти среднюю теплоемкость
по уравнению (1.32) по линейной зависимости.
Значения а и в
в уравнении (1.32) для различных газов
приводятся в литературе.
Количество
теплоты, подведенной или отведенной от
рабочего тела, можно рассчитать по
какому-либо из уравнений:
(1.36)
(1.37)
,
(1.38)
где
— соответственно средняя массовая,
объемная и мольная теплоемкости; М —
масса газа; n — число киломолей газа; Vн
— объем газа при нормальных условиях.
Объем
газа Vн
может
быть найден следующим образом. Записав
уравнение состояния для заданных
условий: pV = MRT и для нормальных условий:
pнVн
= MRTн,
отнесем второе уравнение к первому:
,
отсюда
.
(1.39)
Теплоемкость
газовых смесей
Теплоемкость
газовой смеси может быть вычислена,
если задан состав смеси и известны
теплоемкости компонентов, входящих в
смесь.
Для
нагревания смеси массой Мсм
на 1К необходимо температуру каждого
из компонентов также повысить на 1К. При
этом на нагревание i-го компонента смеси
массой Мi
затрачивается количество теплоты,
равное ciMi.
Для всей смеси количество теплоты
,
где
ci
и cсм
— массовые теплоемкости i-го компонента
и смеси.
Поделив
последнее выражение на Мсм,
получим
расчетную формулу для массовой
теплоемкости смеси:
,
(1.40)
где
mi
— массовая доля i-го компонента.
Рассуждая
аналогично, найдем объемную c¢см
и мольную cmсм
теплоемкости смеси:
(1.41)
где
c¢i
— объемная теплоемкость i-го компонента,
ri
— объемная доля i-го компонента,
,
(1.42)
где
cmi
— мольная теплоемкость i-го компонента,
ri
— мольная (объемная) доля i-го компонента.
17
Теплоемкость газов и их смесей
Теплоемкостью (С) называют отношение количества теплоты, необходимой для изменения температуры в веществе на бесконечно малую величину:
Такую теплоемкость называют истинной.
При решении практических задач используют среднюю теплоемкость — условную постоянную величину в определенном интервале температур:
В зависимости от единиц количества вещества различают:
- • массовую теплоемкость с, кДж/(кг • К);
- • молярную теплоемкость рс или См, кДжДкмоль-К);
• объемную теплоемкость С или с’, отнесенную к 1 м 3 газа при нормальных физических условиях (j) = 760 мм рт. ст., t = 0°С), кДж/(м 3 • К) .
Массовая, молярная и объемная теплоемкости связаны между собой следующими зависимостями:
где |i — молекулярная масса вещества, кг/кмоль; vH, рн — удельный объем и плотность вещества при нормальных условиях; 22,4 м 3 /кмоль — объем одного киломоля любого идеального газа при нормальных физических условиях [1] .
Теплоемкость рабочего тела зависит от характера процесса, поэтому тоже является функцией процесса. В различных процессах теплоемкость может принимать значения в пределах -©о .
При анализе термодинамических процессов, протекающих при постоянном объеме (изохорных), используют изохорную теплоемкость cv, icv, c‘v, при анализе термодинамических процессов, протекающих при постоянном давлении (изобарных), используют изобарную теплоемкость ср, хср, с’р.
Используя выражения первого начала термодинамики, запишем:
Поскольку внутренняя энергия и энтальпия идеального газа зависят только от температуры, то их изменения в любом процессе можно рассчитать по формулам:
Связь между изобарной и изохорной теплоемкостями можно установить следующим образом. В изобарном процессе подведенная qp теплота расходуется на изменение внутренней энергии и на совершение внешней работы, а в изохорном — теплота qv расходуется только на изменение внутренней энергии. При нагревании 1 кг рабочего тела на одинаковую температуру разность между теплотой qp и qv будет равна работе, произведенной в процессе при р = const, т.е.
Для идеального газа работа в изобарном процессе может быть определена из уравнения состояния после дифференцирования последнего:
После подстановки значений (к]р и с1дг, и сокращения на с1Т получаем
Формула (1.27), устанавливающая связь между изобарной и изохорной теплоемкостями, называется уравнением Майера. Из нее вытекает также физический смысл газовой постоянной: газовая постоянная Я равна работе 1 кг газа в изобарном процессе при изменении его температуры на один кельвин (1 К). Разные газы в изобарном процессе производят неодинаковую работу.
Умножая обе части равенства (1.27) на молекулярную массу, получаем
Величина хЯ (или /?м) называется универсальной газовой постоянной. Из (1.28) следует, что разность молярных изобарной и изохорной теплоемкостей для идеальных газов является величиной постоянной.
При решении теплотехнических задач необходимо знать значения теплоемкостей различных газов. При невысоких температурах можно пользоваться значениями теплоемкостей, полученными на основе класси- ческой молекулярно-кинетической теории газов, согласно которой теплоемкость идеального газа зависит только от количества атомов в молекуле газа, характера процесса и не зависит от температуры.
Мольные теплоемкости идеальных газов в процессе, протекающем при постоянном объеме, имеют следующие значения: рсГ = 12,6 кДжДкмоль • К) — одноатомные газы; рс?1= 20,9 кДжДкмоль • К) — двухатомные газы; цс1)= 29 кДжДкмоль • К) — трех- и многоатомные газы.
Мольная изобарная теплоемкость может быть рассчитана но формуле (1.28). Массовые и объемные теплоемкости идеальных газов определяют по (1.21) и (1.22).
Сравнивая приведенные значения теплоемкости с опытными данными, можно прийти к следующим выводам. Если для одноатомных газов приведенные значения теплоемкостей хорошо совпадают с опытными результатами, то для двухатомных газов такое совпадение наблюдается только при температурах 0—20°С. При более высоких температурах имеют место значительные расхождения в величинах теплоемкостей.
Для трех- и многоатомных газов значения теплоемкости, полученные на основании молекулярно-кинетической теории газов, даже при невысоких температурах резко отличаются от величин теплоемкости, определяемой опытным путем. Эти расхождения объясняются тем, что классическая молекулярно-кинетическая теория газов не учитывает внутреннюю энергию колебательного движения атомов внутри молекулы. Влияние ее на величину теплоемкости тем сильнее, чем больше число атомов в молекуле и выше температура. Так, например, теплоемкость воздуха при 300°С по сравнению с теплоемкостью при 0°С увеличивается на 4%, а при 2000°С — почти на 25%. Еще больше увеличивается теплоемкость с повышением температуры у трехатомных газов.
В тепловых двигателях происходит значительное изменение температуры газа, поэтому необходимо учитывать зависимость теплоемкости от температуры:
Эту зависимость находят экспериментальным путем, она имеет вид алгебраического многочлена:
где а, /?, сI — коэффициенты, определяемые опытным путем.
Как следует из (1.29) и рис. 1.1, в общем случае теплоемкость имеет криволинейную зависимость от температуры. Величины истинных и средних изохорных и изобарных теплоемкостей в зависимости от температуры приводятся в справочных таблицах. В них средние значения теплоемкостей дают для интервала температур от 0 до ?°С. Средние теплоемкости в интервале температур и ?2 с использованием таблиц вычисляют по формуле
где с0_Г1, с0_Г2 — средние табличные теплоемкости газа в интервале температур (0—и (0—?2), °С.
В (1.30) числитель представляет собой количество теплоты, подводимой к газу с целью повышения его температуры от до ?2> °С.
Часто в теплотехнических расчетах криволинейную зависимость теплоемкости от температуры заменяют близкой к ней прямолинейной зависимостью (рис. 1.1). В этом случае истинную теплоемкость определяют но следующей приближенной формуле:
Рис. 1.1. Зависимость теплоемкости от температуры
Графически коэффициент а выражает теплоемкость газа при 0°С, а коэффициент Ь является тангенсом угла а наклона прямой. В таком случае среднюю теплоемкость газа в интервале температур от Ьх до ?2 находят по формуле
Расчетные приближенные формулы для определения средних теплоемкостей при постоянном давлении для различных газов в интервале температур от 0 до 1000°С приведены в специальных таблицах. Использование (1.31) и (1.32) позволяет обойтись при расчетах без справочных таблиц.
На теплоемкость реальных газов влияет не только температура, но и давление.
Для определения теплоемкости смеси газов необходимо знать ее состав и значения теплоемкостей компонентов.
При нагреве смеси на 1°С каждый компонент также нагревается на 1°С. Следовательно, если смесь задана массовыми долями, то теплоемкость смеси, кДж/К,
где Мш — масса смеси, кг; ссм — массовая теплоемкость смеси, кДж/(кг • К); М1? М2,Мп — массы компонентов, кг; сх, с2,сп — массовые теплоемкости компонентов, кДж/(кг • К).
Разделив обе части последнего уравнения на Мсм, получим
Если смесь задана объемными долями, то объемную теплоемкость 1 м 3 смеси газов при нормальных физических условиях находят по формуле
Мольную теплоемкость газовой смеси определяют но аналогичной формуле:
Уравнение Майера
Уравнение Майера связывает теплоемкости идеального газа в двух изопроцессах, тогда перейдем к самому его определению.
Теплоемкость. Уравнение Майера
Переданное телу количество теплоты для его нагревания на 1 К получило название теплоемкости тела данной системы. Обозначение принимается буквой » С » :
Значение теплоемкости единицы молярной массы тела:
c μ = C v ( 2 ) . Выражение называется молярной теплоемкостью.
Теплоемкость не считается функцией состояния, так как является характеристикой бесконечно близких состояний системы или выражается в качестве функции бесконечно малого процесса, совершаемого в системе. В количественном выражении это означает, что из ( 1 ) , применяя первое начало термодинамики, дифференциальная форма получится:
C = δ Q d T = d U + p d V d T ( 3 ) .
Уравнение Майера для идеального газа
Определение термодинамической системы производится при помощи трех параметров p , V , T . Существующее между ними отношение получило название уравнения состояния. Для идеального газа используется уравнение Менделеева-Клапейрона. Данная связь запишется в виде:
p = p ( T , V ) или T = T ( p , V ) , V = V ( p , T ) .
При выборе независимых переменных в качестве V и T внутренняя энергия системы выражается в виде функции U = U ( T , V ) . Получим, что значение полного дифференциала от внутренней энергии примет вид:
d U = ∂ U ∂ T V d T + ∂ U ∂ V T d V ( 4 ) .
Произведем подстановку из ( 4 ) в ( 3 ) , тогда
c = ∂ U ∂ T V d T + ∂ U ∂ V T d V + p d V d T = ∂ U ∂ T V + p + ∂ U ∂ V T d V d T ( 5 ) .
Исходя из формулы ( 5 ) , теплоемкость находится в зависимости от процесса. Если он изохорный, то
Значение теплоемкости изохорного процесса запишется как:
C V = ∂ U ∂ T V ( 6 ) .
При изобарном теплоемкость выражается через формулу:
C p = ∂ U ∂ T V + p + ∂ U ∂ V T ∂ V ∂ T p = C V + p + ∂ U ∂ V T ∂ V ∂ T p ( 7 ) .
Перейдем к рассмотрению исследуемой системе идеального газа. Запись малого приращения энергии идеального газа:
d U = i 2 v R d T ( 8 ) .
d U d V T = 0 ( 9 ) .
Состояние идеального газа описывается при помощи уравнения Менделеева-Клапейрона:
∂ V ∂ T p = v R p ( 11 ) .
Произведем подстановку в ( 7 ) из ( 10 ) и ( 11 ) :
C p = C V + p + 0 v R p = C V + v R ( 12 ) .
Выражение ( 12 ) называют выведенным соотношением Майера.
Или для молярных теплоемкостей:
C μ p = C μ V + R ( 13 ) .
Найти удельную теплоемкость смеси 16 г кислорода и 10 г гелия в процессе с постоянным давлением.
Если Q считается количеством тепла, получаемым смесью газов в процессе, то
Q = c p m ∆ T ( 1 . 1 ) , где m является массой смеси, c p – удельной теплоемкостью смеси при неизменном давлении.
Q O 2 — это количество тепла, получаемое кислородом:
Q O 2 = c p O 2 m O 2 ∆ T ( 1 . 2 ) , m O 2 выражается массой кислорода, c p O 2 – теплоемкостью кислорода с постоянным давлением.
Для гелия аналогично:
Q H e = c p H e m H e ∆ T ( 1 . 3 ) .
Кроме этого рассмотрим:
Q = c p m ∆ T = Q O 2 + Q H e = c p O 2 m O 2 ∆ T + c p H e m H e ∆ T ( 1 . 4 ) .
Нахождение массы смеси производится по закону сохранения массы:
m = m O 2 + m H e ( 1 . 5 ) .
Произведем выражение теплоемкости c p из ( 1 . 4 ) , учитывая ( 1 . 5 ) . Тогда имеем:
c p = c p O 2 m O 2 + c p H e m H e m O 2 + m H e ( 1 . 6 ) .
Существует связь между молярной теплоемкостью и удельной:
c μ = c · μ → c = c μ μ ( 1 . 7 ) .
Если c μ V = i 2 R , то по уравнению Роберта Майера c μ p = c μ V + R :
c μ p = i + 2 2 R ( 1 . 8 ) ; i H e = 3 , i O 2 = 5 .
В данном случае удельные теплоемкости запишутся как:
c p H e = 5 2 R μ H e , c p O 2 = 7 R 2 μ O 2 ( 1 . 9 ) .
Результатом будет записанная формула удельной теплоемкости смеси:
c p = 7 R 2 μ O 2 m O 2 + 5 2 R μ H e m H e m O 2 + m H e ( 1 . 10 ) .
c p = 3 , 5 · 8 , 31 · 16 32 + 2 , 5 · 8 , 31 · 10 4 26 = 14 , 5 + 51 , 94 26 = 2 , 56 Д ж г К .
Ответ: удельная теплоемкость смеси равняется 2 , 56 Д ж г К .
При проведении опытов Джоулем было получено, что с μ p — c μ V = 1 , 986 к а л К · м о л ь . Значение газовой постоянной, измеренной в механических единицах R = 8 , 314 · 10 7 э р г К · м о л ь . Определите, как соотносятся 1 к а л , э р г , Д ж .
Основой решения данного задания принято считать уравнение Майера, формула записывается:
с μ p = c μ V + R → c μ p — c μ V = R ( 2 . 1 ) .
Отсюда получим, что:
c μ p — c μ V = 1 , 986 к а л К · м о л ь = 8 , 314 · 10 7 э р г К · м о л ь → 1 к а л = 4 , 18 · 10 7 э р г = 4 , 18 Д ж .
Ответ: 1 к а л = 4 , 18 · 10 7 э р г = 4 , 18 Д ж .
Газовые смеси и теплоемкости
Методические указания
В инженерной практике часто приходится иметь дело с газообразными веществами, близкими по свойствам к идеальным газам и представляющими собой механическую смесь отдельных компонентов различных газов, химически не реагирующих между собой. Это так называемые газовые смеси.
Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в неё компонентов
.
Состав газовой смеси определяется количеством каждого из газов, входящих в смесь, и может быть задан массовыми или объёмными долями. Массовая доля определяется отношением массы отдельного газа входящего в смесь, к массе всей смеси
,
где gi – массовая доля компонента смеси;
m – масса всей смеси, кг.
Объёмной долей газа называется отношение объёма каждого компонента, входящего в смесь, к объёму всей газовой смеси при условии, что объём каждого компонента, отнесён к давлению и температуре смеси
где ri – объёмная доля компонента смеси;
Vi – приведённые объёмы компонентов газов, входящих в смесь, м 3 ;
V – общий объём газовой смеси, м 3 .
Очевидно, что , .
Основные формулы, применяемые при расчётах газовых смесей, приведены в таблице 1.1.1.
Таблица 1.1.1 – Формулы для расчёта газовых смесей
| Состав смеси | Перевод из одного состава в другой | Удельный объём смеси | Кажущаяся молекулярная масса смеси | Газовая постоянная смеси | Парциальное давление |
| Массовые доли | |||||
| Объёмные доли |
Теплоемкостью называют количество теплоты, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо количественной единицы на 1 0 С. В зависимости от выбранной количественной единицы вещества различают удельные мольную кДж/(кмоль·К), массовую кДж/(кг·К) и объемную кДж/(м 3 ·К) теплоемкости.
1 м 3 газа в зависимости от параметров его состояния имеет разные массы. В связи с этим объемную теплоемкость всегда относят к массе газа, заключенной в 1 м 3 его при нормальных условиях Рн = 101325 Па (760 мм.рт.ст.) и Т = 273 К (t =0 0 С). Для определения значений перечисленных выше теплоёмкостей достаточно знать величину одной какой-либо из них. Удобнее всего иметь величину мольной теплоемкости. Тогда массовая теплоемкость , а объемная теплоемкость . Объемная и массовая теплоемкости связаны между собой зависимостью ,где — плотность газа при нормальных условиях.
Теплоемкость газа зависит от его температуры. По этому признаку различают среднюю и истинную теплоемкость. Если q — количество теплоты, сообщаемой единице количества газа (или отнимаемого от него) при изменении температуры газа от t1 до t2 то средняя теплоемкость впределах температур . Предел этого отношения, когда разность температур стремится к нулю, называют истинной теплоемкостью.Аналитически последняя определяется, как . Теплоемкость идеальных газов зависит не только от их температуры, но и от их атомности и характера процесса. Теплоемкость реальных газов зависит от их природных свойств, характера процесса, температуры и давления. Для газов важное значение имеют следующие два случая нагревания (охлаждения): 1) изменение состояния при постоянном объеме; 2) изменение состояния при постоянном давлении. Обоим этим случаям соответствуют различные значения теплоемкостей. Таким образом, различают истинную и среднюю теплоемкости: а) мольную при постоянном объеме , и постоянном давлении , ; б) массовую при постоянном объеме , и постоянном давлении , ; в) объемную при постоянном объеме , и постоянном давлении , .
Между мольными теплоемкостями при р=const и v=const существует следующая зависимость: кДж/(кмоль·К).
Для приближённых расчётов при невысоких температурах можно принять значения мольных теплоёмкостей указанные в таблице 1.1.2.
Отношение теплоёмкостей при р=const и v=const обозначается
Таблица 1.1.2 – Значения мольных теплоёмкостей при р=const и v=const
| Газы | Мольная теплоёмкость | ||
| Одноатомные | 12,56 | 20,93 | 1,67 |
| Двухатомные | 20,93 | 29,31 | 1,41 |
| Трёх и многоатомные | 29,31 | 37,68 | 1,29 |
;
Количество теплоты, которое участвует в процессе нагревания (охлаждения) М, кг или V, м 3 газа
Теплоёмкость газов изменяется с изменением температуры, причём эта зависимость носит криволинейный характер. Нелинейную зависимость истинной теплоёмкости от температуры представляют в виде
,
где a, b, d – величины постоянные для данного газа.
В расчётах нелинейную зависимость заменяют близкой к ней линейной зависимостью , а средняя теплоёмкость при изменении температуры от t1 до t2
Для средней теплоёмкости в пределах 0 0 —t эта формула принимает вид
Теплоёмкость смеси идеальных газов
Если смесь газов задана массовыми долями, то её массовая теплоёмкость определяется как сумма произведений массовых долей на массовую теплоёмкость каждого компонента , .
При задании смеси объёмными долями объёмная теплоёмкость смеси , .
Аналогично мольная теплоёмкость смеси равна сумме произведений объёмных долей на мольные теплоёмкости составляющих смесь газов , .
В приложениях 2-9 приведены теплоёмкости наиболее часто встречающихся в расчётах газов.
Задание №1
Газовая смесь задана в массовых gi или объемных ri долях процентным составом компонентов смеси; давление смеси Рсм, МПа, объём смеси Vсм, м 3 температура смеси tсм, 0 С (таблица 1.2.1).
1. Состав смеси (если по условию состав смеси задан в объемных долях ri, то следует определить дополнительно состав смеси в массовых долях gi и наоборот);
2. Газовые постоянные компонентов смеси Ri, кДж/(кг·К);
3. Газовую постоянную смеси Rсм, кДж/(кг·К) через объёмные и массовые доли;
4. Среднюю молярную массу смеси μсм, кмоль/кг через объемные ri и массовые gi доли;
5. Парциальные давления компонентов Рi,МПа через объемные ri и массовые gi доли;
7. Парциальные объёмы , парциальные удельные объемы vi, м 3 /кг и плотности ρi, кг/м 3 компонентов смеси;
9. Плотности компонентов ρi, кг/м 3 при нормальных физических условиях;
10. Плотность смеси ρсм, кг/м 3 при нормальных физических условиях через объемные ri и массовые gi доли;
11. Истинную молярную μС, кДж/(кмоль·К) , объемную , кДж/(м 3 ·К) , и массовую С, кДж/(кг·К) теплоемкости при p=const и v=const для температуры смеси tсм,, 0 С;
12. Среднюю молярную μС, кДж/(кмоль·К) , объемную , кДж/(м 3 ·К) и массовую С, кДж/(кг·К) теплоемкости при p=const и v=const для интервала температур Δtсм,, 0 С ;
13. Количество теплоты, необходимое на нагревание (охлаждение) в интервале температур Δtсм,, 0 С при р=const и v=const количества вещества 2 кмоль, 5 м 3 и 7 кг смеси.
Таблица 1.2.1– Параметры газовой смеси
| № вар | Состав смеси | Давление смеси, Рсм, МПа | Объём смеси, Vсм, м 3 | Температура смеси, tсм,, 0 С | Интервал температур, Δtсм,, 0 С | |
| СО2 | Н2 | СО | N2 | Н2О | SO2 | O2 |
| — | — | — | 0,095 | 200-1000 | ||
| — | — | — | 0,1 | 300-100 | ||
| — | — | — | 0,09 | 100-300 | ||
| — | — | — | 0,105 | 600-200 | ||
| — | — | — | 0,105 | 1000-100 | ||
| — | — | — | 0,085 | 900-200 | ||
| — | — | — | 0,07 | 700-500 | ||
| — | — | — | — | 0,095 | 500-200 | |
| — | — | — | 0,1 | 800-300 | ||
| — | — | — | 0,105 | 600-100 | ||
| Продолжение таблицы 1.2.1 | ||||||
| № вар | Состав смеси | Давление смеси, Рсм, МПа | Объём смеси, Vсм, м 3 | Температура смеси, tсм,, 0 С | Интервал температур, Δtсм,, 0 С | |
| СО2 | Н2 | СО | N2 | Н2О | SO2 | O2 |
| — | — | — | 0,115 | 750-250 | ||
| — | — | — | 0,12 | 1000-500 | ||
| — | — | — | 0,125 | 300-1300 | ||
| — | — | — | 0,105 | 600-900 | ||
| — | — | — | 0,085 | 100-400 | ||
| — | — | — | 0,12 | 850-350 | ||
| — | — | — | 0,10 | 350-750 | ||
| — | — | — | 0,09 | 900-600 | ||
| — | — | — | 0,1 | 450-300 | ||
| — | — | — | 0,105 | 300-150 | ||
| — | — | — | 0,105 | 800-300 | ||
| — | — | — | 0,1 | 400-300 | ||
| — | — | — | 0,095 | 800-300 | ||
| — | — | — | 0,115 | 650-150 | ||
| — | — | — | 0,085 | 150-1200 | ||
| — | — | — | 0,1 | 300-800 | ||
| — | — | — | 0,1 | 1200-1000 | ||
| — | — | — | 0,09 | 400-900 | ||
| — | — | — | 0,095 | 800-600 | ||
| — | — | — | 0,1 | 600-100 | ||
| — | — | — | 0,11 | 500-1000 | ||
| — | — | — | — | 0,10 | 500-200 | |
| — | — | — | 0,085 | 800-250 | ||
| — | — | — | 0,10 | 200-700 | ||
| — | — | — | 0,095 | 400-100 |
Пример решения задания
Смесь имеет следующий объемный состав:
| СО2=12%; ; | Н 2О=8%; ; |
| N2=75%; ; | О 2 =5%; . |
Всего 100%; .
Объем смеси Vcм=3 м 3 ; давление смеси Рсм =0,1МПа; температура смеси tcм=100 0 С (Тсм=373 К). Температуру, при которой определяется истинная теплоемкость смеси t=2000 0 С (Т=2273 К) Интервал температур, для которого определяется средняя теплоемкость смеси t1=200 0 С (T1=473К); t2=1000 0 C (Т2=1273К). Провести расчет в соответствии с заданием (п. 1.2)
1. Определяем состав смеси в массовых долях
,
где μi – молярная масса компонента смеси, кг/кмоль (приложение 1).
;
.
Аналогично для остальных компонентов смеси
Проверка
2. Определяем газовые постоянные компонентов смеси
3. Определяем газовую постоянную смеси:
а) через объёмные доли
;
б) через массовые доли
;
4. Находим среднюю молярную массу смеси
а) через объёмные доли
б) через массовые доли
Проверка
5. Определяем парциальные давления компонентов смеси:
а) через объёмные доли
б) через массовые доли
Проверка
6. Находим массу смеси
Определяем массу компонентов газовой смеси
Проверка
7. Определяем парциальные объемы компонентов смеси
Проверка
Парциальные удельные объемы компонентов смеси
| , где — парциальный объём и масса конкретного газа | |
Находим плотности компонентов смеси
8. Плотности компонентов и смеси при заданных условиях Рсм и tсм
9. Определяем плотности компонентов смеси при нормальных физических условиях НФУ ( )
10. Определяем плотность смеси при НФУ:
а) через объемные ri доли
б) через массовые доли
11. Находим истинную теплоемкость смеси (при tсм=2000 0 С)
а) молярная теплоёмкость смеси при р=const
,
где — молярная изобарная теплоёмкость компонента при температуре смеси tсм , (приложения 2-9).
;
;
молярная теплоёмкость смеси при v=const
б) объемная теплоёмкость смеси при р=const и v=const
в) массовая теплоёмкость смеси при р=const и v=const
12. Определяем среднюю теплоемкость смеси в интервале температур
а) средняя молярная теплоёмкость смеси при р=const
где — средняя молярная теплоёмкость смеси при р=const в интервале температур ;
средняя молярная теплоёмкость компонента смеси при р=const в интервале температур согласно заданию из приложений 2-9.
Аналогично находим среднюю молярную теплоёмкость смеси при р=const в интервале температур
.
Средняя молярная теплоёмкость смеси при v=const
б) средняя объемная теплоёмкость при р=const средняя объёмная теплоёмкость при v=const в) средняя массовая теплоёмкость при р=const массовая теплоёмкость при v=const 11. Определяем количество теплоты, необходимое на нагревание (охлаждение) смеси при р=const: а) 2 кмоль смеси б) 5 м 3 смеси в) 7 кг смеси Количество теплоты, необходимое на нагревание смеси при v=const: а) 2 кмоль смеси б) 5 м 3 смеси в) 7 кг смеси
Термодинамические циклы
Методические указания
Круговым процессом или циклом называется совокупность термодинамических процессов, в результате осуществления которых рабочее тело возвращается в исходное состояние. Работа кругового процесса изображается в диаграмме P-v площадью, заключённой внутри замкнутого контура цикла, причём работа положительна, если цикл совершается по часовой стрелке (прямой цикл), и отрицательна, если он совершается против часовой стрелки (обратный цикл).Степень совершенства процесса превращения теплоты в работу в круговых процессах характеризуется термическим КПД
Цикл идеальной тепловой машины представляет собой цикл Карно. При его осуществлении предполагается использование горячего источника с постоянной температурой, т. е. фактически с бесконечной теплоемкостью. Цикл состоит из двух адиабат и двух изотерм. Количество подведённой теплоты
Количество отведённой теплоты
Термический КПД цикла
где Т1 и Т2 – температуры верхнего и нижнего источников теплоты.
Цикл с подводом теплоты при постоянном объёме состоит из двух адиабат и двух изохор.
Характеристиками цикла являются
— степень сжатия ;
— степень повышения давления .
Количество подведенной теплоты
.
Количество отведённой теплоты
Количество тепла за цикл
Изменение внутренней энергии, энтальпии и энтропии за цикл
Термический КПД цикла
Цикл с подводом теплоты при постоянном давлении состоит из двух адиабат, одной изобары и одной изохоры.
Характеристиками цикла являются
— степень сжатия ;
— степень предварительного расширения .
Количество подведенной теплоты
.
Количество отведённой теплоты
Количество тепла за цикл
Изменение внутренней энергии, энтальпии и энтропии за цикл
Термический КПД цикла
Цикл с комбинированным подводом теплоты состоит из двух адиабат, двух изохор и одной изобары.
Характеристиками цикла являются
— степень сжатия ;
— степень повышения давления ;
— степень предварительного расширения .
Количество подведенной теплоты
Количество отведённой теплоты
Количество тепла за цикл
Изменение внутренней энергии, энтальпии и энтропии за цикл
Термический КПД цикла
Во всех случаях с=const.
Цикл газовой турбины с подводом теплоты при постоянном давлении состоит из двух адиабат и двух изобар.
Характеристиками цикла являются
— степень повышения давления в компрессоре ;
— степень сжатия ;
— степень расширения .
Термический КПД цикла
или .
Цикл газовой турбины с подводом теплоты при постоянном объёме состоит из двух адиабат, одной изохоры и одной изобары
Характеристиками цикла являются
— степень сжатия ;
— степень добавочного повышения давления ;
— степень расширения .
Термический КПД цикла
.
Так как уходящие из газовой турбины продукты сгорания имеют достаточно высокую температуру, то для повышения экономичности газотурбинного агрегата вводят регенерацию, т.е. предварительный подогрев сжатого в компрессоре воздуха за счёт теплоты, уходящих газов. Термический КПД цикла турбины с подводом теплоты при р=constс полной предельной регенерацией и адиабатным сжатием
Термический КПД цикла турбины с подводом теплоты при v=constc предельной регенерацией и адиабатным сжатием
Коэффициент полезного действия идеального цикла ГТУ
При этом теплоемкость ср принята для простоты постоянной. Одной из основных характеристик цикла является степень повышения давления в компрессоре . Тогда коэффициент полезного действия идеального цикла ГТУ
Задание №2
Для заданного варианта цикла теплового двигателя (2.2.1 – 2.2.5) выполнить следующие теоретические, расчетные и графические работы:
1. Дать краткое, описание цикла в целом и характеристику каждого его процесса;
2. Определить параметры р, v, T во всех характерных точках цикла;
3. Провести полный термодинамический расчет каждого процесса;
4. Вычислить термодинамические характеристики цикла;
5. Вычислить термический КПД идеализированного цикла, у которого теплообменом в процессах сжатия и расширения пренебрегают;
6. Вычислить термический КПД цикла Карно осуществляемого в том же интервале температур и энтропии;
7. Изобразить цикл в р—v и Т—S координатах;
8. Определить коэффициент заполнения цикла;
9. Определить среднеинтегральную температуру процесса отвода тепла;
10. На основе расчета сделать заключение и результаты свести в таблицу.
Во всех случаях в качестве рабочего тела принимать воздух. Расчет произвести на 1 кг рабочего тела. Учитывать зависимость теплоемкости от температуры.
http://zaochnik.com/spravochnik/fizika/termodinamika/uravnenie-majera/
http://lektsii.org/7-49229.html
На практике чаще всего приходится сталкиваться не с отдельными газами, а с их смесями, поэтому необходимо знать определение теплоемкости смеси. При нагревании газовой смеси подведенная теплота расходуется на нагревание отдельных ее компонентов, и теплоемкость смеси определяется по ее составу.
При задании смеси массовыми долями подведенную теплоту можно определить следующим образом:
или
,
где ,
— удельная теплоемкость и масса i-го компонента соответственно,
следовательно,
.
Деля левую и правую части последнего уравнения на , получим:
.
Но поскольку – массовая доля i –того компонента, то можно записать
.
Таким образом, массовая теплоемкость смеси равна сумме произведений массовых теплоемкостей газов, входящих в смесь, на их массовые доли.
При задании смеси объемными долями, учитывая, что и
, получим:
,
т.е. объемная теплоемкость газовой смеси равна сумме произведений объемных теплоемкостей газов, входящих в состав смеси, на их объемные доли.
При задании смеси молярными долями, исходя из того, что объемные и мольные доли равны, запишем:
,
т.е. молярная теплоемкость газовой смеси равна сумме произведений молярных теплоемкостей газов, входящих в состав смеси, на их молярные доли.