Эта тема входит в бесплатную часть моего курса по биохимии.
Белки — это полимерные молекулы, которые состоят из молекул поменьше — мономеров. Этими мономерами будут аминокислоты. Если упростить, то белок — это большой кирпичный дом. Где кирпичики — это аминокислоты. В этой статье мы посмотрим на эти кирпичики: какие они бывают, сколько их и какие у них свойства. Потом соединим аминокислоты вместе — синтезируем пептид. Подробно поговорим о пептидной связи, удерживающей аминокислоты вместе. А в конце небольшой подарок — торсионные углы.
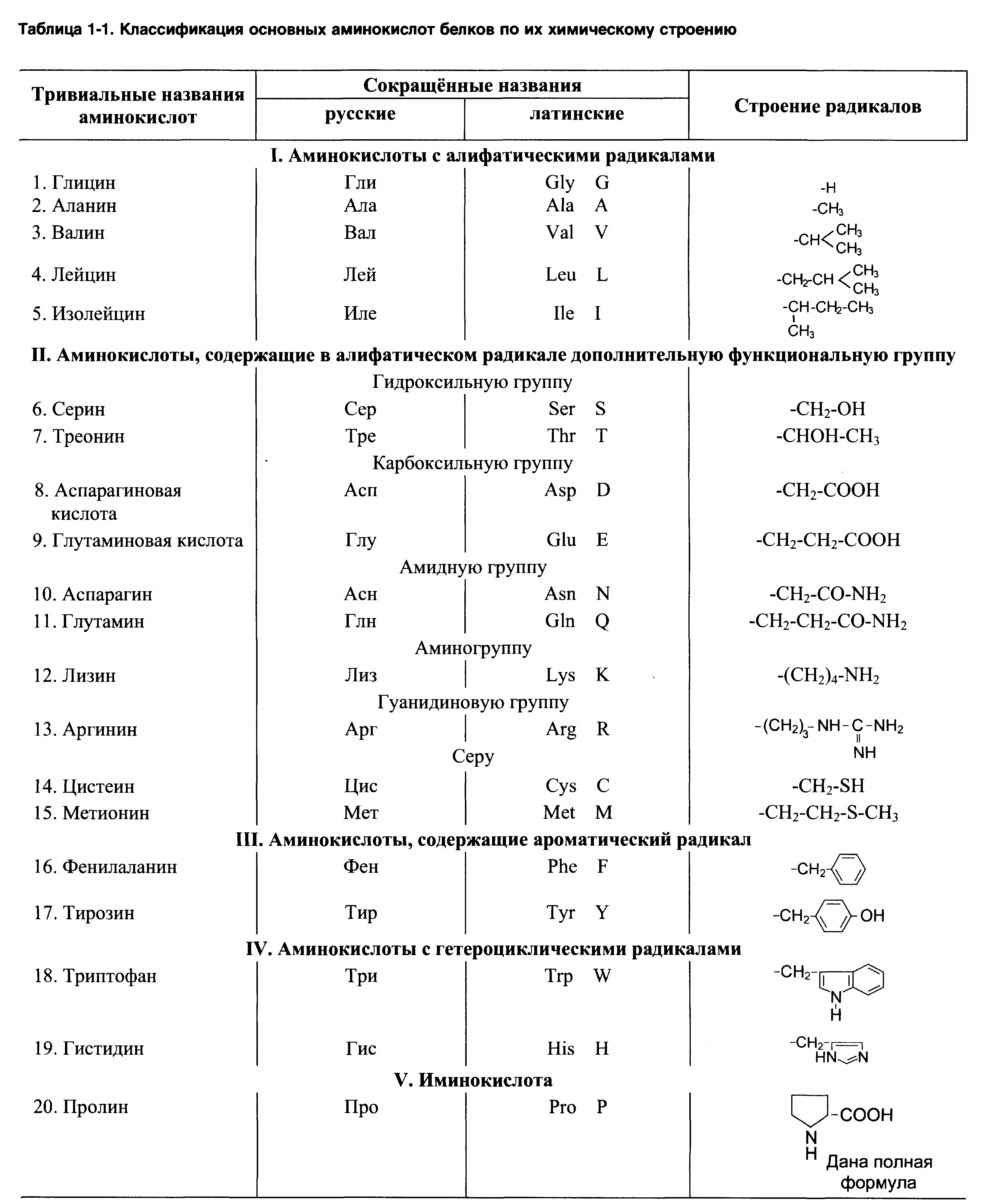
Строение аминокислот
По названию понятно, что в аминокислоте должны быть две вещи: аминогруппа и карбоксильная группа. Аминокислот довольно много, но в белках встречаются только такие:
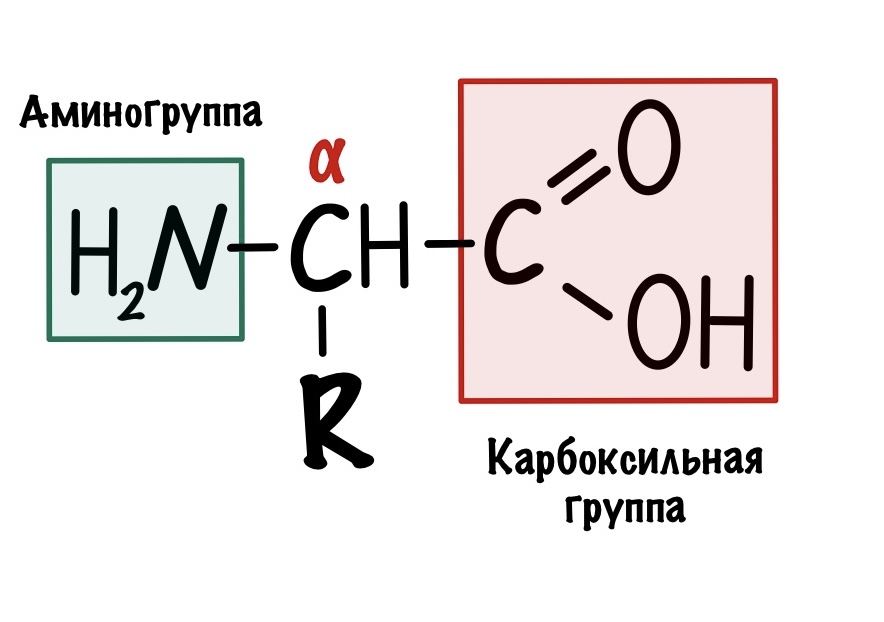
Это альфа-аминокислоты. В них есть центральный атом углерода, который связан с четырьмя заместителями: водородом, аминогруппой, карбоксильной группой и радикалом. Над этим атомом стоит греческая буква — альфа, почему? Это способ нумерации атомов углерода, входящих в органическое соединение. Для нумерации используют буквы греческого алфавита: альфа, бета, гамма, дельта и так далее. Нумерацию начинают с атома углерода, который следует после карбоксильной группы.
Альфа-углерод связан с четырьмя разными заместителями. Ещё разок повторим, что это — водород, аминогруппа, карбоксильная группа и радикал. Такие атомы называются хиральными центрами. Если в молекуле есть хиральный центр, то она хиральна. Что это значит? Это значит, что у молекулы есть изомер — он является её зеркальным отражением. Две этих молекулы будут несопоставимы в пространстве — они разные! Самый простой пример хиральности — левая и правая рука. Руки являются зеркальным отражением друг друга, но у нас не получится идеально сопоставить их в пространстве. Для этого пришлось бы превратить правую руку в левую. Или левую в правую.
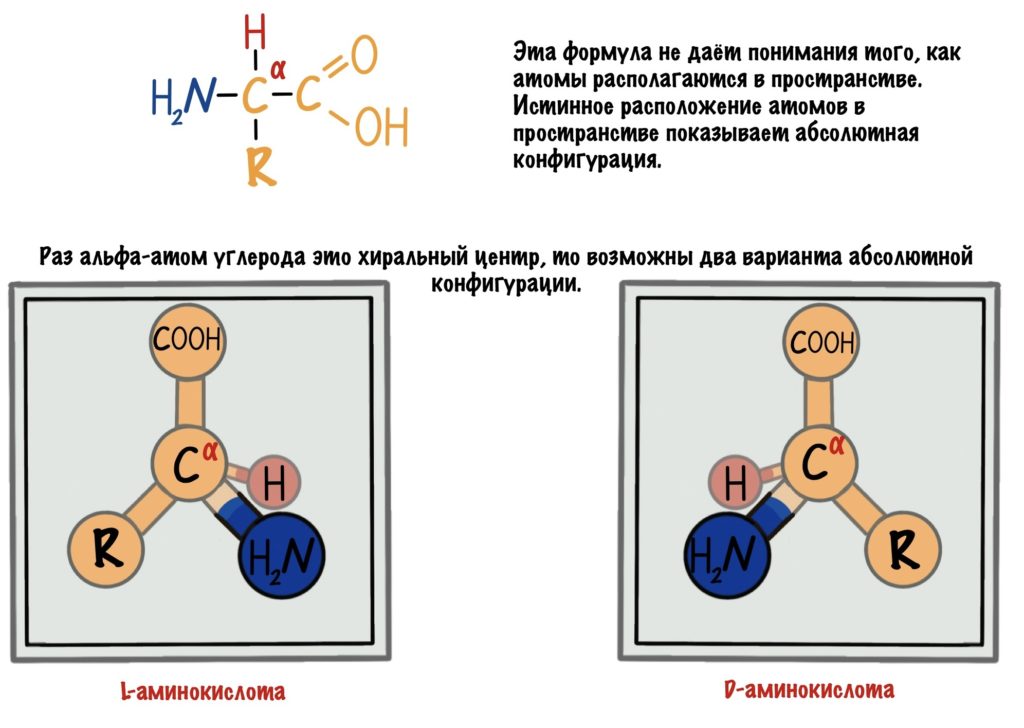
Живые организмы используют и синтезируют только L-аминокислоты.
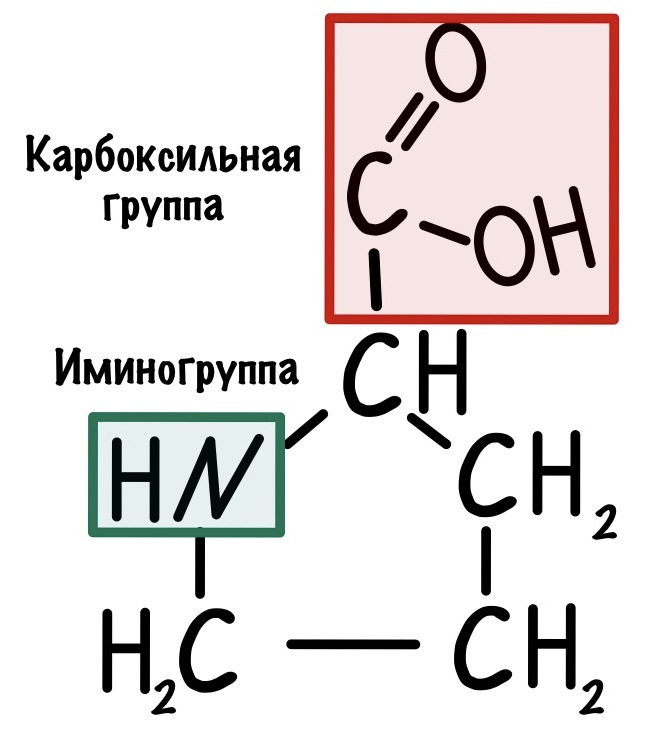
Альфа-аминокислоты будут различаться по своим радикалам. Всего нам нужно запомнить 20 аминокислот. Одна из них будет иметь особое строение — правильнее было бы назвать её иминокислотой. Вот наша легенда — пролин.
Вернемся к различиям между аминокислотами. Есть несколько классификаций радикалов, но мы возьмем самую полезную для нас — по полярности. А если говорить простыми словами, то по растворимости радикала в воде. Радикалы делятся на неполярные и полярные. Первые не растворимы в воде, а вторые растворимы. Когда будем говорить о строении белка, то поймем почему нас интересует именно эта классификация.
Неполярные радикалы аминокислот
У этих ребят нет групп, которые могут образовать водородные связи с водой, поэтому они нерастворимы. Вместо этого у них есть алифатические и ароматические группы. Радикалы выделены фиолетовым цветом.
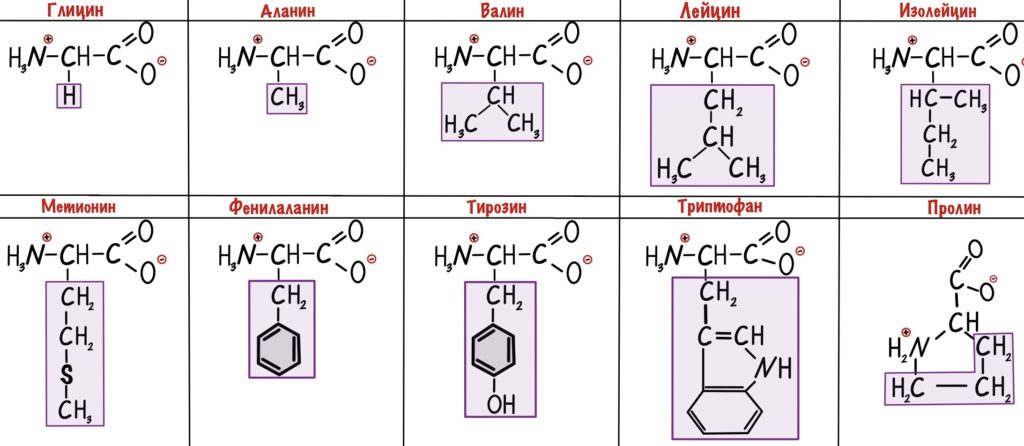
У глицина радикал — атом водорода. Выходит, что у его альфа-атома углерода два одинаковых заместителя — он не является хиральным атомом.
Полярные радикалы аминокислот
Перед этим остановимся на одной вещичке. Я писал формулы аминокислот так, как будто они не находятся в растворе. Но если мы заглянем в клетку, pH в цитоплазме которой 7 и 0, то увидим такую картину.
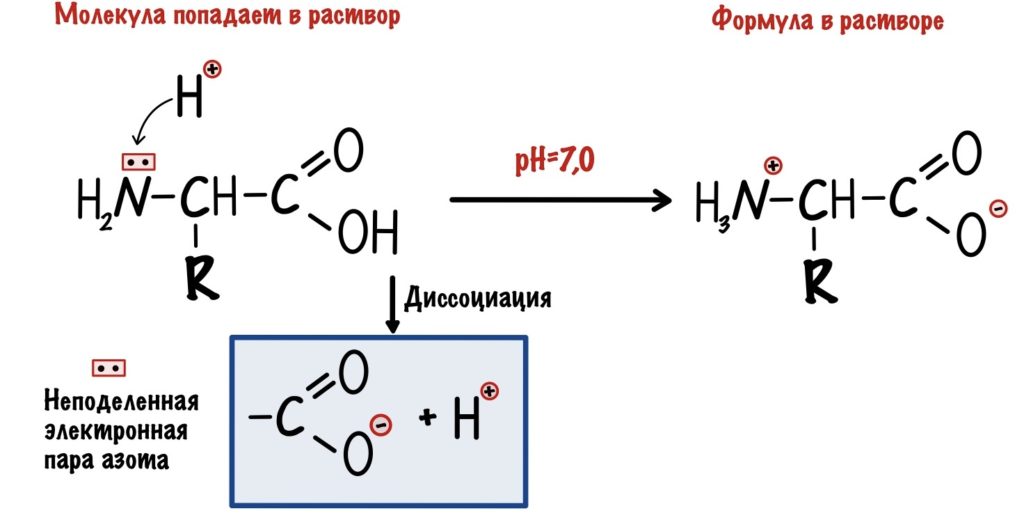
Еще разок, в цитоплазме клетки pH 7,0, то есть в в ней равное количество H+ и OH—. Так как у азота есть неподеленная электронная пара, то он может присоединить протон водорода по донорно-акцепторному механизму. А остаток кислоты диссоциирует с образованием протона. Понятное дело, что радикалы подчиняются таким же правилам.
Полярные радикалы можно разделить на две группы: полярные незаряженные и полярные заряженные.
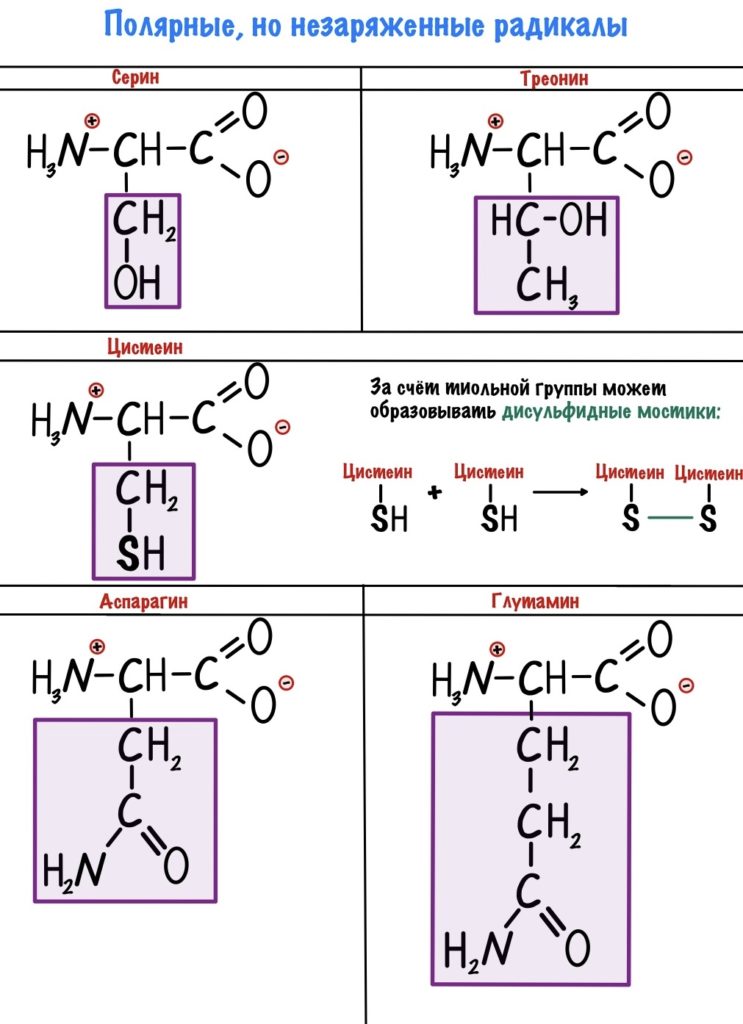
В этих аминокислотах есть сильно электроотрицательные атомы — азот, кислород и сера. С их помощью молекулы образуют водородные связи и растворяются в воде. Но заряда у них нет.
Заряд у радикала может быть положительным или отрицательным, поэтому здесь небольшое деление.
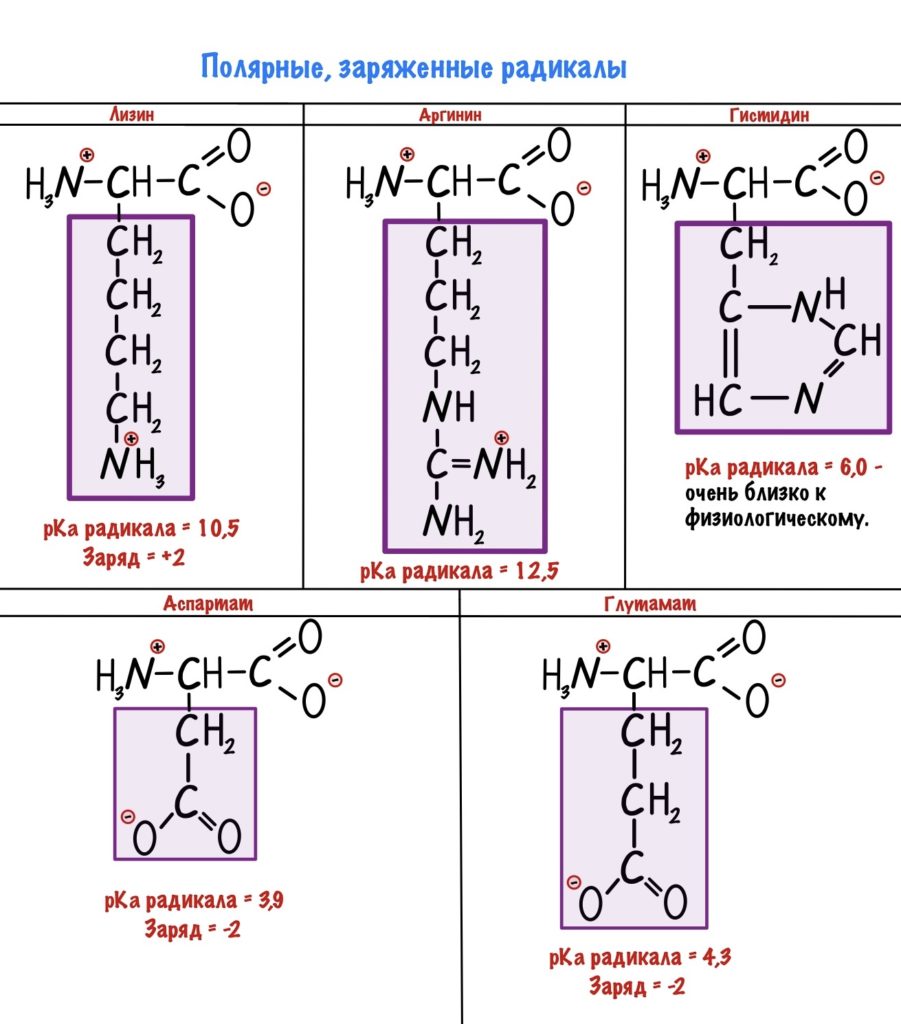
Кстати, лучше растворимы в воде заряженные радикалы. Но разница между полярными заряженными и незаряженными не слишком большая. И еще одно — аспартат и глутамат это название аспарагиновой и глутаминовой кислот в растворе.
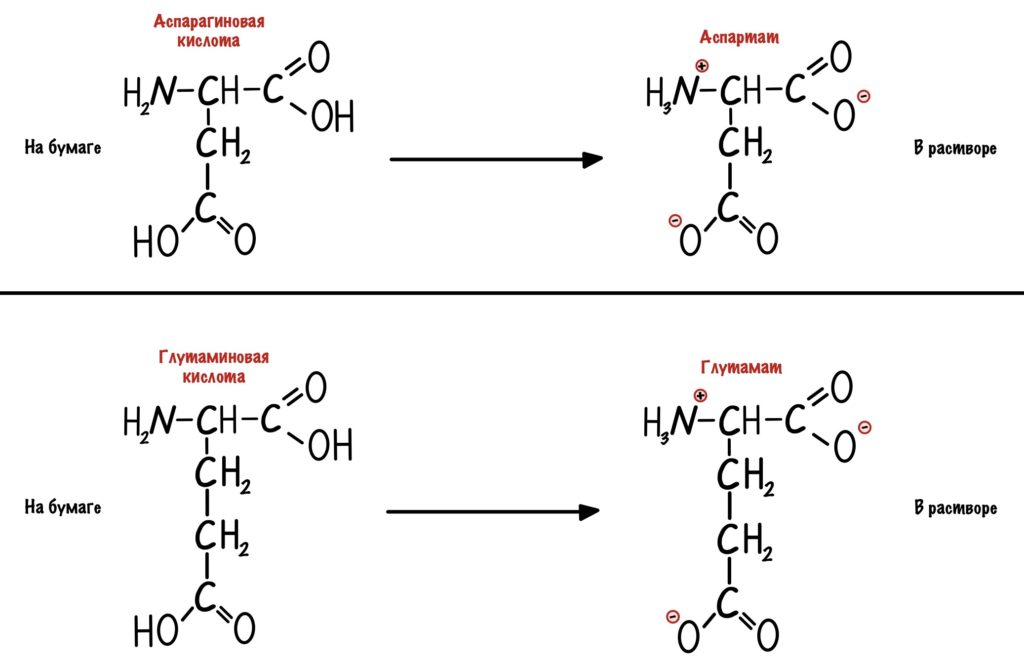
Аминокислоты делятся на полярные и неполярные. Полярные аминокислоты могут быть заряженными или незаряженными.
Аминокислоты называли по месту их выделения или физическим свойствам, поэтому у них такие странные названия. Гликос с греческого — сладкий, вот и глицин сладковат. Так что придется зазубрить это.
Изоэлектрическая точка
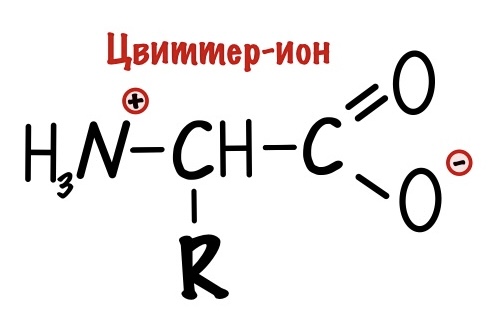
Вы уже заметили, что у аминокислот есть положительная и отрицательная части. Не так много молекул имеют такую особенность. Так что аминокислоты — это такой гибрид, поэтому их так и назвали — гибридные ионы. Правда на немецком…. А звучит это так: «Цвиттер-ион». Но как всегда есть один нюанс — у гибридного иона общий заряд молекулы равен нулю.
И вы уже смекнули, что не у всех аминокислот будет общий заряд равен нулю. Для неполярных и полярных незаряженных аминокислот это верно, но че делать с заряженными? До этого мы разбирали заряд аминокислот в клетке, то есть при нейтральном pH. Но что будет с ними, если поместить их в другие значения среды, например, в сильнощелочную или кислотную? Аминокислоты будут менять свой заряд и сейчас посмотрим как.
Для начала возьмем что-нибудь простенькое — пусть это будет глицин. Нужно понять, что мы берём раствор — у него будет определённая кислотность среды (pH) равная 7,0. В этом растворе будет множество молекул глицина. Добавляем в этот раствор кислоту. Прямо по капле. Сначала ничего не меняется, но при значении pH=2,34 половина карбоксильных групп глицина присоединит к себе протон водорода. Продолжим уменьшать pH (добавлять кислоту) — всё большее количество глицина присоединяет протон. Что же получается? При снижении pH менее 2,34 большая часть карбоксильных групп глицина присоединит к себе протон. Заряд молекул глицина изменится — теперь он равен +1. Начнем добавлять к этому же раствору щелочь по капле. Дойдем до pH равного 9,6 и от половины аминогрупп глицинов отлетит водород. Заряд молекулы будет -1. Чуть дальше будет хорошая картинка, на которой можно будет проследить за всеми изменениями.
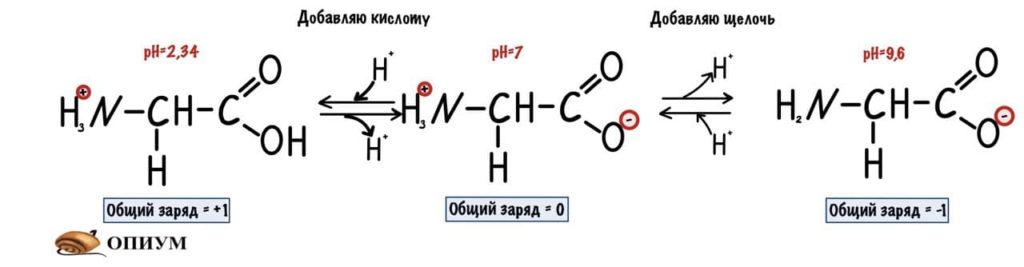
Как же назвать pH при котором происходит переход из одной формы в другую? Очень просто, показатель константы диссоциации или pKa. Константа диссоциации показывает при каком pH среды половина функциональных групп связана с протоном, а другая половина не связана. Получается, что в молекуле глицина pKa карбоксильной группы = 2,34, а pKa аминогруппы = 9,6. Я написал про молекулу глицина, потому что в остальных аминокислотах значения немного отличаются.
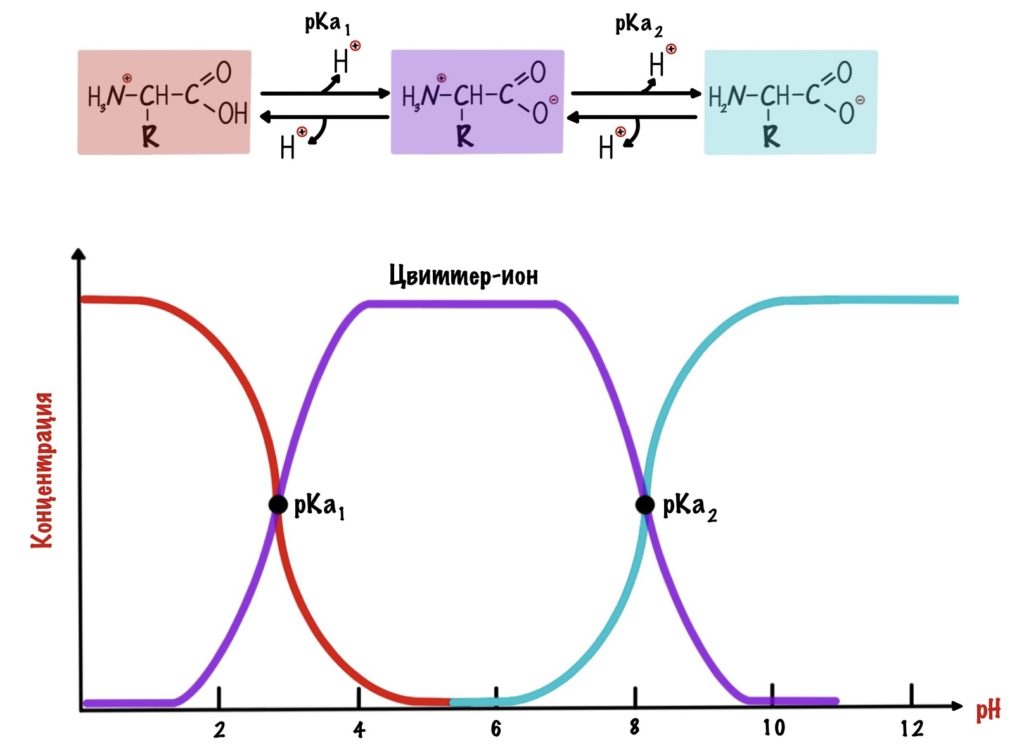
А теперь о том, ради чего все это затевалось — изоэлектрическая точка.
Изоэлектрическая точка — это pH среды, при которой заряд молекулы равен нулю. Да, вот так вот просто. Ее, кстати, можно посчитать — для этого нужно сложить pKa двух ближних функциональных групп и поделить на их количество. А их количество — две.
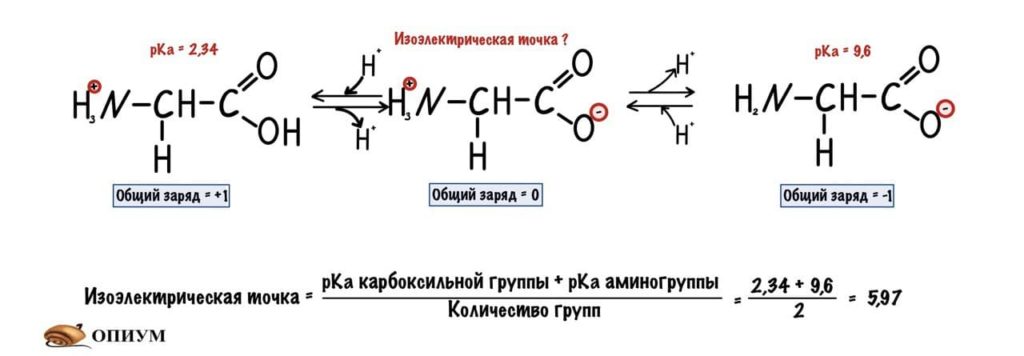
Сделаем тоже самое с молекулами посложнее, начнем с гистидина.
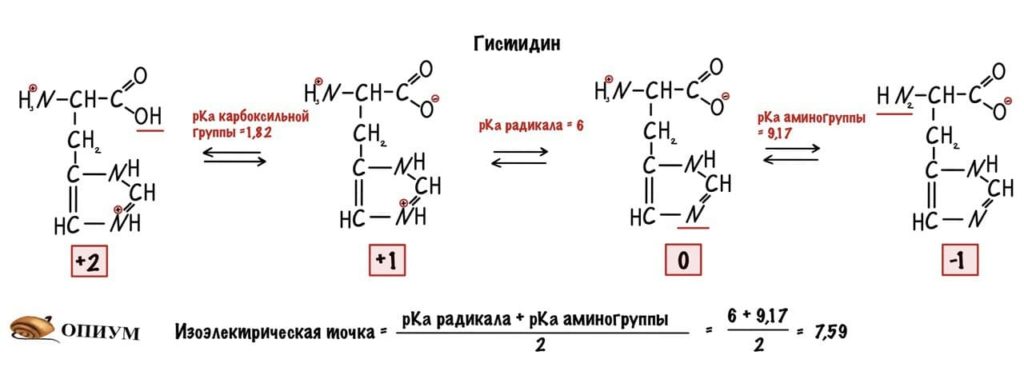
У гистидина есть заряженная группа, поэтому у него побольше вариантов заряда, чем у глицина. Мы видим, что у гистидина карбоксильная группа присоединяет водород при pH =1,82, а аминогруппа отдает протон водорода при pH=9,17. Вот про эти отличия я и говорил до этого, но так-то они не слишком большие. Радикал же отдает протон водорода при pH=6.
Сделаем тоже самое с глутаматом.
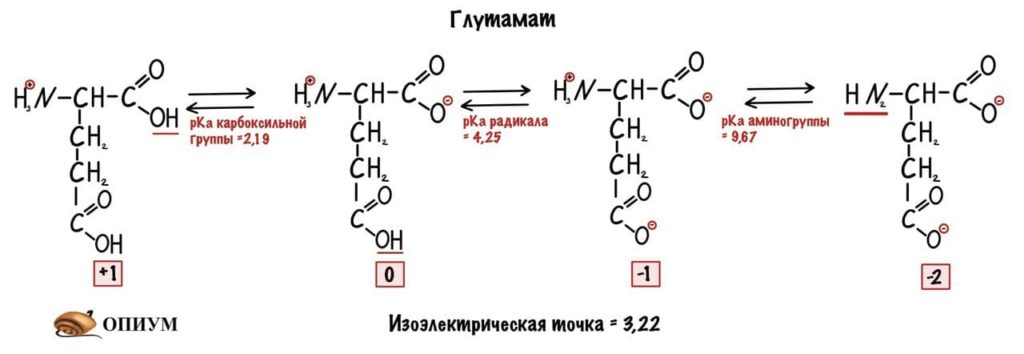
Думаю, что смысл понятен. У каждой аминокислоты своя собственная изоэлектрическая точка. Точки уже давно подсчитаны — достаточно найти их в интернете.
Сделаем красивый вывод:
Любая аминокислота цвиттер-ион, но только в изоэлектрической точке
Зачем это нужно? Ну давайте посмотрим. Мы знаем, что каждая аминокислота несет определенный заряд, но этот заряд меняется от pH среды. Если мы поместим аминокислоты в нейтральную среду и закинем туда катод и анод, то положительно заряженные аминокислоты направятся к аноду, а отрицательные к катоду. Остальные аминокислоты можно будет разделить с помощью изменения pH среды, ведь в изоэлектрической точке у аминокислоты не будет заряда. Нет заряда — нет движения к катоду или аноду, аминокислота стоит на месте. Вот мы и разделили аминокислоты в растворе, можно их изучить.
Образование пептидов
Теперь давайте соединим между собой парочку аминокислот, пусть это будет глицин и аланин. Соединяем их с помощью реакции дегидратации — отщепляем молекулу воды и получаем пептид.
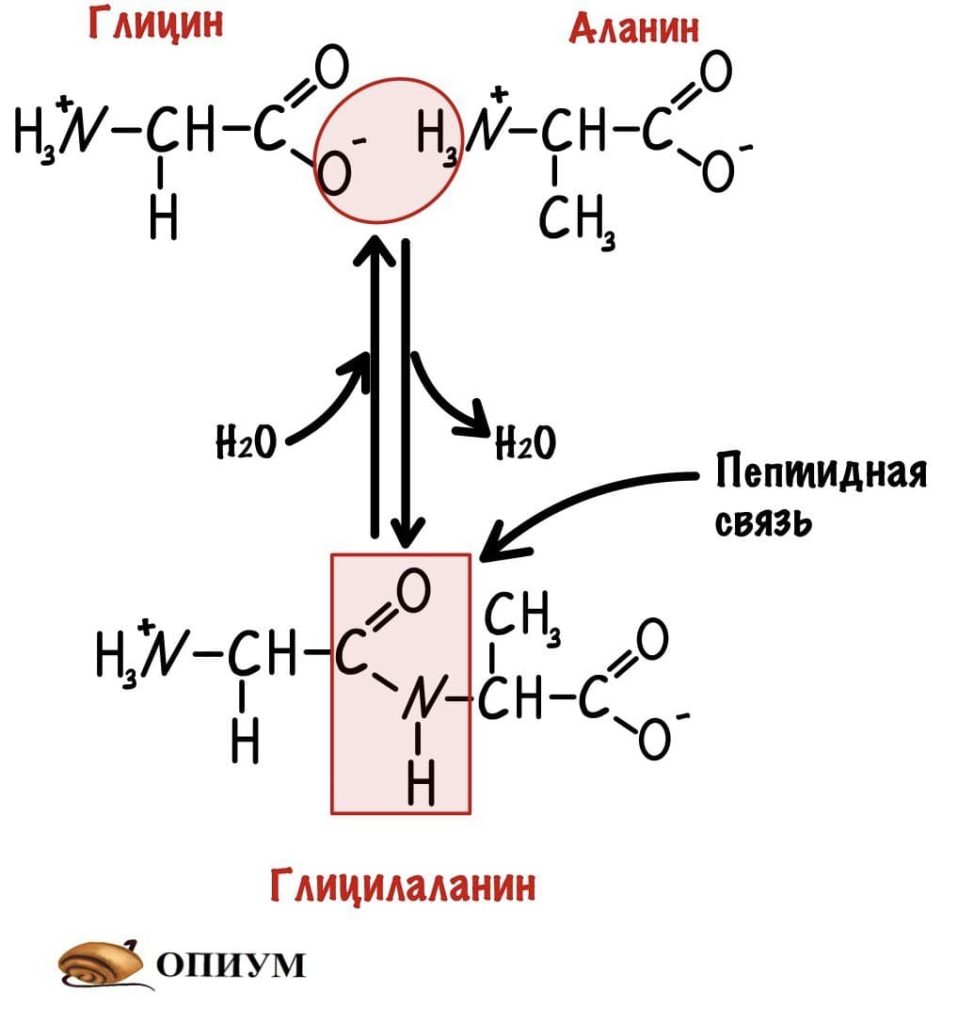
Какие группы вступали в реакцию? Да, аминогруппа и карбоксильная группа. Получается, что пептидная связь — это связь между аминогруппой одной аминокислоты с карбоксильной группой другой аминокислоты. Так как соединены две аминокислоты, то название молекулы — дипептид. Ничего не мешает мне присоединить еще одну.
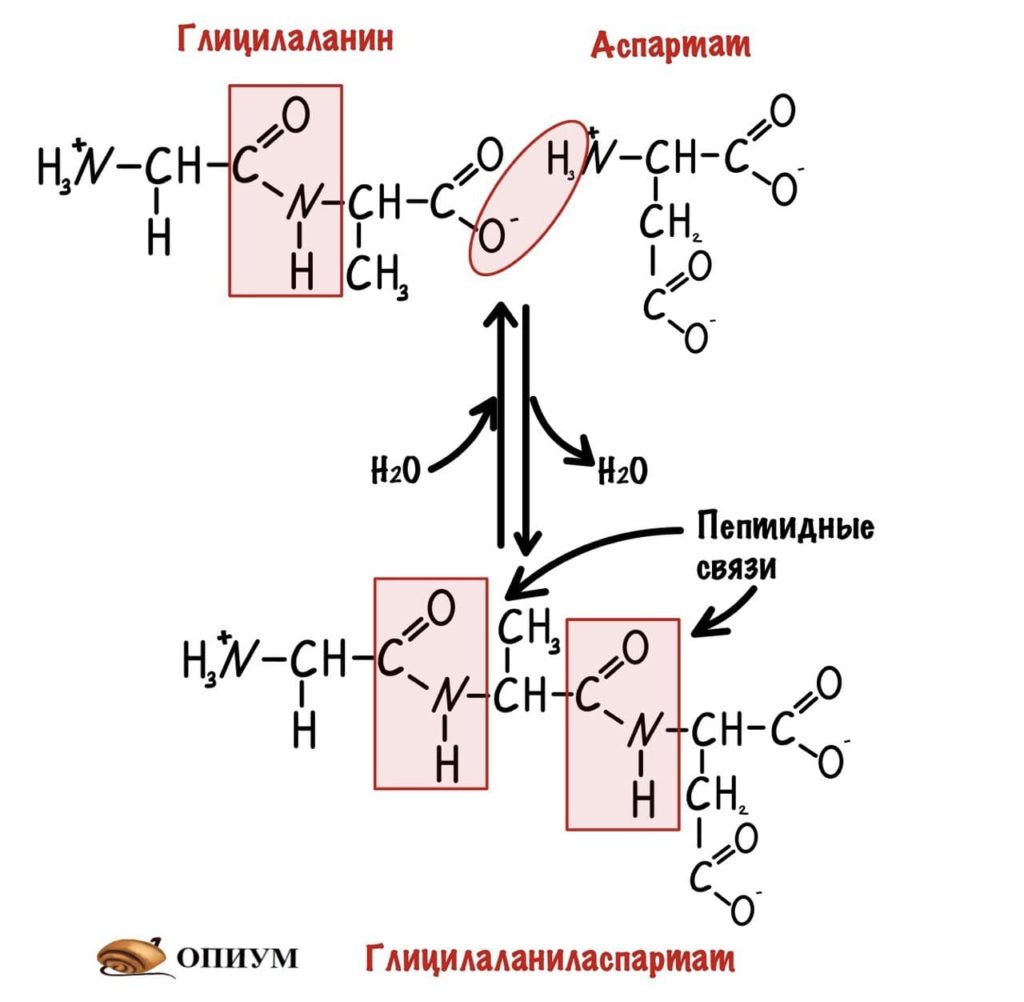
И это уже трипептид. Если соединены до 10 пептидов, то это олигопептид. От 10 до 50 — полипептид, ну а если больше 50, то это белок. Как видите реакция обратима, можно провести гидратацию по пептидной связи и пептид разрушится. На самом деле реакция гидратации идет намного лучше, а вот для дегидратации нужен источник энергии — АТФ, и рибосомальная РНК. Так что для синтеза пептидов/белков организм неплохо так тратится.
Ну и вы заметили, что я располагаю радикалы с разных сторон — то сверху, а то снизу. Это транс положение, оно более устойчиво, но можете писать как хотите.
Белок — это пептид, который содержит более 50 остатков аминокислот
Пептидная связь
У пептидной связи есть свои секретики, но мы не дадим ей хранить их просто так. Главный секрет в том, что двойная связь находится не у кислорода, а у азота… Хотя это не совсем двойная связь, но близка к ней. Как же это происходит? У азота есть неподеленная электронная пара, электроны могут перейти от азота к кислороду, а двойная связь перейдет от кислорода к азоту — неплохой такой обменчик. Это явление называется резонанс пептидной связи, именно из-за него во всех учебниках пишут про «частично-двойной характер пептидной связи».
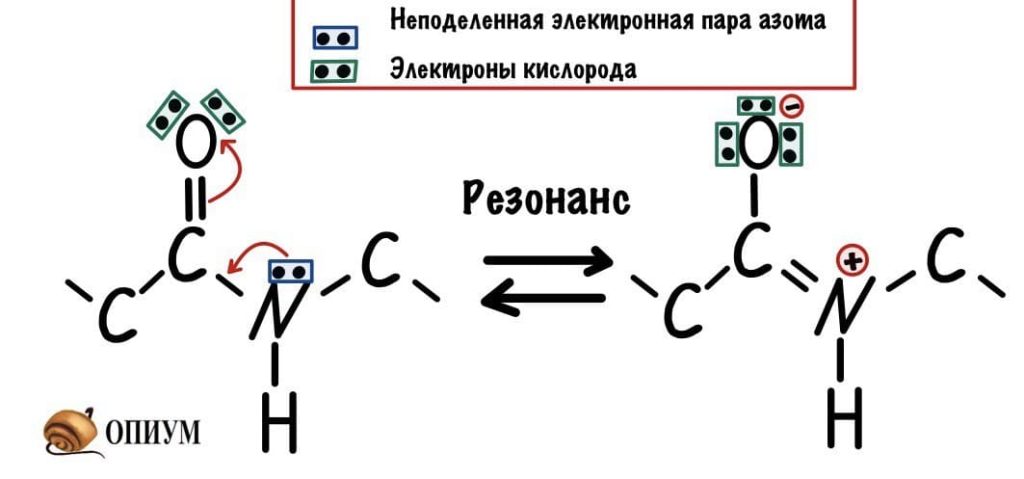
Пойдем еще немного дальше, о чем нам говорит двойная связь? Правильно, о гибридизации углерода — она здесь sp2. А значит угол между связями углерода 120 градусов, здесь они не прямо 120 градусов, но близки к этому. Идем дальше. Азот здесь тоже в sp2 гибридизации, понятно какие углы и у него. Но к чему я это все? Ах да, как будет выглядеть молекула?
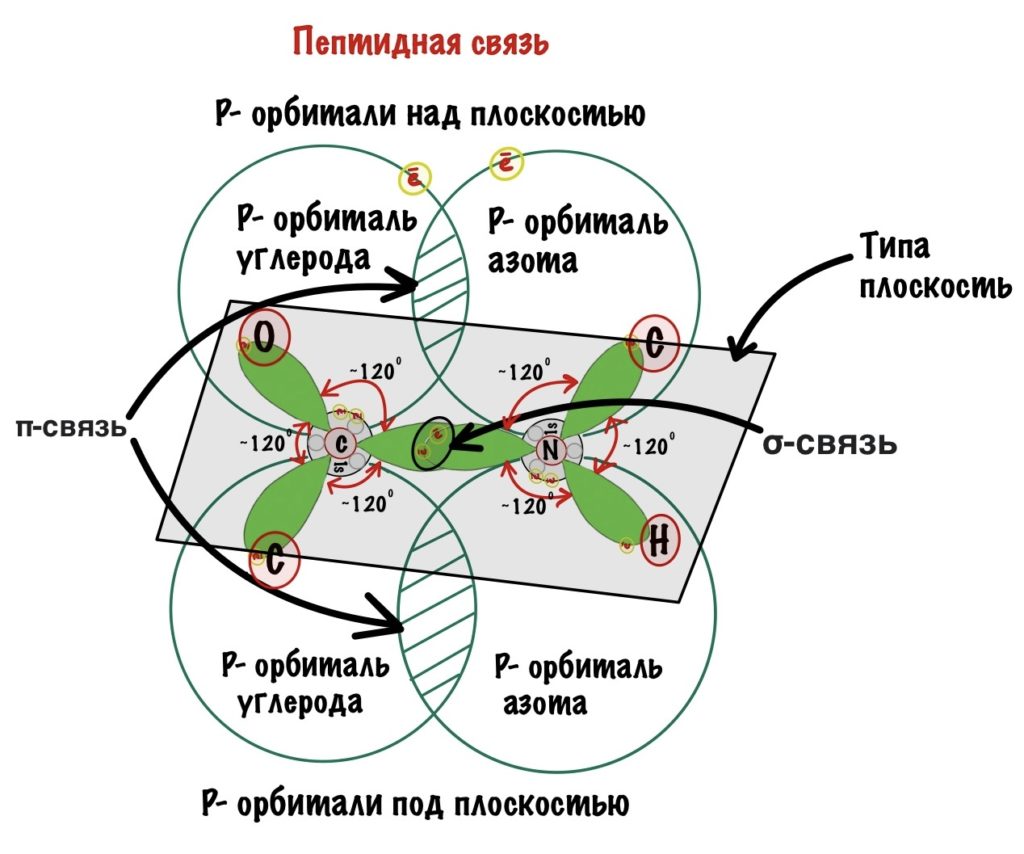
Так как все углы по 120 градусов, то все 6 атомов — 3 углерода, азот, водород и кислород, лежат в одной плоскости, как будто на ладошке. За счет того, что углерод и азот образуют две связи — одну пи и одну сигму, вращение вокруг этих связей практически невозможно. Но об этом чуть позже, сейчас давайте упростим эту схему.
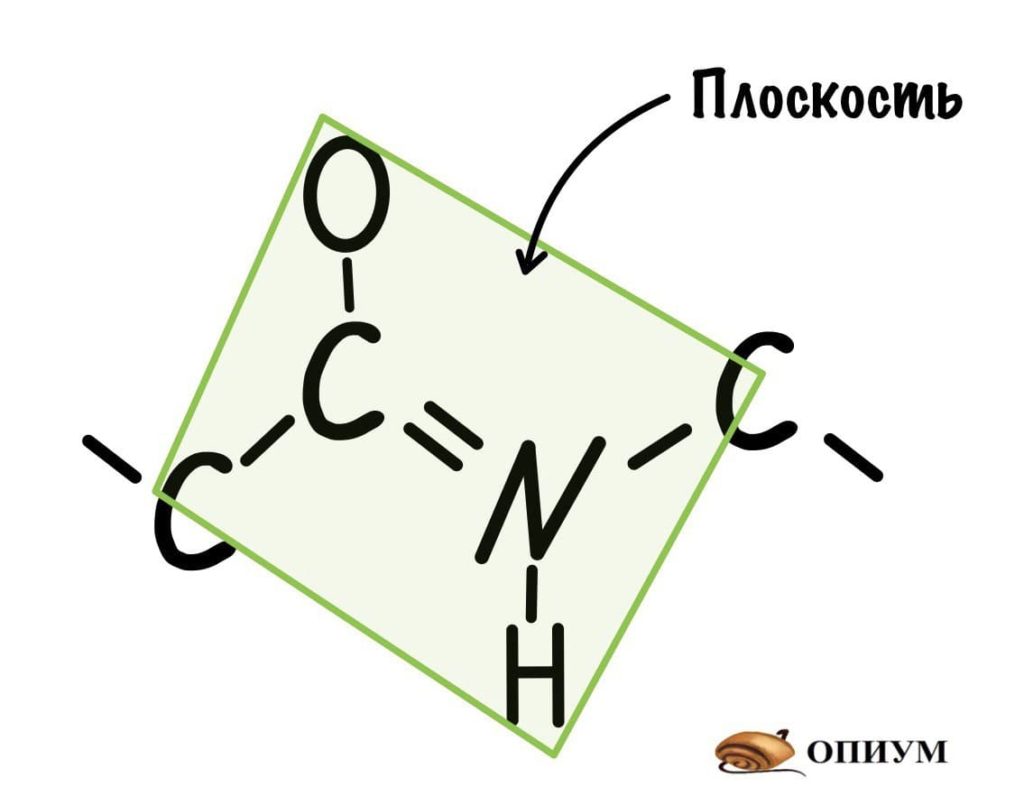
Это мы сделали только с одной пептидной связью, но что если добавить вторую? Получится кое что интересненькое…
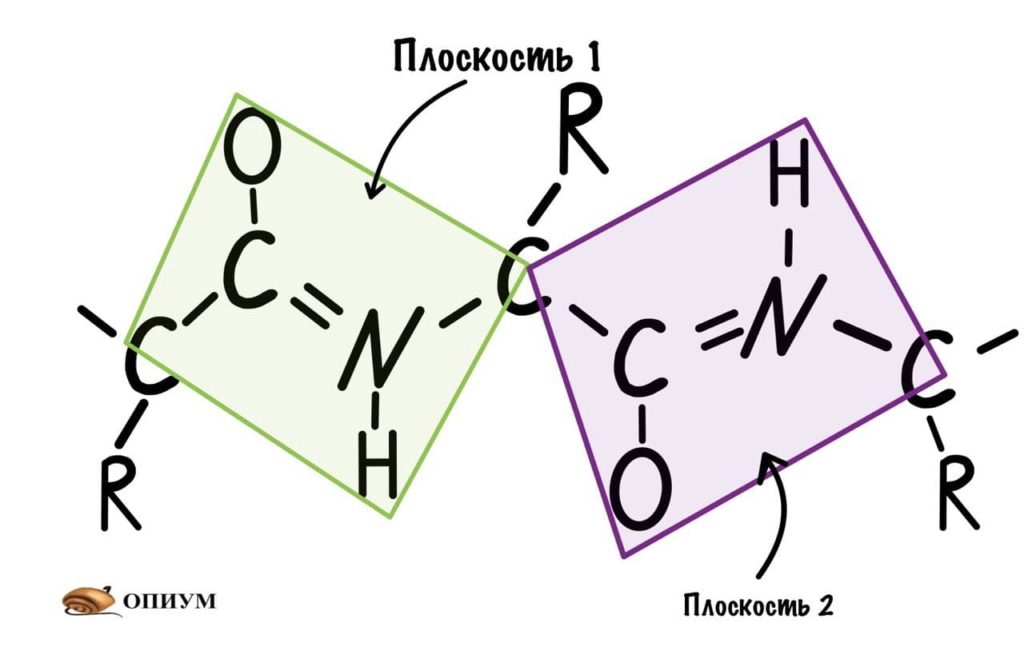
Следующая пептидная связь такая же, как и предыдущая. Получается, что опять 6 атомов лежат в одной плоскости, вы видите, что один атом углерода принадлежит сразу к двум плоскостям и это удивительно! Можно даже подумать, что все эти пептидные связи будут лежать в одной и той же плоскости, но это не так, а виной этому — вращение вокруг связей.
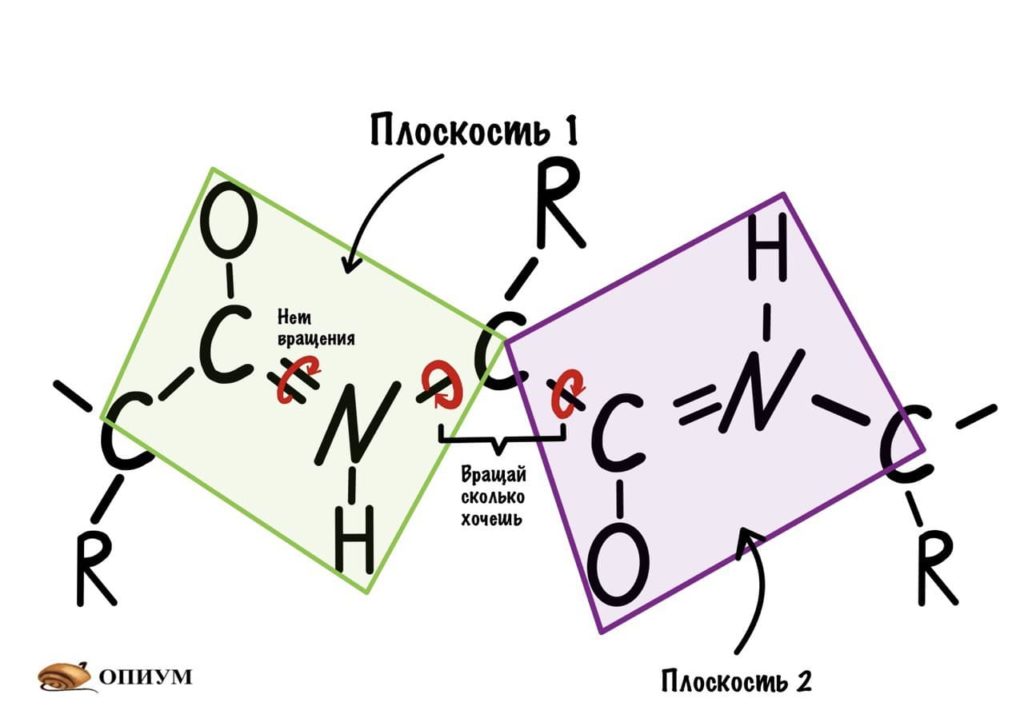
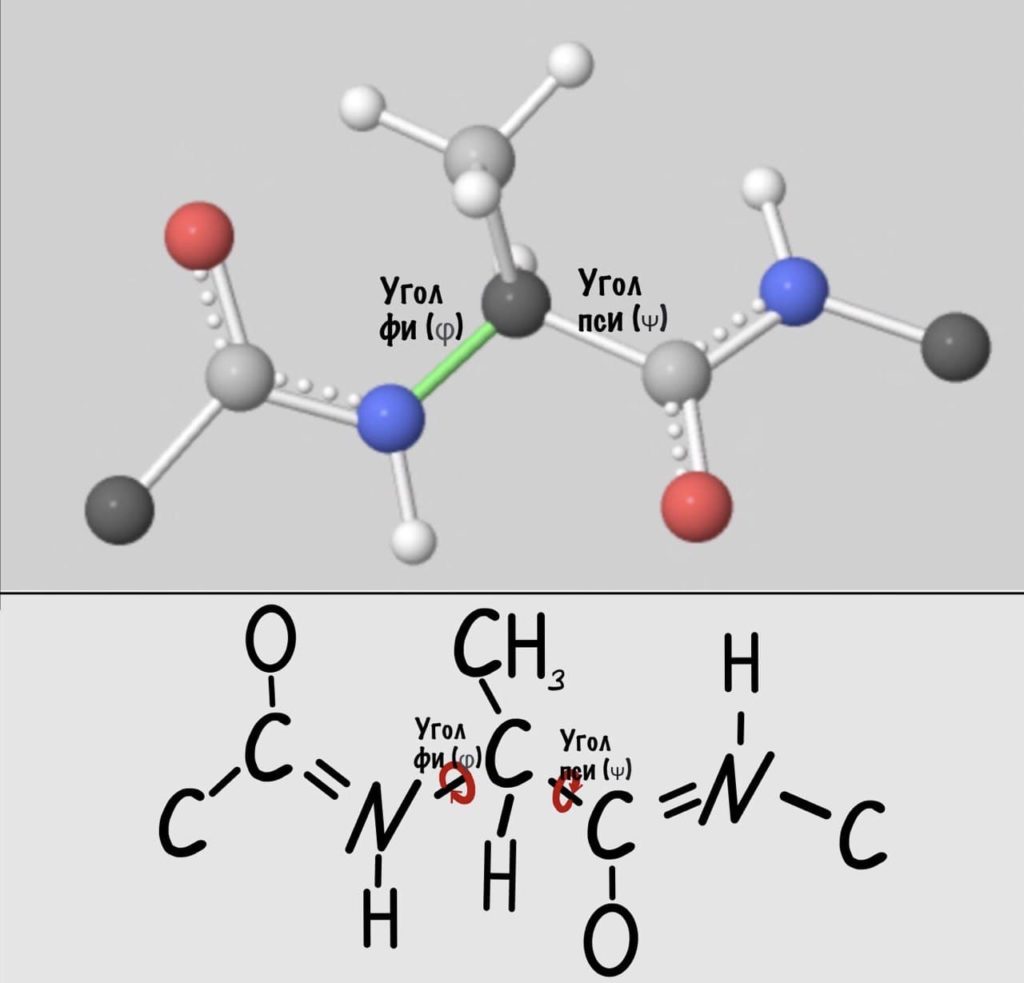
Диэдральные или торсионные углы
Название пугающее, но сейчас как устроим этим углам! Так, мы уже говорили о том, что вокруг пептидной связи не повращаться из-за того, что она частично двойная. Но ведь есть и другие связи, вокруг которых можно устроить веселуху.
Понимаю, что представить это не так уж и легко, но можно попробовать сделать! Получится конечно не совсем так, но принцип поймем. Возьмем ручку и два колпачка, засунем бумажку под каждый колпачок и начнем крутить. Условимся, что мои пальцы — альфа-углеродный атом, то есть место пересечения двух плоскостей.


Теперь мы поняли, как происходит вращение, но это еще не все. Существуют определенные углы между плоскостями и всего их два. Представьте, что нам захочется найти угол между углеродами, у которых карбоксильная группа, двух плоскостей. Или угол между двумя атомами азота, опять же, двух разных плоскостей. Задачка кажется сложной… Но перед этим, а зачем я вообще мучаю вас этим? Дело в том, что когда мы дойдем до конформации белковых молекул, то благодаря этим углам мы поймем: как и почему образуется альфа-спираль, тоже самое с бета-складчатостью. Так что потерпите немного!
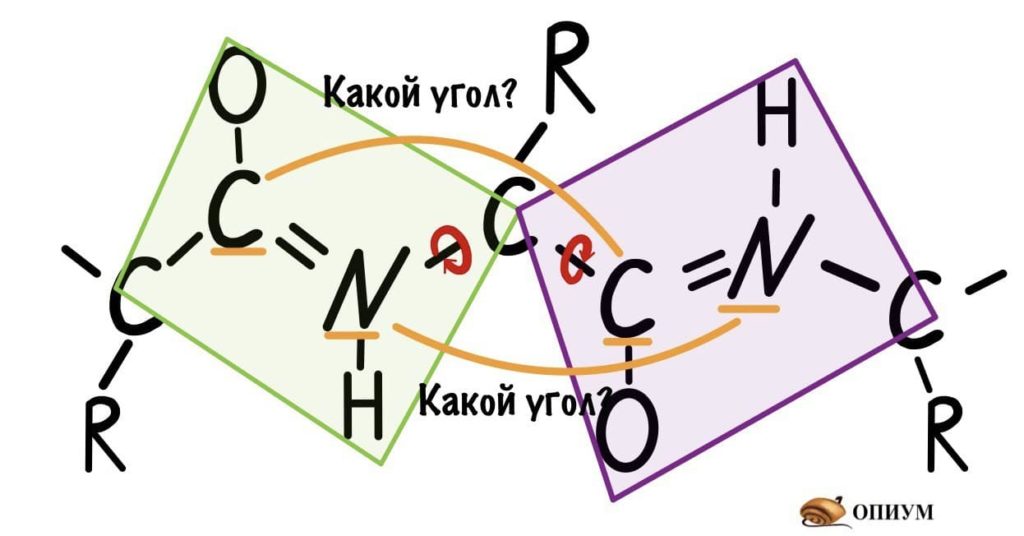
Если посмотреть на эту схему, то можно кое-что прикинуть: если мы будем вращать связь между N и C, то углерод с карбоксильной группой изменит положение относительно углерода другой плоскости, а вот азот останется на том же месте — угол между двумя азотами не изменится. А вот если начнем вращать связь между C и C, то все будет наоборот: угол между азотами изменится, но вот углероды с карбоксильной группой останутся на месте. Сложновато, но чуть дальше я дам пространственную картинку. Пока что мы пришли к выводу, что связь между N и C влияет на угол между углеродами — этот угол называется фи. А вот связь между C и C влияет на угол между атомами азота — угол пси.
Теперь можно и добавить атомы водорода в схему, они скоро нам понадобятся.
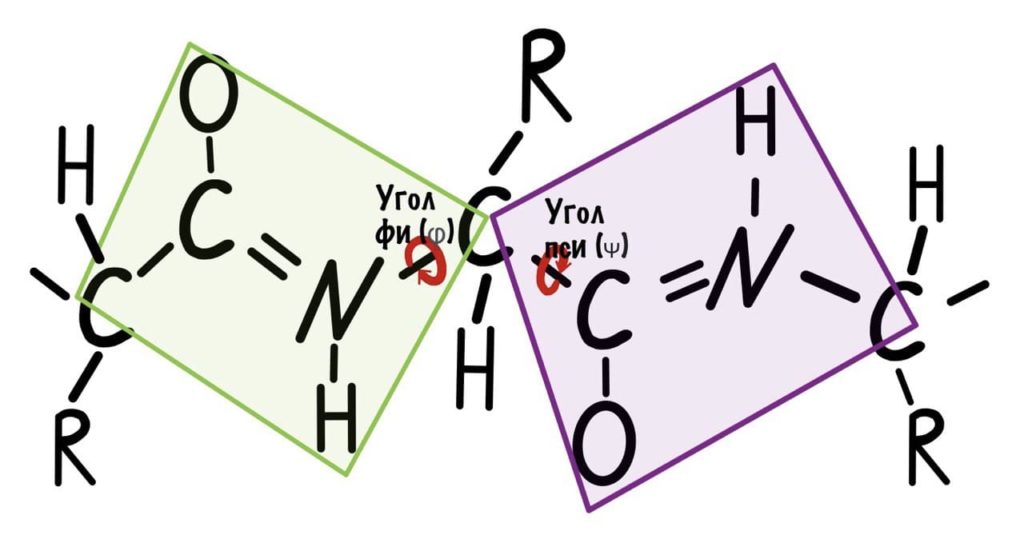
Добавим реалистичности, центральным радикалом у нас будет -CH3, а остальные радикалы уберем.
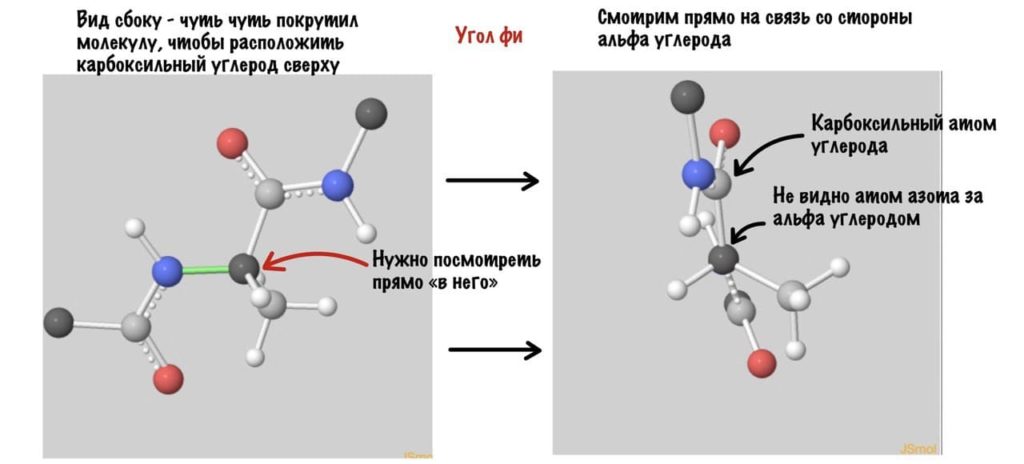
А теперь главный вопрос — как измерить эти углы? Хорошо, что уже это придумали… И мы можем сделать это вместе — заходите сюда и поехали! Первым делом нам нужно перевернуть молекулу так, чтобы расположить атом углерода с карбоксильной группой сверху. Зачем такие выкрутасы? Расскажу позже. А теперь посмотрим прямо в альфа атом углерода, да так что за ним спрятался азот. Как-то это странно звучит, но давайте попробуем.
Еще это можно посмотреть графически с помощью проекций Ньюмана.
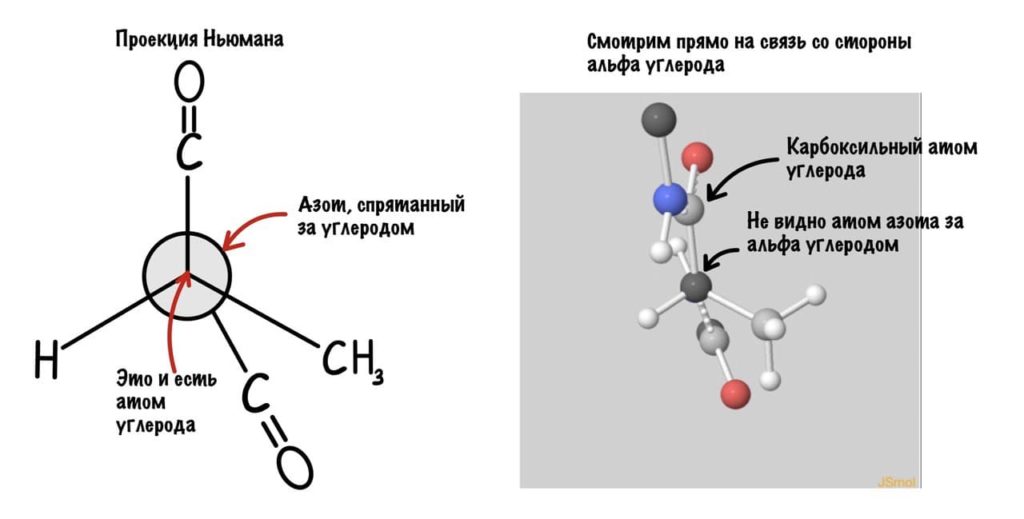
Так, повторим что такое угол фи — это угол между двумя карбоксильными атомами углерода. На рисунке уже их видно.
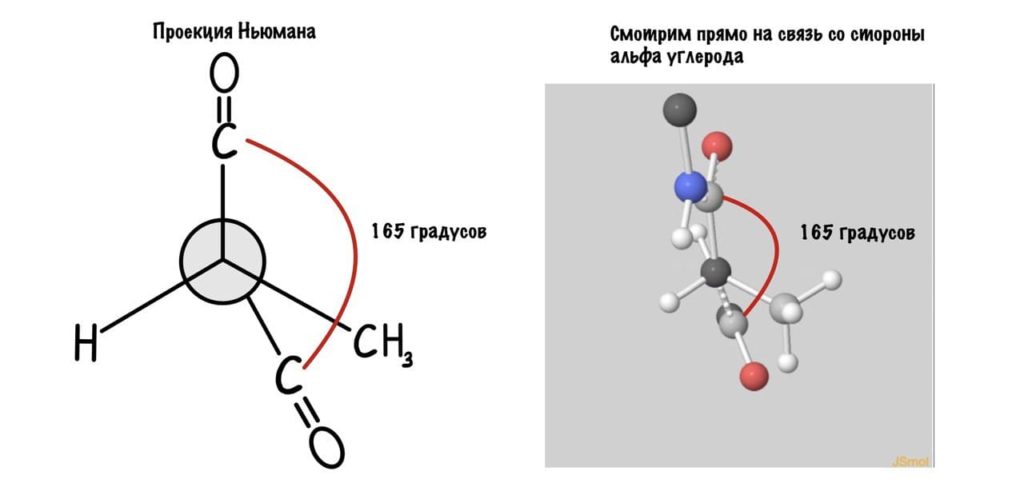
Поняли зачем так крутили молекулу? Да, просто так нам удобнее смотреть угол. А теперь начнем вращать и посмотрим как меняются углы.
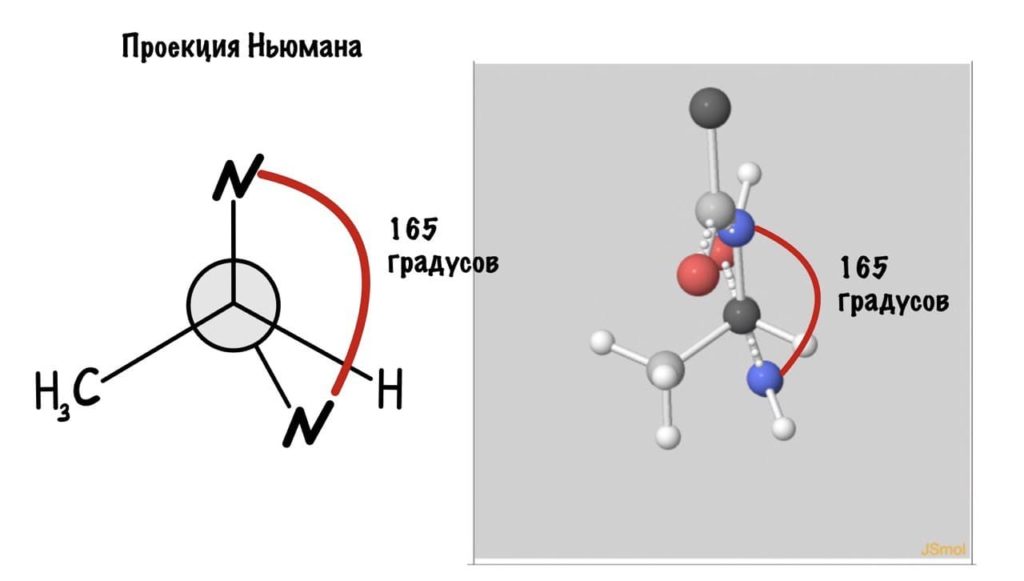
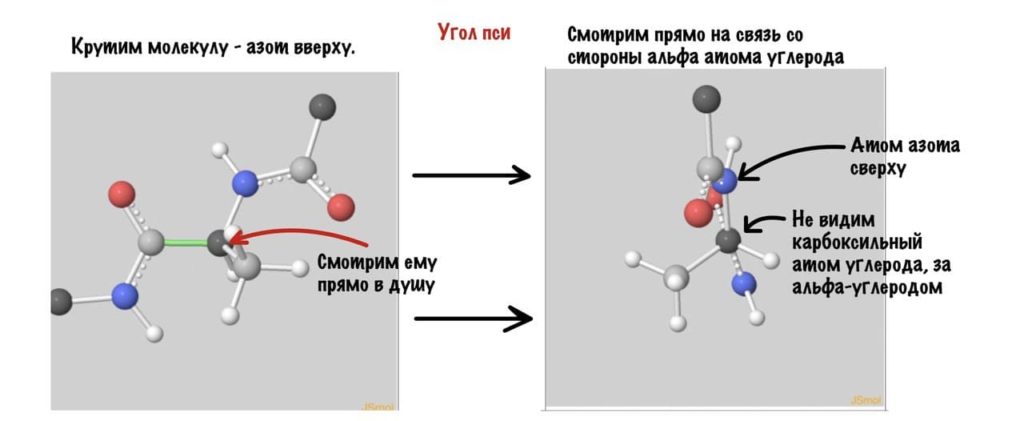
Угол пси по такой же логике. Крутим молекулу, чтобы атом азота оказался сверху и смотрим прямо в альфа атом углерода.
Еще разок построим проекцию Ньюмана, она немного отличается, и сразу же отметим углы.
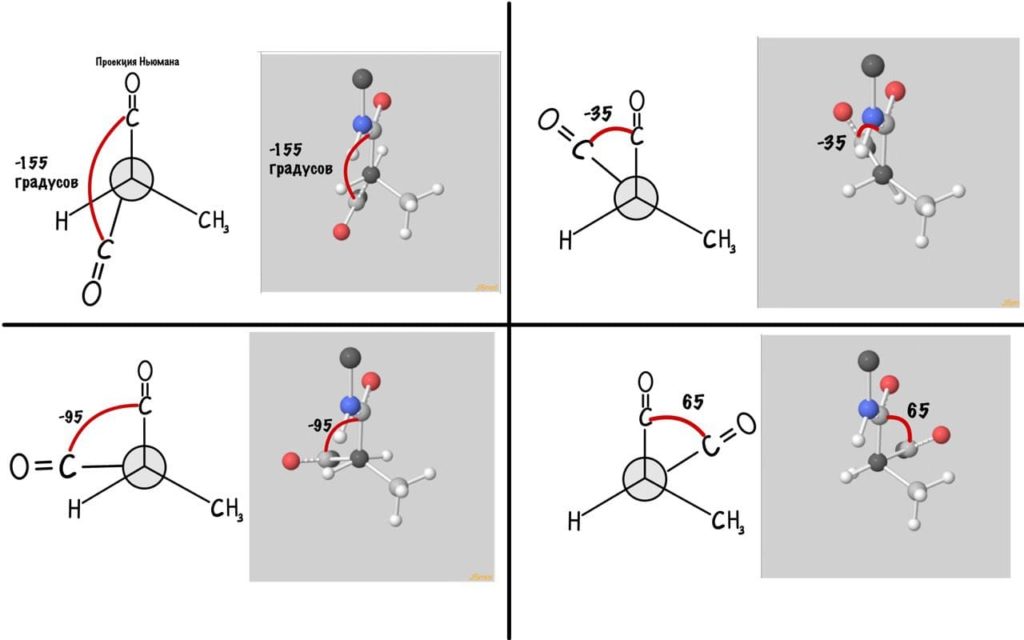
Думаю, что принцип понятен. Дальше можете покрутить сами, правильно? Я не сказал про одно большое «НО» — не каждый угол возможен, так как у атомов есть электронные оболочки, которые заряжены отрицательно. Если электронные оболочки подходят слишком близко, то они отталкиваются и угол меняется. Какие углы возможны? Для этого еще разок зайдите сюда и включите на панельке справа силы Ван-дер-Вальса и show clashes.
Подробнее о влиянии этих углов в следующей статье.
Peptides are short polymer fragments composed from amino acids. Each peptide has a certain amino acid sequence denoted with a three letter or one letter code; for example the amino acid alanine is abbreviated as “Ala” or “A.” The charge of the peptides in the solution depends upon the solution acidity. The isoelectric point (pI) refers to the solution acidity value at which the peptide molecule has the net charge of zero. The solubility of the peptide is minimal at the isoelectric point. Use available web servers to calculate the pI value for a peptide amino acid sequence.
Write the peptide sequence using the one-letter code. For example, if a peptide has an amino acid sequence Ala-Ser-Glu-Leu-Pro (Alanine—Serin—Glumatic acid—Leucine—Proline), then the one letter sequence is «ASELP.» If necessary consult the three letter to one letter conversion table given in Resources.
Use any web browser, Internet Explorer or Firefox, for example, to navigate to a server that calculates the peptide isoelectric point (pI); see Resources.
Enter the peptide one-letter sequence—»ASELP» in our example—in the box, and click on «Compute.»
Read the isoelectric point (pI) value given in the line «Theoretical pI/Mw.» In our example, the pI is 4.00. Note the server also calculates the molecular weight (Mw) of the peptide.
Смотреть видео:
#химия #химияпросто #неорганика #егэпохимии #эксперименты #химик #егэхимия #опыты #химияегэ
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Задача на определение формулы трипептида. Биохимия.
День знаний

Движение пептидов в электрофоретическом поле при разных рН. Биохимия.
День знаний

Степень окисления. Определение степеней окисления. Часть 1
Your system education

Олимпиадная задача на определение состава смеси органических веществ.
День знаний
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
10.12.2021
Методические
рекомендации
к лабораторным
занятиям по дисциплине «Биохимия»
для студентов
специальности «Биология»
Рассмотрены и
рекомендованы на заседании кафедры
химии
протокол №7 от
25.01.2012
Занятие №1
АМИНОКИСЛОТЫ И
ПЕПТИДЫ
Цель занятия:
изучить классификацию, номенклатуру,
физико-химические свойства и биологическую
роль аминокислот, основные биохимические
реакции аминокислот.
Теоретическая
часть:
1. Какие соединения
называются аминокислотами? Назвать их
функциональные группы. На чем основана
классификация аминокислот?
2. Привести
структурные формулы наиболее часто
встречающихся в живых организмах
аминокислот, укажите характер их
радикалов.
3. Какие виды
изомерии характерны для аминокислот?
Рассмотрите стереоизомерию аминокислот
на примере аланина и треонина. Укажите
число ассиметричных атомов, запишите
возможные изомерные формы.
4. Чем обусловлены
особенности свойств аминокислот:
кристалличность, высокие температуры
плавления, нелетучесть, которые отличают
их от карбоновых кислот?
5. Запишите строение
цвиттер-ионов для аминокислот валина,
серина. Укажите, как изменится их заряд
в сильнокислой и сильнощелочной среде.
6. Рассмотрите
основные физико-химические свойства
аминокислот: амфотерность, буферные
свойства, изоэлектрическое состояние.
7. Как образуются
ди-, три-, тетра-, … и полипептиды и как
они называются?
8. Характеристика
пептидной связи.
9. Написать формулы
и дать названия трипептидам, которые
можно получить из следующих аминокислот:
а) аланина, глицина, триптофана; б)
лейцина, лизина, аланина; в) гистидина,
цистеина, аргинина; г) метионина, валина,
тирозина; д) фенилаланина, треонина,
серина; е) аспарагина, изолейцина,
метионина.
10. Основные
биохимические реакции аминокислот:
переаминирование, дезаминирование,
декарбоксилирование и их биологическая
роль.
Задания и
упражнения: 1.
Вычислите значения рН, для анализа,
серина, глутаминовой кислоты, гистидина,
исходя из величин рК аминокислот.
2. Сколько граммов
NaOH нужно добавить к 500 мл гистидина (0,01
моль/л) в полностью протонированной
форме, чтобы получить буфер с рН 7,0.
3. Вычислите значение
рН; для глицина, лизина, треонина (табл.
1).
4. К 1 л раствора
глицина (1,0 моль/л) в изоэлектрической
точке добавлено 0,3 моля НС 1. Укажите рН
полученного раствора.
5. К 1
л раствора глицина (1,0 моль/л) в
изоэлектрической точке добавлено 0,3
моля NaOH.
Укажите рН полученного раствора.
6.
Раствор L-аланина
(400 мл) был доведен до рН 8,0. Затем в этот
раствор был добавлен избыток формальдегида.
Для обратного титрования полученного
раствора до рН 8,0 потребовалось 250 мл
NaOH
(0,2 моль/л). Сколько граммов L-аланина
содержалось в исходном растворе?
7. Укажите суммарный
заряд для глицина, аспарагиновой кислоты,
лизина и гистидина при следующих рН: а)
1,0; б) 2,1; в) 4,0; г) 10 (—, 0 или +), исходя из
данных табл. 1.
8.
Укажите суммарный заряд для аланина,
цистеина, глутаминовой кислоты, глицина
при следующих рН: а) 1,0; б) 2,5; в) 4,2; г) 10 (—,
0 или +), исходя из данных табл. 1.
9.
Укажите суммарный заряд (+, 0 или —) для
лейцина, треонина, цистеина и лизина
при следующих рН: а) 1,5; б) 6,0; в) 8,5; г) 11,
исходя из данных табл. 1.
10.
Вычислите значение
рН
(для
лейцина, триптофана, аспарагиновой
кислоты и аргинина, исходя из величин
рК аминокислот (табл. 1)).
11. Смесь глицина,
аланина, глутаминовой кислоты, лизина,
аргинина и серина разделяли методом
электрофореза на бумаге при рН 6,0.
Укажите, какие соединения двигались к
аноду — А (а), к катоду — К (б), оставались
на старте — С (в).
12.
Каково направление движения пептидов
(остаются на старте, движутся к аноду
или катоду) в процессе электрофореза
при рН 2,0; 3,5; 6,5; 10: а) лиз-гли-ала-глу;
б)
глу-гли-ала-глу;
в)
гли-гли-ала-лиз?
13.
Укажите направление движения пептида
лиз-гли-ала-гли
в
процессе электрофореза на бумаге при
рН 1,9; 3,0; 6,5; 10,0.
14.
Укажите направление движения пептида
гис-гли-ала-глу
в
процессе электрофореза на бумаге при
рН 1,9; 3,0; 6,5; 10,0.
15.
Укажите направление движения пептида
арг-вал-ала-асп
в
процессе электрофореза на бумаге при
рН 1,9; 3,0; 6,5; 10,0.
16.
Укажите, каким образом действует отдельно
трипсин (а) и пепсин (б) на пептид
лиз-ала-гли-асп-ала-глу-сер-арг-гли.
17.
Укажите, каким образом действует трипсин
(а) и химотрипсин (б) на следующий пептид:
тир-цис-лиз-ала-арг-арг-гли.
18.
Укажите, каким образом действует трипсин
(а) и пепсин (б) на следующий пептид:
ала-фен-лиз-ала-глу-гли.
19.
Какие пептиды образуются при обработке
трипсином полипептида
еал-лиз-глу-глу-фен-мет-арг-цис-глу-три-мет-гли?
20.
Какие пептиды образуются при обработке
химотрипсином полипептида
ала-вал-лиз-глу-глу-фен-вал-мет-тир-цис-глу-три-мет-ели-глц-фен?
Образование
пептидов и их номенклатура
Схема В. Номенклатура пептидов
При написании
формул пептидов необходимо:
-
выделять пептидные
связи, -
указывать N-
и С-концы пептида, -
уметь строить
полное и краткое название пептида -
указывать характер
среды в водном растворе данного пептида.
Расчет изоэлектрической
точки моноаминомонокарбоновых кислот
осуществляется по формуле:
рI
=
(pKcoo—
+ pKNH3+)
/ 2
Значения pK
карбоксильной и аминогруппы, а также
дополнительных ионогенных групп,
содержащихся в радикале, представлены
в таблице 1.2
Таблица 1.2
Величины рК ионизированных групп
некоторых аминокислот (250С)
|
Аминокислота |
рК1, α-СООН |
рК2, |
рК3, |
|
Аланин |
2,34 |
9,69 |
– |
|
Аргинин |
2,17 |
9,04 |
12,48 |
|
Аспарагин |
2,02 |
8,80 |
– |
|
Аспарагиновая |
2,09 |
9,82 |
3,86 |
|
Валин |
2,32 |
9,62 |
– |
|
Гистидин |
1,82 |
9,17 |
6,0 |
|
Глицин |
2,34 |
9,60 |
– |
|
Глутамин |
2,17 |
9,13 |
– |
|
Глутаминовая |
2,19 |
9,67 |
4,25 |
|
Изолейцин |
2,36 |
9,68 |
– |
|
Лейцин |
2,36 |
9,60 |
– |
|
Лизин |
2,18 |
8,95 |
10,53 |
|
Метионин |
2,28 |
9,21 |
– |
|
Оксипролин |
1,92 |
9,73 |
– |
|
Пролин |
1,99 |
10,96 |
– |
|
Серин |
2,21 |
9,15 |
– |
|
Тирозин |
2,20 |
9,11 |
10,07 |
|
Треонин |
2,71 |
9,62 |
– |
|
Триптофан |
2,38 |
9,39 |
– |
|
Цистеин |
1,71 |
8,33 |
10,28 |
Пример 1:
рассчитайте значение ИЭТ аминокислоты
аланина.
Используя данные
таблицы 1.2 находим, что значения pKcoo—
и pKNH3+
составляют соответственно 2,34 и 9,69
Отсюда рIаланина
= (pKcoo—
+ pKNH3+)
/ 2 = (2,34+9,69) / 2= 6,21
Пример 2:
рассчитайте суммарный заряд аланина
при рН равном 1,5 7,0 и 11,0. Определите
направление перемещения аминокислоты
под действием электрического поля в
указанных условиях.
При значении рН<<
рI
аминокислоты превращаются в катион,
имеют положительный заряд и под действием
электрического поля перемещаются в
сторону катода.
При значении рН>>
рI
аминокислоты превращаются в анион,
имеют отрицательный заряд и под действием
электрического поля перемещаются в
сторону анода.
Следовательно,
при рН 1,5 аланин является катионом и
под действием электрического поля
перемещаются в сторону катода. При рН
7,0, близком к значению рI
данной аминокислоты, суммарный заряд
равен 0. Аминокислота электрофоретически
неподвижна. При рН 11,0 аланин является
анионом и под действием электрического
поля перемещаются в сторону анода.
В случае аминокислот,
имеющих дополнительные ионогенные
группы в радикале, для расчета суммарного
заряда молекулы при данных условиях,
значения рК каждой ионогенной группы
сопоставляются со значением рН раствора:
— для групп,
диссоциирующих по кислотному типу,
диссоциацией практически пренебрегают,
если рН <
рК
— для групп,
диссоциирующих по основному типу,
диссоциацией практически пренебрегают,
если рН >
рК
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Изоэлектрической точкой ( ИЭТ , рН (I) , МЭП ), является рН , при которой молекула не несет никакой чистый электрический заряд или электрически нейтрален в статистическом среднем . Стандартная номенклатура для представления изоэлектрической точки — pH (I). Однако также используется pI. Для краткости в этой статье используется pI. Чистый заряд молекулы зависит от pH окружающей среды и может стать более положительным или отрицательным из-за увеличения или потери протонов (H + ) соответственно.
Поверхности естественным образом заряжаются, образуя двойной слой . В общем случае, когда ионы, определяющие поверхностный заряд, представляют собой H + / HO — , чистый поверхностный заряд зависит от pH жидкости, в которую погружено твердое тело.
Значение pI может влиять на растворимость молекулы при заданном pH. Такие молекулы обладают минимальной растворимостью в воде или растворах солей при pH, соответствующем их pI, и часто выпадают в осадок из раствора . Биологические амфотерные молекулы, такие как белки, содержат как кислотные, так и основные функциональные группы . Аминокислоты, из которых состоят белки, могут быть положительными, отрицательными, нейтральными или полярными по своей природе и вместе придают белку его общий заряд. При pH ниже их pI белки несут чистый положительный заряд; выше их pI они несут чистый отрицательный заряд. Таким образом, белки можно разделить по суммарному заряду в полиакриламидном геле, используя либо препаративный гель-электрофорез , при котором используется постоянный pH для разделения белков, либо изоэлектрическое фокусирование , которое использует градиент pH для разделения белков. Изоэлектрическая фокусировка также является первым шагом в электрофорезе в 2-мерном полиакриламидном геле .
В биомолекулах белки можно разделить с помощью ионообменной хроматографии . Биологические белки состоят из цвиттерионных аминокислотных соединений; чистый заряд этих белков может быть положительным или отрицательным в зависимости от pH окружающей среды. Конкретную pI целевого белка можно использовать для моделирования процесса, а затем соединение можно очистить от остальной смеси. Для этого процесса очистки можно использовать буферы с различным pH, чтобы изменить pH окружающей среды. Когда смесь, содержащая целевой белок, загружается в ионообменник, неподвижная матрица может быть либо положительно заряженной (для подвижных анионов), либо отрицательно заряженной (для подвижных катионов). При низких значениях pH чистый заряд большинства белков в смеси положительный — в катионообменниках эти положительно заряженные белки связываются с отрицательно заряженной матрицей. При высоких значениях pH чистый заряд большинства белков отрицательный, поскольку они связываются с положительно заряженной матрицей в анионообменниках. Когда среда имеет значение pH, равное pI белка, чистый заряд равен нулю, и белок не связан с каким-либо обменником и, следовательно, может быть элюирован.
Расчет значений pI
Для аминокислоты, содержащей только один амин и одну карбоксильную группу, pI можно рассчитать из среднего значения pKas этой молекулы.
РН от электрофоретического геля определяется буфером , используемым для этого геля. Если pH буфера выше pI запускаемого белка, белок будет мигрировать к положительному полюсу (отрицательный заряд притягивается к положительному полюсу). Если pH буфера ниже pI запускаемого белка , белок будет мигрировать к отрицательному полюсу геля (положительный заряд притягивается к отрицательному полюсу). Если белок запускается с буферным pH, равным pI, он вообще не будет мигрировать. Это верно и для отдельных аминокислот.
Примеры
В двух примерах (справа) изоэлектрическая точка показана зеленой вертикальной линией. В глицине значение рК отделено друг от друга почти на 7 единиц. Таким образом, в газовой фазе концентрация нейтрального вещества, глицина (GlyH), составляет 100% аналитической концентрации глицина. Глицин может существовать в виде цвиттериона в изоэлектрической точке, но константа равновесия для реакции изомеризации в растворе
- H 2 NCH 2 CO 2 H ⇌ H 3 N + CH 2 CO 2 —
не известно.
Другой пример, аденозинмонофосфат, показан для иллюстрации того факта, что в принципе может быть задействован третий вид. Фактически, в этом случае концентрацией (AMP) H 3 2+ можно пренебречь в изоэлектрической точке. Если pI больше pH, молекула будет иметь положительный заряд.
Изоэлектрическая точка пептидов и белков
Разработан ряд алгоритмов оценки изоэлектрических точек пептидов и белков . Большинство из них используют уравнение Хендерсона – Хассельбаха с разными значениями pK. Например, в рамках модели, предложенной Бьеллквистом и соавторами, pK определяли между близкородственными иммобилинами, фокусируя один и тот же образец в перекрывающихся градиентах pH. Также были предложены некоторые улучшения в методологии (особенно в определении значений pK для модифицированных аминокислот). Более продвинутые методы учитывают влияние соседних аминокислот на ± 3 остатка от заряженной аспарагиновой или глутаминовой кислоты , влияние на свободный С-конец, а также применяют поправочный член к соответствующим значениям pK с использованием генетического алгоритма . Другие недавние подходы основаны на машинном алгоритме опорных векторов и оптимизации pKa относительно экспериментально известных изоэлектрических точек белка / пептида.
Более того, экспериментально измеренные изоэлектрические точки белков были объединены в базы данных. Недавно была также разработана база данных изоэлектрических точек для всех белков, предсказанных с использованием большинства доступных методов.
Керамические материалы
Изоэлектрические точки (IEP) металлооксидной керамики широко используются в материаловедении на различных стадиях обработки воды (синтез, модификация и т. Д.). В отсутствие хемосорбированных или физадсорбированных частиц поверхности частиц в водной суспензии обычно предполагается покрытыми поверхностными гидроксильными частицами, M-OH (где M представляет собой металл, такой как Al, Si и т. Д.). При значениях pH выше IEP преобладающими поверхностными видами являются MO — , в то время как при значениях pH ниже IEP преобладают виды M-OH 2 + . Некоторые приблизительные значения обычной керамики перечислены ниже:
| Материал | IEP | Материал | IEP | Материал | IEP | Материал | IEP | Материал | IEP | Материал | IEP |
|---|---|---|---|---|---|---|---|---|---|---|---|
| WO 3 | 0,2-0,5 | Та 2 О 5 | 2,7-3,0 | δ-MnO 2 | 1.5 | Fe 2 O 3 | 3,3-6,7 | Fe 2 O 3 | 8,4-8,5 | ZnO | 8,7-10,3 |
| Сб 2 О 5 | <0,4–1,9 | SnO 2 | 4-5,5 (7,3) | β-MnO 2 | 7.3 | CeO 2 | 6,7-8,6 | α Al 2 O 3 | 8-9 | NiO | 10-11 |
| V 2 O 5 | 1-2 (3) | ZrO 2 | 4-11 | TiO 2 | 2,8–3,8 | Cr 2 O 3 | 6,2-8,1 (7) | Si 3 N 4 | 9 | PbO | 10,7-11,6 |
| SiO 2 | 1,7-3,5 | MnO 2 | 4-5 | Si 3 N 4 | 6-7 | γ Al 2 O 3 | 7-8 | Y 2 O 3 | 7,15–8,95 | La 2 O 3 | 10 |
| SiC | 2-3,5 | ITO | 6 | Fe 3 O 4 | 6,5-6,8 | Tl 2 O | 8 | CuO | 9,5 | MgO | 12-13 (9,8-12,7) |
Примечание. В следующем списке приведена изоэлектрическая точка при 25 ° C для выбранных материалов в воде. Точное значение может широко варьироваться в зависимости от таких факторов материала, как чистота и фаза, а также физических параметров, таких как температура. Более того, точное измерение изоэлектрических точек может быть затруднено, поэтому многие источники часто приводят разные значения для изоэлектрических точек этих материалов.
Смешанные оксиды могут иметь значения изоэлектрической точки, промежуточные по сравнению с соответствующими чистыми оксидами. Например, синтетически полученный аморфный алюмосиликат (Al 2 O 3 -SiO 2 ) первоначально был измерен как имеющий IEP 4,5 (в электрокинетическом поведении поверхности преобладали поверхностные частицы Si-OH, что объясняет относительно низкое значение IEP). Другие сообщали о значительно более высоких значениях IEP (pH от 6 до 
Изоэлектрическая точка в сравнении с точкой нулевого заряда
Термины изоэлектрическая точка (IEP) и точка нулевого заряда (PZC) часто используются как синонимы, хотя при определенных обстоятельствах может быть полезно провести различие.
В системах, в которых H + / OH — являются ионами, определяющими межфазный потенциал, точка нулевого заряда дается в единицах pH. Значение pH, при котором поверхность демонстрирует нейтральный чистый электрический заряд, является точкой нулевого заряда на поверхности. Электрокинетические явления обычно измеряют дзета-потенциал , и нулевой дзета-потенциал интерпретируется как точка нулевого суммарного заряда в плоскости сдвига . Это называется изоэлектрической точкой. Таким образом, изоэлектрическая точка — это значение pH, при котором коллоидная частица остается неподвижной в электрическом поле. Ожидается, что изоэлектрическая точка будет несколько отличаться от точки нулевого заряда на поверхности частицы, но на практике это различие часто игнорируется для так называемых первичных поверхностей, то есть поверхностей без специально адсорбированных положительных или отрицательных зарядов. В этом контексте специфическая адсорбция понимается как адсорбция, происходящая в слое Штерна, или хемосорбция . Таким образом, точка нулевого заряда на поверхности принимается равной изоэлектрической точке при отсутствии специфической адсорбции на этой поверхности.
Согласно Жоливе, при отсутствии положительных или отрицательных зарядов поверхность лучше всего описывается точкой нулевого заряда. Если положительный и отрицательный заряды присутствуют в равных количествах, то это изоэлектрическая точка. Таким образом, PZC относится к отсутствию любого типа поверхностного заряда, в то время как IEP относится к состоянию нейтрального чистого поверхностного заряда. Таким образом, разница между ними заключается в количестве заряженных сайтов в точке с нулевым чистым зарядом. Жоливе использует внутренние константы равновесия поверхности, p K — и p K +, чтобы определить два условия в терминах относительного количества заряженных сайтов:
Для больших Δp K (> 4 согласно Жоливе) преобладающим видом является MOH, в то время как заряженных частиц относительно мало, поэтому актуален PZC. При малых значениях Δp K имеется много заряженных частиц в примерно равном количестве, поэтому говорят об ИЭП.
Смотрите также
- Уравнение Хендерсона-Хассельбаха
- Изоэлектрическая фокусировка
- Дзета-потенциал
- Электрофоретическое осаждение
- Изоионная точка
- константа диссоциации кислоты pK
- QPNC-PAGE
использованная литература
дальнейшее чтение
- Нельсон Д.Л., Кокс М.М. (2004). Принципы биохимии Ленингера . WH Freeman; 4-е издание (в твердом переплете). ISBN 0-7167-4339-6
- Космульский М. (2009). Поверхностная зарядка и точки нулевого заряда . CRC Press; 1-е издание (в твердом переплете). ISBN 978-1-4200-5188-9
внешние ссылки
- IPC — Калькулятор изоэлектрической точки — вычисляет изоэлектрическую точку белка с использованием более 15 методов
- prot pi — изоэлектрическая точка белка — онлайн-программа для расчета pI белков (включая множественные субъединицы и посттрансляционные модификации)
- CurTiPot — набор электронных таблиц для расчета кислотно-основного равновесия (график зависимости заряда от pH амфотерных молекул, например аминокислот)
- pICalculax — предиктор изоэлектрической точки (pI) для химически модифицированных пептидов и белков
- SWISS-2DPAGE — база данных изоэлектрических точек, полученных в результате двумерного электрофореза в полиакриламидном геле (~ 2000 белков)
- PIP-DB — база данных изоэлектрических точек белка (~ 5000 белков)
- Proteome-pI — база данных изоэлектрических точек протеома (предсказанная изоэлектрическая точка для всех белков)




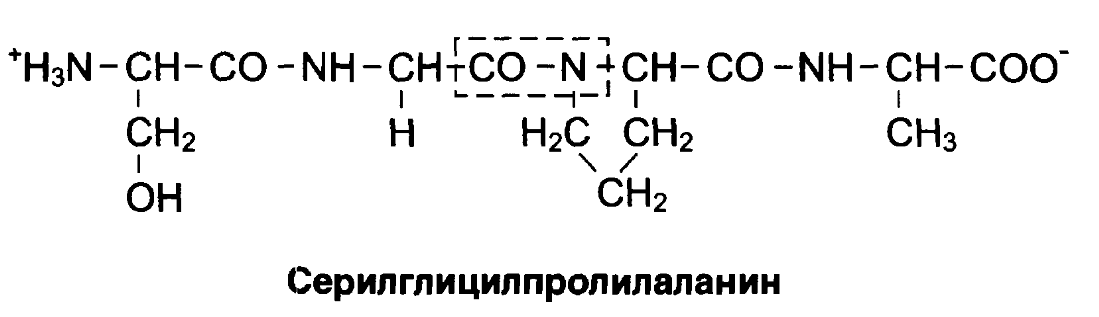



![{ mathrm {p}} K ^ {-} - { mathrm {p}} K ^ {+} = Delta { mathrm {p}} K = log {{ frac { left [{ mathrm {MOH}} right] ^ {2}} { left [{ mathrm {MOH}} {_ {2} ^ {+}} right] left [{ mathrm {MO}} ^ {-} Правильно]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e3191d7ab56090ff3c419b53868c6c52134d80a)