to continue to Google Sites
Not your computer? Use Guest mode to sign in privately. Learn more
Теплоемкость идеального газа — это отношение тепла, сообщенного газу, к изменению температуры δТ, которое при этом произошло.

Молярная теплоемкость
Молярная теплоемкость — теплоемкость 1 моля идеального газа.


Теплоемкость идеального газа в процессах
Адиабатический
В адиабатическом процессе теплообмена с окружающей средой не происходит, т.е. δQ=0. Следовательно, теплоемкость идеального газа в адиабатическом процессе также равна нулю: Садиаб=0.
Изотермический
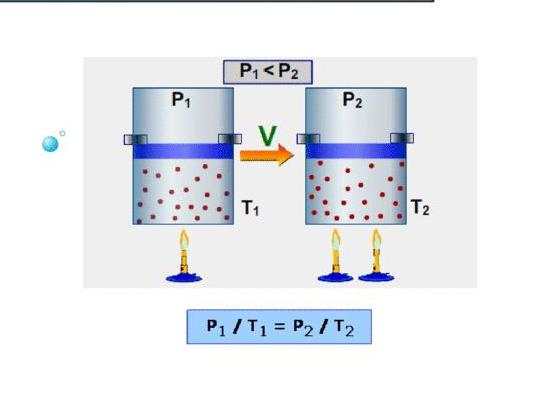
В изотермическом процессе постоянна температура, т.е. 

Изохорический
В изохорическом процессе постоянен объем, т.е. 


А для идеального газа

Таким образом,

где 
Изобарический
В изобарическом процессе (

CP=δQ/νΔT=CV+R=(5/2)*R
Вывод формулы для теплоемкости в данном процессе
Согласно 1 началу термодинамики существует 2 способа изменить внутреннюю энергию тела (в нашем случае идеального газа): передать ему тепло или совершить над ним работу.
dU=δQ+δA, где δA — работа окр. среды над газом.
δAокр.среды=-δAгаза
δQ=dU+δAгаза
В расчете на 1 моль:
С=δQ/ΔT=(ΔU+pΔV)/ΔT
ΔU=CV*ΔT
C=CV+(pΔV/ΔT)в данном процессе
См. также
- Идеальный газ
- Первое начало термодинамики
- Теплоемкость
Ссылки
1. Открытый Колледж
2. CГГА
3. Статья в «Кванте», формат djvu
В термодинамике при изучении переходов из начального в конечное состояние некоторой системы важно знать тепловой эффект процесса. С этим эффектом тесно связано понятие теплоемкости. В данной статье рассмотрим вопрос, что понимают под изохорной теплоемкостью газа.
Идеальный газ
Идеальным называется такой газ, частицы которого считаются материальными точками, то есть не имеют размеров, но обладают массой, и у которого вся внутренняя энергия состоит исключительно из кинетической энергии движения молекул и атомов.
Любой реальный газ в идеале никогда не будет удовлетворять описанной модели, поскольку его частицы все же имеют некоторые линейные размеры и взаимодействуют между собой с помощью слабых ван-дер-ваальсовых связей или химических связей другого типа. Однако при низких давлениях и высоких температурах расстояния между молекулами велики, а их кинетическая энергия превышает потенциальную в десятки раз. Все это позволяет применять с высокой степенью точности идеальную модель для реальных газов.
Внутренняя энергия газа
Внутренняя энергия любой системы — это физическая характеристика, которая равна сумме потенциальной и кинетической энергии. Поскольку в идеальных газах можно пренебречь потенциальной энергией, то для них можно записать равенство:
U = Ek.
Где Ek — энергия кинетическая системы. Используя молекулярно-кинетическую теорию и применяя универсальное уравнение состояния Клапейрона-Менделеева, несложно получить выражение для U. Оно записано ниже:
U = z/2*n*R*T.
Здесь T, R и n — абсолютная температура, газовая постоянная и количество вещества соответственно. Величина z — это целое число, показывающее количество степеней свободы, которыми обладает молекула газа.
Изобарная и изохорная теплоемкость
В физике теплоемкостью называется количество теплоты, которое необходимо предоставить изучаемой системе, чтобы нагреть ее на один кельвин. Справедливо также и обратное определение, то есть теплоемкость — это количество теплоты, которое система выделяет при охлаждении на один кельвин.
Проще всего для системы определить изохорную теплоемкость. Под ней понимают теплоемкость при постоянном объеме. Поскольку система в таких условиях работу не совершает, то вся энергия расходуется на повышение внутренних энергетических запасов. Обозначим изохорную теплоемкость символом CV, тогда можно записать:
dU = CV*dT.
То есть изменение внутренней энергии системы прямо пропорционально изменению ее температуры. Если сравнить это выражение, с записанным в предыдущем пункте равенством, то приходим к формуле для CV в идеальном газе:
СV = z/2*n*R.
Данной величиной на практике неудобно пользоваться, поскольку она зависит от количества вещества в системе. Поэтому было введено понятие удельной изохорной теплоемкости, то есть величины, которую рассчитывают либо на 1 моль газа, либо на 1 кг. Обозначим первую величину символом CVn, вторую — символом CVm. Для них можно записать такие формулы:
CVn = z/2*R;
CVm = z/2*R/M.
Здесь M — молярная масса.
Изобарной называется теплоемкость при поддержании постоянного давления в системе. Примером такого процесса является расширение газа в цилиндре под поршнем при его нагревании. В отличие от изохорного, во время изобарного процесса подводимое к системе тепло расходуется на повышение внутренней энергии и на выполнение механической работы, то есть:
H = dU + P*dV.
Энтальпия изобарного процесса представляет собой произведение изобарной теплоемкости на изменение температуры в системе, то есть:
H = CP*dT.
Если рассмотреть расширение при постоянном давлении 1 моль газа, то первое начало термодинамики запишется в виде:
CPn*dT = CVn*dT + R*dT.
Последнее слагаемое получено из уравнения Клапейрона-Менделеева. Из этого равенства следует связь между изобарной и изохорной теплоемкостями:
CPn = CVn + R.
Для идеального газа удельная молярная теплоемкость при постоянном давлении всегда больше соответствующей изохорной характеристики на величину R=8,314 Дж/(моль*К).
Степени свободы молекул и теплоемкость
Выпишем еще раз формулу для удельной молярной изохорной теплоемкости:
CVn = z/2*R.
В случае газа одноатомного величина z = 3, поскольку атомы в пространстве могут перемещаться лишь в трех независимых направлениях.
Если же речь идет о газе, состоящем из двухатомных молекул, например, кислород O2 или водород H2, то, помимо поступательного движения, эти молекулы могут еще вращаться вокруг двух взаимно перпендикулярных осей, то есть z будет равно 5.
В случае более сложных молекул для определения CVn следует использовать z=6.
Теплоемкость идеального газа
Определение теплоемкости
Теплоемкость – это количество тепла, которое затрачивается для того, чтобы повысить температуру тела на один кельвин. Теплоемкость зависит от массы вещества, условий при которых системе сообщают теплоту. Уравнение (1) – это определение теплоемкости через интегральные параметры. Иногда удобнее использовать следующее определение теплоемкости:
где – бесконечно мало количество плоты, которое получает тело; dT – приращение температуры тела.
При единичной массе тела теплоемкость называют удельной. Обозначают ее обычно маленькой буквой c. Еще используют молярную теплоемкость () – это теплоемкость одного моля вещества.
Теплоемкость и первое начало термодинамики
Используя первое начало термодинамики в интегральной записи, теплоёмкость можно найти как:
где – изменение внутренней энергии термодинамической системы; A – работа системы над внешними силами. Для идеального газа имеем:
где m – масса газа; – молярная масса газа; R – универсальная газовая постоянная.
В дифференциальном виде:
Для идеального газа теплоемкость равна:
Теплоемкость для процессов, проводимых в идеальном газе
Теплоемкость связана с характером процесса. Она может изменяться от бесконечных отрицательных величин до бесконечных положительных.
Рассмотрим изохорный процесс . При проведении изохорного процесса газ работы не совершает, поэтому теплоемкость газа в изохорном процессе (
) равна:
Или:
При изобарном процессе () теплоемкость обозначают как
. Она равна:
Или:
Теплоемкости, при постоянных давлении и объеме, являются функциями состояний. Надо отметить, что независимость теплоемкости от температуры не подтвердили эксперименты.
В изотермическом процессе теплоемкость идеального газа считают бесконечной:
В адиабатном процессе теплоемкость равна нулю.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
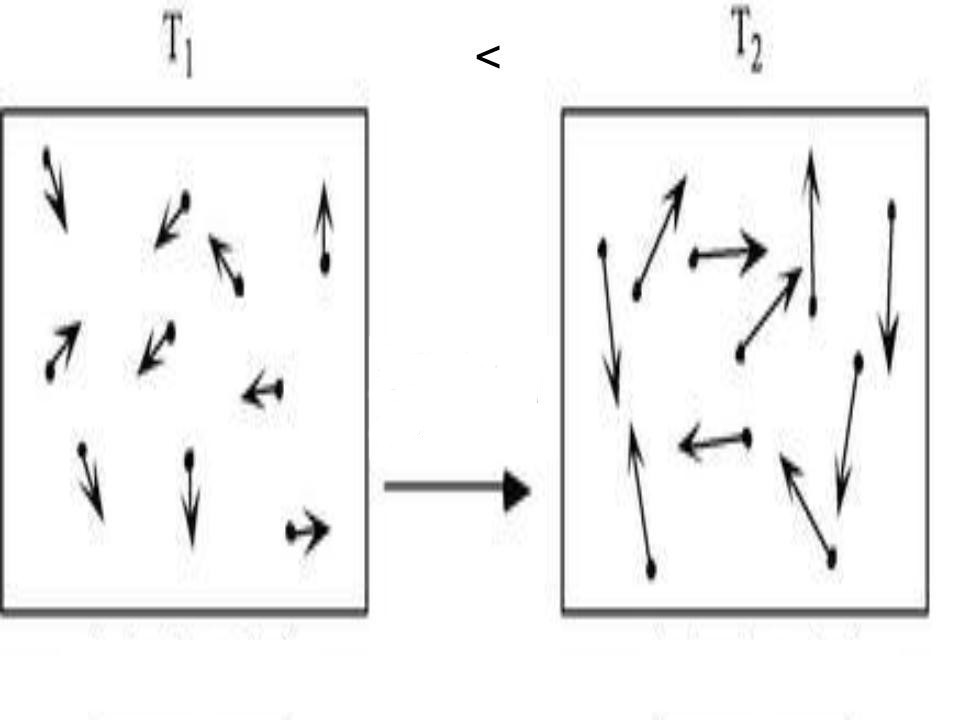
Перевод термодинамической системы (например, порции идеального газа) из состояния `1` в состояние `2` можно осуществить разными способами. На рис. 12 показаны графики двух возможных процессов (`1-«а»-2` и `1-«в»-2`), позволяющих осуществить такой перевод. Изменение внутренней энергии системы в том и в другом случае одинаково (оно определяется положениями точек `1` и `2` на -диаграмме), а работа, совершённая системой над окружающими телами, различна (площадь фигур под графиками процессов `1-«а»-2` и `1-«в»-2` разная, площадь под графиком процесса `1-«в»-2` больше).
Следовательно, и количество теплоты, затраченное на перевод системы из состояния `1` в `2` ( $$ Q=Delta U+{A}^{text{‘}}$$ ), будет разным.
Теплоёмкостью $$ C$$ термодинамической системы (тела) называют отношение бесконечно малого количества теплоты $$ Delta Q$$, переданного системе, к изменению $$ Delta T$$ его температуры, вызванного этим количеством теплоты.
$$ C={displaystyle frac{Delta Q}{Delta T}}$$ — теплоёмкость тела (системы).
Единицей измерения этой величины будет $$ left[Cright]={displaystyle frac{1mathrm{Дж}}{mathrm{К}}}$$.
Численное значение теплоёмкости тела показывает, какое количество теплоты потребуется для изменения температуры всего тела на `1` градус по шкале Цельсия (Кельвина).
При расчётах чаще пользуются удельной теплоёмкостью (теплоёмкостью `1` кг вещества).
называют отношение теплоёмкости тела (системы) к массе этого тела (системы):
| $$ {c}_{mathrm{уд}}={displaystyle frac{C}{m}}={displaystyle frac{Delta Q}{m· Delta T}}$$ — удельная теплоёмкость тела (системы). | (1) |
Единицей измерения этой величины будет $$ left[cright]={displaystyle frac{1mathrm{Дж}}{mathrm{кг}·mathrm{К}}}$$.
называют отношение теплоёмкости тела (системы) к количеству вещества в этом теле (системе):
| $$ {c}_{mathrm{мол}}={displaystyle frac{C}{nu }}={displaystyle frac{Delta Q}{ Delta T·nu }}$$ — молярная теплоёмкость тела (системы). | (2) |
Единицей измерения этой величины будет $$ left[{c}_{mathrm{мол}}right]={displaystyle frac{1mathrm{Дж}}{mathrm{моль}·mathrm{К}}}$$.
Получим соотношение между удельной и молярной теплоёмкостями:
| $$ {c}_{mathrm{мол}}={displaystyle frac{Q}{ Delta T·frac{m}{M}}}={displaystyle frac{Q·M}{ Delta T·m}}={c}_{mathrm{уд}}·M$$ — соотношение между молярной и удельной теплоёмкостями | (3) |
Теперь найдём молярную теплоёмкость идеального газа при изобарном и при изохорном процессах.
При изобарном процессе присутствуют и $$ Delta U$$, и $$ {A}^{text{‘}}$$, следовательно:
$$ {c}_{p}={displaystyle frac{Q}{nu · Delta T}}={displaystyle frac{Delta U+Atext{‘}}{nu · Delta T}}={displaystyle frac{Delta U}{nu Delta T}}+{displaystyle frac{Atext{‘}}{nu Delta T}}={displaystyle frac{frac{i}{2}nu R Delta T}{nu Delta T}}+{displaystyle frac{nu R Delta T}{nu Delta T}}={displaystyle frac{iR}{2}}+R=R{displaystyle frac{i+2}{2}}$$,
$${c}_{p}=R{displaystyle frac{i+2}{2}}$$ — молярная теплоёмкость газа при изобарном процессе.
При изохорном процессе работа не совершается, $$ {A}^{text{‘}}=0$$, следовательно:
$$ {c}_{V}={displaystyle frac{Q}{nu Delta T}}={displaystyle frac{Delta U+{A}^{text{‘}}}{nu Delta T}}={displaystyle frac{Delta U}{nu Delta T}}={displaystyle frac{frac{i}{2}nu R Delta T}{nu Delta T}}={displaystyle frac{iR}{2}}$$
$$ {c}_{V}=R{displaystyle frac{i}{2}}$$ — молярная теплоёмкость газа при изохорном процессе.
Соотношение между $$ {c}_{V}$$ и $$ {c}_{р}$$ можно записать в двух формах:
1) $$ {c}_{p}={c}_{V}+R$$ — закон Майера, и
2) $$ gamma ={displaystyle frac{{c}_{p}}{{c}_{V}}}$$ — коэффициент Пуассона.
Т. к. мы уже знаем, чему равно число степеней свободы у разных молекул, то можем вычислить и значения $$ {с}_{р}$$ и $$ gamma $$:
|
формула |
Одноатомные `(i = 3)` |
Двухатомные `(i = 5)` |
|||
| `c_p` |
`R((i+2)/2)` |
`5/2 R` |
`20,775 «Дж»/(«моль»*»К»)` | `7/2 R` | `29,085 «Дж»/(«моль»*»К»)` |
|
`gamma` |
`(i+2)/i` |
`5/3` |
`1,66667` |
`7/5` |
`1,4` |
Воздух представляет собой смесь газов, преимущественно двухатомных азота и кислорода, потому для него эксперименты дают значение $$ gamma approx mathrm{1,4}$$.
Для твёрдых тел теплоёмкости $$ {с}_{р}$$ и $$ {c}_{V}$$ будут почти одинаковыми. Это можно показать следующим образом. По определению $$ C={displaystyle frac{Delta Q}{ Delta T}}$$, но $$ Delta Q= Delta U+pDelta V$$, тогда
$$ {C}_{p}={displaystyle frac{Delta U+pDelta V}{ Delta T}}={displaystyle frac{Delta U}{ Delta T}}+{displaystyle frac{pDelta V}{ Delta T}}={C}_{V}+{displaystyle frac{pDelta V}{ Delta T}}$$.
При нагревании твёрдых или жидких тел изменение объёма составляет около $$ {10}^{-6}$$ первоначального объёма, поэтому вторым слагаемым можно пренебречь по сравнению с первым, что и позволяет говорить о равенстве $$ {c}_{p}={c}_{V}$$.
Для газов $$ frac{ Delta V}{V}$$ на два порядка больше, чем для твёрдых или жидких тел, потому пренебрегать вторым слагаемым нельзя, более того, оно будет составлять заметную долю теплоёмкости $$ {c}_{p}$$.


![Rendered by QuickLaTeX.com [C=frac{frac{i}{2}frac{m}{mu}RdT+pdV}{dT}=frac{i}{2}frac{m}{mu}R+pfrac{dV}{dT} qquad (6) ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-bc49437affd37c7a2b86038ef2b410a7_l3.png)