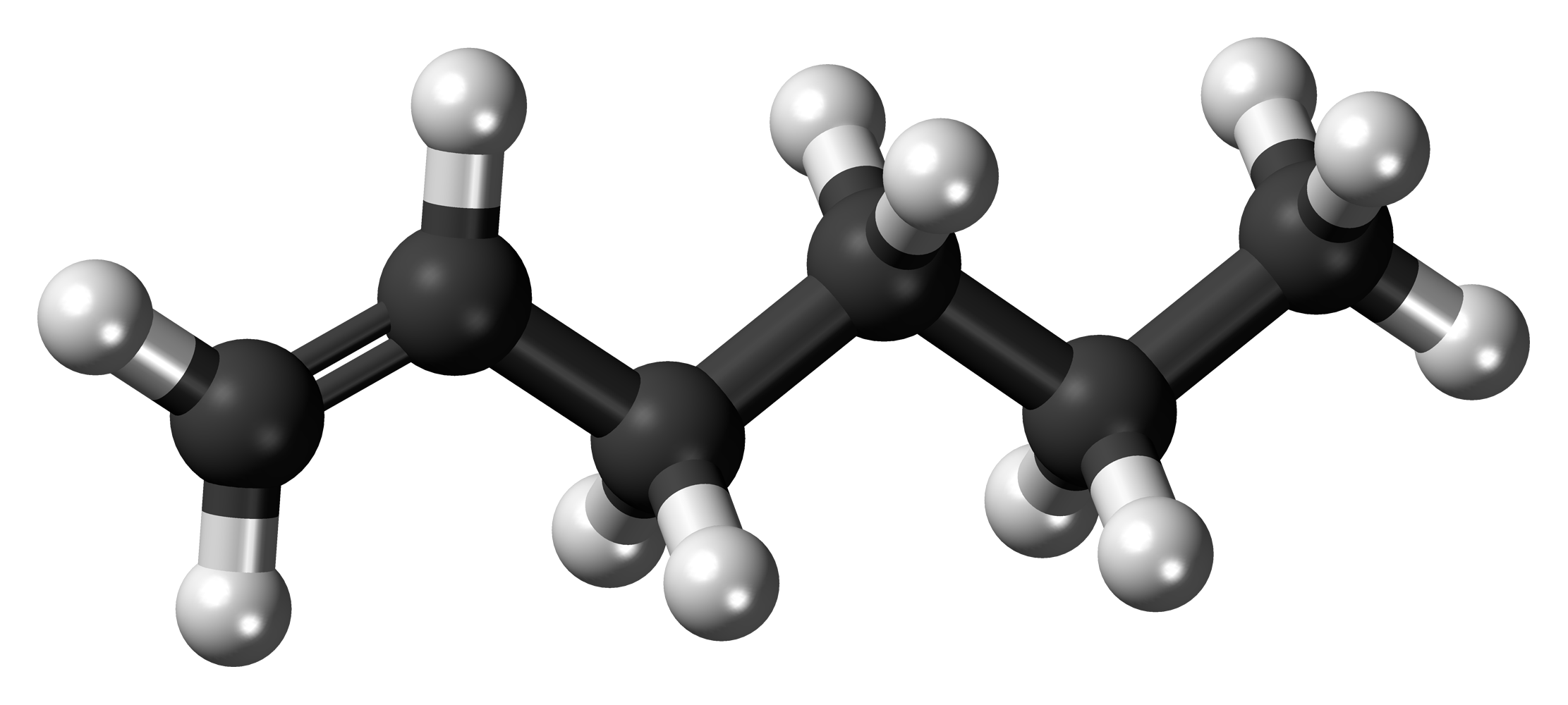
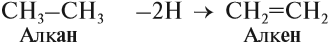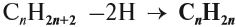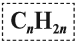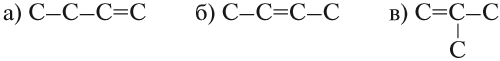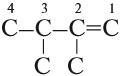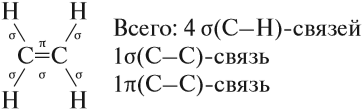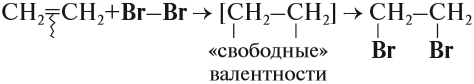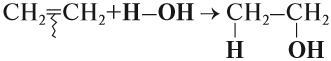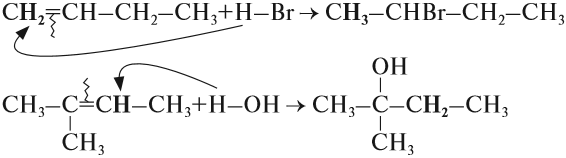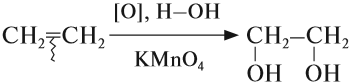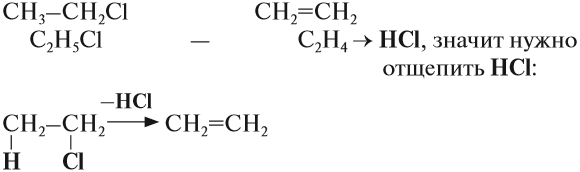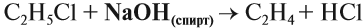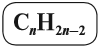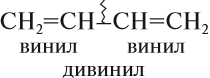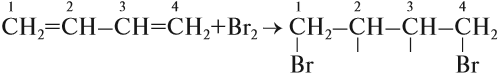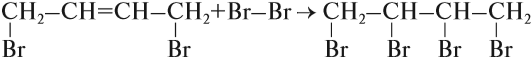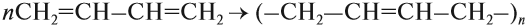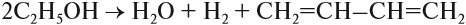Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Строение, изомерия и гомологический ряд алкенов
Химические свойства алкенов
Получение алкенов
Гомологический ряд алкенов
Все алкены имеют некоторые общие или похожие физические и химические свойства. Схожие по строению алкены, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкены образуют гомологический ряд.
Самый первый представитель гомологического ряда алкенов – этен (этилен) C2H4, или СH2=СH2.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
| Название алкена | Формула алкена |
| Этилен (этен) | C2H4 |
| Пропилен (пропен) | C3H6 |
| Бутилен (бутен) | C4H8 |
| Пентен | C5H10 |
| Гексен | C6H12 |
| Гептен | C7H14 |
| Октен | C8H16 |
| Нонен | C9H18 |
Общая формула гомологического ряда алкенов CnH2n.
Первые четыре члена гомологического ряда алкенов – газы, начиная с C5 – жидкости.
Алкены легче воды, не растворимы в воде и не смешиваются с ней.
Строение алкенов
Рассмотрим особенности строения алкенов на примере этилена.
В молекуле этилена присутствуют химические связи C–H и С=С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp2:
При образовании связи σ-связи между атомами углерода происходит перекрывание sp2-гибридных орбиталей атомов углерода:
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120о друг к другу:
Изображение с сайта orgchem.ru
Это соответствует плоско-треугольному строению молекулы.
Например, молекуле этилена C2H4 соответствует плоское строение.
Изображение с сайта orgchem.ru
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
Например, в молекуле пропилена присутствует атом углерода в sp3-гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение и располагается вне плоскости двойной связи.
Изображение с сайта orgchem.ru
Изомерия алкенов
Для алкенов характерна структурная и пространственная изомерия.
Структурная изомерия
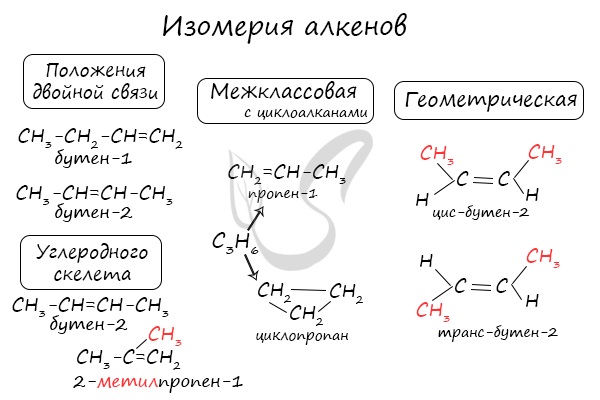
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Изомеры с различным углеродным скелетом и с формулой С4Н8 — бутен-1 и метилпропен
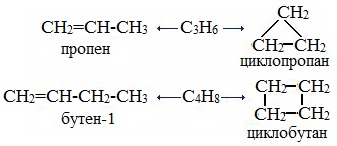
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкены являются межклассовыми изомерами с циклоалканами. Общая формула и алкенов, и циклоалканов — CnH2n.
Межклассовые изомеры с общей формулой С3Н6 — пропилен и циклопропан
Изомеры с различным положением двойной связи отличаются положением двойной связи в углеродном скелете.
Изомеры положения двойной связи, которые соответствуют формуле С4Н8 — бутен-1 и бутен-2
Пространственная изомерия
Для алкенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у алкенов.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
Для бутена-2 характерна цис- и транс-изомерия. В цис-изомере метильные радикалы CH3 располагаются по одну сторону от плоскости двойной связи, в транс-изомере — по разные стороны.
| цис-Бутен-2 | транс-Бутен-2 |

|
Цис-транс-изомерия не характерна для тех алкенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Для пентена-1 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода)
Алкенам характерна как структурная, так и пространственная изомерия.
Виды структурной изомерии алкенов:
- изомерия углеродной цепи;
- изомерия положения двойной связи;
- межклассовая изомерия с циклоалканами.
Обрати внимание!
Изомерия углеродной цепи и положения двойной связи возможна при числе атомов углерода не меньше (4).
В молекулах структурных изомеров атомы углерода соединяются в разном порядке. Молекулы могут иметь линейное или разветвлённое строение. Двойная связь в них может располагаться в разных местах.
Межклассовые изомеры существуют у всех алкенов, кроме этилена. Например, пропену
CH2=CH−CH3
изомерен циклопропан, структурная формула которого выглядит следующим образом:
Для некоторых алкенов и их производных возможна пространственная изомерия. Она обусловлена невозможностью вращения частей молекулы вокруг двойной связи.
У веществ, в молекулах которых оба атома углерода при двойной связи соединены с разными группами, существуют геометрические изомеры (цис-транс-изомеры). В молекулах этих веществ порядок соединения атомов одинаковый, но их пространственное расположение различается. Приведём пример пространственных изомеров для галогенпроизводного — (1), (2)-дихлорбутена.
|
|
|
|
Цис-(1), (2)-дихлорбутен-(2) |
Транс-(1), (2)-дихлорбутен-(2) |
Составим структурные формулы изомеров, имеющих состав
C4H8
.
|
Структурная формула изомера |
Название |
Вид изомерии |
|
|
бутен-(1) |
структурная, положения двойной связи |
|
|
бутен-(2) |
структурная, положения двойной связи |
|
|
метилпропен |
структурная, углеродной цепи |
|
|
циклобутан |
структурная, межклассовая |
|
|
метилциклопропан |
структурная, межклассовая |
|
|
цис-бутен-(2) |
пространственная, цис-транс-изомерия |
|
|
транс-бутен-(2) |
пространственная, цис-транс-изомерия |
Значит, всего существует шесть веществ, имеющих состав
C4H8
, — пять структурных изомеров, один из которых (бутен-(2)) представлен двумя цис-транс-изомерами.
Для алкенов характерна структурная и пространственная изомерия.
Структурная изомерия алкенов
1. Изомерия углеродного скелета (начиная с С4Н8).
Первые два члена гомологического ряда – этен и пропен – изомеров, относящихся к классу алкенов, не имеют.
Простейший алкен, для которого характерны структурные изомеры, — это бутен:
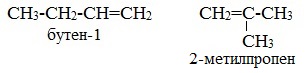
2. Изомерия положения двойной связи (начиная с С4Н8):
3. Межклассовая изомерия, начиная с С3Н6 (алкены изомерны другому классу соединений — циклоалканам):
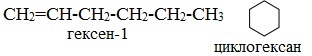
Пространственная изомерия
Геометрическая или цис-транс изомерия
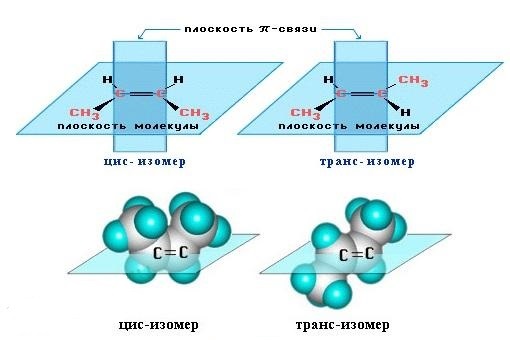
Цис-транс изомерия обусловлена различным положением заместителей относительно плоскости двойной связи.
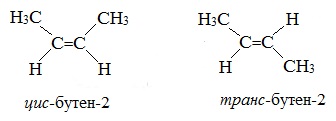
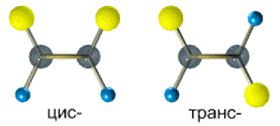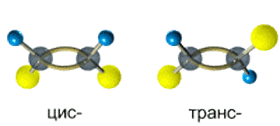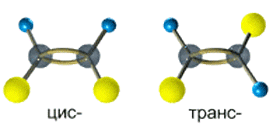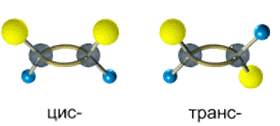
Эти два изомера нельзя перевести друг в друга без вращения вокруг двойной связи С=С, а это вращение требует разрыва π-связи и затраты большого количества энергии. Поэтому цис- и транс-изомеры – это разные вещества, которые отличаются друг от друга физическими и химическими свойствами.
Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной связи в цис-изомере, либо по разные стороны в транс-изомере.
Алкены, у которых хотя бы один из атомов углерода при связи С=С имеет два одинаковых заместителя, не имеют цис-транс- изомеров.
Например,бутен-1 СН2=СН–СН2–СН3 не имеет цис— и транс-изомеров, т.к. первый атом С связан с двумя одинаковыми атомами Н.
Иногда цис-транс-изомерию не совсем точно называют геометрической изомерией. Неточность состоит в том, что все пространственные изомеры различаются своей геометрией, а не только цис— и транс— .
Алкены (непредельные углеводороды)
Содержание
- Гомологический ряд, номенклатура, изомерия
- Строение молекул
- Свойства алкенов
- Физические свойства
- Химические свойства
- Получение и применение алкенов
- Понятие об алкадиенах (диены)
- Выводы
Гомологический ряд, номенклатура, изомерия
Алкены — это нециклические углеводороды, в молекулах которых есть одна двойная связь.
Алкены относятся к группе непредельных углеводородов. Непредельными углеводородами являются вещества, в состав молекул которых входит меньшее, чем у алканов, число атомов водорода. Поэтому они способны к реакциям присоединения, т. е. являются ненасыщенными.
Вопрос. Может ли существовать алкен, в состав которого входит один атом углерода?
Поскольку двойная связь связывает два атома углерода, минимальное число атомов углерода в молекуле алкена равно двум. Сравним состав алкана и алкена:
Общая формула:
Таким образом, алкены образует гомологический ряд, общая формула которого
Вопрос. Почему в названиях алкенов появился суффикс ЕН? (См. урок 17.7.)
Упражнение 19.1. Составьте графические формулы алкенов для n = 4.
Решение. Состав этого углеводорода С4Н8. Он содержит двойную связь. Для него возможны три углеродные цепочки:
Допишите атомы водорода к этим цепочкам и убедитесь, что это — изомеры.
Вывод. Начиная с бутена (n = 4) у алкенов возможна структурная изомерия, которая связана
- со строением углеродной цепи: (а) и (в);
- с положением двойной связи: (а) и (б).
Кроме того, для некоторых алкенов возможна пространственная (цис-транс-) изомерия. Цис-транс-изомеры отличаются друг от друга расположением одинаковых атомов или групп атомов по отношению к двойной связи. Такие изомеры есть у алкенов, в молекулах которых около двойной связи имеются разные радикалы (атомы, группы). Например, у бутена-2 [это формула (б)] второй и третий атомы углерода связаны с двумя разными группами: –СН3 и –Н:
Задание 19.1. Назовите оставшиеся два изомера бутена (а) и (в).
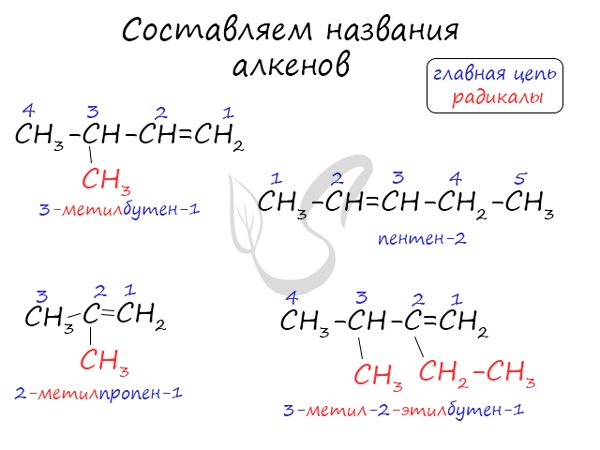
Таким образом, в названиях алкенов присутствие двойной связи обозначают при помощи суффикса ЕН, а положение двойной связи показывают цифрой, которую записывают после суффикса. Эта цифра указывает на меньший номер атома углерода при двойной связи. Нумерация атомов углерода основной, главной цепи начинается с того конца, к которому ближе двойная связь.
Упражнение 19.2. Назвать углеводород:
Решение. Основная цепь содержит 4 атома углерода, причём двойная связь соединяет атомы углерода № 1 и № 2 (нумеруем справа налево, так как к правому концу ближе двойная связь). Получаем: бутен-1.
У второго и третьего атомов углерода имеются радикалы «метил», всего их два (обозначение — ДИ); получаем: 2,3-диметилбутен-1.
Задание 19.2. Составьте графические формулы изомеров алкена с n = 5; назовите полученные соединения.
Кроме рассмотренных выше названий по международной номенклатуре IUPAC, на практике применяются и так называемые тривиальные названия. Например, этен обычно называют этилен, пропен — пропилен и т. д. Поэтому алкены называются «этиленовые углеводороды», тем более что по свойствам похожи на этилен.
Строение молекул
Молекулы алкенов отличаются по строению от молекул алканов тем, что они содержат двойную связь. Рассмотрим строение этой связи. Эта связь ковалентная, но неоднородная. Одна из двух связей имеет ту же природу, что и связь в молекулах алканов, т. е. это прочная σ-связь. Другая связь двойной связи образуется иначе, она менее прочная и обозначается буквой π(пи). Это π-связь. Таким образом, в молекуле этена (этилена) имеется:
Вопрос. Какая связь будет легче разрушаться в химических реакциях: σ- или π-связь?
В результате алкены (и любые другие углеводороды), имеющие π-связь, легко, иногда даже при обычных условиях, вступают в химические реакции, причём эти реакции происходят за счёт разрыва π-связи.
Свойства алкенов
Физические свойства
По физическим свойствам алкены почти не отличаются от алканов: низшие алкены (этилен, пропилен и др.) — газы, а с увеличением молекулярной массы увеличиваются и температуры кипения и температуры плавления. Это неполярные вещества, поэтому они практически нерастворимы в воде, но хорошо растворяются в бензине, маслах.
Химические свойства
Наиболее характерной реакцией для алкенов является реакция присоединения. В ходе этой реакции разрывается непрочная π-связь, в результате у обоих атомов углерода, которые соединялись этой связью, появляются «свободные» валентности, за счёт чего и происходит присоединение:
Эта реакция бромирования этилена (и других алкенов) происходит при нормальных условиях под действием раствора брома в воде (бромной воды). В результате цвет бромной воды изменяется: был жёлтым, становится бесцветным.
Поэтому реакция обесцвечивания бромной воды является качественной* на двойную связь.
* Качественной называется химическая реакция, при помощи которой можно обнаружить вещество в смеси или в растворе. В результате качественной реакции изменяется цвет, выделяется газ, осадок.
Упражнение 19.3. В двух пробирках находятся бесцветные жидкости: н-пентан и пентен-1. Как при помощи химической реакции определить, где какая жидкость находится?
Решение. В обе пробирки добавляем жёлтую бромную воду и сильно встряхиваем: в пробирке, где был пентен-1, смесь обесцветится, а в другой пробирке цвет бромной воды не изменится.
Задание 19.3. Составьте уравнения реакций этих процессов.
Аналогично происходят и другие реакции присоединения: с Н2 (гидрирование), с Н2O (гидратация), с НСl и т. д. При этом в результате реакции присоединения двойная связь всегда разрушается (разрывается π-связь). Изменяется характер химической связи: вместо двойной связи появляется простая связь. Образуется одно вещество:
Задание 19.4. Составьте уравнения реакций:
- пропен + водород;
- бутен-2 + вода.
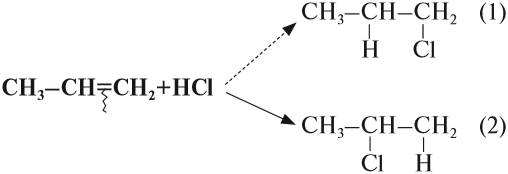
Во всех случаях, которые рассматривались ранее, в результате реакции присоединения могло получиться только одно вещество (один изомер). Но так бывает не всегда. Попробуем составить уравнение реакции пропена с хлороводородом:
Какой изомер получится: (1)? или (2)? или оба? Эта задача решается при помощи правила Марковникова (1869 год)*.
* Марковников Владимир Васильевич (25.12.1837–11.02.1904) — русский химик-органик. Ввёл понятие о взаимном влиянии атомов как главном содержании теории химического строения.
Соединения типа Н-Х присоединяются по месту разрыва двойной связи так, что при этом атом водорода (вещества Н-Х) присоединяется к атому углерода, у которого было больше атомов водорода (наиболее гидрогенизированный атом углерода).
Вопрос. Какой изомер получился при гидрировании бутена-2: (1) или (2)?
При составлении уравнений таких реакций, конечно, нужно «считать» атомы водорода только у тех атомов углерода, которые связаны двойной связью:
Задание 19.5. Составьте уравнения реакций:
- пропен + бром;
- бутен-1 + хлороводород;
- 2-метилпропен + вода.
В отличие от алканов, алкены вступают в реакции окисления* и при обычных условиях. Так, если этилен пропустить через розовый раствор перманганата калия (КМnО4), то раствор станет бесцветным:
* Реакции мягкого окисления, в которых не разрушается углеродная цепь атомов, обозначается [O], а формула вещества-окислителя записывается под стрелочкой.
Вопрос. Является ли эта реакция качественной на двойную связь?
Таким образом, для обнаружения двойной связи в углеводороде, можно воспользоваться любой из качественных реакций:
- обесцвечивание бромной воды;
- обесцвечивание раствора перманганата калия.
Алкены горят, но, в отличие от газообразных алканов, пламя которых бесцветно, газообразные алкены горят светящимся (ярким) пламенем.
Задание 19.6. Составьте уравнение реакции горения этилена.
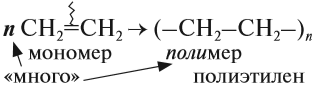
Алкены легко вступают в реакцию полимеризации. Это процесс, при котором из большого числа молекул (мономеров) образуется ОДНА большая молекула (полимер):
Вопрос. Является ли полиэтилен химически активным веществом? Почему?
Полиэтилен, в отличие от этилена, уже не содержит двойной связи, поэтому он химически инертен, т. е. практически не вступает в химические реакции. Поэтому из него делают плёнки, различные изделия, которые широко применяются в быту (полиэтиленовые пакеты*) и в химической промышленности (трубы, ёмкости и др.).
* Полиэтиленовые пакеты часто неправильно называют «целлофановыми», хотя целлофан — совсем другой материал (см. урок 26).
Получение и применение алкенов
Главный промышленный источник алкенов — природный газ, нефть и продукты их переработки (например, продукты крекинга).
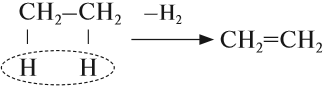
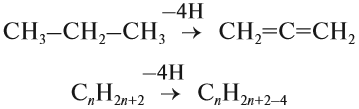
Основным способом получения алкенов является реакция отщепления. В этом случае от двух соседних атомов углерода отщепляется по одному атому или группе:
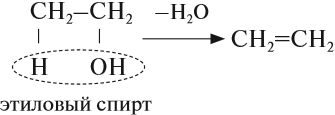
В лаборатории алкены можно получить реакцией дегидратации (отщепления воды) спиртов. Эта реакция происходит при нагревании в присутствии концентрированной серной кислоты:
Упражнение 19.4. Какую молекулу нужно отщепить от хлорэтана, чтобы получить алкен?
Решение. Сравним состав хлорэтана и этилена:
Эта реакция происходит под действием спиртового раствора щёлочи. Уравнение этого процесса записывается так:
Вопрос. Какую молекулу нужно отщепить от 1,2-дихлорэтана для получения этилена?
Алкены легко вступают в химические реакции, поэтому они применяются для получения различных веществ: спиртов, растворителей, полимеров. Например, из этилена получают этиловый спирт, растворители (хлорэтан и дихлорэтан), полиэтилен.
Задание 19.7. Составьте уравнения реакций получения перечисленных веществ.
Плёнки полиэтилена находят большое применение не только для хранения пищевых продуктов: ими устилают дно каналов, чтобы уменьшить потери влаги; полиэтиленовую пленку используют для устройства парников; ею оборачивают трубы, чтобы уменьшить потери от коррозии и т. д.
Понятие об алкадиенах (диены)
Алкадиены — это углеводороды, в молекулах которых есть две двойные связи.
Алкадиены относят к группе непредельных ненасыщенных углеводородов.
Для того чтобы вывести общую формулу гомологического ряда алкадиенов, сравним состав алканов и алкадиенов:
Таким образом, алкадиены образуют гомологический ряд, общая формула которого
Первый член гомологического ряда алкадиенов С3Н4 называется пропадиен. Таким образом, названия составляют, используя те же принципы номенклатуры IUPAC, с использованием суффикса диен.
Вопрос. На что указывает этот суффикс?
Некоторые диены (так кратко обозначают представителей этого гомологического ряда) имеют тривиальные названия. Например, бутадиен-1,3 известен под названием дивинил, поскольку каждая его половинка является непредельным радикалом, который называется «винил»:
Его гомолог — 2-метилбутадиен-1,3 называется изопрен.
Задание 19.8. Составьте графическую формулу этого соединения.
Начиная с n = 4, возникает изомерия, которая связана не только со строением углеродной цепи, но и положением кратных связей. По этому признаку различают:
- диены с кумулированными связями С–С–С=С=С;
- диены с сопряжёнными связями С–С=С–С=С;
- диены с изолированными связями С=С–С–С=С.
Наибольшее значение и применение имеют диены с сопряжёнными связями. Рассмотрим их свойства.
Для алкадиенов, как и для алкенов, характерны реакции присоединения, которые идут в две стадии. Но диены с сопряжёнными связями вначале присоединяют бром (или другое вещество) в положение 1,4:
Образовавшиеся «свободные валентности» замыкаются, образуя двойную связь.
Вопрос. Возможна ли для полученного соединения реакция присоединения?
Поскольку полученное вещество содержит двойную связь, возможна вторая стадия этого процесса:
Установлено, что на первой стадии присоединения образуется 2 изомера: 80 % указанного вещества (1,4-дибромбутен-2) и 20 % 3,4-дибромбутена-1*.
* Здесь нумерация цепи идёт по двойной связи, так как галогены не являются функциональной группой.
Задание 19.9. Составьте формулы обоих соединений.
Большое практическое значение имеет процесс полимеризации сопряжённых диенов. Вначале, как в случае бромирования, возникает двойная связь в положении 2,3:
Поскольку в полученном полимере имеется двойная связь, такие полимеры имеют два изомера: цис- и транс- (см. урок 19.1). Цис-изомеры таких полимеров являются эластичными и называются каучуки.
Каучуки — это эластичные полимеры, из которых получают резину. Резина образуется из каучука в результате вулканизации. Дело в том, что чистый каучук имеет крайне низкие эксплуатационные качества. Он становится твёрдым и хрупким на морозе, липким на жаре, быстро окисляется, крайне непрочен.
Бутадиен получают синтезом Лебедева**, который заключается в том, что этиловый спирт в присутствии определённых катализаторов подвергают одновременно дегидрированию и дегидратации:
** Лебедев Сергей Васильевич (25.07.1874–02.05.1934) — советский химик. Впервые получил (1910) образец синтетического бутадиенового каучука, разработал (1930) методы получения резины и резинотехнических изделий из синтетического каучука. По способу Лебедева впервые получен (1932) промышленный синтетический каучук.
Для алкадиенов, так же как и для алкенов, характерна реакция окисления. Например, они обесцвечивают раствор перманганата калия. При этом образуются многоатомные спирты.
Производные изопрена широко распространены в природе. К ним относятся многие душистые вещества (мяты, лимона), витамины (каротин, витамин А), а также холестерин.
Выводы
Алкены и алкадиены — это непредельные углеводороды, содержащие двойные связи. Для таких веществ характерны реакции
- присоединения;
- окисления;
- полимеризации.
Все они происходят за счёт разрыва π-связи, которая входит в состав двойной связи.
Алкадиены с сопряжёнными связями образуют полимеры с особыми свойствами — каучуки.
Алкены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит
одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда — этилену — CH2=CH2.
Общая формула их гомологического ряда — CnH2n.
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом:
этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию
атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого
начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая
изомерия в виде существования цис- и транс-изомеров.
Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) — sp2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
- Дегидрирование алканов
- Дегидрогалогенирование галогеналканов
- Дегалогенирование дигалогеналканов
- Внутримолекулярная дегидратация спиртов
В результате крекинга нефти образуется один алкан и один алкен.
C12H26 → C6H12 + C6H14
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко
водород отдает третичный атом, чуть труднее — вторичный и заметно труднее — первичный.
CH3-CH3 → (t, кат) CH2=CH2 + H2

В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород
отщепляется от соседнего наименее гидрированного атома углерода.

В подобных реакциях применяется цинк (цинковая пыль) — двухвалентный металл, который связывает расположенные
рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.

При нагревании спиртов c серной кислотой — H2SO4, обладающей выраженными водоотнимающими
свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.

Химические свойства алкенов
Алкены — ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Гидратация
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).

Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная
вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
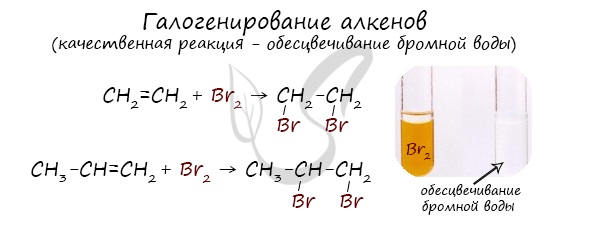
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а
атом галогена — к наименее гидрированному атому углерода.

Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода,
гидроксогруппа — к наименее гидрированному.

При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. При неполном
окислении образуются окиси.

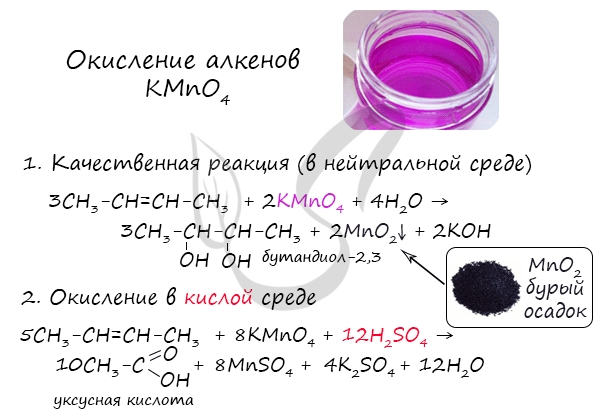
Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные
углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета — MnO2.
В более жестких условиях — при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы — двойной
связи.
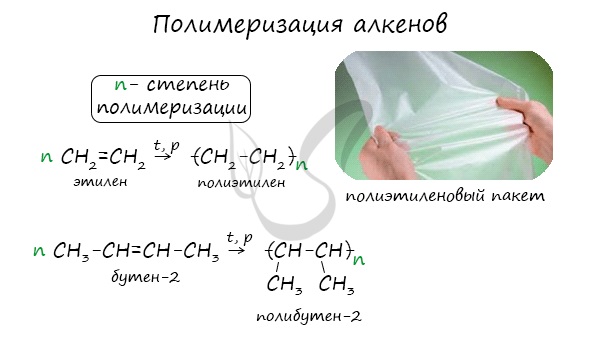
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения
молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.