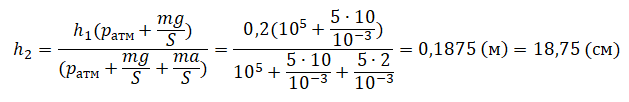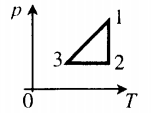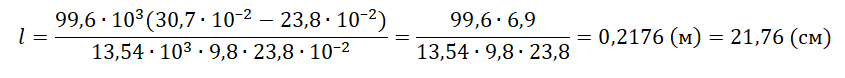Изопроцессы
-
Темы кодификатора ЕГЭ: изопроцессы — изотермический, изохорный, изобарный процессы.
-
Изотермический процесс
-
Графики изотермического процесса
-
Изобарный процесс
-
Графики изобарного процесса
-
Изохорный процесс
-
Графики изохорного процесса
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: изопроцессы — изотермический, изохорный, изобарный процессы.
На протяжении этого листка мы будем придерживаться следующего предположения: масса и химический состав газа остаются неизменными. Иными словами, мы считаем, что:
• , то есть нет утечки газа из сосуда или, наоборот, притока газа в сосуд;
• , то есть частицы газа не испытывают каких-либо изменений (скажем, отсутствует диссоциация — распад молекул на атомы).
Эти два условия выполняются в очень многих физически интересных ситуациях (например, в простых моделях тепловых двигателей) и потому вполне заслуживают отдельного рассмотрения.
Если масса газа и его молярная масса фиксированы, то состояние газа определяется тремя макроскопическими параметрами: давлением, объёмом и температурой. Эти параметры связаны друг с другом уравнением состояния (уравнением Менделеева — Клапейрона).
Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры.
Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов.
1. Изотермический процесс идёт при постоянной температуре газа: .
2. Изобарный процесс идёт при постоянном давлении газа: .
3. Изохорный процесс идёт при постоянном объёме газа: .
Изопроцессы описываются очень простыми законами Бойля — Мариотта, Гей-Люссака и Шарля. Давайте перейдём к их изучению.
к оглавлению ▴
Изотермический процесс
Пусть идеальный газ совершает изотермический процесс при температуре . В ходе процесса меняются только давление газа и его объём.
Рассмотрим два произвольных состояния газа: в одном из них значения макроскопических параметров равны , а во втором —
. Эти значения связаны уравнением Менделеева-Клапейрона:
Как мы сказали с самого начала,масса и молярная масса
предполагаются неизменными.
Поэтому правые части выписанных уравнений равны. Следовательно, равны и левые части:
(1)
Поскольку два состояния газа были выбраны произвольно, мы можем заключить, что в ходе изотермического процесса произведение давления газа на его объём остаётся постоянным:
(2)
Данное утверждение называется законом Бойля — Мариотта.
Записав закон Бойля — Мариотта в виде
(3)
можно дать и такую формулировку: в изотермическом процессе давление газа обратно пропорционально его объёму. Если, например, при изотермическом расширении газа его объём увеличивается в три раза, то давление газа при этом в три раза уменьшается.
Как объяснить обратную зависимость давления от объёма с физической точки зрения? При постоянной температуре остаётся неизменной средняя кинетическая энергия молекул газа, то есть, попросту говоря, не меняется сила ударов молекул о стенки сосуда. При увеличении объёма концентрация молекул уменьшается, и соответственно уменьшается число ударов молекул в единицу времени на единицу площади стенки — давление газа падает. Наоборот, при уменьшении объёма концентрация молекул возрастает, их удары сыпятся чаще и давление газа увеличивается.
к оглавлению ▴
Графики изотермического процесса
Вообще, графики термодинамических процессов принято изображать в следующих системах координат:
• -диаграмма: ось абсцисс
, ось ординат
;
• -диаграмма: ось абсцисс
, ось ординат
;
• -диаграмма: ось абсцисс
, ось ординат
.
График изотермического процесса называется изотермой.
Изотерма на -диаграмме — это график обратно пропорциональной зависимости
.
Такой график является гиперболой (вспомните алгебру — график функции ). Изотерма-гипербола изображена на рис. 1.
Рис. 1. Изотерма на -диаграмме
Каждая изотерма отвечает определённому фиксированному значению температуры. Оказывается, что чем выше температура, тем выше лежит соответствующая изотерма на —диаграмме.
В самом деле, рассмотрим два изотермических процесса, совершаемых одним и тем же газом (рис. 2). Первый процесс идёт при температуре , второй — при температуре
.
Рис. 2. Чем выше температура, тем выше изотерма
Фиксируем некоторое значение объёма . На первой изотерме ему отвечает давление
, на второй —
. Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит,
.
В оставшихся двух системах координат изотерма выглядит очень просто: это прямая, перпендикулярная оси (рис. 3):
Рис. 3. Изотермы на и
-диаграммах
к оглавлению ▴
Изобарный процесс
Напомним ещё раз, что изобарный процесс — это процесс, проходящий при постоянном давлении. В ходе изобарного процесса меняются лишь объём газа и его температура.
Типичный пример изобарного процесса: газ находится под массивным поршнем, который может свободно перемещаться. Если масса поршня и поперечное сечение поршня
, то давление газа всё время постоянно и равно
где — атмосферное давление.
Пусть идеальный газ совершает изобарный процесс при давлении . Снова рассмотрим два произвольных состояния газа; на этот раз значения макроскопических параметров будут равны
и
.
Выпишем уравнения состояния:
Поделив их друг на друга, получим:
В принципе, уже и этого могло бы быть достаточно, но мы пойдём немного дальше. Перепишем полученное соотношение так, чтобы в одной части фигурировали только параметры первого состояния, а в другой части — только параметры второго состояния (иными словами, «разнесём индексы» по разным частям):
(4)
А отсюда теперь — ввиду произвольности выбора состояний! — получаем закон Гей-Люссака:
(5)
Иными словами, при постоянном давлении газа его объём прямо пропорционален температуре:
(6)
Почему объём растёт с ростом температуры? При повышении температуры молекулы начинают бить сильнее и приподнимают поршень. При этом концентрация молекул падает, удары становятся реже, так что в итоге давление сохраняет прежнее значение.
к оглавлению ▴
Графики изобарного процесса
График изобарного процесса называется изобарой. На -диаграмме изобара
является прямой линией (рис. 4):
Рис. 4. Изобара на -диаграмме
Пунктирный участок графика означает, что в случае реального газа при достаточно низких температурах модель идеального газа (а вместе с ней и закон Гей-Люссака) перестаёт работать. В самом деле, при снижении температуры частицы газа двигаются всё медленнее, и силы межмолекулярного взаимодействия оказывают всё более существенное влияние на их движение (аналогия: медленный мяч легче поймать, чем быстрый). Ну а при совсем уж низких температурах газы и вовсе превращаются в жидкости.
Разберёмся теперь, как меняется положение изобары при изменении давления. Оказывается, что чем больше давление, тем ниже идёт изобара на —диаграмме.
Чтобы убедиться в этом, рассмотрим две изобары с давлениями и
(рис. 5):
Рис. 5. Чем ниже изобара, тем больше давление
Зафиксируем некоторое значение температуры . Мы видим, что
. Но при фиксированной температуре объём тем меньше, чем больше давление (закон Бойля — Мариотта!).
Стало быть, .
В оставшихся двух системах координат изобара является прямой линией, перпендикулярной оси (рис. 6):
Рис. 6. Изобары на и
-диаграммах
к оглавлению ▴
Изохорный процесс
Изохорный процесс, напомним, — это процесс, проходящий при постоянном объёме. При изохорном процессе меняются только давление газа и его температура.
Изохорный процесс представить себе очень просто: это процесс, идущий в жёстком сосуде фиксированного объёма (или в цилиндре под поршнем, когда поршень закреплён).
Пусть идеальный газ совершает изохорный процесс в сосуде объёмом . Опять-таки рассмотрим два произвольных состояния газа с параметрами
и
. Имеем:
Делим эти уравнения друг на друга:
Как и при выводе закона Гей-Люссака, «разносим» индексы в разные части:
(7)
Ввиду произвольности выбора состояний мы приходим к закону Шарля:
(8)
Иными словами, при постоянном объёме газа его давление прямо пропорционально температуре:
(9)
Увеличение давления газа фиксированного объёма при его нагревании — вещь совершенно очевидная с физической точки зрения. Вы сами легко это объясните.
к оглавлению ▴
Графики изохорного процесса
График изохорного процесса называется изохорой. На -диаграмме изохора
является прямой линией (рис. 7):
Рис. 7. Изохора на -диаграмме
Смысл пунктирного участка тот же: неадекватность модели идеального газа при низких температурах.
Далее, чем больше объём, тем ниже идёт изохора на —диаграмме (рис. 8):
Рис. 8. Чем ниже изохора, тем больше объём
Доказательство аналогично предыдущему. Фиксируем температуру и видим, что
. Но при фиксированной температуре давление тем меньше, чем больше объём (снова закон Бойля — Мариотта). Стало быть,
.
В оставшихся двух системах координат изохора является прямой линией, перпендикулярной оси (рис. 9):
Рис. 9. Изохоры на и
-диаграммах
Законы Бойля — Мариотта, Гей-Люссака и Шарля называются также газовыми законами.
Мы вывели газовые законы из уравнения Менделеева — Клапейрона. Но исторически всё было наоборот: газовые законы были установлены экспериментально, и намного раньше. Уравнение состояния появилось впоследствии как их обобщение.
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Изопроцессы» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023
Изопроцесс — процесс, при котором один из макроскопических параметров состояния газа данной массы остается постоянным.
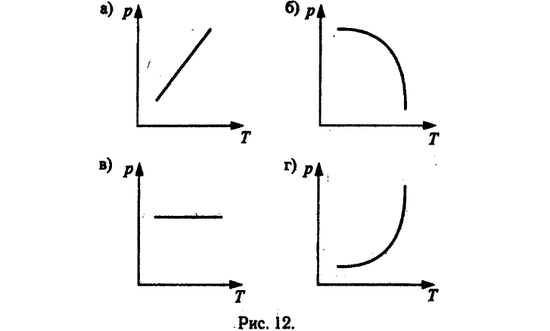
Изопроцессы? Какие из них?
Изотермической процесс — процесс изменения состояния газа определенной массы при постоянной температуре.
Закон Бойля-Мариотта: для газа данной массы при постоянной температуре
$$ p_{1}V_{1}=p_{2}V_{2} $$
, где — $ p_{1} $,$ p_{2} $ давление и $ V_{1} $,$ V_{2} $
объём газа в начальном и конечном состояниях.
Изотерма — график изменения макроскопических параметров газа при изотермическом процессе.
Изобарный процесс — процесс изменения состояния газа определенной массы при постоянном давлении. Рис 12. в)
Закон Гей-Люссака: для газа данной массы при постоянном давлении
$$ frac{V_{1}}{T_{1}}=frac{V_{2}}{T_{2}} $$
где- ${V_{1}}$,${V_{2}}$,${T_{1}}$,${T_{2}}$ — объем и температура газа в начальном и конечном состояниях.
Изобара — график изменения макроскопических параметров газа при изобарном процессе.
Изохорный процесс – процесс изменения состояния газа определенной массы при постоянном объеме. (V=const. m=const) Рис 12. а)
Закон Шарля: для газа данной массы при постоянном объеме
$$ frac{p_{1}}{T_{1}}=frac{p_{2}}{T_{2}} $$
где $ {p_{1}} $,$ p_{2} $,${T_{1}}$,${T_{2}}$ -давление и температура газа в начальном и конечном состояниях.
Изохора — график изменения макроскопических параметров газа при изохорном процессе.
Закон Дальтона
для давления смеси газов
$$ p= p_{1}+p_{2}+ldots+p_{n} $$
n — число газов,
$ p_{i} $ — порпорциональное давление i-го газа (i=1,2,….,n), т.е.
давление, которое оказывал бы стенку сосуда i-ый газ при отсутствии других газов.
Объединенный газовый закон был открыт экспериментально. Он также является следствием основного уравнения состояния идеального газа. Согласно ему:
Определение
При постоянной массе газа и его неизменной молярной массе отношение произведения давления на объем к его абсолютной температуре остается величиной постоянной:
pVT=const или p1V1T1=p2V2T2
Объединенный газовый закон применительно к изопроцессам
Объединенный газовый закон объединяет три независимых газовых закона: Бойля — Мариотта, Шарля и Гей-Люссака. Газовые законы действуют в частных случаях — изопроцессах.
Определение
Изопроцессы — термодинамические процессы, во время которых количество вещества и один из параметров состояния: давление, объём, температура или энтропия — остаётся неизменным.
Изотермический процесс. Закон Бойля — Мариотта.
Изотермический процесс — термодинамический процесс, происходящий в системе при постоянной температуре и массе:
m = const (m1 = m2)
T = const (T1 = T2)
Для изотермического процесса действует закон Бойля — Мариотта:
Закон Бойля — Мариотта
Для газа данной массы произведение газа на его объем постоянно, если температура газа не меняется.
pV = const (p1V1 = p2V2)
Изохорный процесс. Закон Шарля.
Изохорный процесс — термодинамический процесс, происходящий в системе при постоянном объеме и массе:
m = const (m1 = m2)
V = const (V1 = V2)
Для изохорного процесса действует закон Шарля:
Закон Шарля
Для газа данной массы отношение давления к температуре постоянно, если объем не меняется.
pT=const (p1T1=p2T2)
Изобарный процесс. Закон Гей-Люссака.
Изобарный процесс — термодинамический процесс, происходящий в системе при постоянном давлении и массе:
m = const (m1 = m2)
p = const (p1 = p2)
Закон Гей-Люссака
Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется.
VT=const (V1T1=V2T2)
Пример №1. Идеальный газ изобарно нагревают так, что его температура изменяется на ∆T = 240 К, а давление — в 1,6 раза. Масса газа постоянна. Найдите начальную температуру газа по шкале Кельвина.
Так как газ нагревают, то:
T2 – T1 = 240 (К)
Отсюда:
T2 = 240 + T1 (К)
p1 = p
p2 = 1,6p
Запишем закон Шарля применительно к данному случаю:
pT1=1,6p240+ T1
Сделаем некоторые преобразования и вычислим начальную температуру:
pT1=1,6p240+ T1
240+ T1=1,6T1
0,6T1=240
T1=2400,6=400 (К)
Подсказки к задачам на газовые законы
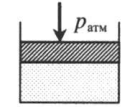 |
Газ под невесомым поршнем: p = pатм p — давление газа; pатм — давление, оказываемое на газ со стороны поршня. |
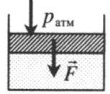 |
На невесомый поршень действует сила: p=pатм+FS F — сила, действующая на поршень; S — площадь поршня. |
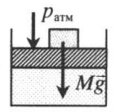 |
На невесомый поршень поставили груз. В данном случае на поршень дополнительно будет действовать сила тяжести: p=pатм+FтяжS=pатм+MgS Fтяж — сила тяжести, действующая на поршень со стороны груза; M — масса груза; g — ускорение свободного падения. |
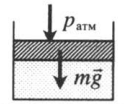 |
Газ под массивным поршнем. В данном случае на него дополнительно будет действовать сила тяжести поршня: p=pатм+mgS m — масса поршня. |
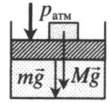 |
На массивный поршень поставили груз. В данном случае на поршень дополнительно будут действовать силы тяжести со стороны поршня и груза: p=pатм+MgS+mgS |
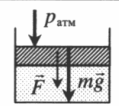 |
На массивный поршень действует сила. В данном случае газ сдавливается как атмосферным давлением, так и силой тяжести поршня, а также силой, которая на него действует: p=pатм+mgS+FS |
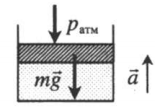 |
Газ, находящийся в цилиндре под массивным поршнем, находится в лифте, ускорение которого направлено вверх. Когда ускорение движения лифта противоположно направлено ускорению свободного падения, вес тел увеличивается. Поэтому: p=pатм+mgS+maS a — модуль ускорения, с которым движется лифт. |
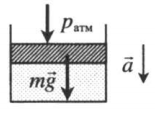 |
Газ, находящийся в цилиндре под массивным поршнем, находится в лифте, ускорение которого направлено вниз. Когда ускорение движения лифта направлено в сторону вектора ускорения свободного падения, вес тел уменьшается. Поэтому: p=pатм+mgS−maS |
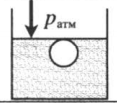 |
«Пузырек у поверхности воды» — на пузырек действует только атмосферное давоение: p = pатм |
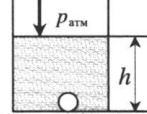 |
«Пузырек на глубине» — на пузырек действует атмосферное давление и давление столба жидкости: p = pатм + ρgh ρ — плотность жидкости; h — глубина, на которой находится пузырек. |
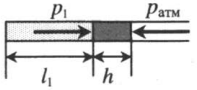 |
Газ, находящийся в горизонтальной пробирке, отделен от атмосферы столбиком ртути. Объем газа можно вычислить, используя параметры пробирки: V1 = l1S V1 — объем газа; l1 — длина части пробирки, которую занимает газ; S — площадь поперечного сечения пробирки. Давление газа равно атмосферному давлению: p1 = pатм |
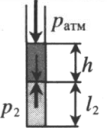 |
Пробирку поворачивают открытым концом вверх. В этом случае кроме атмосферного давления на газ давит давление со стороны ртути: P2 = pатм + ρgh Объем газа можно вычислить, используя параметры пробирки: V2 = l2S |
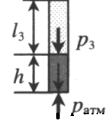 |
Пробирку поворачивают открытым концом вниз. В этом случае сумма давлений газа и ртути в пробирке равна атмосферному давлению. Отсюда давление газа равно: P3 = pатм – ρgh Объем газа можно вычислить, используя параметры пробирки: V3 = l3S |
| Шар или понтон поднимается вверх в воздухе или жидкости | Архимедова сила больше силы тяжести:
FA > Fтяж |
Пример №2. Поршень площадью 10 см2 массой 5 кг может без трения перемещаться в вертикальном цилиндрическом сосуде, обеспечивая при этом герметичность. Сосуд с поршнем, заполненный газом, покоится на полу неподвижного лифта при атмосферном давлении 100 кПа, при этом расстояние от нижнего края поршня до дна сосуда 20 см. Каким станет это расстояние, когда лифт поедет вверх с ускорением, равным 2 м/с2? Изменение температуры газа не учитывать.
10 см2 = 10–3 м2
20 см = 0,2 м
100 кПа = 105 Па
Составим уравнения для 1 и 2 случая. Когда лифт находится в покое, давление газа равно сумме атмосферного давления и давления, оказываемое массивным поршнем:
p1=pатм+mgS
Когда лифт начал двигаться, появилось дополнительное давление, связанное с увеличением веса поршня при ускоренном движении вверх:
p2=pатм+mgS+maS
Так как изменением температуры можно пренебречь, можно считать, что это процесс изотермический. Следовательно:
p1V1 = p2V2
Объемы в 1 и 2 случае будут определяться формулами:
V1 = Sh1
V2 = Sh2
h1 — расстояние от нижнего края поршня до дна сосуда в первом случае. h2 — та же самая величина, но во втором случае (искомая величина).
Запишем закон Бойля — Мариотта для обоих случаев с учетом объемов:
p1V1=Sh1(pатм+mgS)
p2V2=Sh2(pатм+mgS+maS)
Так как это изотермический процесс, правые части уравнений можно приравнять:
Sh1(pатм+mgS)= Sh2(p
атм+mgS+maS)
Отсюда:
Графики изопроцессов
Изопроцессы можно изобразить графически в координатах (p;V), (V;T) и (p;T). Рассмотрим все виды графиком для каждого из процессов.
| Изопроцесс | График в координатах (p;V) | График в координатах (V;T) | График в координатах (p;T) |
| Изотермический (график — изотерма) | 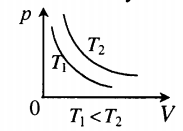
Изотерма в координатах (p;V) — гипербола. Чем ближе изотерма к началу координат и осям, тем меньшей температуре она соответствует. Характер изменения переменных величин хорошо виден на графике. |
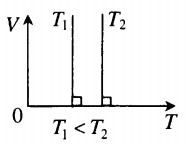
Изотерма в координатах (V;T) — прямая, перпендикулярная оси OT и параллельная оси OV. Чем ближе изотерма к оси OV, тем меньшей температуре она соответствует. С увеличением объема давление уменьшается. |
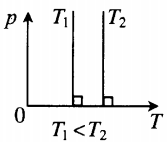
Изотерма в координатах (p;T) — прямая, перпендикулярная оси OT и параллельная оси Op. Чем ближе изотерма к оси Op, тем меньшей температуре она соответствует. С увеличением давления объем уменьшается. |
| Изохорный (график — изохора) | 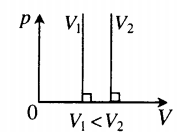
Изохора в координатах (p;V) — прямая, перпендикулярная оси OV и параллельная оси Op. Чем ближе изохора к оси Op, тем меньшему объему она соответствует. С увеличением давления увеличивается температура. |
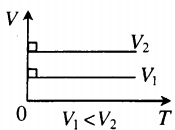
Изохора в координатах (V;T) — прямая, перпендикулярная оси OV и параллельная оси OT. Чем ближе изохора к оси OT, тем меньшему объему она соответствует. С увеличением температуры увеличивается давление. |
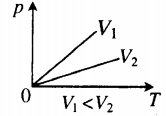
Изохора в координатах (p;T) — прямая, исходящая из начала координат. Чем меньше угол наклона изохоры к оси OT, тем меньшему объему она соответствует. Характер изменения переменных величин хорошо виден на графике. |
| Изобарный (график — изобара) | 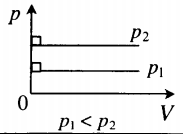
Изобара в координатах (p;V) — прямая, перпендикулярная оси Op и параллельная оси OV. Чем ближе изобара к оси OV, тем меньшему давлению она соответствует. С увеличением объема температура растет. |
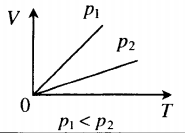
Изобара в координатах (V;T) — прямая, исходящая из начала координат. Чем меньше угол наклона изобары к оси OT, тем меньшему давлению она соответствует. Характер изменения переменных величин хорошо виден на графике. |

Изобара в координатах (p;T) — прямая, перпендикулярная оси Op и параллельная оси OT. Чем ближе изобара к оси OT, тем меньшему давлению она соответствует. С увеличением температуры объем растет. |
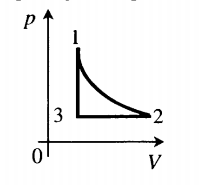
Пример №3. На рисунке представлен график циклического процесса. Вычертить его в координатах (p;T).
Определим характер изменения величин:
- Процесс 1–2. Гипербола — это изотерма. Следовательно T12 = const. В координатах (p;T) изотерма будет выглядеть как прямая, перпендикулярная оси OT.
- Процесс 2–3. Прямая линия, перпендикулярная оси Op — это изобара. Следовательно p23 = const. В координатах (p;T) изобара будет выглядеть как прямая, перпендикулярная оси Op.
- Процесс 3–1. Прямая линия, перпендикулярная оси OV — это изохора. Следовательно V31 = const. В координатах (p;T) изохора будет выглядеть как прямая, выходящая из начала координат.
Теперь, зная, какими будут графики всех величин в координатах (p;T), можно построить сам график. Он примет следующий вид:
Задание EF19012

Алгоритм решения
1.Указать, в каких координатах построен график.
2.На основании основного уравнения МКТ идеального газа и уравнения Менделеева — Клапейрона выяснить, как меняются указанные физические величины во время процессов 1–2 и 2–3.
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
T=2−Ek3
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
νR=p1V1T1=p2V2T2
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
Ответ:
• Участок 1–2 — изобарный процесс. Температура увеличивается, давление постоянно.
• Участок 2–3 — изотермический процесс. Температура постоянно, давление увеличивается.
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17615
1 моль идеального газа изохорно охлаждают на 200 К, при этом его давление уменьшается в 2 раза. Какова первоначальная абсолютная температура газа?
Ответ:
а) 600 К
б) 400 К
в) 350 К
г) 300 К
Алгоритм решения
1.Записать исходные данные.
2.Определить вид изопроцесса.
3.Выбрать и записать подходящий для данного изопроцесса газовый закон.
4.Выполнить решение в общем виде.
5.Вычислить искомую величину.
Решение
Запишем исходные данные:
• Изменение температуры ∆T = 200 К.
• Первоначальный объем p1 = 2p.
По условию задачи это изохорный процесс, следовательно он происходит в соответствии с законом Шарля:
p1T1=p2T2
Выразим конечную температуру и получим:
T2 = T1 – ∆T
Перепишем закон Шарля применительно к задаче и выразим первоначальную температуру:
2pT1=pT1−ΔT
2(T1−ΔT)=T1
2T1−T1=2ΔT
T1=2ΔT=2·200=400 (К)
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18859
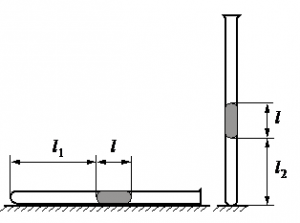
Алгоритм решения
1.Записать исходные данные и перевести единицы измерения физических величин в СИ.
2.Определить вид изопроцесса и записать для него газовый закон.
3.Выполнить решение в общем виде.
4.Вычислить искомую величину.
Решение
Запишем исходные данные:
• Длина столбика воздуха под столбиком ртути в первоначальном состоянии: l1 = 30,7 см.
• Длина столбика воздуха под столбиком ртути в конечном состоянии: l2 = 23,8 см.
• Атмосферное давление: pатм = 747 мм рт. ст.
30,7 см = 30,7∙10–2 м
23,8 см = 23,8∙10–2 м
1 мм рт. ст. = 133,322 Па
747 мм рт. ст. = 99,6∙103 Па
Плотность ртути равна: ρрт = 13,54∙103 кг/м3.
Так как процесс изменения состояния газа происходит при постоянной температуре, процесс можно считать изотермическим. Для него действует газовый закон Бойля — Мариотта:
p1V1 = p2V2
Первоначальное давление на столбик воздуха равно атмосферному давлению:
p1 = pатм
Конечное давление на столбик воздуха равно сумме атмосферного давления и давления, оказываемое силой тяжести столбика ртути:
p2=pатм+mртgS
S —площадь поперечного сечения трубки.
Масса ртути равна произведению плотности на объем столбика металла. Объем в свою очередь равен произведению длины столбика ртути на площадь поперечного сечения трубки. Поэтому:
p2=pатм+ρртVртgS=pатм+ρртlSgS=pатм+ρртlg
Первоначальный объем столбика воздуха равен произведению площади поперечного сечения трубки на высоту этого столбика:
V1 = Sl1
Конечный объем столбика воздуха равен произведению площади поперечного сечения трубки на высоту этого столбика:
V2 = Sl2
Выразив первоначальные и конечный величины, можем записать закон Бойля — Мариотта применительно к данной задаче:
pатмSl1=(pатм+ρртlg)Sl2
Преобразуем уравнение, выразим искомую величину и произведем вычисления:
pатмl1=pатмl2+ρртlgl2
ρртlgl2=pатмl1−pатмl2
l=pатм(l1−l2)ρртgl2
Ответ: 21,76
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18139
Паук-серебрянка медленно спускается на дно равномерно прогретого озера, неся между волосками брюшка пузырьки воздуха для своего подводного жилища. Какой процесс происходит с воздухом в пузырьках по мере погружения паука?
Ответ:
а) изобарное сжатие
б) изохорное нагревание
в) изотермическое сжатие
г) адиабатное сжатие
Алгоритм решения
- Установить, какие величины меняются по мере погружения пузырьков воздуха на глубину.
- Выяснить, какие величины сохраняются постоянными.
- Установить вид изопроцесса.
Решение
Когда паук спускается в воде на глубину, давление постепенно увеличивается. На пузырьки воздуха будет действовать сумма атмосферного давления и давления столба воды. Под действием этого давления пузырек будет сжиматься. То есть, давление будет уменьшаться. Но само давление воздуха в пузырьке при этом будет равно давлению, оказываемому на него со стороны внешней среды. Следовательно, давление в пузырьке будет увеличиваться. При условии, что количество вещества в пузырьке при этом не меняется, величина температуры также должна оставаться постоянной. Это следует из уравнения состояния идеального газа. Следовательно, воздух в пузырьках претерпевает изотермическое сжатие.
Ответ: в
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 11.7k
Изопроцессы в газах.
Изопроцессами называются процессы, протекающие при неизменном значении одного из параметров: давления (p), объема (V), температуры (T).
Изопроцессами в газах являются термодинамические процессы, на протяжении течения которых количество вещества и давление, объём, температура либо энтропия не поддаются изменениям. Таким образом, при изобарном процессе не изменяется давление, при изохорном — объём, при изотермическом — температура, при изоэнтропийном — энтропия (к примеру, обратимый адиабатический процесс). И линии, которые отображают перечисленные процессы на некой термодинамической диаграмме, называют, соответственно, изобара, изохора, изотерма и адиабата. Все эти изопроцессы являются частными случаями политропного процесса.
В идеальном газе эти процессы подчиняются газовым законам.
Газовыми законами называются количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра.
Изобарный процесс.
Изобарный (или изобарический) процесс — это изменение термодинамической системы с условием не изменения давления (P = const). Изобарой называют линию, которая отображает изобарический процесс на графике. Этот процесс описывает закон Гей-Люссака.
Изохорный процесс.
Изохорный (или изохорический) процесс — это изменение термодинамической системы с условием не изменения объема (V = const). Изохорой называют линию, которая отображает изохорический процесс на графике. Этот процесс описывает закон Шарля.
Изотермический процесс.
Изотермический процесс — это изменение термодинамической системы с условием не изменения температуры (T = const). Изотермой называют линию, которая отображает изотермический процесс на графике. Этот процесс описывает закон Бойля-Мариотта.
Изоэнтропийный процесс.
Изоэнтропийный процесс — это изменение термодинамической системы с условием не изменения энтропии (S = const). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:
где γ — показатель адиабаты, определяемый типом газа.
Изопроцессы
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: изопроцессы — изотермический, изохорный, изобарный процессы.
На протяжении этого листка мы будем придерживаться следующего предположения: масса и химический состав газа остаются неизменными. Иными словами, мы считаем, что:
• , то есть нет утечки газа из сосуда или, наоборот, притока газа в сосуд;
• , то есть частицы газа не испытывают каких-либо изменений (скажем, отсутствует диссоциация — распад молекул на атомы).
Эти два условия выполняются в очень многих физически интересных ситуациях (например, в простых моделях тепловых двигателей) и потому вполне заслуживают отдельного рассмотрения.
Если масса газа и его молярная масса фиксированы, то состояние газа определяется тремя макроскопическими параметрами: давлением, объёмом и температурой. Эти параметры связаны друг с другом уравнением состояния (уравнением Менделеева — Клапейрона).
Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры.
Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов.
1. Изотермический процесс идёт при постоянной температуре газа: .
2. Изобарный процесс идёт при постоянном давлении газа: .
3. Изохорный процесс идёт при постоянном объёме газа: .
Изопроцессы описываются очень простыми законами Бойля — Мариотта, Гей-Люссака и Шарля. Давайте перейдём к их изучению.
Изотермический процесс
Пусть идеальный газ совершает изотермический процесс при температуре . В ходе процесса меняются только давление газа и его объём.
Рассмотрим два произвольных состояния газа: в одном из них значения макроскопических параметров равны , а во втором — . Эти значения связаны уравнением Менделеева-Клапейрона:
Как мы сказали с самого начала,масса и молярная масса предполагаются неизменными.
Поэтому правые части выписанных уравнений равны. Следовательно, равны и левые части:
Поскольку два состояния газа были выбраны произвольно, мы можем заключить, что в ходе изотермического процесса произведение давления газа на его объём остаётся постоянным:
Данное утверждение называется законом Бойля — Мариотта.
Записав закон Бойля — Мариотта в виде
можно дать и такую формулировку: в изотермическом процессе давление газа обратно пропорционально его объёму. Если, например, при изотермическом расширении газа его объём увеличивается в три раза, то давление газа при этом в три раза уменьшается.
Как объяснить обратную зависимость давления от объёма с физической точки зрения? При постоянной температуре остаётся неизменной средняя кинетическая энергия молекул газа, то есть, попросту говоря, не меняется сила ударов молекул о стенки сосуда. При увеличении объёма концентрация молекул уменьшается, и соответственно уменьшается число ударов молекул в единицу времени на единицу площади стенки — давление газа падает. Наоборот, при уменьшении объёма концентрация молекул возрастает, их удары сыпятся чаще и давление газа увеличивается.
Графики изотермического процесса
Вообще, графики термодинамических процессов принято изображать в следующих системах координат:
• -диаграмма: ось абсцисс , ось ординат ;
• -диаграмма: ось абсцисс , ось ординат ;
• -диаграмма: ось абсцисс , ось ординат .
График изотермического процесса называется изотермой.
Изотерма на -диаграмме — это график обратно пропорциональной зависимости .
Такой график является гиперболой (вспомните алгебру — график функции ). Изотерма-гипербола изображена на рис. 1 .
Рис. 1. Изотерма на -диаграмме
Каждая изотерма отвечает определённому фиксированному значению температуры. Оказывается, что чем выше температура, тем выше лежит соответствующая изотерма на —диаграмме.
В самом деле, рассмотрим два изотермических процесса, совершаемых одним и тем же газом (рис. 2 ). Первый процесс идёт при температуре , второй — при температуре .
Рис. 2. Чем выше температура, тем выше изотерма
Фиксируем некоторое значение объёма . На первой изотерме ему отвечает давление , на второй — p_1′ alt=’p_2 > p_1′ /> . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, T_1′ alt=’T_2 > T_1′ /> .
В оставшихся двух системах координат изотерма выглядит очень просто: это прямая, перпендикулярная оси (рис. 3 ):
Рис. 3. Изотермы на и -диаграммах
Изобарный процесс
Напомним ещё раз, что изобарный процесс — это процесс, проходящий при постоянном давлении. В ходе изобарного процесса меняются лишь объём газа и его температура.
Типичный пример изобарного процесса: газ находится под массивным поршнем, который может свободно перемещаться. Если масса поршня и поперечное сечение поршня , то давление газа всё время постоянно и равно
где — атмосферное давление.
Пусть идеальный газ совершает изобарный процесс при давлении . Снова рассмотрим два произвольных состояния газа; на этот раз значения макроскопических параметров будут равны и .
Выпишем уравнения состояния:
Поделив их друг на друга, получим:
В принципе, уже и этого могло бы быть достаточно, но мы пойдём немного дальше. Перепишем полученное соотношение так, чтобы в одной части фигурировали только параметры первого состояния, а в другой части — только параметры второго состояния (иными словами, «разнесём индексы» по разным частям):
А отсюда теперь — ввиду произвольности выбора состояний! — получаем закон Гей-Люссака:
Иными словами, при постоянном давлении газа его объём прямо пропорционален температуре:
Почему объём растёт с ростом температуры? При повышении температуры молекулы начинают бить сильнее и приподнимают поршень. При этом концентрация молекул падает, удары становятся реже, так что в итоге давление сохраняет прежнее значение.
Графики изобарного процесса
График изобарного процесса называется изобарой. На -диаграмме изобара является прямой линией (рис. 4 ):
Рис. 4. Изобара на -диаграмме
Пунктирный участок графика означает, что в случае реального газа при достаточно низких температурах модель идеального газа (а вместе с ней и закон Гей-Люссака) перестаёт работать. В самом деле, при снижении температуры частицы газа двигаются всё медленнее, и силы межмолекулярного взаимодействия оказывают всё более существенное влияние на их движение (аналогия: медленный мяч легче поймать, чем быстрый). Ну а при совсем уж низких температурах газы и вовсе превращаются в жидкости.
Разберёмся теперь, как меняется положение изобары при изменении давления. Оказывается, что чем больше давление, тем ниже идёт изобара на —диаграмме.
Чтобы убедиться в этом, рассмотрим две изобары с давлениями и (рис. 5 ):
Рис. 5. Чем ниже изобара, тем больше давление
Зафиксируем некоторое значение температуры . Мы видим, что . Но при фиксированной температуре объём тем меньше, чем больше давление (закон Бойля — Мариотта!).
Стало быть, p_1′ alt=’p_2 > p_1′ /> .
В оставшихся двух системах координат изобара является прямой линией, перпендикулярной оси (рис. 6 ):
Рис. 6. Изобары на и -диаграммах
Изохорный процесс
Изохорный процесс, напомним, — это процесс, проходящий при постоянном объёме. При изохорном процессе меняются только давление газа и его температура.
Изохорный процесс представить себе очень просто: это процесс, идущий в жёстком сосуде фиксированного объёма (или в цилиндре под поршнем, когда поршень закреплён).
Пусть идеальный газ совершает изохорный процесс в сосуде объёмом . Опять-таки рассмотрим два произвольных состояния газа с параметрами и . Имеем:
Делим эти уравнения друг на друга:
Как и при выводе закона Гей-Люссака, «разносим» индексы в разные части:
Ввиду произвольности выбора состояний мы приходим к закону Шарля:
Иными словами, при постоянном объёме газа его давление прямо пропорционально температуре:
Увеличение давления газа фиксированного объёма при его нагревании — вещь совершенно очевидная с физической точки зрения. Вы сами легко это объясните.
Графики изохорного процесса
График изохорного процесса называется изохорой. На -диаграмме изохора является прямой линией (рис. 7 ):
Рис. 7. Изохора на -диаграмме
Смысл пунктирного участка тот же: неадекватность модели идеального газа при низких температурах.
Далее, чем больше объём, тем ниже идёт изохора на —диаграмме (рис. 8 ):
Рис. 8. Чем ниже изохора, тем больше объём
Доказательство аналогично предыдущему. Фиксируем температуру и видим, что . Но при фиксированной температуре давление тем меньше, чем больше объём (снова закон Бойля — Мариотта). Стало быть, V_1′ alt=’V_2 > V_1′ /> .
В оставшихся двух системах координат изохора является прямой линией, перпендикулярной оси (рис. 9 ):
Рис. 9. Изохоры на и -диаграммах
Законы Бойля — Мариотта, Гей-Люссака и Шарля называются также газовыми законами.
Мы вывели газовые законы из уравнения Менделеева — Клапейрона. Но исторически всё было наоборот: газовые законы были установлены экспериментально, и намного раньше. Уравнение состояния появилось впоследствии как их обобщение.
Уравнения изотермы изохоры изобары и изотермы
ЛЕКЦИЯ № 5. Химическое равновесие
1. Понятие химического равновесия. Закон действующих масс
При протекании химической реакции через некоторое время устанавливается химическое равновесие. Существует два признака химического равновесия: кинетический, термодинамический. В кинетическом – ?пр = ?обр, в термодинамическом – характеризует химическую реакцию при условиях P, t – const (?G = 0); при условиях V, Т – const (?F = 0).
Химический потенциал – функция, которая характеризует состояние i-го компонента при определенных внешних условиях.
где n1 – число молей i-го компонента.
Если к бесконечно большому количеству раствора прибавить определенное количество какого-нибудь компонента, то химический потенциал системы определяется изменением изобарного потенциала при изобарных условиях или изменением изохорного потенциала при изохорных условиях.
Химический потенциал зависит от концентрации данного компонента
где Рi– парциальное давление – вклад каждого компонента в общее давление или давление, которое компонент имел бы, если бы находился в смеси.
Парциальное давление – элементарная функция (можно складывать). Пример (O2, N2, H2) – их общее давление
?0– значение химического потенциала при стандартных условиях.
Химический потенциал характеризует способность данного компонента выходить из данной фазы путем испарения, растворения, кристаллизации и т. д. Переход этот происходит произвольно.
В результате химического равновесия скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается.
Концентрации, которые соответствуют химическому равновесию, называются равновесными концентрациями. Связь между равновесными концентрациями устанавливается законом действующих масс (ЗДМ). Этот закон в 1867 г. вывели К. М. Гульберг и П. Вааге.
Кинетический вывод ЗДМ
f – фугитивность – парциальное давление для реальных газов. Возникает вопрос, будут ли равняться Кpи Кс.
Кpи Кc– отличаются на RT ?vi в сумме стехиометрических коэффициентов.
если ?vi = 0, то Kp = Kc. ?vi = 1 + 1 – 1 – 1 =0 – когда стехиометрический коэффициент = 1.
2. Уравнение изотермы химической реакции
Если реакция протекает обратимо, то ?G= 0.
Если реакция протекает необратимо, то ?G? 0 и можно рассчитать изменение ?G.
где ? – пробег реакции – величина, которая показывает, сколько молей изменилось в ходе реакции. I сп – характеризует равновесное и неравновесное состояние реакции, II сп – характеризует только неравновесные состояния.
это уравнение изотермы химической реакции.
С помощью уравнения изотермы химической реакции можно судить о направлении протекания реакции.
3. Уравнения изохоры, изобары химической реакции
Зависимость К от температуры
По ним судят о направлении протекания реакции:
4. Расчет KP (метод Темкина-Шварцмана)
термодинамический метод расчета Kp.
Пример. Расчет Kp для реакции PbS04 распадается на РbО и S03.
Результаты вычислений занесены в таблицу 2.
5. Расчет равновесного состава химического равновесия
Равновесный состав можно рассчитать только для газовой системы
Исходная концентрация всех компонентов
Изменение каждого компонента по числу молей (или стехиометрическому коэффициенту):
??– (пробег реакции) – химическая переменная.
Она показывает изменение количества вещества по числу молей. Если реакция не началась, то ?? = 0. Если количество исходных веществ превратилось в такое же количество продуктов реакции, то ?? = 1.
Рассчитать равновесный состав по третьему компоненту при условии, что А = а моль/л; В = в моль/л.
Рассчитываем по 4 компоненту:
Газообразные вещества реагируют по уравнению:
Найти парциальное давление каждого компонента.
Вещества А и В превращаются в С в количестве Х. Исходные вещества А= 2 моль, В= 1 моль.
Для того, чтобы найти парциальное давление, мы должны Роб умножить на мольную долю. Мольная доля определяется отношением числа молей каждого компонента, отнесенного к общему числу молей всех компонентов.
где En – общее число молей, участвующих в этой газовой смеси.
где РА – парциальное давление.
http://ege-study.ru/ru/ege/materialy/fizika/izoprocessy/
http://nnre.ru/fizika/fizicheskaja_himija_konspekt_lekcii/p6.php