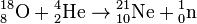From Wikipedia, the free encyclopedia
|
||||||||||||||||
| Standard atomic weight Ar°(Ne) | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||
|
The abundances of the naturally occurring isotopes of neon
Neon (10Ne) possesses three stable isotopes: 20
Ne
, 21
Ne
, and 22
Ne
. In addition, 17 radioactive isotopes have been discovered, ranging from 15
Ne
to 34
Ne
, all short-lived. The longest-lived is 24
Ne
with a half-life of 3.38(2) min. All others are under a minute, most under a second. The least stable is 15
Ne
with a half-life of 770(300) ys (7.7(3.0)×10−22 s). See isotopes of carbon for notes about the measurement. Light radioactive neon isotopes usually decay to fluorine or oxygen, while heavier ones decay to sodium.
List of isotopes[edit]
| Nuclide[4] [n 1] |
Z | N | Isotopic mass (Da)[5] [n 2][n 3] |
Half-life
[resonance width] |
Decay mode [n 4] |
Daughter isotope [n 5] |
Spin and parity [n 6] |
Natural abundance (mole fraction) | |
|---|---|---|---|---|---|---|---|---|---|
| Excitation energy | Normal proportion | Range of variation | |||||||
| 15 Ne [6] |
10 | 5 | 15.043170(70) | 770(300) ys [590(230) keV] |
2p | 13 O |
(3/2−) | ||
| 16 Ne |
10 | 6 | 16.025751(22) | > 5.7 zs [< 80 keV] |
2p | 14 O |
0+ | ||
| 17 Ne [n 7] |
10 | 7 | 17.0177140(4) | 109.2(6) ms | β+p (94.4(2.9)%) | 16 O |
1/2− | ||
| β+α (3.51(1)%) | 13 N |
||||||||
| β+ (2.1(2.9)%) | 17 F |
||||||||
| β+pα (0.014(4)%) | 12 C |
||||||||
| 18 Ne |
10 | 8 | 18.0057087(4) | 1664.20(47) ms | β+ | 18 F |
0+ | ||
| 19 Ne |
10 | 9 | 19.00188091(17) | 17.2569(19) s | β+ | 19 F |
1/2+ | ||
| 20 Ne |
10 | 10 | 19.9924401753(16) | Stable | 0+ | 0.9048(3) | [0.8847, 0.9051][7] | ||
| 21 Ne |
10 | 11 | 20.99384669(4) | Stable | 3/2+ | 0.0027(1) | [0.0027, 0.0171][7] | ||
| 22 Ne |
10 | 12 | 21.991385114(19) | Stable | 0+ | 0.0925(3) | [0.0920, 0.0996][7] | ||
| 23 Ne |
10 | 13 | 22.99446691(11) | 37.15(3) s | β− | 23 Na |
5/2+ | ||
| 24 Ne |
10 | 14 | 23.9936106(6) | 3.38(2) min | β− | 24m Na |
0+ | ||
| 25 Ne |
10 | 15 | 24.997810(30) | 602(8) ms | β− | 25 Na |
1/2+ | ||
| 26 Ne |
10 | 16 | 26.000516(20) | 197(2) ms | β− (99.87(3)%) | 26 Na |
0+ | ||
| β−n (0.13(3)%) | 25 Na |
||||||||
| 27 Ne |
10 | 17 | 27.007570(100) | 30.9(1.1) ms | β− (98.0(5)%) | 27 Na |
(3/2+) | ||
| β−n (2.0(5)%) | 26 Na |
||||||||
| β−2n ?[n 8] | 25 Na ? |
||||||||
| 28 Ne |
10 | 18 | 28.012130(140) | 18.8(2) ms | β− (84.3(1.1)%) | 28 Na |
0+ | ||
| β−n (12(1)%) | 27 Na |
||||||||
| β−2n (3.7(5)%) | 26 Na |
||||||||
| 29 Ne |
10 | 19 | 29.019750(160) | 14.7(4) ms | β− (68.0(5.1)%) | 29 Na |
(3/2−) | ||
| β−n (28(5)%) | 28 Na |
||||||||
| β−2n (4(1)%) | 27 Na |
||||||||
| 30 Ne |
10 | 20 | 30.024990(270) | 7.22(18) ms | β− (78.1(4.6)%) | 30 Na |
0+ | ||
| β−n (13(4)%) | 29 Na |
||||||||
| β−2n (8.9(2.3)%) | 28 Na |
||||||||
| 31 Ne |
10 | 21 | 31.033470(290) | 3.4(8) ms | β− | 31 Na |
(3/2−) | ||
| β−n ?[n 8] | 30 Na ? |
||||||||
| β−2n ?[n 8] | 29 Na ? |
||||||||
| 32 Ne |
10 | 22 | 32.039720(540)# | 3.5(9) ms | β− | 32 Na |
0+ | ||
| β−n ?[n 8] | 31 Na ? |
||||||||
| β−2n ?[n 8] | 30 Na ? |
||||||||
| 33 Ne ?[n 9] |
10 | 23 | 33.049520(640)# | < 260 ns | n ?[n 8] | 32 Ne |
7/2−# | ||
| 34 Ne |
10 | 24 | 34.056730(550)# | 2 ms# [> 1.5 μs] | β− ?[n 8] | 34 Na |
0+ | ||
| β−2n ?[n 8] | 32 Ne ? |
||||||||
| β−n ?[n 8] | 33 Ne ? |
||||||||
This table header & footer:
|
- ^ mNe – Excited nuclear isomer.
- ^ ( ) – Uncertainty (1σ) is given in concise form in parentheses after the corresponding last digits.
- ^ # – Atomic mass marked #: value and uncertainty derived not from purely experimental data, but at least partly from trends from the Mass Surface (TMS).
- ^
Modes of decay:
- ^ Bold symbol as daughter – Daughter product is stable.
- ^ ( ) spin value – Indicates spin with weak assignment arguments.
- ^ Has 2 halo protons.
- ^ a b c d e f g h i Decay mode shown is energetically allowed, but has not been experimentally observed to occur in this nuclide.
- ^ This isotope has not yet been observed; given data is inferred or estimated from periodic trends.
- The isotopic composition refers to that in air.
References[edit]
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). «The NUBASE2020 evaluation of nuclear properties» (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ «Standard Atomic Weights: Neon». CIAAW. 1985.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; et al. (2022-05-04). «Standard atomic weights of the elements 2021 (IUPAC Technical Report)». Pure and Applied Chemistry. doi:10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ Half-life, decay mode, nuclear spin, and isotopic composition is sourced in:
Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). «The NUBASE2020 evaluation of nuclear properties» (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae. - ^ Wang, Meng; Huang, W.J.; Kondev, F.G.; Audi, G.; Naimi, S. (2021). «The AME 2020 atomic mass evaluation (II). Tables, graphs and references*». Chinese Physics C. 45 (3): 030003. doi:10.1088/1674-1137/abddaf.
- ^ Wamers, F.; Marganiec, J.; Aksouh, F.; Aksyutina, Yu.; Álvarez-Pol, H.; Aumann, T.; Beceiro-Novo, S.; Boretzky, K.; Borge, M. J. G.; Chartier, M.; Chatillon, A.; Chulkov, L. V.; Cortina-Gil, D.; Emling, H.; Ershova, O.; Fraile, L. M.; Fynbo, H. O. U.; Galaviz, D.; Geissel, H.; Heil, M.; Hoffmann, D. H. H.; Johansson, H. T.; Jonson, B.; Karagiannis, C.; Kiselev, O. A.; Kratz, J. V.; Kulessa, R.; Kurz, N.; Langer, C.; Lantz, M.; Le Bleis, T.; Lemmon, R.; Litvinov, Yu. A.; Mahata, K.; Müntz, C.; Nilsson, T.; Nociforo, C.; Nyman, G.; Ott, W.; Panin, V.; Paschalis, S.; Perea, A.; Plag, R.; Reifarth, R.; Richter, A.; Rodriguez-Tajes, C.; Rossi, D.; Riisager, K.; Savran, D.; Schrieder, G.; Simon, H.; Stroth, J.; Sümmerer, K.; Tengblad, O.; Weick, H.; Wimmer, C.; Zhukov, M. V. (4 April 2014). «First Observation of the Unbound Nucleus 15Ne» (PDF). Physical Review Letters. 112 (13): 132502. doi:10.1103/PhysRevLett.112.132502. PMID 24745409 – via APS.
- ^ a b c Meija, Juris; Coplen, Tyler B.; Berglund, Michael; Brand, Willi A.; Bièvre, Paul De; Gröning, Manfred; Holden, Norman E.; Irrgeher, Johanna; Loss, Robert D.; Walczyk, Thomas; Prohaska, Thomas (2016-03-01). «Isotopic compositions of the elements 2013 (IUPAC Technical Report)». Pure and Applied Chemistry. 88 (3): 293–306. doi:10.1515/pac-2015-0503. ISSN 1365-3075. S2CID 104472050.
Изотопы неона
Материал из Большого Справочника
Изото́пы нео́на — разновидности атомов (и ядер) химического элемента неона, имеющие разное содержание нейтронов в ядре. Существует три стабильных нуклида неона: 20Ne (изотопная распространённость 90,48 %), 21Ne (0,27 %) и 22Ne (9,25 %)[1]. Повсеместно преобладает легкий 20Ne.
Во многих альфа-активных минералах относительное содержание тяжёлых 21Ne и 22Ne в десятки и сотни раз больше содержания их в воздухе. Это вызвано тем, что основными механизмами образования этих изотопов являются ядерные реакции, происходящие при бомбардировке ядер алюминия, натрия, магния и кремния продуктами распада ядер тяжёлых элементов. Кроме того, подобные реакции происходят в земной коре и атмосфере под воздействием космического излучения. Так, например, при бомбардировке нейтронами нуклидов магния 24Mg и 25Mg получаются нуклиды неона 21Ne и 22Ne, соответственно[источник не указан 3252 дня]:


Зафиксирован также ряд малопродуктивных ядерных реакций[2], при которых образуются 21Ne и 22Ne — это захват альфа-частиц ядрами тяжёлого кислорода 18О и фтора 19F:


Источник преобладающего на Земле лёгкого нуклида 20Ne до сих пор не установлен.
Считается, что в космическом пространстве неон также преимущественно представлен лёгким нуклидом 20Ne. В метеоритах обнаруживают немало 21Ne и 22Ne, но эти нуклиды предположительно образуются в самих метеоритах под воздействием космических лучей за время странствий во Вселенной.
Кроме трёх стабильных нуклидов неона, известны ещё как минимум шестнадцать нестабильных.
Таблица изотопов неона
| Символ нуклида |
Z(p) | N(n) | Масса изотопа[3] (а. е. м.) |
Избыток массы[3] (кэВ) |
Период полураспада[4] (T1/2) |
Спин и чётность ядра[4] |
Распространённость изотопа в природе[4] (%) |
|---|---|---|---|---|---|---|---|
| 16Ne | 10 | 6 | 16,025761(22) | 23996(20) | 9 зс | 0+ | |
| 17Ne | 10 | 7 | 17,017672(29) | 16461(27) | 109,2(6) мс | 1/2− | |
| 18Ne | 10 | 8 | 18,0057082(3) | 5317,17(28) | 1,672(8) с | 0+ | |
| 19Ne | 10 | 9 | 19,0018802(3) | 1751,44(29) | 17,296(5) с | 1/2+ | |
| 20Ne | 10 | 10 | 19,9924401754(19) | -7041,9313(18) | стабилен | 0+ | 90,48(3) |
| 21Ne | 10 | 11 | 20,99384668(4) | -5731,78(4) | стабилен | 3/2+ | 0,27(1) |
| 22Ne | 10 | 12 | 21,991385114(19) | -8024,715(18) | стабилен | 0+ | 9,25(3) |
| 23Ne | 10 | 13 | 22,99446690(11) | -5154,05(10) | 37,24(12) с | 5/2+ | |
| 24Ne | 10 | 14 | 23,9936108(4) | -5951,5(4) | 3,38(2) мин | 0+ | |
| 25Ne | 10 | 15 | 24,997737(28) | -2108(26) | 602(8) мс | (3/2)+ | |
| 26Ne | 10 | 16 | 26,000461(29) | 430(27) | 197(1) мс | 0+ | |
| 27Ne | 10 | 17 | 27,007590(120) | 7070(110) | 32(2) мс | 3/2+# | |
| 28Ne | 10 | 18 | 28,012070(160) | 11240(150) | 18,3(22) мс | 0+ | |
| 29Ne | 10 | 19 | 29,019390(290) | 18060(270) | 15,6(5) мс | 3/2+# | |
| 30Ne | 10 | 20 | 30,024800(610) | 23100(570) | 5,8(2) мс | 0+ | |
| 31Ne | 10 | 21 | 31,033110(970)# | 30840(900)# | 3,4(8) мс | 7/2−# | |
| 32Ne | 10 | 22 | 32,040020(860)# | 37280(800)# | 3,5(9) мс | 0+ | |
| 33Ne | 10 | 23 | 33,049380(860)# | 46000(800)# | < 260 нс | 7/2−# | |
| 34Ne | 10 | 24 | 34,057030(870)# | 53120(810)# | 1# мс | 0+ |
Пояснения к таблице
- Распространённость изотопов приведена для земной атмосферы. Для других источников значения могут сильно отличаться.
- Значения, помеченные решёткой (#), получены не из одних лишь экспериментальных данных, а (хотя бы частично) оценены из систематических трендов у соседних нуклидов (с такими же соотношениями Z и N). Неуверенно определённые значения спина и/или его чётности заключены в скобки.
- Погрешность приводится в виде числа в скобках, выраженного в единицах последней значащей цифры, означает одно стандартное отклонение (за исключением распространённости и стандартной атомной массы изотопа по данным ИЮПАК, для которых используется более сложное определение погрешности). Примеры: 29770,6(5) означает 29770,6 ± 0,5; 21,48(15) означает 21,48 ± 0,15; −2200,2(18) означает −2200,2 ± 1,8.
Примечания
- ↑ Isotopes of neon (англ.). www.webelements.com. Проверено 8 июля 2009.
- ↑ Финкельштейн Д.Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 83. — 200 с. — («Наука и технический прогресс»). — 19 000 экз. Архивировано 5 сентября 2012 года.
- ↑ 1 2 Данные приведены по Audi G., Wapstra A. H., Thibault C. The AME2003 atomic mass evaluation (II). Tables, graphs, and references (англ.) // Nuclear Physics A. — 2003. — Vol. 729. — P. 337—676. — DOI:10.1016/j.nuclphysa.2003.11.003. — Bibcode: 2003NuPhA.729..337A.
- ↑ 1 2 3 Данные приведены по Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — DOI:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729….3A.
-
ГДЗ
- /
⭐️ 10 класс ⭐️
- /
Физика 👍
- /
сборник задач Рымкевич 10 и 11 класс
- /
1205
Автор: А.П. Рымкевич.
Издательство:
Дрофа 2016
Тип: Задачник
Подробный решебник (ГДЗ) по Физике за 10‐11 (десятый‐одиннадцатый) класс задачник — готовый ответ номер — 1205. Авторы учебника: Рымкевич. Издательство: Дрофа 2016.
Условие /
номер / 1205
1205. Каков состав изотопов неона 20(10)Ne, 21(10)Ne и 22(10)Ne
Решебник №1 / номер / 1205
Видеорешение / номер / 1205
Решебник №2 / номер / 1205
Другие номера из решебника
Оцените решебник:
4.4/5
387
| Таблица У,5. Изотопы неона |  |
Различные изотопы данного элемента имеют одинаковые заряды ядер, но разные массовые числа. Следовательно, в ядрах различных изотопов содержится одинаковое число протонов, но различное число нейтронов. У неона-20, неона-21 и неона-22 по 10 протонов в ядре, порядковый номер всех этих изотопов 10, и электроны распределены по оболочкам так 2, 8. Однако в ядре неона-20 содержится 10 протонов плюс 10 нейтронов, в ядре неона-21 —10 протонов плюс 11 нейтронов, а в ядре неона-22—10 протонов плюс [c.168]
В результате бомбардировки изотопа неона Ке некоторыми частицами образуются изотоп фтора и а-ча-стица. Определите бомбардирующую частицу. Ответ хр. [c.106]
В 1%4 Г. группой ученых под руководством Г. Н. Флерова был получен изотоп 104-го элемента при облучении в мощном ускорителе плутония-242 (2=94) ядрами неона-22 (2=10) [c.47]
Природный неон состоит из трех стабильных изотопов Ые, и -2Ые. [c.496]
В звездах другого типа и возраста при температурах выше 150 млн. градусов протекают термоядерные реакции гелия с образованием устойчивых изотопов углерода, кислорода, неона, магния, серы, аргона, кальция и др. [c.665]
Элемент неон, обнаруженный в земной атмосфере, присутствует в ней в концентрации примерно 1 часть на 65 ООО. Все три его природных изотопа одинаково применимы в неоновых огнях и других случаях применений неона. Данные об этих изотопах приведены в табл. У.5. Как вы считаете, будет ли молярная масса неона ближе к 20, 21 или 22 Почему Рассчитайте молярную массу неона. [c.317]
Предметом ядерной химии являются реакции, в которых происходит превращение элементов, т. е. изменение ядер их атомов. Самопроизвольный распад радиоактивных атомов, рассмотренный выше, представляет собой ядерную реакцию, в которой исходным является одно ядро. Известны и другие реакции, в которых с ядром реагируют протон р, дейтрон (ядро атома дейтерия Н) й, альфа-частица а, нейтрон п или фотон у (обычно гамма-лучи). Удалось вызвать атомные превращения и под действием очень быстрых электронов. Вместо а-частиц (ядер Не) иногда используют ядра более легкого изотопа гелия Не. В последнее время все шире применяют для бомбардировки атомных ядер ускоренные ядра более тяжелых элементов вплоть до неона. [c.581]
Изотоп Масса Содержание в природном неоне, % [c.317]
Методы низкотемпературной ректификации (см. разд. 5.3.1) обычно применяют для разделения смесей изотопов Н—О, В— В, —а также изотопов инертных газов — гелия, неона и аргона. [c.222]
Там же путем бомбардировки урана ядрами неона был получен изотоп элемента № 102 с массовым числом 256. Таким образом, в настоящее время вопрос о приоритете в открытии элемента № 102 окончательно не решен. [c.449]
Относительная атомная масса неона равна 20,2. Неон состоит из двух изотопов «N6 и Г 1е. Рассчитайте молярную долю каждого изотопа в природном неоне. Ответ 90% Ме и 10% = N6. [c.26]
Бомбардировкой америция в Аш ядрами неона в Дубне (1967) были получены два изотопа 105-го элемента с массовыми числами 260 и 261. Напишите два соответствующих уравнения и определите число нейтронов, которые выбрасываются в каждом случае. Ответ-. 5п 4п. [c.108]
Среднюю атомную массу неона вычисляют следующим образом чтобы найти полную массу каждого обнаруженного изотопа, умножим относительный вклад (высоту пика) на массовое число — [c.18]
Если имеется несколько изотопов, то находят среднюю молекулярную массу и относительную молекулярную массу (разд. 3.3), как в примере с неоном. Некоторые большие молекулы (например, полимеры) при ионизации распадаются на фрагменты и не дают собственных молекулярных ионов (разд. 34.9.5). Идентификация соединений. Получают масс-спектр и вводят данные о высоте пиков и значениях т/е в ЭВМ, которая сравнивает спектр исследуемого соединения со спектрами в банке данных и таким образом идентифицирует соединения. [c.19]
Природный неон состоит из 90% изотопа «Ме и 10% изотопа 2 Ке. Вычислить средний атомный вес неона. [c.102]
Метод использован для разделения изотопов неона, водорода, ар го на, азота и углерода (в виде метана) и др. [c.78]
Преимуществом таких колонн является их конструктивная простота. Именно с помощью такого типа колонн в 1938 г. К. Клу-зиусу и Г. Диккелю [72] впервые удалось применить принцип противотока к термодиффузионному разделению смесей водорода и углекислого газа, гелия и брома для концентрирования кислорода в воздухе, тяжелого изотопа N6 в обычном неоне, изотопа С1 в хлористом водороде. В последующих опытах [2, 3], используя систему колонн общей длиной около 36 м, авторы достигли очень хорошего разделения Н С] и Н С1 друг от друга в обычном хлористом водороде (в верху колонны — 96% Н С1, в низу колонны — 99,4% Н С1). Полученная в их опытах величина фактора разделения ( 4000) позволила оценить значение [c.297]
Открытие масс-спектра относится примерно к 1914 г., когда Дж. Дж. Томсоном при исследовании положительных (каналовых) лучей было обнаружено, что вновь открытый элемент — неон — должен состоять из двух элементов, одного с атомным весом 20 и другого с атомным весом 22. Спустя шесть лет Астоном был создан масс-спектрограф и было доказано, что обычный неон действительно состоит из двух изотопов. Это открытие полои нло начало интенсивной работе, которая в конце концов привела к измерению масс изотопов всех устойчивых элементов и к установленшо физической шкалы атомных весов. [c.335]
В 1964 г. группа учеи1> х, возглавлявшаяся академиком Г. Н. Флеровым, бомбардируя изотоп плутония «мРи ядрами неона 1Ме, получила изотоп элемента 104, названного кирчатовивм 1Ки) [c.112]
Окончательные выражения для вириальных коэффициентов даны в трех формах. Квантовомеханическая форма является совершенно общей, но она не очень удобна для практических вычислений. Такие выражения используются только для очень легких газов (изотопы гелия или водорода) при очень низких температурах. Форма классического приближения более удобна для вычислений и применима почти ко всем обычным газам. Область между этими двумя формами может быть заполнена полуклассическим приближением, представляющим собой разложение в ряд по степеням постоянной Планка. Эта полуклассиче-ская форма необходима для гелия или водорода при промежуточных температурах и, возможно, для неона при низких температурах. Полуклассическое приближение позволяет также оценить влияние квантовых эффектов на вириальные коэффициенты. [c.24]
Легкие частицы имеют скорости больше, чем тяжелые, и чаще сталкиваются с пористой диафрагмой (мембраной), что способствует их предпочтительному проникновению. Чтобы обеспечить режим кнудсеновской диффузии, диаметр отверстий в диафрагме должен быть меньиле десятой части среднего свободного пробега молекул. Таким образом, метод газовой диффузии основан на различии кинетических свойств разделяемых газов. Этот метод был впервые применен в 1932 г. для разделения изотопов неона. В настоящее время метод широко применяется для разделения изотопов урана 235 и 238 (р / = 1,0043), который предварительно превращают в газообразный гексафторид урана, сублимирующий при 56 °С. [c.239]
Эти газы, а также криптон и ксенон получают из воздуха путем его разделения при глубоком охлаждении. Аргон, в связи с его сравнительно высоким содержанием в воздухе, получают в значительных количествах, остальные газы — в меньших. Аргон в природе образуется в результате ядерной реакции из изотопа jgK. Неон и аргон имеют широкое применение. Как тот, так и другой применяются для заполнения ламп накаливания. Кроме того, ими заполняют газосветные трубки для неона характерно красное свечение, для аргона — синеголубое. Аргон как наиболее доступный из благородных газов применяется также в металлургических и химических процессах, требующих инертной среды. Так металлы Li, Be, Ti, Та в процессе их получения реагируют со всеми газами, кроме благородных. Используя аргон в качестве защитной атмосферы от вредного вляния кислорода, азота и других газов проводят аргонно-дуговую сварку нержавеющих сталей, титана, алюминиевых и алюн <ниево-магниевых сплавов. Сварной шов при этом получается исключительно чистый и прочный. [c.493]
НЕОН (Neon, от греч.— новый) Ne — химический элемент VIII группы 2-го периода периодической системы элемен тов Д. И. Менделеева, п. н. 10, ат. м 20,179, относится к инертным газам Открыт в 1898 г. У. Рамзаем и М. Тра версом. Природный Н. состоит из 3 ста бильных изотопов, известны 5 радио активных изотопов. Н.— одноатомный газ, не вступает в обычные химические реакции. Получен гидрат Ne oHjO и некоторые другие соединения, в которых связь осуществляется молекулярными силами. В промышленности Н. получают из воздуха. Н. применяется в электротехнике для наполнения ламп накаливания, газосветных и сигнальных ламп. Для Н, характерно красное свечение. Н. применяют также в различных электронных приборах, в вакуумной технике. [c.172]
Изотоп нильсборий-261 был получен при бомбардировке ядра америция-243 ядрами неона-22, а изотоп ннльсбо-рий-260 — при бомбардировке ядра калифорния-249 ядрами азота-15 (второй продукт — нейтроны). Составьте уравнения этих ядерных реакций. Рассмотрите возможную электронную формулу ато а нильсбория и обоснуйте проявление им максимальной (для элементов VB группы) степени окисления. Будет ли высший хлорид нильсбория более или менее летучим, чем высшие хлориды ниобия и тантала [c.135]
Элементы гелий Не, неон Ne, аргон Аг, криптон Кг, ксенон Хе и радон Rn составляют VIUA группу Периодической системы. Элемент радон — радиоактивный, наиболее долгоживущий изотоп имеет период полураспада, равный 3,824 сут. [c.224]
Как было установлено впоследствии, аа исключением гелия, все благородные газы имеют изотопы. Неон был первым иерадиоактипным элементом, ДЛЯ которого Дж. Дж, Томсон в 1913 г. установил существование изотопов с атомными массами 20 и 22. В 1920 г. Ф. Лстон показал, что аргон состоит из двух изотопов с массовыми числами 40 и 36 криптон 80, 82, 83, 86 ксенон 128, 130, 131, 133, 135. [c.282]
Элемент был назван менделевием (М(1) в честь выдающихся заслуг Д. И. Менделеева в создании и развитии периодической системы элементов. Несмотря на исчезающе малое количество нового элемента, удалось хроматографически отделить его от других продуктов. Известны шесть изотопов менделевия с массовыми числами 252, 254—258. Самый долгоживущий вМс (7 1/2=56 дней), а наиболее доступен 2 М(1 (Т 1,2=75 мин), который получают бомбардировкой урана ядрами неона [c.448]
Распространение в природе. Инертные элементы полиизотопньг. Например, у криптона 6, а у радона даже 16 радиоактивных изотопов. Содержание благородных газов в воздухе соетавляет от 0,932% (об.) аргона до 10 % (об.) ксенона. В литосфере также в наибольших количествах содержится аргон [3,5-10 1% (мае.)], несколько меньше гелия и неона [8—5-10 % (мае.)], еще меньше криптона и ксенона [1,9-10 и 2,9″ % (мае.)]. Минимально содержание в земной коре радона 4-10 1 % (мае.). Промышленные месторождения гелия обычно сопровождают в недрах Земли залегания природных газов некоторые из них содержат до 8% (об.) гелия. [c.402]
Для разделения водорода и дейтерия, а также изотопов инертных газов — гелия, неона и аргона — до настоящего врелшни применяют метод низкотемпературной ректификации (см. главу. 5.31). Используя некоторое различие в упругостях паров сж1г-/кенных газов, посредством низкотемпературной ректификации можно получить значительное обогащение. В табл. 41 приведены [c.247]
При помощи этого метода удалось обнаружить, что обычный неон (ат. масса 20,2) образует параболы, отвечающие массам 20 и 22. Работа эта была первой, давшей экспериментальные указания на суш,ествование изотопии нерадиоактивных элементов. Однако в течение нескольких последующих лет она, остваясь единственной, не привлекла к себе особого внимания. [c.500]
Там же путем бомбауздировки урана ядрами неона был получен изотоп э.ггемента 102 с массовым числом 256. Таким образом, Г настоящее время вопрос о приоритете в открытии элемента № 102 окончательно не решен. Д.ля исследования химических свойств этого. элемента мспо.льзуют два наиболее доступных изотопа [c.516]
В настоящее время для получения стабильных изотопов иапользуют методы дистиллядии, химического (изото цного) обмена, термодиффузии, ценгрнфугирования, массчдиффузии, газовой хроматографии, ионного обмена и др. При помощи электромагнитного разделения (масс-спектрометрии) можно получить в небольших количествах все стабильные изотопы, в том числе изотопы водорода, гелия, неона, ксенона. [c.76]
| Неон | |
|---|---|
| Атомный номер | 10 |
| Внешний вид простого вещества | инертный газ без цвета, вкуса и запаха |
| Свойства атома | |
|
Атомная масса (молярная масса) |
20,1797 а. е. м. (г/моль) |
| Радиус атома | ? (38) пм |
|
Энергия ионизации (первый электрон) |
2079,4(21,55) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s2 2p6 |
| Химические свойства | |
| Ковалентный радиус | 58 пм |
| Радиус иона | 112 пм |
|
Электроотрицательность (по Полингу) |
0,0 |
| Электродный потенциал | 0 |
| Степени окисления | n/a |
| Термодинамические свойства простого вещества | |
| Плотность | ( при −246 °C)1,204 г/см³ |
| Молярная теплоёмкость | 20,79[2] Дж/(K·моль) |
| Теплопроводность | (0,0493) Вт/(м·K) |
| Температура плавления | 24,55 K |
| Теплота плавления | n/a кДж/моль |
| Температура кипения | 27,1 K |
| Теплота испарения | 1,74 кДж/моль |
| Молярный объём | 16,8 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированная |
| Параметры решётки | 4,430 Å |
| Отношение c/a | — |
| Температура Дебая | 63,00 K |
| Ne | 10 |
| 20,1797 | |
| [He]2s22p6 | |
| Неон |
Неон — элемент главной подгруппы восьмой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 10. Обозначается символом Ne (Neon). Пятый по распространённости элемент во Вселенной (после водорода, гелия, кислорода и углерода). Простое вещество неон (CAS-номер: 7440-01-9) — инертный одноатомный газ без цвета, вкуса и запаха.
Схема атома неона
Неон открыли в июне 1898 года шотландский химик Уильям Рамзай и английский химик Морис Траверс. Они выделили этот инертный газ «методом исключения», после того, как кислород, азот, и все более тяжёлые компоненты воздуха были превращены в жидкость. Элементу дали незамысловатое название «неон», что в переводе с греческого означает «новый». В декабре 1910 года французский изобретатель Жорж Клод сделал газоразрядную лампу, заполненную неоном.
Происхождение названия
Название происходит от греч. νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше.
Распространение
В мировой материи неон распределен неравномерно, однако в целом по распространенности во Вселенной он занимает пятое место среди всех элементов — около 0,13 % по массе. Наибольшая концентрация неона наблюдается на Солнце и других горячих звездах, в газовых туманностях, в атмосфере внешних планет Солнечной системы — Юпитера, Сатурна, Урана, Нептуна. В атмосфере многих звезд неон занимает третье место после водорода и гелия.
Земная кора
Из всех элементов второго периода неон — самый малочисленный на Земле. В рамках восьмой группы неон по содержанию в земной коре занимает третье место — после аргона и гелия. Газовые туманности и некоторые звезды содержат неона во много раз больше, чем его находится на Земле.
На Земле наибольшая концентрация неона наблюдается в атмосфере — 1,82·10−3% по объему, а его общие запасы оцениваются в 7,8·1014 м³. В 1 м³ воздуха содержится около 18,2 см³ неона (для сравнения: в том же объеме воздуха содержится только 5,2 см³ гелия). Среднее содержание неона в земной коре мало − 7·10−9% по массе. Всего на нашей планете около 6,6·1010 т неона. В изверженных породах находится около 109 т этого элемента. По мере разрушения пород газ улетучивается в атмосферу. В меньшей мере атмосферу снабжают неоном и природные воды.
Причину неоновой бедности нашей планеты ученые усматривают в том, что некогда Земля потеряла свою первичную атмосферу, которая и унесла с собой основную массу инертных газов, которые не могли, как кислород и другие газы, химически связаться с другими элементами в минералы и тем самым закрепиться на планете.
Определение
Качественно неон определяют по спектрам испускания (характеристические линии 585,25 нм и 540,05 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа.
Физические свойства
- Благородные газы — бесцветные одноатомные газы без цвета и запаха.
- Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся, в частности неон огненно-красным светом, так как самые яркие его линии лежат в красной части спектра.
Эмиссионный спектр неона (слева направо: от ультрафиолетовых до инфракрасных линий, показанных белым цветом)
- Насыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом.
Химические свойства
Все благородные газы имеют завершенную электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Даже так называемые клатратные соединения неона с водой (Ne·6Н2О), гидрохиноном и другими веществами (подобные соединения тяжелых благородных газов — радона, ксенона, криптона и даже аргона — широко известны) получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne+, (NeAr)+, (NeH)+, и (HeNe)+.
Изотопы неона
Существует три стабильных изотопа неона: 20Ne (изотопная распространённость 90,48 %), 21Ne (0,27 %) и 22Ne (9,25 %)[10]. Повсеместно преобладает легкий 20Ne.
Во многих альфа-активных минералах относительное содержание тяжелых 21Ne и 22Ne в десятки и сотни раз больше содержания их в воздухе. Это вызвано тем, что основными механизмами образования этих изотопов являются ядерные реакции, происходящие при бомбардировке ядер алюминия, натрия, магния и кремния продуктами распада ядер тяжёлых элементов. Кроме того, подобные реакции происходят в земной коре и атмосфере под воздействием космического излучения.
Зафиксирован также ряд малопродуктивных ядерных реакций, при которых образуются 21Ne и 22Ne — это захват альфа-частиц ядрами тяжелого кислорода 18О и фтора 19F:
Источник преобладающего на Земле лёгкого нуклида 20Ne до сих пор не установлен.
Считается, что в космическом пространстве неон также преимущественно представлен лёгким нуклидом 20Ne. В метеоритах обнаруживают немало 21Ne и 22Ne, но эти нуклиды предположительно образуются в самих метеоритах под воздействием космических лучей за время странствий во Вселенной.
Кроме трех стабильных нуклидов неона, существует еще шестнадцать нестабильных.
Получение
Неон получают совместно с гелием в качестве побочного продукта в процессе сжижения и разделения воздуха. Разделение гелия и неона осуществляется за счет адсорбции и конденсации. Адсорбционный метод основан на способности неона в отличие от гелия адсорбироваться активированным углем, охлаждаемым жидким азотом. Конденсационный способ основан на вымораживании неона при охлаждении смеси жидким водородом.
Неон извлекают из воздуха в аппаратах двукратной ректификации жидкого воздуха. Газообразные неон и гелий скапливаются в верхней части колонны высокого давления, то есть в конденсаторе-испарителе, откуда под давлением около 0.55 МПа подаются в трубное пространство дефлегматора, охлаждаемое жидким N2. Из дефлегматора обогащенная смесь Ne и Не направляется для очистки от N2 в адсорберы с активированным углем, из которых после нагревания поступает в газгольдер (содержание Ne + He до 70 %); степень извлечения смеси газов 0.5-0.6. Последнюю очистку от N2 и разделение Ne и Не можно осуществлять либо селективной адсорбцией при температуре жидкого N2, либо конденсационными методами — с помощью жидких Н2 или Ne. При использовании жидкого водорода дополнительно проводят очистку от примеси водорода с помощью CuO при 700 °С. В результате получают неон 99,9%-ной чистоты по объему.
Применение
Неоновая вывеска
Жидкий неон используют в качестве охладителя в криогенных установках. Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном.
Символ элемента, выполненный из неоновых трубок
Неоном наполняют газоразрядные лампы, сигнальные лампы в радиотехнической аппаратуре, фотоэлементы, выпрямители.
Смесь неона и гелия используют как рабочую среду в газовых лазерах (гелий-неоновый лазер).
Трубки, заполненные смесью неона и азота, при пропускании через них электрического разряда дают красно-оранжевое свечение, в связи с чем они широко используются в рекламе.
Неоновые лампы используют для сигнальных целей на маяках и аэродромах, так как их красный цвет очень мало рассеивается туманом и мглой.
Биологическая роль
Неон не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотическое воздействие неона (как и гелия) при нормальном давлении в опытах не регистрируется, в то время как при повышении давления раньше возникают симптомы «нервного синдрома высокого давления» (НСВД).
В связи с этим, наряду с гелием, неон в составе неоно-гелиевой смеси используется для дыхания океанавтов, водолазов, людей, работающих при повышенных давлениях, чтобы избежать газовой эмболии и азотного наркоза. Преимущество смеси в том, что она меньше охлаждает организм, так как теплопроводность неона меньше, чем гелия.
Лёгкий неоно-гелиевый воздух облегчает также состояние больных, страдающих расстройствами дыхания.
Содержание неона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии.
Интересные факты
«Неоновые огни» оправдывают своё название только в случае свечения красного цвета. Для получения других цветов используют ртуть и фосфор в определённых пропорциях или другие благородные газы.
Неон, Neon, Nе (10)
Химический элемент неон был открыт Рамзаем и Траверсом в 1898 г., через несколько дней после открытия криптона. Ученые отобрали первые пузырьки газа, образующегося при испарении жидкого аргона, и установили, что спектр этого газа указывает на присутствие нового элемента. Рамзай так рассказывает о выборе названия для этого элемента: «Когда мы впервый раз рассматривали его спектр, при этом находился мой 12-летний сын.»
Отец, — сказал он — как называется этот красивый газ?
Это еще не решено — ответил я.
Он новый? — полюбопытствовал сын.
Новооткрытый — возразил я.
Почему бы в таком случае не назвать его Novum, отец?
Это не подходит, потому что novum не греческое слово — ответил я.
Мы назовем его неоном, что по гречески значит новый, таким то образом газ получил свое название.