From Wikipedia, the free encyclopedia
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(U) | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Uranium (92U) is a naturally occurring radioactive element that has no stable isotope. It has two primordial isotopes, uranium-238 and uranium-235, that have long half-lives and are found in appreciable quantity in the Earth’s crust. The decay product uranium-234 is also found. Other isotopes such as uranium-233 have been produced in breeder reactors. In addition to isotopes found in nature or nuclear reactors, many isotopes with far shorter half-lives have been produced, ranging from 214U to 242U (with the exception of 220U). The standard atomic weight of natural uranium is 238.02891(3).
Naturally occurring uranium is composed of three major isotopes, uranium-238 (99.2739–99.2752% natural abundance), uranium-235 (0.7198–0.7202%), and uranium-234 (0.0050–0.0059%).[5] All three isotopes are radioactive (i.e., they are radioisotopes), and the most abundant and stable is uranium-238, with a half-life of 4.4683×109 years (close to the age of the Earth).
Uranium-238 is an alpha emitter, decaying through the 18-member uranium series into lead-206. The decay series of uranium-235 (historically called actino-uranium) has 15 members and ends in lead-207. The constant rates of decay in these series makes comparison of the ratios of parent-to-daughter elements useful in radiometric dating. Uranium-233 is made from thorium-232 by neutron bombardment.
Uranium-235 is important for both nuclear reactors (energy production) and nuclear weapons because it is the only isotope existing in nature to any appreciable extent that is fissile in response to thermal neutrons, i.e., thermal neutron capture has a high probability of inducing fission. A chain reaction can be sustained with a sufficiently large (critical) mass of uranium-235. Uranium-238 is also important because it is fertile: it absorbs neutrons to produce a radioactive isotope that subsequently decays to the isotope plutonium-239, which also is fissile.
List of isotopes[edit]
| Nuclide[6] [n 1] |
Historic name |
Z | N | Isotopic mass (Da) [n 2][n 3] |
Half-life | Decay mode [n 4] |
Daughter isotope [n 5][n 6] |
Spin and parity [n 7][n 8] |
Natural abundance (mole fraction) | |
|---|---|---|---|---|---|---|---|---|---|---|
| Excitation energy[n 8] | Normal proportion | Range of variation | ||||||||
| 214U[7] | 92 | 122 | 0.52(+0.95−0.21) ms | α | 210Th | 0+ | ||||
| 215U | 92 | 123 | 215.026760(90) | 1.4(0.9) ms | α | 211Th | 5/2−# | |||
| 216U | 92 | 124 | 216.024760(30) | 6.9(2.9) ms | α | 212Th | 0+ | |||
| 216mU | 1.4(0.9) ms | 8+ | ||||||||
| 217U | 92 | 125 | 217.02437(9) | 0.85(0.71) ms | α | 213Th | 1/2−# | |||
| 218U | 92 | 126 | 218.02354(3) | 0.35(0.09) ms | α | 214Th | 0+ | |||
| 219U | 92 | 127 | 219.02492(6) | 60(7) μs | α | 215Th | 9/2+# | |||
| 221U | 92 | 129 | 221.02640(11)# | 0.66(14) μs | α | 217Th | (9/2+) | |||
| 222U | 92 | 130 | 222.02609(11)# | 4.7(0.7) μs | α | 218Th | 0+ | |||
| β+ (10−6%) | 222Pa | |||||||||
| 223U | 92 | 131 | 223.02774(8) | 65(12) μs | α | 219Th | 7/2+# | |||
| 224U | 92 | 132 | 224.027605(27) | 396(17) μs | α | 220Th | 0+ | |||
| 225U | 92 | 133 | 225.02939# | 62(4) ms | α | 221Th | (5/2+)# | |||
| 226U | 92 | 134 | 226.029339(14) | 269(6) ms | α | 222Th | 0+ | |||
| 227U | 92 | 135 | 227.031156(18) | 1.1(0.1) min | α | 223Th | (3/2+) | |||
| β+ (.001%) | 227Pa | |||||||||
| 228U | 92 | 136 | 228.031374(16) | 9.1(0.2) min | α (95%) | 224Th | 0+ | |||
| EC (5%) | 228Pa | |||||||||
| 229U | 92 | 137 | 229.033506(6) | 57.8(0.5) min | β+ (80%) | 229Pa | (3/2+) | |||
| α (20%) | 225Th | |||||||||
| 230U | 92 | 138 | 230.033940(5) | 20.23(0.02) d | α | 226Th | 0+ | |||
| SF (1.4×10−10%) | (various) | |||||||||
| 231U | 92 | 139 | 231.036294(3) | 4.2(0.1) d | EC | 231Pa | (5/2)(+#) | |||
| α (.004%) | 227Th | |||||||||
| 232U | 92 | 140 | 232.0371562(24) | 68.9(0.4) y | α | 228Th | 0+ | |||
| CD (8.9×10−10%) | 208Pb 24Ne |
|||||||||
| CD (5×10−12%) | 204Hg 28Mg |
|||||||||
| SF (10−12%) | (various) | |||||||||
| 233U | 92 | 141 | 233.0396352(29) | 1.592(2)×105 y | α | 229Th | 5/2+ | Trace[n 9] | ||
| SF (6×10−9%) | (various) | |||||||||
| CD (7.2×10−11%) | 209Pb 24Ne |
|||||||||
| CD (1.3×10−13%) | 205Hg 28Mg |
|||||||||
| 234U[n 10][n 11] | Uranium II | 92 | 142 | 234.0409521(20) | 2.455(6)×105 y | α | 230Th | 0+ | [0.000054(5)][n 12] | 0.000050– 0.000059 |
| SF (1.73×10−9%) | (various) | |||||||||
| CD (1.4×10−11%) | 206Hg 28Mg |
|||||||||
| CD (9×10−12%) | 184Hf 26Ne 24Ne |
|||||||||
| 234mU | 1421.32(10) keV | 33.5(2.0) ms | 6− | |||||||
| 235U[n 13][n 14][n 15] | Actin Uranium Actino-Uranium |
92 | 143 | 235.0439299(20) | 7.038(1)×108 y | α | 231Th | 7/2− | [0.007204(6)] | 0.007198– 0.007207 |
| SF (7×10−9%) | (various) | |||||||||
| CD (8×10−10%) | 186Hf 25Ne 24Ne |
|||||||||
| 235mU | 0.0765(4) keV | ~26 min | IT | 235U | 1/2+ | |||||
| 236U | Thoruranium[8] | 92 | 144 | 236.045568 | 2.342(3)×107 y | α | 232Th | 0+ | Trace[n 16] | |
| SF (9.6×10−8%) | (various) | |||||||||
| 236m1U | 1052.89(19) keV | 100(4) ns | (4)− | |||||||
| 236m2U | 2750(10) keV | 120(2) ns | (0+) | |||||||
| 237U | 92 | 145 | 237.0487302(20) | 6.752(0.002) d | β− | 237Np | 1/2+ | Trace[n 17] | ||
| 238U[n 11][n 13][n 14] | Uranium I | 92 | 146 | 238.0507882(20) | 4.468(3)×109 y | α | 234Th | 0+ | [0.992742(10)] | 0.992739– 0.992752 |
| SF (5.45×10−5%) | (various) | |||||||||
| β−β− (2.19×10−10%) | 238Pu | |||||||||
| 238mU | 2557.9(5) keV | 280(6) ns | 0+ | |||||||
| 239U | 92 | 147 | 239.0542933(21) | 23.45(0.02) min | β− | 239Np | 5/2+ | |||
| 239m1U | 20(20)# keV | >250 ns | (5/2+) | |||||||
| 239m2U | 133.7990(10) keV | 780(40) ns | 1/2+ | |||||||
| 240U | 92 | 148 | 240.056592(6) | 14.1(0.1) h | β− | 240Np | 0+ | Trace[n 18] | ||
| α (10−10%) | 236Th | |||||||||
| 241U[9] | 92 | 149 | 241.06031(5) | ~40 min[10][11] | β− | 241Np | 7/2+# | |||
| 242U | 92 | 150 | 242.06293(22)# | 16.8(0.5) min | β− | 242Np | 0+ | |||
This table header & footer:
|
- ^ mU – Excited nuclear isomer.
- ^ ( ) – Uncertainty (1σ) is given in concise form in parentheses after the corresponding last digits.
- ^ # – Atomic mass marked #: value and uncertainty derived not from purely experimental data, but at least partly from trends from the Mass Surface (TMS).
- ^
Modes of decay:
- ^ Bold italics symbol as daughter – Daughter product is nearly stable.
- ^ Bold symbol as daughter – Daughter product is stable.
- ^ ( ) spin value – Indicates spin with weak assignment arguments.
- ^ a b # – Values marked # are not purely derived from experimental data, but at least partly from trends of neighboring nuclides (TNN).
- ^ Intermediate decay product of 237Np
- ^ Used in uranium–thorium dating
- ^ a b Used in uranium–uranium dating
- ^ Intermediate decay product of 238U
- ^ a b Primordial radionuclide
- ^ a b Used in Uranium–lead dating
- ^ Important in nuclear reactors
- ^ Intermediate decay product of 244Pu, also produced by neutron capture of 235U
- ^ Neutron capture product, parent of trace quantities of 237Np
- ^ Intermediate decay product of 244Pu
Actinides vs fission products[edit]
|
Actinides and fission products by half-life
|
|||||||
|---|---|---|---|---|---|---|---|
| Actinides[12] by decay chain | Half-life range (a) |
Fission products of 235U by yield[13] | |||||
| 4n | 4n + 1 | 4n + 2 | 4n + 3 | 4.5–7% | 0.04–1.25% | <0.001% | |
| 228Ra№ | 4–6 a | 155Euþ | |||||
| 244Cmƒ | 241Puƒ | 250Cf | 227Ac№ | 10–29 a | 90Sr | 85Kr | 113mCdþ |
| 232Uƒ | 238Puƒ | 243Cmƒ | 29–97 a | 137Cs | 151Smþ | 121mSn | |
| 248Bk[14] | 249Cfƒ | 242mAmƒ | 141–351 a |
No fission products have a half-life in the range of 100 a–210 ka … |
|||
| 241Amƒ | 251Cfƒ[15] | 430–900 a | |||||
| 226Ra№ | 247Bk | 1.3–1.6 ka | |||||
| 240Pu | 229Th | 246Cmƒ | 243Amƒ | 4.7–7.4 ka | |||
| 245Cmƒ | 250Cm | 8.3–8.5 ka | |||||
| 239Puƒ | 24.1 ka | ||||||
| 230Th№ | 231Pa№ | 32–76 ka | |||||
| 236Npƒ | 233Uƒ | 234U№ | 150–250 ka | 99Tc₡ | 126Sn | ||
| 248Cm | 242Pu | 327–375 ka | 79Se₡ | ||||
| 1.53 Ma | 93Zr | ||||||
| 237Npƒ | 2.1–6.5 Ma | 135Cs₡ | 107Pd | ||||
| 236U | 247Cmƒ | 15–24 Ma | 129I₡ | ||||
| 244Pu | 80 Ma |
… nor beyond 15.7 Ma[16] |
|||||
| 232Th№ | 238U№ | 235Uƒ№ | 0.7–14.1 Ga | ||||
|
Uranium-214[edit]
Uranium-214 is the lightest known isotope of uranium. It was discovered in 2021 at the Spectrometer for Heavy Atoms and Nuclear Structure (SHANS) at the Heavy Ion Research Facility in Lanzhou, China in 2021, produced by firing argon-36 at tungsten-182. It undergoes alpha decay with a half-life of 0.5 ms.[17][18][19][20]
Uranium-232[edit]
Uranium-232 has a half-life of 68.9 years and is a side product in the thorium cycle. It has been cited as an obstacle to nuclear proliferation using 233U as the fissile material, because the intense gamma radiation emitted by 208Tl (a daughter of 232U, produced relatively quickly) makes the 233U contaminated with it more difficult to handle. Uranium-232 is a rare example of an even-even isotope that is fissile with both thermal and fast neutrons.[21][22]
Uranium-233[edit]
Uranium-233 is a fissile isotope of uranium that is bred from thorium-232 as part of the thorium fuel cycle. Uranium-233 was investigated for use in nuclear weapons and as a reactor fuel. It was occasionally tested but never deployed in nuclear weapons and has not been used commercially as a nuclear fuel.[23] It has been used successfully in experimental nuclear reactors and has been proposed for much wider use as a nuclear fuel. It has a half-life of around 160,000 years.
Uranium-233 is produced by the neutron irradiation of thorium-232. When thorium-232 absorbs a neutron, it becomes thorium-233, which has a half-life of only 22 minutes. Thorium-233 decays into protactinium-233 through beta decay. Protactinium-233 has a half-life of 27 days and beta decays into uranium-233; some proposed molten salt reactor designs attempt to physically isolate the protactinium from further neutron capture before beta decay can occur.
Uranium-233 usually fissions on neutron absorption but sometimes retains the neutron, becoming uranium-234. The capture-to-fission ratio is smaller than the other two major fissile fuels uranium-235 and plutonium-239; it is also lower than that of short-lived plutonium-241, but bested by very difficult-to-produce neptunium-236.
Uranium-234[edit]
Uranium-234 is an isotope of uranium. In natural uranium and in uranium ore, 234U occurs as an indirect decay product of uranium-238, but it makes up only 0.0055% (55 parts per million) of the raw uranium because its half-life of just 245,500 years is only about 1/18,000 as long as that of 238U. The path of production of 234U via nuclear decay is as follows: 238U nuclei emit an alpha particle to become thorium-234. Next, with a short half-life, a 234Th nucleus emits a beta particle to become protactinium-234. Finally, 234Pa nuclei each emit another beta particle to become 234U nuclei.[24][25]
234U nuclei usually last for hundreds of thousands of years, but then they decay by alpha emission to thorium-230, except for the small percentage of nuclei that undergo spontaneous fission.
Extraction of rather small amounts of 234U from natural uranium would be feasible using isotope separation, similar to that used for regular uranium-enrichment. However, there is no real demand in chemistry, physics, or engineering for isolating 234U. Very small pure samples of 234U can be extracted via the chemical ion-exchange process—from samples of plutonium-238 that have been aged somewhat to allow some decay to 234U via alpha emission.
Enriched uranium contains more 234U than natural uranium as a byproduct of the uranium enrichment process aimed at obtaining uranium-235, which concentrates lighter isotopes even more strongly than it does 235U. The increased percentage of 234U in enriched natural uranium is acceptable in current nuclear reactors, but (re-enriched) reprocessed uranium might contain even higher fractions of 234U, which is undesirable.[26] This is because 234U is not fissile, and tends to absorb slow neutrons in a nuclear reactor—becoming 235U.[25][26]
234U has a neutron capture cross section of about 100 barns for thermal neutrons, and about 700 barns for its resonance integral—the average over neutrons having various intermediate energies. In a nuclear reactor, non-fissile isotopes capture a neutron breeding fissile isotopes. 234U is converted to 235U more easily and therefore at a greater rate than uranium-238 is to plutonium-239 (via neptunium-239), because 238U has a much smaller neutron-capture cross section of just 2.7 barns.
Uranium-235[edit]
Uranium-235 is an isotope of uranium making up about 0.72% of natural uranium. Unlike the predominant isotope uranium-238, it is fissile, i.e., it can sustain a fission chain reaction. It is the only fissile isotope that is a primordial nuclide or found in significant quantity in nature.
Uranium-235 has a half-life of 703.8 million years. It was discovered in 1935 by Arthur Jeffrey Dempster. Its (fission) nuclear cross section for slow thermal neutron is about 504.81 barns. For fast neutrons it is on the order of 1 barn. At thermal energy levels, about 5 of 6 neutron absorptions result in fission and 1 of 6 result in neutron capture forming uranium-236.[27] The fission-to-capture ratio improves for faster neutrons.
Uranium-236[edit]
Uranium-236 is an isotope of uranium with a half-life of about 23 million years that is neither fissile with thermal neutrons, nor very good fertile material, but is generally considered a nuisance and long-lived radioactive waste. It is found in spent nuclear fuel and in the reprocessed uranium made from spent nuclear fuel.
Uranium-237[edit]
Uranium-237 is an isotope of uranium. It has a half-life of about 6.75(1) days. It decays into neptunium-237 by beta decay. It was discovered by Japanese physicist Yoshio Nishina.[28]
Uranium-238[edit]
Uranium-238 (238U or U-238) is the most common isotope of uranium found in nature. It is not fissile, but is a fertile material: it can capture a slow neutron and after two beta decays become fissile plutonium-239. Uranium-238 is fissionable by fast neutrons, but cannot support a chain reaction because inelastic scattering reduces neutron energy below the range where fast fission of one or more next-generation nuclei is probable. Doppler broadening of 238U’s neutron absorption resonances, increasing absorption as fuel temperature increases, is also an essential negative feedback mechanism for reactor control.
Around 99.284% of natural uranium is uranium-238, which has a half-life of 1.41×1017 seconds (4.468×109 years, or 4.468 billion years). Depleted uranium has an even higher concentration of the 238U isotope, and even low-enriched uranium (LEU), while having a higher proportion of the uranium-235 isotope (in comparison to depleted uranium), is still mostly 238U. Reprocessed uranium is also mainly 238U, with about as much uranium-235 as natural uranium, a comparable proportion of uranium-236, and much smaller amounts of other isotopes of uranium such as uranium-234, uranium-233, and uranium-232.
Uranium-239[edit]
Uranium-239 is an isotope of uranium. It is usually produced by exposing 238U to neutron radiation in a nuclear reactor. 239U has a half-life of about 23.45 minutes and decays into neptunium-239 through beta decay, with a total decay energy of about 1.29 MeV.[29] The most common gamma decay at 74.660 keV accounts for the difference in the two major channels of beta emission energy, at 1.28 and 1.21 MeV.[30]
239Np further decays to plutonium-239 also through beta decay (239Np has a half-life of about 2.356 days), in a second important step that ultimately produces fissile 239Pu (used in weapons and for nuclear power), from 238U in reactors.
Uranium-241[edit]
Uranium-241 is an isotope of uranium. In 2023, in a paper published in Physical Review Letters, a group of researchers based in Korea reported that they had found uranium-241 in an experiment involving 238U+198Pt multinucleon transfer reactions.[31][32]
Its half-life is approximately 40 minutes.[31]
References[edit]
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). «The NUBASE2020 evaluation of nuclear properties» (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Magurno, B.A.; Pearlstein, S, eds. (1981). Proceedings of the conference on nuclear data evaluation methods and procedures. BNL-NCS 51363, vol. II (PDF). Upton, NY (USA): Brookhaven National Lab. pp. 835 ff. Retrieved 2014-08-06.
- ^ «Standard Atomic Weights: Uranium». CIAAW. 1999.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; et al. (2022-05-04). «Standard atomic weights of the elements 2021 (IUPAC Technical Report)». Pure and Applied Chemistry. doi:10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ «Uranium Isotopes». GlobalSecurity.org. Retrieved 14 March 2012.
- ^ Half-life, decay mode, nuclear spin, and isotopic composition is sourced in:
Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). «The NUBASE2020 evaluation of nuclear properties» (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae. - ^ Zhang, Z. Y.; Yang, H. B.; Huang, M. H.; Gan, Z. G.; Yuan, C. X.; Qi, C.; Andreyev, A. N.; Liu, M. L.; Ma, L.; Zhang, M. M.; Tian, Y. L.; Wang, Y. S.; Wang, J. G.; Yang, C. L.; Li, G. S.; Qiang, Y. H.; Yang, W. Q.; Chen, R. F.; Zhang, H. B.; Lu, Z. W.; Xu, X. X.; Duan, L. M.; Yang, H. R.; Huang, W. X.; Liu, Z.; Zhou, X. H.; Zhang, Y. H.; Xu, H. S.; Wang, N.; Zhou, H. B.; Wen, X. J.; Huang, S.; Hua, W.; Zhu, L.; Wang, X.; Mao, Y. C.; He, X. T.; Wang, S. Y.; Xu, W. Z.; Li, H. W.; Ren, Z. Z.; Zhou, S. G. (2021). «New α-Emitting Isotope U214 and Abnormal Enhancement of α-Particle Clustering in Lightest Uranium Isotopes». Physical Review Letters. 126 (15): 152502. arXiv:2101.06023. Bibcode:2021PhRvL.126o2502Z. doi:10.1103/PhysRevLett.126.152502. PMID 33929212. S2CID 231627674.
- ^ Trenn, Thaddeus J. (1978). «Thoruranium (U-236) as the extinct natural parent of thorium: The premature falsification of an essentially correct theory». Annals of Science. 35 (6): 581–97. doi:10.1080/00033797800200441.
- ^ Niwase, T.; Watanabe, Y. X.; Hirayama, Y.; et al. (2023). «Discovery of New Isotope 241U and Systematic High-Precision Atomic Mass Measurements of Neutron-Rich Pa-Pu Nuclei Produced via Multinucleon Transfer Reactions» (PDF). Physical Review Letters. 130 (13): 132502-1–132502-6. doi:10.1103/PhysRevLett.130.132502. S2CID 257976576.
- ^ Mukunth, Vasudevan (2023-04-05). «In pursuit of a ‘magic number’, physicists discover new uranium isotope». The Hindu. ISSN 0971-751X. Retrieved 2023-04-12.
- ^ Yirka, Bob (April 5, 2023). «Previously unknown isotope of uranium discovered». Phys.org. Retrieved 2023-04-12.
- ^ Plus radium (element 88). While actually a sub-actinide, it immediately precedes actinium (89) and follows a three-element gap of instability after polonium (84) where no nuclides have half-lives of at least four years (the longest-lived nuclide in the gap is radon-222 with a half life of less than four days). Radium’s longest lived isotope, at 1,600 years, thus merits the element’s inclusion here.
- ^ Specifically from thermal neutron fission of uranium-235, e.g. in a typical nuclear reactor.
- ^ Milsted, J.; Friedman, A. M.; Stevens, C. M. (1965). «The alpha half-life of berkelium-247; a new long-lived isomer of berkelium-248». Nuclear Physics. 71 (2): 299. Bibcode:1965NucPh..71..299M. doi:10.1016/0029-5582(65)90719-4.
«The isotopic analyses disclosed a species of mass 248 in constant abundance in three samples analysed over a period of about 10 months. This was ascribed to an isomer of Bk248 with a half-life greater than 9 [years]. No growth of Cf248 was detected, and a lower limit for the β− half-life can be set at about 104 [years]. No alpha activity attributable to the new isomer has been detected; the alpha half-life is probably greater than 300 [years].» - ^ This is the heaviest nuclide with a half-life of at least four years before the «sea of instability».
- ^ Excluding those «classically stable» nuclides with half-lives significantly in excess of 232Th; e.g., while 113mCd has a half-life of only fourteen years, that of 113Cd is nearly eight quadrillion years.
- ^ «Physicists Discover New Uranium Isotope: Uranium-214». Sci-News.com. 14 May 2021. Retrieved 15 May 2021.
- ^ Zhang, Z. Y.; et al. (2021). «New α -Emitting Isotope 214 U and Abnormal Enhancement of α -Particle Clustering in Lightest Uranium Isotopes». Physical Review Letters. 126 (15): 152502. arXiv:2101.06023. Bibcode:2021PhRvL.126o2502Z. doi:10.1103/PhysRevLett.126.152502. PMID 33929212. S2CID 231627674. Retrieved 15 May 2021.
- ^ «Lightest-known form of uranium created». Live Science. 3 May 2021. Retrieved 15 May 2021.
- ^ «Physicists have created a new and extremely rare kind of uranium». New Scientist. Retrieved 15 May 2021.
- ^ «Uranium 232». Nuclear Power. Archived from the original on 26 February 2019. Retrieved 3 June 2019.
- ^ «INCIDENT NEUTRON DATA». atom.kaeri.re.kr. 2011-12-14.
- ^ C. W. Forsburg; L. C. Lewis (1999-09-24). «Uses For Uranium-233: What Should Be Kept for Future Needs?» (PDF). Ornl-6952. Oak Ridge National Laboratory.
- ^ Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). «The NUBASE2016 evaluation of nuclear properties» (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ a b Ronen, Y., ed. (1990). High converting water reactors. CRC Press. p. 212. ISBN 0-8493-6081-1. LCCN 89-25332.
- ^ a b Use of Reprocessed Uranium (PDF). Technical Document. Vienna: International Atomic Energy Agency. 2009. ISBN 978-92-0-157109-0. ISSN 1684-2073.
- ^ B. C. Diven; J. Terrell; A. Hemmendinger (1 January 1958). «Capture-to-Fission Ratios for Fast Neutrons in U235». Physical Review Letters. 109 (1): 144–150. Bibcode:1958PhRv..109..144D. doi:10.1103/PhysRev.109.144.
- ^ Ikeda, Nagao (July 25, 2011). «The discoveries of uranium 237 and symmetric fission — From the archival papers of Nishina and Kimura». Proceedings of the Japan Academy. Series B, Physical and Biological Sciences. 87 (7): 371–376. doi:10.2183/pjab.87.371. PMC 3171289. PMID 21785255.
- ^ CRC Handbook of Chemistry and Physics, 57th Ed. p. B-345
- ^ CRC Handbook of Chemistry and Physics, 57th Ed. p. B-423
- ^ a b Yirka, Bob; Phys.org. «Previously unknown isotope of uranium discovered». phys.org. Retrieved 2023-04-10.
- ^ Niwase, T.; Watanabe, Y. X.; Hirayama, Y.; Mukai, M.; Schury, P.; Andreyev, A. N.; Hashimoto, T.; Iimura, S.; Ishiyama, H.; Ito, Y.; Jeong, S. C.; Kaji, D.; Kimura, S.; Miyatake, H.; Morimoto, K. (2023-03-31). «Discovery of New Isotope $^{241}mathrm{U}$ and Systematic High-Precision Atomic Mass Measurements of Neutron-Rich Pa-Pu Nuclei Produced via Multinucleon Transfer Reactions». Physical Review Letters. 130 (13): 132502. doi:10.1103/PhysRevLett.130.132502. S2CID 257976576.
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
- ∆m=(Zmp+Nmn)-Mя
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
- ∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Изотопы урана
Материал из Большого Справочника
Изото́пы ура́на — разновидности атомов (и ядер) химического элемента урана, имеющие разное содержание нейтронов в ядре. На данный момент известны 26 изотопов урана и еще 6 возбуждённых изомерных состояний некоторых его нуклидов. В природе встречаются три изотопа урана: 234U (изотопная распространенность 0,0055 %), 235U (0,7200 %), 238U (99,2745 %)[1].
Нуклиды 235U и 238U являются родоначальниками радиоактивных рядов — ряда актиния и ряда радия соответственно. Нуклид 235U используется как топливо в ядерных реакторах, а также в ядерном оружии (благодаря тому, что в нём возможна самоподдерживающаяся цепная ядерная реакция). Нуклид 238U используется для производства плутония-239, который также имеет чрезвычайно большое значение как в качестве топлива для ядерных реакторов, так и в производстве ядерного оружия.
Таблица изотопов урана
| Символ нуклида |
Z(p) | N(n) | Масса изотопа[2] (а. е. м.) |
Избыток массы[2] (кэВ) |
Период полураспада[1] (T1/2) |
Спин и чётность ядра[1] |
Распространённость изотопа в природе[1] (%) |
|---|---|---|---|---|---|---|---|
| Энергия возбуждения (кэВ) | |||||||
| 217U | 92 | 125 | 217,024370(90) | 22 700(90) | 26(14) мс | 1/2−# | |
| 218U | 92 | 126 | 218,023540(30) | 21 920(30) | 6(5) мс | 0+ | |
| 219U | 92 | 127 | 219,024920(60) | 23 210(60) | 55(25) мкс | 9/2+# | |
| 220U | 92 | 128 | 220,024720(220)# | 23 030(200)# | 60# нс | 0+ | |
| 221U | 92 | 129 | 221,026400(110)# | 24 590(100)# | 700# нс | 9/2+# | |
| 222U | 92 | 130 | 222,026090(110)# | 24 300(100)# | 1,4(7) мкс | 0+ | |
| 223U | 92 | 131 | 223,027740(80) | 25 840(70) | 21(8) мкс | 7/2+# | |
| 224U | 92 | 132 | 224,027605(27) | 25 714(25) | 940(270) мкс | 0+ | |
| 225U | 92 | 133 | 225,029391(12) | 27 377(12) | 61(4) мс | 5/2+# | |
| 226U | 92 | 134 | 226,029339(14) | 27 329(13) | 269(6) мс | 0+ | |
| 227U | 92 | 135 | 227,031156(18) | 29 022(17) | 1,1(1) мин | (3/2+) | |
| 228U | 92 | 136 | 228,031374(16) | 29 225(15) | 9,1(2) мин | 0+ | |
| 229U | 92 | 137 | 229,033506(6) | 31 211(6) | 58(3) мин | (3/2+) | |
| 230U | 92 | 138 | 230,033940(5) | 31 615(5) | 20,8 сут | 0+ | |
| 231U | 92 | 139 | 231,036294(3) | 33 807(3) | 4,2(1) сут | (5/2)(+#) | |
| 232U | 92 | 140 | 232,0371562(24) | 34 610,7(22) | 68,9(4) года | 0+ | |
| 233U | 92 | 141 | 233,0396352(29) | 36 920,0(27) | 1,592(2)·105 лет | 5/2+ | |
| 234U | 92 | 142 | 234,0409521(20) | 38 146,6(18) | 2,455(6)·105 лет | 0+ | 0,0055(2) |
| 234Um[1] | 1421,32(10) | 39 567,9(18) | 33,5(20) мкс | 6− | |||
| 235U | 92 | 143 | 235,0439299(20) | 40 920,5(18) | 7,04(1)·108 лет | 7/2− | 0,7200(51) |
| 235Um[1] | 0,0765(4) | 40 920,6(18) | 26 мин | 1/2+ | |||
| 236U | 92 | 144 | 236,0455680(20) | 42 446,3(18) | 2,342(3)·107 лет | 0+ | |
| 236Um[1] | 2750(10) | 45 196(10) | 115 нс | 0+ | |||
| 237U | 92 | 145 | 237,0487302(20) | 45 391,9(19) | 6,75(1) сут | 1/2+ | |
| 238U | 92 | 146 | 238,0507882(20) | 47 308,9(19) | 4,468(3)·109 лет | 0+ | 99,2745(106) |
| 238Um[1] | 2 557,9(5) | 49 866,8(20) | 280(6) нс | 0+ | |||
| 239U | 92 | 147 | 239,0542933(21) | 50 573,9(19) | 23,45(2) мин | 5/2+ | |
| 239Um[1] | 20(20)# | 50 594(20) | >250 нс | (5/2+) | |||
| 239Un[1] | 133,7990(10) | 50 707,7(19) | 780(40) нс | 1/2+ | |||
| 240U | 92 | 148 | 240,056592(6) | 52 715(5) | 14,1(1) ч | 0+ | |
| 241U | 92 | 149 | 241,060330(320)# | 56 200(300)# | 5# мин | 7/2+# | |
| 242U | 92 | 150 | 242,062930(220)# | 58 620(200)# | 16,8(5) мин | 0+ | |
| 243U | 92 | 151 |
Пояснения к таблице
- Распространённость изотопов приведена для большинства природных образцов. Для других источников значения могут сильно отличаться.
- Индексами ‘m’, ‘n’, ‘p’ (рядом с символом) обозначены возбужденные изомерные состояния нуклида.
- Значения, помеченные решёткой (#), получены не из одних лишь экспериментальных данных, а (хотя бы частично) оценены из систематических трендов у соседних нуклидов (с такими же соотношениями Z и N). Неуверенно определённые значения спина и/или его чётности заключены в скобки.
- Погрешность приводится в виде числа в скобках, выраженного в единицах последней значащей цифры, означает одно стандартное отклонение (за исключением распространённости и стандартной атомной массы изотопа по данным ИЮПАК, для которых используется более сложное определение погрешности). Примеры: 29770,6(5) означает 29770,6 ± 0,5; 21,48(15) означает 21,48 ± 0,15; −2200,2(18) означает −2200,2 ± 1,8.
Примечания
- ↑ 1 2 3 4 5 6 7 8 9 10 Данные приведены по Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — DOI:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729….3A.
- ↑ 1 2 Данные приведены по Audi G., Wapstra A. H., Thibault C. The AME2003 atomic mass evaluation (II). Tables, graphs, and references (англ.) // Nuclear Physics A. — 2003. — Vol. 729. — P. 337—676. — DOI:10.1016/j.nuclphysa.2003.11.003. — Bibcode: 2003NuPhA.729..337A.
| Уран | |
|---|---|
| Тяжёлый серебристо-белый глянцеватый металл | |
 |
|
| Название, символ, номер | Уран / Uranium (U), 92 |
| Атомная масса (молярная масса) |
238,02891(3) а. е. м. (г/моль) |
| Электронная конфигурация | [Rn] 5f3 6d1 7s2 |
| Радиус атома | 138 пм |
| Ковалентный радиус | 142 пм |
| Радиус иона | (+6e) 80 (+4e) 97 пм |
| Электроотрицательность | 1,38 (шкала Полинга) |
| Электродный потенциал | U←U4+ -1,38В U←U3+ -1,66В U←U2+ -0,1В |
| Степени окисления | 6, 5, 4, 3 |
| Энергия ионизации (первый электрон) |
686,4(7,11) кДж/моль (эВ) |
| Плотность (при н. у.) | 19,05 г/см³ |
| Температура плавления | 1405,5 K |
| Температура кипения | 4018 K |
| Уд. теплота плавления | 12,6 кДж/моль |
| Уд. теплота испарения | 417 кДж/моль |
| Молярная теплоёмкость | 27,67 Дж/(K·моль) |
| Молярный объём | 12,5 см³/моль |
| Структура решётки | орторомбическая |
| Параметры решётки | a = 2,854 Å; b = 5,870 Å; c = 4,955 Å |
| Теплопроводность | (300 K) 27,5 Вт/(м·К) |
| Номер CAS | 7440-61-1 |
Уран (U, лат. uranium; устаревший вариант ураний) — химический элемент с атомным номером 92 в периодической системе, атомная масса — 238,029; относится к семейству актиноидов. Уран — слаборадиоактивный элемент, он не имеет стабильных изотопов. Самыми распространёнными изотопами урана являются уран-238 (имеет 146 нейтронов, в природном уране составляет 99,3 %) и уран-235 (143 нейтрона, природная распространённость 0,7204 %).
Содержание
- 1 История
- 2 Физические свойства
- 3 Химические свойства
- 3.1 Характерные степени окисления
- 3.2 Свойства простого вещества
- 3.3 Соединения урана III
- 3.4 Соединения урана IV
- 3.5 Соединения урана V
- 3.6 Соединения урана VI
- 4 Изотопы
- 5 Нахождение в природе
- 5.1 Месторождения
- 6 Получение
- 7 Применение
- 7.1 Ядерное топливо
- 7.1.1 Тепловыделяющая способность урана
- 7.2 Производство искусственных изотопов
- 7.3 Геология
- 7.4 Другие сферы применения
- 7.5 Обеднённый уран
- 7.5.1 Сердечники бронебойных снарядов
- 7.1 Ядерное топливо
- 8 Физиологическое действие
- 9 Добыча урана
- 9.1 Добыча по странам
- 9.2 Добыча по компаниям
- 9.3 Уран из вторичных источников
- 9.4 Добыча в СССР
- 9.5 Добыча в России
- 9.6 Добыча в Казахстане
- 9.7 Добыча на Украине
- 10 Стоимость и аффинаж
История
Ещё в древнейшие времена природная окись урана использовалась для изготовления жёлтой посуды. Так, возле Неаполя найден осколок жёлтого стекла, содержащий 1 % оксида урана и датируемый 79 годом н. э. Первая важная дата в истории урана — 1789 год, когда немецкий натурфилософ и химик Мартин Генрих Клапрот восстановил извлечённую из саксонской руды настурана золотисто-жёлтую «землю» до чёрного металлоподобного вещества. В честь самой далёкой из известных тогда планет (открытой Гершелем восемью годами раньше) Клапрот, считая новое вещество элементом, назвал его ураном (этим он хотел поддержать предложение Иоганна Боде назвать новую планету «Уран» вместо «Звезда Георга», как предложил Гершель). Пятьдесят лет уран Клапрота числился металлом. Только в 1841 году французский химик Эжен Пелиго (1811—1890) доказал, что, несмотря на характерный металлический блеск, уран Клапрота не элемент, а оксид UO2. В 1840 году Пелиго удалось получить простое вещество уран — тяжёлый металл серо-стального цвета — и определить его атомный вес. Следующий важный шаг в изучении урана сделал в 1874 году Д. И. Менделеев. Опираясь на разработанную им периодическую систему, он поместил уран в самой дальней клетке своей таблицы. Прежде атомный вес урана считали равным 120. Менделеев удвоил это значение. Через 12 лет его предвидение было подтверждено опытами немецкого химика Циммермана (J. Zimmermann).
В 1804 году немецкий химик Адольф Гелен открыл светочувствительность раствора хлорида уранила в эфире; это свойство французский изобретатель Абель Ньепс де Сен-Виктор в 1857 году пытался использовать в фотографии, однако обнаружил, что соли урана испускают некое невидимое излучение, экспонирующее светочувствительные материалы; на тот момент это наблюдение осталось незамеченным.
В 1896 году, исследуя уран, французский учёный Антуан Анри Беккерель случайно открыл радиоактивный распад. В это же время французскому химику Анри Муассану удалось разработать способ получения чистого металлического урана. В 1899 году Эрнест Резерфорд обнаружил, что излучение урановых препаратов неоднородно, что есть два вида излучения — альфа- и бета-лучи. Они несут различный электрический заряд; далеко не одинаковы их пробег в веществе и ионизирующая способность. В мае 1900 года, Поль Вийяр открыл третий вид излучения — гамма-лучи.
Резерфорд провёл в 1907 году первые опыты по определению возраста минералов при изучении радиоактивных урана и тория на основе созданной им совместно с Фредериком Содди теории радиоактивности.
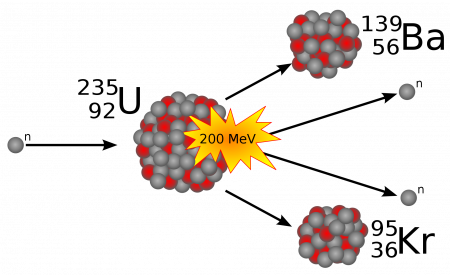
В 1938 году немецкие физики Отто Ган и Фриц Штрассман открыли непредсказанное явление, происходящее с ядром урана при облучении его нейтронами. Захватывая свободный нейтрон, ядро изотопа урана 235U делится, при этом выделяется (в расчёте на одно ядро урана) достаточно большая энергия, в основном за счёт кинетической энергии осколков и излучения. Позднее теория этого явления была обоснована Лизой Мейтнер и Отто Фришем и независимо от них Готтфридом фон Дросте и Зигфридом Флюгге. Данное открытие явилось истоком как мирного, так и военного использования внутриатомной энергии.
В 1939—1940 годах Ю. Б. Харитон и Я. Б. Зельдович впервые теоретически показали, что при небольшом обогащении природного урана ураном-235 можно создать условия для непрерывного деления атомных ядер, то есть придать процессу цепной характер.
2 декабря 1942 года в США была экспериментально доказана теория о возможности процесса превращения урана в плутоний.
Физические свойства
Уран — очень тяжёлый, серебристо-белый глянцевитый металл. В чистом виде он немного мягче стали, ковкий, гибкий, обладает небольшими парамагнитными свойствами. Температура плавления 1132,3 °C. Уран имеет три кристаллические модификации:
- α-U, (стабильна до 667,7 °C), ромбическая сингония, пространственная группа C mcm, параметры ячейки a = 0,2858 нм, b = 0,5877 нм, c = 0,4955 нм, Z = 4;
- β-U, (стабильна от 667,7 °C до 774,8 °C), тетрагональная сингония, пространственная группа P 42/mnm, параметры ячейки a = 1,0759 нм, c = 0,5656 нм, Z = 30;
- γ-U, (существующей от 774,8 °C до точки плавления), кубическая сингония, пространственная группа I m3m, параметры ячейки a = 0,3524 нм, Z = 2.
Химические свойства
Характерные степени окисления
Уран может проявлять степени окисления от +3 до +6.
| Степень окисления | Оксид | Гидроксид | Характер | Форма | Примечание |
|---|---|---|---|---|---|
| +3 | Не существует | Не существует | — | U3+, UH3 | Сильный восстановитель |
| +4 | UO2 | Не существует | Основный | UO2, галогениды | |
| +5 | Не существует | Не существует | — | Галогениды | В воде диспропорционирует |
| +6 | UO3 | UO2(OH)2 | Амфотерный | UO22+ (уранил) UO42- (уранат) U2O72- (диуранат) |
Устойчив на воздухе и в воде |
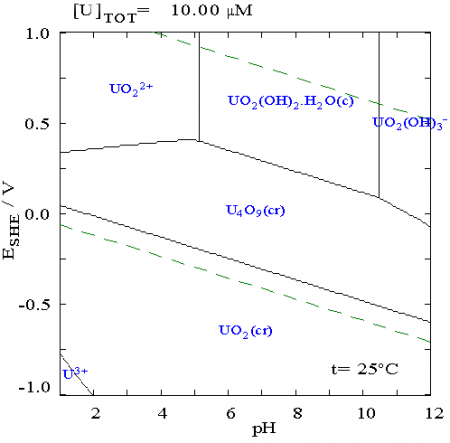
Диаграмма Пурбе для урана.
Кроме того, существует оксид U3O8. Степень окисления в нём формально дробная, а реально он представляет собой смешанный оксид урана (IV) и (VI).
Нетрудно видеть, что по набору степеней окисления и характерных соединений уран близок к элементам VIB подгруппы (хрому, молибдену, вольфраму). Из-за этого его длительное время относили к этой подгруппе («размывание периодичности»).
Свойства простого вещества
Химически уран весьма активен. Он быстро окисляется на воздухе и покрывается радужной плёнкой оксида. Мелкий порошок урана самовоспламеняется на воздухе, он зажигается при температуре 150—175 °C, образуя U3O8. Реакции металлического урана с другими неметаллами приведены в таблице.
| Неметалл | Условия | Продукт |
|---|---|---|
| F2 | +20 oC, бурно | UF6 |
| Cl2 | 180 oC для измельчённого 500—600 oC для компактного |
Смесь UCl4, UCl5, UCl6 |
| Br2 | 650 oC, спокойно | UBr4 |
| I2 | 350 oC, спокойно | UI3, UI4 |
| S | 250—300 oC спокойно 500 oC горит |
US2, U2S3 |
| Se | 250—300 oC спокойно 500 oC горит |
USe2, U2Se3 |
| N2 | 450—700 oC то же под давлением N 1300o |
U4N7 UN2 UN |
| P | 600—1000 oC | U3P4 |
| C | 800—1200 oC | UC, UC2 |
Взаимодействует с водой, вытесняя водород, медленно при низкой температуре, и быстро при высокой, а также при мелком измельчении порошка урана:
-
- U + 2H2O → t UO2 + 2H2↑
В кислотах-неокислителях уран растворяется, образуя UO2 или соли U4+ (при этом выделяется водород). С кислотами-окислителями (азотной, концентрированной серной) уран образует соответствующие соли уранила UO22+
С растворами щелочей уран не взаимодействует.
При сильном встряхивании металлические частицы урана начинают светиться.
Соединения урана III
Соли урана(+3) (преимущественно, галогениды) — восстановители. На воздухе при комнатной температуре они обычно устойчивы, однако при нагревании окисляются до смеси продуктов. Хлор окисляет их до UCl4. Образуют неустойчивые растворы красного цвета, в которых проявляют сильные восстановительные свойства:
-
- 4UCl3 + 2H2O → 3UCl4 + UO2 + 2H2↑
Галогениды урана III образуются при восстановлении галогенидов урана (IV) водородом:
-
- 2UCl4 + H2 → 2UCl3 + 2HCl (550—590 оC)
или йодоводородом:
-
- 2UCl4 + 2HI → 2UCl3 + 2HCl + I2 (500 оC)
а также при действии галогеноводорода на гидрид урана UH3.
Кроме того, существует гидрид урана (III) UH3. Его можно получить, нагревая порошок урана в водороде при температурах до 225 оC, а выше 350 оC он разлагается. Большую часть его реакций (например, реакцию с парами воды и кислотами) можно формально рассматривать как реакцию разложения с последующей реакцией металлического урана:
-
- UH3 + 3HCl → UCl3 + 3H2↑
- 2UH3 + 7Cl2 → 2UCl4 + 6HCl
Соединения урана IV
Уран (+4) образует легко растворимые в воде соли зелёного цвета. Они легко окисляются до урана (+6)
Соединения урана V
Соединения урана(+5) неустойчивы и легко диспропорционируют в водном растворе:
-
- 2UO2Cl → UO2Cl2 + UO2
Хлорид урана V при стоянии частично диспропорционирует:
-
- 2UCl5 → UCl4 + UCl6
а частично отщепляет хлор:
-
- 2UCl5 → 2UCl4 + Cl2
Соединения урана VI
Степени окисления +6 соответствует оксид UO3. В кислотах он растворяется с образованием соединений катиона уранила UO22+:
-
- UO3 + 2CH3COOH → UO2(CH3COO)2 + H2O
C основаниями UO3 (аналогично CrO3, MoO3 и WO3) образует различные уранат-анионы (в первую очередь, диуранат U2O72-). Последние, однако, чаще получают действием оснований на соли уранила:
-
- 2UO2(CH3COO)2 + 6NaOH → Na2U2O7 + 4CH3COONa + 3H2O
Из соединений урана (+6), не содержащих кислород, известны только гексахлорид UCl6 и фторид UF6. Последний играет важнейшую роль в разделении изотопов урана.
Соединения урана (+6) наиболее устойчивы на воздухе и в водных растворах.
Ураниловые соли, такие, как уранилхлорид, распадаются на ярком свету или в присутствии органических соединений.
Уран также образует ураноорганические соединения.
Изотопы
Радиоактивные свойства некоторых изотопов урана (жирным выделены природные изотопы):
| 238 | 4,47⋅109 лет | α |
|---|---|---|
| 235 | 7,13⋅108 лет | α |
| 234 | 2,45⋅105 лет | α |
| Массовое число | Период полураспада | Основной тип распада |
| 233 | 1,59⋅105 лет | α |
| 236 | 2,39⋅107 лет | α |
| 237 | 6,75 сут. | β− |
| 239 | 23,54 минуты | β− |
| 240 | 14 часов | β− |
Природный уран состоит из смеси трёх изотопов: 238U (изотопная распространённость 99,2745 %, период полураспада T1/2 = 4,468⋅109 лет), 235U (0,7200 %, T1/2 = 7,04⋅108 лет) и 234U (0,0055 %, T1/2 = 2,455⋅105 лет). Последний изотоп является не первичным, а радиогенным, он входит в состав радиоактивного ряда 238U.
Радиоактивность природного урана обусловлена в основном изотопами 238U и его дочерним нуклидом 234U. В равновесии их удельные активности равны. Удельная активность изотопа 235U в природном уране в 21 раз меньше активности 238U.
На данный момент известно 23 искусственных радиоактивных изотопа урана с массовыми числами от 217 до 242. Наиболее важный из них — 233U (T1/2 = 1,59⋅105 лет) получается при облучении тория-232 нейтронами и способен к делению под воздействием тепловых нейтронов, что делает его перспективным топливом для ядерных реакторов. Наиболее долгоживущим из изотопов урана, не встречающихся в природе, является 236U с периодом полураспада 2,39⋅107 лет.
Изотопы урана 238U и 235U являются родоначальниками двух радиоактивных рядов. Конечными элементами этих рядов являются изотопы свинца 206Pb и 207Pb.
В природных условиях распространены в основном изотопы 234U, 235U и 238U с относительным содержанием 234U : 235U : 238U = 0,0054 : 0,711 : 99,283. Почти половина радиоактивности природного урана обусловлена изотопом 234U, который, как уже отмечено, образуется в ходе распада 238U. Для отношения содержаний 235U : 238U, в отличие от других пар изотопов и независимо от высокой миграционной способности урана, характерно географическое постоянство: 238U/235U = 137,88. Величина этого отношения в природных образованиях не зависит от их возраста. Многочисленные натурные измерения показали его незначительные колебания. Так, в роллах величина этого отношения относительно эталона изменяется в пределах 0,9959—1,0042, в солях — 0,996—1,005. В урансодержащих минералах (настуран, урановая чернь, циртолит, редкоземельные руды) величина этого отношения колеблется в пределах 137,30—138,51, причём различие между формами UIV и UVI не установлено; в сфене — 138,4. В отдельных метеоритах выявлен недостаток изотопа 235U. Наименьшая его концентрация в земных условиях найдена в 1972 году французским исследователем Бужигесом в местечке Окло в Африке (месторождение в Габоне). Так, в природном уране содержится 0,720 % урана 235U, а в Окло оно составляет 0,557 %. Это послужило подтверждением гипотезы о существовании природного ядерного реактора, который стал причиной выгорания изотопа 235U. Гипотеза была высказана американскими учёными Джорджем Ветриллом, Марком Ингрэмом и Полом Курода, ещё в 1956 г. описавшим процесс. Кроме этого, в этих же округах найдены природные ядерные реакторы: Окелобондо, Бангомбе (Bangombe) и другие. В настоящее время известно 17 природных ядерных реакторов, которые обычно объединяют под общим названием «Природный ядерный реактор в Окло».
Нахождение в природе
Уран является элементом с самым большим номером из встречающихся в больших количествах. Содержание в земной коре составляет 0,00027 % (вес.), концентрация в морской воде — 3,2 мкг/л (по другим данным, 3,3·10-7%). Количество урана в литосфере оценивается в 3 или 4·10−4%.
Основная масса урана находится в кислых породах с высоким содержанием кремния. Значительная масса урана сконцентрирована в осадочных породах, особенно богатых органикой. В больших количествах как примесь уран присутствует в ториевых и редкоземельных минералах (алланит (Ca,LREE,Th)2(Al,Fe+3)3[SiO4][Si2O7]OOH, монацит (La,Ce)PO4, циркон ZrSiO4, ксенотим YPO4 и др.). Важнейшими урановыми рудами являются настуран (урановая смолка, уранинит) и карнотит. Основными минералами-спутниками минералов урана являются молибденит MoS2, галенит PbS, кварц SiO2, кальцит CaCO3, гидромусковит и др.
| Минерал | Основной состав минерала | Содержание урана, % |
|---|---|---|
| Уранинит | UO2, UO3 + ThO2, CeO2 | 65-74 |
| Карнотит | K2(UO2)2(VO4)2·2H2O | ~50 |
| Казолит | PbO2·UO3·SiO2·H2O | ~40 |
| Самарскит | (Y, Er, Ce, U, Ca, Fe, Pb, Th)·(Nb, Ta, Ti, Sn)2O6 | 3,15-14 |
| Браннерит | (U, Ca, Fe, Y, Th)3Ti5O15 | 40 |
| Тюямунит | CaO·2UO3·V2O5·nH2O | 50-60 |
| Цейнерит | Cu(UO2)2(AsO4)2·nH2O | 50-53 |
| Отенит | Ca(UO2)2(PO4)2·nH2O | ~50 |
| Шрекингерит | Ca3NaUO2(CO3)3SO4(OH)·9H2O | 25 |
| Уранофан | CaO·UO2·2SiO2·6H2O | ~57 |
| Фергюсонит | (Y, Ce)(Fe, U)(Nb, Ta)O4 | 0,2-8 |
| Торбернит | Cu(UO2)2(PO4)2·nH2O | ~50 |
| Коффинит | U(SiO4)(OH)4 | ~50 |
Основными формами нахождений урана в природе являются уранинит, настуран (урановая смолка) и урановые черни. Они отличаются только формами нахождения; имеется возрастная зависимость: уранинит присутствует преимущественно в древних (докембрийских породах), настуран — вулканогенный и гидротермальный — преимущественно в палеозойских и более молодых высоко- и среднетемпературных образованиях; урановые черни — в основном в молодых — кайнозойских и моложе — образованиях преимущественно в низкотемпературных осадочных породах.
Месторождения
Количество урана в земной коре примерно в 1000 раз превосходит количество золота, в 30 раз — серебра, при этом данный показатель приблизительно равен аналогичному показателю у свинца и цинка. Немалая часть урана рассеяна в почвах, горных породах и морской воде. Только относительно небольшая часть концентрируется в месторождениях, где содержание данного элемента в сотни раз превышает его среднее содержание в земной коре. По оценке 2015 года разведанные мировые запасы урана в месторождениях составляют более 5,7 млн тонн.
Крупнейшие запасы урана, с учётом резервных месторождений, имеют: Австралия, Казахстан (первое место в мире по добыче), Россия. По оценке 2015 года, в месторождениях России содержится около 507 800 тонн запасов урана (9 % его мировых запасов); около 63 % их сосредоточено в Республике Саха (Якутия). Основными месторождениями урана в России являются: Стрельцовское, Октябрьское, Антей, Мало-Тулукуевское, Аргунское молибден-урановые в вулканитах (Забайкальский край), Далматовское урановое в песчаниках (Курганская область), Хиагдинское урановое в песчаниках (Республика Бурятия), Южное золото-урановое в метасоматитах и Северное урановое в метасоматитах (Республика Якутия). Кроме того, выявлено и оценено множество более мелких урановых месторождений и рудопроявлений.
| № | Название месторождения | Страна | Запасы, т | Оператор месторождения | начало разработки |
|---|---|---|---|---|---|
| 1 | Северный Хорасан | Казахстан | 200 000 | Казатомпром | 2008 |
| 2 | Мак-Артур-Ривер | Австралия | 160 000 | Cameco | 1999 |
| 3 | Сигар-Лейк | Канада | 135 000 | Cameco | |
| 4 | Южное Эльконское | Россия | 112 600 | Атомредметзолото | |
| 5 | Инкай | Казахстан | 75 900 | Казатомпром | 2007 |
| 6 | Стрельцовское | Россия | 50 000 | Атомредметзолото | |
| 7 | Зоовч Овоо | Монголия | 50 000 | AREVA | |
| 8 | Моинкум | Казахстан | 43 700 | Казатомпром, AREVA | |
| 9 | Мардай | Монголия | 22 000 | Khan Resources, Атомредметзолото, Правительство Монголии | |
| 10 | Ирколь | Казахстан | 18 900 | Казатомпром, China Guangdong Nuclear Power Co | 2009 |
| 11 | Жёлтые Воды | Украина | 12 000 | ВостГок | 1959 |
| 12 | Олимпик-Дэм | Австралия | 1988 | ||
| 13 | Россинг | Намибия | 1976 | ||
| 13 | Доминион | ЮАР | 2007 | ||
| 13 | Рейнджер | Австралия | 1980 |
Получение
Самая первая стадия уранового производства — концентрирование. Породу дробят и смешивают с водой. Тяжёлые компоненты взвеси осаждаются быстрее. Если порода содержит первичные минералы урана, то они осаждаются быстро: это тяжёлые минералы. Вторичные минералы урана легче, в этом случае раньше оседает тяжёлая пустая порода. (Впрочем, далеко не всегда она действительно пустая; в ней могут быть многие полезные элементы, в том числе и уран).
Следующая стадия — выщелачивание концентратов, перевод урана в раствор. Применяют кислотное и щелочное выщелачивание. Первое — дешевле, поскольку для извлечения урана используют серную кислоту. Но если в исходном сырье, как, например, в урановой смолке, уран находится в четырёхвалентном состоянии, то этот способ неприменим: четырёхвалентный уран в серной кислоте практически не растворяется. В этом случае нужно либо прибегнуть к щелочному выщелачиванию, либо предварительно окислять уран до шестивалентного состояния.
Не применяют кислотное выщелачивание и в тех случаях, если урановый концентрат содержит доломит или магнезит, реагирующие с серной кислотой. В этих случаях пользуются едким натром (гидроксидом натрия).
Проблему выщелачивания урана из руд решает кислородная продувка. В нагретую до 150 °C смесь урановой руды с сульфидными минералами подают поток кислорода. При этом из сернистых минералов образуется серная кислота, которая и вымывает уран.
На следующем этапе из полученного раствора нужно избирательно выделить уран. Современные методы — экстракция и ионный обмен — позволяют решить эту проблему.
Раствор содержит не только уран, но и другие катионы. Некоторые из них в определённых условиях ведут себя так же, как уран: экстрагируются теми же органическими растворителями, оседают на тех же ионообменных смолах, выпадают в осадок при тех же условиях. Поэтому для селективного выделения урана приходится использовать многие окислительно-восстановительные реакции, чтобы на каждой стадии избавляться от того или иного нежелательного попутчика. На современных ионообменных смолах уран выделяется весьма селективно.
Методы ионного обмена и экстракции хороши ещё и тем, что позволяют достаточно полно извлекать уран из бедных растворов (содержание урана — десятые доли грамма на литр).
После этих операций уран переводят в твёрдое состояние — в один из оксидов или в тетрафторид UF4. Но этот уран ещё надо очистить от примесей с большим сечением захвата тепловых нейтронов — бора, кадмия, гафния. Их содержание в конечном продукте не должно превышать стотысячных и миллионных долей процента. Для удаления этих примесей технически чистое соединение урана растворяют в азотной кислоте. При этом образуется уранилнитрат UO2(NO3)2, который при экстракции трибутил-фосфатом и некоторыми другими веществами дополнительно очищается до нужных кондиций. Затем это вещество кристаллизуют (или осаждают пероксид UO4·2H2O) и начинают осторожно прокаливать. В результате этой операции образуется трёхокись урана UO3, которую восстанавливают водородом до UO2.
На диоксид урана UO2 при температуре от 430 до 600 °C воздействуют газообразным фтористым водородом для получения тетрафторида UF4. Из этого соединения восстанавливают металлический уран с помощью кальция или магния.
Применение
Ядерное топливо
Наибольшее применение имеет изотоп урана 235U, в котором возможна самоподдерживающаяся цепная ядерная реакция. Поэтому этот изотоп используется как топливо в ядерных реакторах, а также в ядерном оружии. Выделение изотопа 235U из природного урана — сложная технологическая проблема (см. разделение изотопов).
Приведём некоторые цифры для реактора мощностью 1000 МВт, работающего с нагрузкой в 80 %, и вырабатывающего 7000 ГВт·ч в год. Работа одного такого реактора в течение года требует 20 тонн уранового топлива с содержанием 3,5 % 235U, который получают после обогащения примерно 153 тонн природного урана.
Изотоп 238U способен делиться под влиянием бомбардировки высокоэнергетическими нейтронами, эту его особенность используют для увеличения мощности термоядерного оружия (используются нейтроны, порождённые термоядерной реакцией).
В результате захвата нейтрона с последующим β-распадом 238U может превращаться в 239Pu, который затем используется как ядерное топливо.
Уран-233, искусственно получаемый в реакторах из тория (торий-232 захватывает нейтрон и превращается в торий-233, который распадается в протактиний-233 и затем в уран-233), может в будущем стать распространённым ядерным топливом для атомных электростанций (уже сейчас существуют реакторы, использующие этот нуклид в качестве топлива, например, KAMINI в Индии) и производства атомных бомб (критическая масса около 16 кг).
Уран-233 также является наиболее перспективным топливом для газофазных ядерных ракетных двигателей.
Тепловыделяющая способность урана
Полное использование заключённой в уране потенциальной энергии пока технически невозможно. Величина выделившейся в ядерном реакторе полезной энергии урана характеризуется понятием глубины выгорания. Глубина выгорания — это суммарная энергия, отданная килограммом урана за все время работы в реакторе, от свежего топлива до утилизации. Измеряют глубину выгорания обычно в таких единицах как мегаватт-часы выделившейся тепловой энергии на килограмм топлива (МВт·час/кг). Иногда её приводят в пересчёте к реакторному урану того обогащения, которое загружается в реактор, не учитывая обеднённый уран в отвалах обогатительных производств, а иногда в пересчёте на природный уран.
Глубина выгорания ограничена особенностями конкретного типа реактора, конструктивной целостностью топливной матрицы и накоплением паразитных продуктов ядерных реакций. Глубина выгорания в пересчёте на природный уран в современных энергетических реакторах достигает 10 МВт·сутки/кг и более (то есть 240 МВт·час/кг и более). Для сравнения, типичное тепловыделение природного газа 0,013 МВт·час/кг, то есть примерно в 20 000 раз меньше.
Существуют проекты значительно более полного использования урана за счёт трансмутации урана-238 в плутоний. Наиболее проработанным является проект так называемого замкнутого топливного цикла на основе реакторов на быстрых нейтронах. Также развиваются проекты на основе гибридных термоядерных реакторов.
Производство искусственных изотопов
Изотопы урана являются исходным веществом для синтеза многих искусственных (нестабильных) изотопов, применяемых в промышленности и медицине. Наиболее известными искусственными изотопами, синтезируемыми из урана, являются изотопы плутония. Многие другие трансурановые элементы также получают из урана.
В медицине широкое применение нашёл изотоп молибден-99, одним из способов получения которого является выделение из продуктов деления урана, появляющихся в облучённом ядерном топливе.
Геология
Основное применение урана в геологии — определение возраста минералов и горных пород с целью выяснения последовательности протекания геологических процессов. Этим занимается раздел геохронологии, носящий название радиоизотопное датирование. Существенное значение имеет также решение задачи о смешении и источниках вещества.
В основе решения задачи лежат уравнения радиоактивного распада:
-
- N206Pb = N238U(eλ238t−1),
- N207Pb = N235U (eλ235t−1) , где N238U, N235U — современные концентрации изотопов урана; λ238 и λ235 — постоянные распада соответственно 238U и 235U.
Весьма важной является их комбинация:
-
- N206Pb (eλ238t − 1)
- N207Pb = KoU (eλ235t−1).
Здесь
-
- KoU = N238U = 137.88
- N235U — современное отношение концентраций изотопов урана.
В связи с тем, что горные породы содержат различные концентрации урана, они обладают различной радиоактивностью. Это свойство используется при анализе горных пород геофизическими методами. Наиболее широко этот метод применяется в нефтяной геологии при геофизических исследованиях скважин, в этот комплекс входит, в частности, гамма-каротаж или нейтронный гамма-каротаж, гамма-гамма-каротаж и так далее. С их помощью происходит выделение коллекторов и флюидоупоров.
Другие сферы применения
- Небольшая добавка урана придаёт красивую жёлто-зелёную флуоресценцию стеклу (см. Урановое стекло).
- Уранат натрия Na2U2O7 использовался как жёлтый пигмент в живописи.
- Соединения урана применялись как краски для живописи по фарфору и для керамических глазурей и эмалей (окрашивают в цвета: жёлтый, бурый, зелёный и чёрный, в зависимости от степени окисления).
- Некоторые соединения урана светочувствительны.
- В начале XX века уранилнитрат широко применялся для усиления негативов и окрашивания (тонирования) позитивов (фотографических отпечатков) в бурый цвет.
- Карбид урана-235 в сплаве с карбидом ниобия и карбидом циркония применяется в качестве топлива для ядерных реактивных двигателей (рабочее тело — водород + гексан).
- Сплавы железа и обеднённого урана (уран-238) применяются как мощные магнитострикционные материалы.
- Ацетат уранила UO2(CH3COO)2 и ацетат цинка-уранила Zn[(UO2)3(CH3COO)8] применяются в аналитической химии при проведении качественного и количественного анализа катионов лития и натрия.
Обеднённый уран
После извлечения 235U и 234U из природного урана, оставшийся материал (уран-238) носит название «обеднённый уран», так как он обеднён 235-м изотопом. По некоторым данным, в США хранится около 560 000 тонн обеднённого гексафторида урана (UF6). Обеднённый уран в два раза менее радиоактивен, чем природный уран, в основном за счёт удаления из него 234U.
Из-за того, что основное использование урана — производство энергии, обеднённый уран — малополезный продукт с низкой экономической ценностью.
Сколь-нибудь эффективным ядерным топливом обеднённый уран может служить только в редких экстремальных условиях, например, в пучке быстрых нейтронов. В таком качестве обеднённый уран используется только в термоядерном оружии — обеднённые урановые элементы в составе термоядерного заряда, не являясь необходимыми для, собственно, реакции ядерного синтеза, могут обеспечивать до 80 % суммарной энергии заряда.
В обычных же условиях использование обеднённого урана связано в основном с его большой плотностью и относительно низкой стоимостью. Обеднённый уран используется для радиационной защиты (как это ни странно) благодаря чрезвычайно высокому сечению захвата. Обеднённый уран применяется также в качестве балластной массы в аэрокосмических приложениях, таких как рулевые поверхности летательных аппаратов. В первых экземплярах самолёта «Боинг-747» содержалось от 300 до 500 кг обеднённого урана для этих целей (с 1981 года «Боинг» применяет вольфрам). Кроме того, этот материал применяется в высокоскоростных роторах гироскопов, больших маховиках, как балласт в космических спускаемых аппаратах и гоночных яхтах, болидах «Формулы-1», при бурении нефтяных скважин.
Сердечники бронебойных снарядов
Сердечник (вкладыш) снаряда калибра 30 мм (пушки GAU-8 самолёта A-10) диаметром около 20 мм из обеднённого урана
Самое известное применение обеднённого урана — в качестве сердечников для бронебойных снарядов. Большая плотность (в три раза тяжелее стали) делает закалённую урановую болванку чрезвычайно эффективным средством для пробивания брони, аналогичным по эффективности более дорогому и ненамного более тяжёлому вольфраму. Тяжёлый урановый наконечник также изменяет распределение масс в снаряде, улучшая его аэродинамическую устойчивость.
Подобные сплавы типа «Стабилла» применяются в стреловидных оперённых снарядах танковых и противотанковых артиллерийских орудий.
Процесс разрушения брони сопровождается измельчением в пыль урановой болванки и воспламенением её на воздухе с другой стороны брони (см. Пирофорность). Около 300 тонн обеднённого урана остались на поле боя во время операции «Буря в Пустыне» (по большей части это остатки снарядов 30-мм пушки GAU-8 штурмовых самолётов A-10, каждый снаряд содержит 272 г уранового сплава). Усовершенствованные американские танки M1A1, снабжённые 120-мм орудиями, сражались с иракскими Т-72. В этих боях американские силы применяли снаряды с обеднённым ураном M829A1, которые показали высокую эффективность. Снаряд, прозванный «серебряной пулей», был способен пробить эквивалент 570-мм брони с расстояния в 2000 метров, что делало его на стандартной дистанции эффективным даже против Т-80.
Такие снаряды были использованы войсками НАТО в боевых действиях на территории Косово. После их применения обсуждалась экологическая проблема радиационного загрязнения территории страны.
Обеднённый уран используется в современной танковой броне, например, танка M-1 «Абрамс».
Физиологическое действие
В микроколичествах (10−5—10−8 %) обнаруживается в тканях растений, животных и человека. В наибольшей степени накапливается некоторыми грибами и водорослями. Соединения урана всасываются в желудочно-кишечном тракте (около 1 %), в лёгких — 50 %. Основные депо в организме: селезёнка, почки, скелет, печень, лёгкие и бронхо-лёгочные лимфатические узлы. Содержание в органах и тканях человека и животных не превышает 10−7 г.
Уран и его соединения токсичны. Особенно опасны аэрозоли урана и его соединений. Для аэрозолей растворимых в воде соединений урана ПДК в воздухе 0,015 мг/м³, для нерастворимых форм урана ПДК 0,075 мг/м³. При попадании в организм уран действует на все органы, являясь общеклеточным ядом. Уран, как и многие другие тяжёлые металлы, практически необратимо связывается с белками, прежде всего с сульфидными группами аминокислот, нарушая их функцию. Молекулярный механизм действия урана связан с его способностью подавлять активность ферментов. В первую очередь поражаются почки (появляются белок и сахар в моче, олигурия). При хронической интоксикации возможны нарушения кроветворения и нервной системы.
Добыча урана
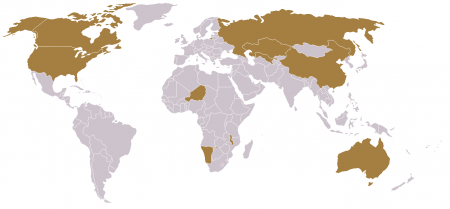
10 стран, дающих 94 % мировой добычи урана
Согласно «Красной книге по урану», выпущенной ОЭСР, в 2005 г. добыто 41 250 тонн урана (в 2003 — 35 492 тонны). Согласно данным ОЭСР, в мире функционирует 440 реакторов коммерческого назначения и около 60 научных, которые потребляли в год 67 тысяч тонн урана. Это означает, что его добыча из месторождений обеспечивала лишь 60 % объёма его потребления (на 2009 год эта доля возросла до 79 %). Остальной уран, потребляемый энергетикой, или 17,7 %, поступал из вторичных источников. На 2016-2017 год потребность в ядерном топливе, 449 действующих реакторов составляла те же 65 000 тонн урана. Первичные источники обеспечили около 85 %, а вторичные источники 15 % (оружейный уран, запасы от переработки отработанного топлива, а также за счёт повторного обогащения хвостов (остатков от первоначального обогащения).
Примечания:
- 1 Не включая 5 судов Атомфлота с 7 реакторами и 129 судов ВМФ различных стран со 177 реакторами на борту.
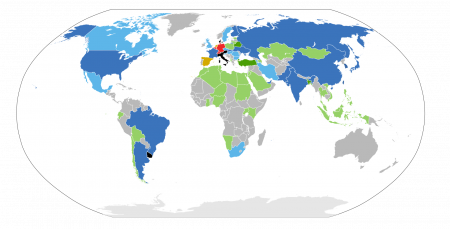
Страны с АЭС: Эксплуатируются АЭС, строятся новые энергоблоки. Эксплуатируются АЭС, планируется строительство новых энергоблоков. Нет АЭС, станции строятся. Нет АЭС, планируется строительство. Эксплуатируются АЭС, строительство новых пока не планируется. Эксплуатируются АЭС, рассматривается сокращение их количества. Гражданская ядерная энергетика запрещена законом. Нет АЭС.
Добыча по странам
В тоннах.
| № | Страна | 2005 год | Страна | 2009 год | Страна | 2012 год | Страна | 2015 год | Страна | 2017 год |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Канада | 11 628 | Казахстан | 14 020 | Казахстан | 19 451 | Казахстан | 23 800 | Казахстан | 23 391 |
| 2 | Австралия | 9516 | Канада | 10 173 | Канада | 9145 | Канада | 13 325 | Канада | 13 116 |
| 3 | Казахстан | 4020 | Австралия | 7982 | Австралия | 5983 | Австралия | 5654 | Австралия | 5882 |
| 4 | Россия | 3570 | Намибия | 4626 | Нигер | 4351 | Нигер | 4116 | Намибия | 4224 |
| 5 | Намибия | 3147 | Россия | 3564 | Намибия | 3258 | Намибия | 2993 | Нигер | 3449 |
| 6 | Нигер | 3093 | Нигер | 3234 | Узбекистан | 3000 | Россия | 3055 | Россия | 2917 |
| 7 | Узбекистан | 2300 | Узбекистан | 2429 | Россия | 2993 | Узбекистан | 2385 | Узбекистан | 2404 |
| 8 | США | 1039 | США | 1453 | США | 1537 | Китай | 1616 | Китай | 1885 |
| 9 | Украина | 800 | Китай | 1200 | Китай | 1500 | США | 1256 | США | 940 |
| 10 | Китай | 750 | Украина | 840 | Украина | 890 | Украина | 1200 | Украина | 550 |
| Итого | 39 863 | 49 521 | 52 108 | 59 400 | 58 758 |
Добыча по компаниям
В тоннах.
| № | Страна | Компания | 2006 год | Страна | Компания | 2009 год | Страна | Компания | 2011 год | Страна | Компания | 2018 год |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Cameco | 8100 (24 %) | Areva | 8600 ▲ (19 %) | Казатомпром | 8884 ▲ (19 %) | Казатомпром | 11074 ▲ (26 %) | ||||
| 2 | Rio Tinto | 7000 (21 %) | Cameco | 8000▼ (18 %) | Areva | 8790▲(19 %) | АРМЗ | 7289▲ (16 %) | ||||
| 3 | Areva | 5000 (15 %) | Rio Tinto | 7900▲(18 %) | Cameco | 8630▲ (19 %) | Orano/Areva | 5809▼ (13 %) | ||||
| 4 | Казатомпром | 3800 (11 %) | Казатомпром | 7500▲ (17 %) | АРМЗ | 7088▲ (15 %) | Cameco | 4613▼ (11 %) | ||||
| 5 | АРМЗ | 3500 (10 %) | АРМЗ | 4600▲ (10 %) | Rio Tinto | 4061▼ (9 %) | CGN | 3185▲ (7 %) | ||||
| 6 | BHP Billiton | 3000 (9 %) | BHP Billiton | 2900▼ (6 %) | BHP Billiton | 3353▲(7 %) | BHP Billiton | 3159▼ (7 %) | ||||
| 7 | Навоийский ГМК | 2100 (4 %) | Навоийский ГМК | 2400▲ (5 %) | Навоийский ГМК | 3000▲ (6 %) | Rio Tinto | 2602▼ (6 %) | ||||
| 8 | Uranium One | 1000 (3 %) | Uranium One | 1400▲ (3 %) | Paladin Energy | 2282▲ (5 %) | Navoi | 2404▼ (5 %) | ||||
| 9 | Heathgate | 800 (2 %) | Paladin Energy | 1200▲ (3 %) | SOPamin | Н/Д▲(менее 1 %) | Energy Asia | 2204▲ (5 %) | ||||
| 10 | Denison Mines | 500 (1 %) | General Atomics | 600▲ (1 %) | CNNC | Н/Д▲ (менее 1 %) | CNNC | 1983▬ (4 %) | ||||
| Итого | 34 800 (100 %) | 45 100 (100 %) | более 46 088 (100 %) | 44 322 (100 %) |
Примечания к таблице:
- 1 Данные по АРМЗ даны с учётом приобретённой в 2010 году компании Uranium One . Основным способом добычи урана с 2010 г. стало скважинное подземное выщелачивание. С целью гарантированного долгосрочного сырьевого обеспечения отраслевых потребностей в уране «Росатом» приобрёл канадскую компанию Uranium One и консолидировал на её основе высокоэффективные урановые активы в Казахстане и других странах. За последние 8 лет производство Uranium One выросло почти в 5 раз, что позволило выйти на четвёртое место в мире среди урановых компаний.
- 2 Оrano SA (до 2018 года Areva) — Переименование было произведено после того, как Areva оказалась на грани банкротства, контрольный пакет остался у правительства Франции.
Также в 2012 году появилялась информация о возможном слиянии урановых подразделений BHP Billiton и Rio Tinto и доведения совместной добычи до 8000 тонн в год.
Уран из вторичных источников
Вторичными источниками традиционно считаются — запасы из ядерного оружия, от переработки отработанного топлива и повторного обогащения хвостов (остатков от первоначального обогащения). Повторное обогащение отвалов, критично (взаимно и неотъемлемо) для использования оружейного урана в мирных целях.
В конце июля 1991 года в Москве СССР и США подписали Договор СНВ-I.
Преемником СССР в декабре 1991 года стала Россия, но ядерное вооружение находилось и в других бывших республиках СССР.
На начало 1992 года на территории России размещалась 961 пусковая установка (73 % от общего количества).
23 мая 1992 года в Лиссабоне Россией, США, Украиной, Казахстаном и Белоруссией был подписан дополнительный протокол к СНВ-1 (Лиссабонский протокол), в соответствии с которым к договору СНВ-1 присоединились Украина, Казахстан и Белоруссия. Все имеющиеся на их территории боеголовки они обязались ликвидировать или передать России.
В конце 1992, Россия, в связи с нежеланием Украины выполнять Лиссабонский протокол, обязалась демонтировать почти половину своих запасов ядерного оружия (около 35 % от запасов СССР) и переработать высвободившийся оружейный уран в металл топливного сорта. США в свою очередь обязались приобрести этот материал по рыночным ценам.
К концу 1996 года на всём постсоветском пространстве Россия осталась единственной страной входящей в ядерный клуб, а все запасы СССР были сосредоточены на eё территории для последующей переработки в соответствии с договором СНВ-1.
Вместе с тем началось повторное обогащение урановых отвалов и переработка ОЯТ. План по переработке предусматривал начало работ с отвалов уровня месторождений III категории (рядовые) от 0,05 до 0,1 % аффинаж менее 60 %. Однако в середине и конце 1990-х годов обогащающие предприятия начали повторно обогащать отвалы для производства разбавителя по соглашению ВОУ-НОУ, в связи с нестабильностью получаемого топлива из отвалов.
Соглашение ВОУ-НОУ было рассчитано на 20 лет, закончило действовать в 2013 году. Всего в рамках программы из России в США было вывезено 14 446 тонн низкообогащённого урана:
- по договору СНВ-II 352 тонны — из оговорённых 500 (несмотря на то, что договор не вступил в силу, в связи с выходом России из договора 14 июня 2002);
- по договору СНВ-I (вступил в силу 5 декабря 1994 года, истёк 5 декабря 2009 года) с российской стороны 500 тонн;
- по договору СНВ-III (ДСНВ) — договор подписан 8 апреля 2010 года в Праге. Договор сменил истёкший в декабре 2009 года СНВ-I и действует до 2021 года.
Добыча в СССР
В СССР основными уранорудными регионами были Украинская ССР (месторождение Желтореченское, Первомайское и другие), Казахская ССР (Северный — Балкашинское рудное поле и другие; Южный — Кызылсайское рудное поле и другие; Восточный; все они принадлежат преимущественно вулканогенно-гидротермальному типу); Забайкалье (Антей, Стрельцовское и другие); регион Кавказских Минеральных Вод (Рудник № 1 в горе Бештау и Рудник № 2 в горе Бык); Средняя Азия, в основном Узбекская ССР с оруденениями в чёрных сланцах с центром в городе Учкудук. Имеется масса мелких рудопроявлений и проявлений.
Добыча в России
В России основным урановорудным регионом осталось Забайкалье. На месторождении в Забайкальском крае (около города Краснокаменска) добывается около 93 % российского урана. Добычу осуществляет шахтным способом «Приаргунское производственное горно-химическое объединение» (ППГХО), входящее в состав ОАО «Атомредметзолото» (Урановый холдинг).
Остальные 7 % получают методом подземного выщелачивания ЗАО «Далур» (Курганская область) и ОАО «Хиагда» (Бурятия).
Полученные руды и урановый концентрат перерабатываются на Чепецком механическом заводе.
На 2008 г по годовому производству урана (около 3,3 тысячи тонн) Россия занимала 4-е место после Казахстана. Годовое же потребление урана в России составляло 16 тысяч тонн и складывалось из расходов на собственные АЭС в объёме 5,2 тысячи тонн, а также на экспорт тепловыделяющих средств (5,5 тысячи тонн) и низкообогащённого урана (6 тысяч тонн).
Добыча в Казахстане
В Казахстане сосредоточена примерно пятая часть мировых запасов урана (21 % и 2-е место в мире). Общие ресурсы урана порядка 1,5 млн тонн, из них около 1,1 млн тонн можно добывать методом подземного выщелачивания.
В 2009 году Казахстан вышел на первое место в мире по добыче урана (добыто 13 500 тонн).
Добыча на Украине
Добыча и переработка — основное предприятие — Восточный горно-обогатительный комбинат в городе Жёлтые Воды.
Стоимость и аффинаж
Горнодобывающие компании поставляют уран в виде закиси-окиси урана U3O8. В 1990-е годы стоимость урана природного изотопного состава колебалась вокруг отметки 20 USD за килограмм. С 2004 года цена начала активно расти и кратковременно достигла пиковых $300 в середине 2007 года, столь же резко обвалившись до $100 к 2009 году. Обновив в 2011 году кратковременный локальный максимум в $140, цена начала снижаться. С 2017 году цена стабилизировалась на отметке около $40 за килограмм закиси-окиси природного урана.
По мнению вице-председателя урановой группы Александра Бойцова, в мире месторождения I категории с себестоимостью добычи до 40 долл./кг уже почти исчерпаны (2010 год). К 2030 году будут исчерпаны известные крупные месторождения II категории, с себестоимостью до 80 долл./кг, и в освоение начнут вовлекаться труднодоступные месторождения III категории с себестоимостью добычи до 130 долл./кг и выше.
На всех этапах переработки урановых руд происходит очистка урана от сопутствующих ему примесей — элементов, обладающих большим сечением захвата нейтронов (гафний, бор, кадмий и т. д.). Наилучшие концентраты содержат 95-96 %, другие всего 60-80 % оксида урана, а остальное более 60 % различных примесей. «В чистом виде» такой уран непригоден в качестве ядерного топлива.
В целом по возможности аффинажа урановые руды делятся на
- I категория — супер богатые содержание свыше 0,3 % аффинаж 95-96 %
- II категория — богатые содержит от 0,1 до 0,3 % аффинаж 60-80 %
- III категория — рядовые от 0,05 до 0,1 % аффинаж менее 60 %
- IV категория — убогие от 0,03 до 0,05 %
- V категория — забалансовые менее 0,03 %.
- 1 Категории пригодные для производства топлива выделены жирным
|
Соединения урана |
|---|
|
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Электрохимический ряд активности металлов |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес A r, стандартный (U) | 238,028 91 (3) | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Уран ( 92 U) — это природный радиоактивный элемент, не имеющий стабильного изотопа. Он имеет два первичных изотопа, уран-238 и уран-235, которые имеют длительный период полураспада и в заметном количестве обнаружены в земной коре. Продукт распада урана-234 также найден. Другие изотопы, такие как уран-233, производятся в реакторах-размножителях. Помимо изотопов, встречающихся в природе или ядерных реакторах, было произведено множество изотопов с гораздо более короткими периодами полураспада, от 214 U до 242 U (за исключением 220 U и 241 U). Стандартный атомный вес из природного урана является238.028 91 (3).
Встречающийся в природе уран состоит из трех основных изотопов : урана-238 ( естественное содержание 99,2739–99,2752%), урана-235 (0,7198–0,7202%) и урана-234 (0,0050–0,0059%). Все три изотопы радиоактивные (то есть, они являются радиоизотопы ), и наиболее распространенным и стабильным является уран-238, с периодом полураспада от4,4683 × 10 9 лет (близко к возрасту Земли ).
Уран-238 — это альфа-излучатель, распадающийся через 18- членный ряд урана до свинца-206. Серия распада урана-235 (исторически называемого актиноураном) состоит из 15 членов и заканчивается свинцом-207. Постоянные скорости распада в этих сериях делают сравнение соотношений родительских и дочерних элементов полезным для радиометрического датирования. Уран-233 выполнен из тория-232 с помощью нейтронной бомбардировки.
Уран-235 важен как для ядерных реакторов, так и для ядерного оружия, потому что это единственный изотоп, существующий в природе в какой-либо заметной степени, который расщепляется в ответ на тепловые нейтроны. Уран-238 важен еще и потому, что он плодороден : он поглощает нейтроны, образуя радиоактивный изотоп, который впоследствии распадается на изотоп плутоний-239, который также является делящимся.
СОДЕРЖАНИЕ
- 1 Список изотопов
- 2 Актиниды против продуктов деления
- 3 Уран-214
- 4 Уран-232
- 5 Уран-233
- 6 Уран-234
- 7 Уран-235
- 8 Уран-236
- 9 Уран-237
- 10 Уран-238
- 11 Уран-239
- 12 Ссылки
Список изотопов
| Нуклид | Историческое название | Z | N | Изотопная масса ( Да ) | Период полураспада | Режим распада | Дочерний изотоп | Спин и паритет | Естественное изобилие (мольная доля) | |
|---|---|---|---|---|---|---|---|---|---|---|
| Энергия возбуждения | Нормальная пропорция | Диапазон вариации | ||||||||
| 214 U | 92 | 122 | 0,52 (+ 0,95−0,21) мс | α | 210 Чт | 0+ | ||||
| 215 U | 92 | 123 | 215.026760 (90) | 1,4 (0,9) мс | α | 211 Чт | 5 / 2- # | |||
| 216 U | 92 | 124 | 216.024760 (30) | 6,9 (2,9) мс | α | 212 Чт | 0+ | |||
| 216м U | 1,4 (0,9) мс | 8+ | ||||||||
| 217 U | 92 | 125 | 217.02437 (9) | 0,85 (0,71) мс | α | 213 Чт | 1/2 — # | |||
| 218 U | 92 | 126 | 218.02354 (3) | 0,35 (0,09) мс | α | 214 Чт | 0+ | |||
| 219 U | 92 | 127 | 219.02492 (6) | 60 (7) мкс | α | 215 Чт | 9/2 + # | |||
| 221 U | 92 | 129 | 221.02640 (11) # | 0,66 (14) мкс | α | 217 Чт | (9/2 +) | |||
| 222 U | 92 | 130 | 222.02609 (11) # | 4,7 (0,7) мкс | α | 218 Чт | 0+ | |||
| β + (10 −6 %) | 222 Па | |||||||||
| 223 U | 92 | 131 | 223.02774 (8) | 65 (12) мкс | α | 219 Чт | 7/2 + # | |||
| 224 U | 92 | 132 | 224.027605 (27) | 396 (17) мкс | α | 220 Тыс | 0+ | |||
| 225 U | 92 | 133 | 225.02939 # | 62 (4) мс | α | 221 Чт | (5/2 +) # | |||
| 226 U | 92 | 134 | 226.029339 (14) | 269 (6) мс | α | 222 Чт | 0+ | |||
| 227 U | 92 | 135 | 227.031156 (18) | 1,1 (0,1) мин | α | 223 Чт | (3/2 +) | |||
| β + (0,001%) | 227 Па | |||||||||
| 228 U | 92 | 136 | 228.031374 (16) | 9,1 (0,2) мин | α (95%) | 224 Чт | 0+ | |||
| ЭК (5%) | 228 Па | |||||||||
| 229 U | 92 | 137 | 229.033506 (6) | 57,8 (0,5) мин | β + (80%) | 229 Па | (3/2 +) | |||
| α (20%) | 225 Чт | |||||||||
| 230 U | 92 | 138 | 230.033940 (5) | 20,23 (0,02) г | α | 226 Чт | 0+ | |||
| SF (1,4 × 10 −10 %) | (различный) | |||||||||
| β + β + (редко) | 230 Чт | |||||||||
| 231 U | 92 | 139 | 231.036294 (3) | 4,2 (0,1) г | EC | 231 Па | (5/2) (+ #) | |||
| α (0,004%) | 227 Чт | |||||||||
| 232 U | 92 | 140 | 232.0371562 (24) | 68,9 (0,4) года | α | 228 Чт | 0+ | |||
| КД (8,9 × 10 -10 %) | 208 Пб 24 Нэ | |||||||||
| КД (5 × 10 -12 %) | 204 рт. Ст. 28 мг | |||||||||
| SF (10 -12 %) | (различный) | |||||||||
| 233 U | 92 | 141 | 233.0396352 (29) | 1,592 (2) × 10 5 лет | α | 229 Чт | 5/2 + | След | ||
| SF (6 × 10 -9 %) | (различный) | |||||||||
| КД (7,2 × 10 −11 %) | 209 Pb 24 Ne | |||||||||
| КД (1,3 × 10 -13 %) | 205 рт. Ст. 28 мг | |||||||||
| 234 U | Уран II | 92 | 142 | 234.0409521 (20) | 2,455 (6) × 10 5 лет | α | 230 Чт | 0+ | [0,000054 (5)] | 0,000050– 0,000059 |
| SF (1,73 × 10 -9 %) | (различный) | |||||||||
| КД (1,4 × 10 −11 %) | 206 рт. Ст. 28 мг | |||||||||
| КД (9 × 10 −12 %) | 184 Hf 26 Ne 24 Ne | |||||||||
| 234м U | 1421.32 (10) кэВ | 33,5 (2,0) мс | 6− | |||||||
| 235 U | Актин уран Актино-уран | 92 | 143 | 235.0439299 (20) | 7,038 (1) × 10 8 лет | α | 231 Чт | 7 / 2− | [0,007204 (6)] | 0,007198– 0,007207 |
| SF (7 × 10 -9 %) | (различный) | |||||||||
| КД (8 × 10 −10 %) | 186 Hf 25 Ne 24 Ne | |||||||||
| 235 м U | 0,0765 (4) кэВ | ~ 26 мин. | ЭТО | 235 U | 1/2 + | |||||
| 236 U | Торуран | 92 | 144 | 236.045568 | 2,342 (3) × 10 7 лет | α | 232 Чт | 0+ | След | |
| SF (9,6 × 10 -8 %) | (различный) | |||||||||
| 236м1 U | 1052,89 (19) кэВ | 100 (4) нс | (4) — | |||||||
| 236м2 U | 2750 (10) кэВ | 120 (2) нс | (0+) | |||||||
| 237 U | 92 | 145 | 237.0487302 (20) | 6,752 (0,002) сут | β — | 237 нп | 1/2 + | След | ||
| 238 U | Уран I | 92 | 146 | 238.0507882 (20) | 4,468 (3) × 10 9 лет | α | 234 Чт | 0+ | [0.992742 (10)] | 0.992739- 0,992752 |
| SF (5,45 × 10 -5 %) | (различный) | |||||||||
| β — β — (2,19 × 10 −10 %) | 238 Pu | |||||||||
| 238м U | 2557,9 (5) кэВ | 280 (6) нс | 0+ | |||||||
| 239 U | 92 | 147 | 239.0542933 (21) | 23,45 (0,02) мин | β — | 239 нп | 5/2 + | |||
| 239м1 U | 20 (20) # кэВ | gt; 250 нс | (5/2 +) | |||||||
| 239м2 U | 133,7990 (10) кэВ | 780 (40) нс | 1/2 + | |||||||
| 240 U | 92 | 148 | 240,056592 (6) | 14,1 (0,1) ч | β — | 240 Нп | 0+ | След | ||
| α (10 -10 %) | 236 Чт | |||||||||
| 242 U | 92 | 150 | 242.06293 (22) # | 16,8 (0,5) мин | β — | 242 нп | 0+ | |||
Этот заголовок и нижний колонтитул таблицы:
|
- ^ m U — Возбужденный ядерный изомер.
- ^ () — Неопределенность (1 σ) дана в сжатой форме в скобках после соответствующих последних цифр.
- ^ # — Атомная масса с пометкой #: значение и погрешность получены не из чисто экспериментальных данных, а, по крайней мере, частично из трендов по массовой поверхности (TMS).
- ^ Режимы распада:
- ^ Дочерний символ выделен жирным курсивом — Дочерний продукт почти стабилен.
- ^ Дочерний символ жирным шрифтом — Дочерний продукт стабилен.
- ^ () значение спина — указывает вращение со слабыми аргументами присваивания.
- ^ a b # — Значения, отмеченные знаком #, получены не только из экспериментальных данных, но, по крайней мере, частично из трендов соседних нуклидов (TNN).
- ^ Промежуточный продукт распада 237 Np
- ^ Используется при датировании уран-торий.
- ^ a b Используется в уран-урановом датировании
- ^ Промежуточный продукт распада из 238 U
- ^ a b Первородный радионуклид
- ^ a b Используется при датировании урана и свинца.
- ^ Важно в ядерных реакторах
- ^ Промежуточный продукт распада из 244 Pu, также получают путем захвата нейтронов из 235 U
- ^ Продукт захвата нейтронов, родительский элемент следовых количеств 237 Np
- ^ Промежуточный продукт распада 244 Pu
Актиниды против продуктов деления
Актиниды и продукты деления по периоду полураспада
|
||||||||
|---|---|---|---|---|---|---|---|---|
| Актиниды по цепочке распада | Период полураспада ( а ) | Продукты деления из 235 U по доходности | ||||||
| 4 п | 4 п +1 | 4 п +2 | 4 п +3 | |||||
| 4,5–7% | 0,04–1,25% | lt;0,001% | ||||||
| 228 Ра№ | 4–6 а | † | 155 Euþ | |||||
| 244 смƒ | 241 Puƒ | 250 КФ | 227 Ас№ | 10–29 а | 90 Sr | 85 кр | 113м кдþ | |
| 232 Uƒ | 238 Puƒ | 243 смƒ | 29–97 а | 137 Cs | 151 смþ | 121 м Sn | ||
| 248 Bk | 249 Cfƒ | 242m Amƒ | 141–351 а |
Никакие продукты деления не имеют период полураспада в диапазоне 100–210 тыс. Лет. |
||||
| 241 Amƒ | 251 Cfƒ | 430–900 а | ||||||
| 226 Ra№ | 247 Bk | 1,3–1,6 тыс. Лет | ||||||
| 240 Pu | 229 Чт | 246 смƒ | 243 Amƒ | 4,7–7,4 тыс. Лет назад | ||||
| 245 смƒ | 250 см | 8,3–8,5 тыс. Лет | ||||||
| 239 Puƒ | 24,1 тыс. Лет назад | |||||||
| 230 Чт№ | 231 Па№ | 32–76 тыс. Лет назад | ||||||
| 236 Npƒ | 233 Uƒ | 234 У№ | 150–250 тыс. Лет назад | ‡ | 99 Tc₡ | 126 Sn | ||
| 248 см | 242 Pu | 327–375 тыс. Лет назад | 79 Se₡ | |||||
| 1,53 млн лет | 93 Zr | |||||||
| 237 Npƒ | 2,1–6,5 млн лет | 135 Cs₡ | 107 Pd | |||||
| 236 U | 247 смƒ | 15–24 млн лет | 129 I₡ | |||||
| 244 Pu | 80 млн лет |
… не более 15,7 млн лет |
||||||
| 232 Чт№ | 238 У№ | 235 Uƒ№ | 0,7–14,1 млрд лет | |||||
|
Легенда для верхнего индекса символов ₡ имеет тепловой захват нейтронов поперечного сечение в диапазоне 8-50 барн ƒ делящегося м метастабильного изомер № прежде всего в природе радиоактивных материалов (NORM) þ нейтронных яда (захват тепловых нейтронов поперечного сечения больше, чем 3k барн) † диапазон 4–97 a: Средноживущий продукт деления ‡ более 200 тыс. Лет назад: Долгоживущий продукт деления |
Уран-214
Уран-214 — самый легкий из известных изотопов урана. Он был обнаружен в 2021 году на Спектрометре тяжелых атомов и ядерной структуры (SHANS) в Центре исследований тяжелых ионов в Ланьчжоу, Китай, в 2021 году. Он был получен путем сжигания аргона-36 на вольфраме-182. Он подвергается альфа-распаду с периодом полураспада0,5 мс.
Уран-232
Основная статья: Уран-232
Уран-232 имеет период полураспада 68,9 года и является побочным продуктом ториевого цикла. Он был назван препятствием для распространения ядерного оружия с использованием 233 U в качестве делящегося материала, поскольку интенсивное гамма-излучение, испускаемое 208 Tl (дочерним элементом 232 U, производимого относительно быстро), затрудняет обращение с загрязненным им 233 U. Уран-232 — редкий пример четно-четного изотопа, который расщепляется как тепловыми, так и быстрыми нейтронами.
Уран-233
Основная статья: Уран-233
Уран-233 — это делящийся изотоп урана, который получают из тория-232 в рамках ториевого топливного цикла. Уран-233 исследовался на предмет использования в ядерном оружии и в качестве реакторного топлива; однако он никогда не использовался в ядерном оружии и не использовался в коммерческих целях в качестве ядерного топлива. Он успешно использовался в экспериментальных ядерных реакторах и был предложен для гораздо более широкого использования в качестве ядерного топлива. Период полураспада1.592 × 10 5 лет.
Уран-233 получают нейтронным облучением тория-232. Когда торий-232 поглощает нейтрон, он становится торием-233, период полураспада которого составляет всего 22 минуты. Торий-233 распадается на протактиний-233 посредством бета-распада. Протактиний-233 имеет период полураспада 27 дней, и бета-распад превращается в уран-233; Некоторые предлагаемые конструкции реакторов на расплаве солей пытаются физически изолировать протактиний от дальнейшего захвата нейтронов до того, как может произойти бета-распад.
Уран-233 обычно делится при поглощении нейтронов, но иногда сохраняет нейтрон, превращаясь в уран-234. Отношение захвата к делению меньше, чем у двух других основных делящихся топлив урана-235 и плутония-239 ; он также ниже, чем у короткоживущего плутония-241, но уступает нептунию-236, который очень трудно производить.
Уран-234
Основная статья: Уран-234
Уран-234 — изотоп урана. В природном уране и в урановой руде 234 U встречается как косвенный продукт распада урана-238, но он составляет всего 0,0055% (55 частей на миллион ) сырого урана, поскольку его период полураспада, составляющий всего 245 500 лет, составляет всего около 1 / 18,000 до тех пор, как у 238 U. Путь образования 234 U в результате ядерного распада следующий: ядра 238 U испускают альфа-частицу, превращаясь в торий-234. Затем, с коротким периодом полураспада, ядро 234 Th испускает бета-частицу, которая становится протактинием-234. Наконец, каждое из ядер 234 Па испускает еще одну бета-частицу, превращаясь в ядра 234 U.
Ядра 234 U обычно существуют в течение сотен тысяч лет, но затем они распадаются посредством альфа-излучения до тория-230, за исключением небольшого процента ядер, которые подвергаются спонтанному делению.
Извлечение довольно небольших количеств 234 U из природного урана было бы осуществимо с использованием разделения изотопов, аналогичного тому, которое используется для обычного обогащения урана. Однако в химии, физике или технике нет реальной потребности в выделении 234 U. Очень маленькие чистые образцы 234 U могут быть извлечены с помощью процесса химического ионного обмена — из образцов плутония-238, которые были несколько состарены, чтобы позволить некоторый распад до 234 U через альфа-излучение.
Обогащенный уран содержит больше 234 U, чем природный уран, как побочный продукт процесса обогащения урана, направленного на получение урана-235, который концентрирует более легкие изотопы даже сильнее, чем 235 U. Повышенное процентное содержание 234 U в обогащенном природном уране приемлемо в в современных ядерных реакторах, но (повторно обогащенный) переработанный уран может содержать даже более высокие фракции 234 U, что нежелательно. Это связано с тем, что 234 U не делящийся и имеет тенденцию поглощать медленные нейтроны в ядерном реакторе, становясь 235 U.
234 U имеет сечение захвата нейтронов около 100 барн для тепловых нейтронов и около 700 барн для его резонансного интеграла — среднее значение по нейтронам, имеющим различные промежуточные энергии. В ядерном реакторе неделящиеся изотопы захватывают нейтроны, воспроизводящие делящиеся изотопы. 234 U превращается в 235 U более легко и, следовательно, со скоростью, большей, чем уран-238 является плутоний-239 (через нептуния-239 ), так как 238 U имеет гораздо меньший захвата нейтронов сечение составляет всего 2,7 сараев.
Уран-235
Основная статья: Уран-235
Уран-235 — изотоп урана, составляющий около 0,72% природного урана. В отличие от преобладающего изотопа урана-238, он делящийся, то есть может выдерживать цепную реакцию деления. Это единственный делящийся изотоп, который является первичным нуклидом или обнаружен в значительном количестве в природе.
Период полураспада урана-235 составляет 703,8 миллиона лет. Он был открыт в 1935 году Артуром Джеффри Демпстером. Его ядерное сечение (деления) для медленных тепловых нейтронов составляет около 504,81 барн. Для быстрых нейтронов это порядка 1 амбара. На уровнях тепловой энергии около 5 из 6 поглощений нейтронов приводят к делению, а 1 из 6 — к захвату нейтронов с образованием урана-236. Отношение деления к захвату улучшается для более быстрых нейтронов.
Уран-236
Основная статья: Уран-236
Уран-236 является изотопом из урана, который не является ни делящимся тепловыми нейтронами, ни очень хорошим плодородным материалом, но, как правило, считается помехой и долгоживущими радиоактивными отходами. Он содержится в отработавшем ядерном топливе и в переработанном уране, полученном из отработавшего ядерного топлива.
Уран-237
Уран-237 — изотоп урана. Его период полураспада составляет около 6,75 (1) дней. Он распадается на нептуний-237 в результате бета-распада.
Уран-238
Основная статья: Уран-238
Уран-238 ( 238 U или U-238) является наиболее распространенным изотопом из урана в природе. Он не делящийся, но является плодородным материалом : он может захватывать медленный нейтрон и после двух бета-распадов превращаться в делящийся плутоний-239. Уран-238 расщепляется быстрыми нейтронами, но не может поддерживать цепную реакцию, потому что неупругое рассеяние снижает энергию нейтронов ниже диапазона, в котором вероятно быстрое деление одного или нескольких ядер следующего поколения. Доплеровское расширение резонансов поглощения нейтронов 238 U, увеличивающее поглощение при повышении температуры топлива, также является важным механизмом отрицательной обратной связи для управления реактором.
Около 99,284% природного урана составляет уран-238, период полураспада которого составляет 1,41 × 10 17 секунд (4,468 × 10 9 лет, или 4,468 миллиарда лет). В обедненном уране содержится еще более высокая концентрация изотопа 238 U, и даже в низкообогащенном уране (НОУ), несмотря на более высокую долю изотопа урана-235 (по сравнению с обедненным ураном), по-прежнему в основном содержится 238 U. Переработанный уран также состоит в основном из 238 U, с примерно таким же количеством урана-235, как у природного урана, сравнимой долей урана-236 и гораздо меньшими количествами других изотопов урана, таких как уран-234, уран-233 и уран-232.
Уран-239
Уран-239 — изотоп урана. Это, как правило, производится путем воздействия 238 U для нейтронного излучения в ядерном реакторе. 239 U имеет период полураспада около 23,45 минут и распадается на нептуний-239 посредством бета-распада с общей энергией распада около 1,29 МэВ. Наиболее распространенный гамма-распад на 74,660 кэВ объясняет разницу в двух основных каналах энергии бета-излучения: 1,28 и 1,21 МэВ.
239 Np далее распадается до плутония-239 также в результате бета-распада ( 239 Np имеет период полураспада около 2,356 дня), на втором важном этапе, который в конечном итоге производит расщепляющийся 239 Pu (используемый в оружии и для ядерной энергетики) из 238 U в реакторах.