4.1.4. Качественные реакции на неорганические вещества и ионы.
Представим себе такую ситуацию:
Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку. При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
В таком случае проблема может быть решена с использованием, так называемых, качественных реакций.
Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный состав неизвестных веществ.
Например, известно, что катионы некоторых металлов при внесении их солей в пламя горелки окрашивают его в определенный цвет:

Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет.
В этих случаях придется отличать вещества с применением других реагентов.
В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
- Одно вещество реагирует с добавленным реагентом, а второе нет. При этом обязательно, должно быть ясно видно, что реакция одного из исходных веществ с добавленным реагентом действительно прошла, то есть наблюдается какой-либо ее внешний признак — выпадал осадок, выделился газ, произошло изменение цвета и т.п.
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют:
NaOH + HCl = NaCl + H2O
Связано это с отсутствием каких-либо внешних признаков реакции. Прозрачный бесцветный раствор соляной кислоты при смешении с бесцветным раствором гидроксида образует такой же прозрачный раствор:
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок:
2NaOH + MgCl2 = Mg(OH)2 ↓+ 2NaCl
2) также вещества можно отличить друг от друга, если они оба реагируют с добавляемым реагентом, но делают это по-разному.
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
с карбонатом натрия соляная кислота реагирует с выделением бесцветного газа без запаха — углекислого газа (СО2):
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
а с нитратом серебра с образованием белого творожистого осадка AgCl
HCl + AgNO3 = HNO3 + AgCl↓
Ниже в таблицах представлены различные варианты обнаружения конкретных ионов:
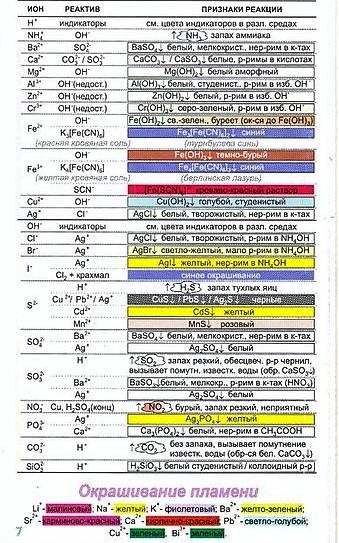
Качественные реакции на катионы
| Катион | Реактив | Признак реакции |
| Ba2+ | SO42- |
Выпадение белого осадка, не растворимого в кислотах: Ba2+ + SO42- = BaSO4↓ |
| Cu2+ |
1) OH− 2) S2- |
1) Выпадение осадка голубого цвета: Cu2+ + 2OH− = Cu(OH)2↓ 2) Выпадение осадка черного цвета: Cu2+ + S2- = CuS↓ |
| Pb2+ | S2- |
Выпадение осадка черного цвета: Pb2+ + S2- = PbS↓ |
| Ag+ | Cl− |
Выпадение белого осадка, не растворимого в HNO3, но растворимого в аммиаке NH3·H2O: Ag+ + Cl− → AgCl↓ |
| Fe2+ |
1) OH− 2) Гексацианоферрат (III) калия (красная кровяная соль) K3[Fe(CN)6] |
1) Выпадение белого осадка, зеленеющего на воздухе: Fe2+ + 2OH− = Fe(OH)2↓ 2) Выпадение синего осадка (турнбулева синь): K+ + Fe2+ + [Fe(CN)6]3- = KFe[Fe(CN)6]↓ |
| Fe3+ |
1) OH− 2) Гексацианоферрат (II) калия (желтая кровяная соль) K4[Fe(CN)6] 3) Роданид-ион SCN− |
1) Выпадение осадка бурого цвета: Fe3+ + 3OH− = Fe(OH)3↓ 2) Выпадение синего осадка (берлинская лазурь): K+ + Fe3+ + [Fe(CN)6]4- = KFe[Fe(CN)6]↓ 3) Появление интенсивно-красного (кроваво-красного) окрашивания: Fe3+ + 3SCN− = Fe(SCN)3 |
| Al3+ | Щелочь (амфотерные свойства гидроксида) |
Выпадение белого осадка гидроксида алюминия при приливании небольшого количества щелочи: OH− + Al3+ = Al(OH)3 и его растворение при дальнейшем приливании: Al(OH)3 + NaOH = Na[Al(OH)4] |
| NH4+ | OH−, нагрев |
Выделение газа с резким запахом: NH4+ + OH− = NH3↑ + H2O Посинение влажной лакмусовой бумажки |
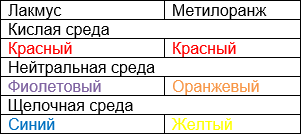
| H+ (кислая среда) |
Индикаторы: − лакмус − метиловый оранжевый |
Красное окрашивание |
Качественные реакции на анионы
| Анион | Воздействие или реактив | Признак реакции. Уравнение реакции |
| SO42- | Ba2+ |
Выпадение белого осадка, не растворимого в кислотах: Ba2+ + SO42- = BaSO4↓ |
| NO3− |
1) Добавить H2SO4 (конц.) и Cu, нагреть 2) Смесь H2SO4 + FeSO4 |
1) Образование раствора синего цвета, содержащего ионы Cu2+, выделение газа бурого цвета (NO2) 2) Возникновение окраски сульфата нитрозо-железа (II) [Fe(H2O)5NO]2+. Окраска от фиолетовой до коричневой (реакция «бурого кольца») |
| PO43- | Ag+ |
Выпадение светло-желтого осадка в нейтральной среде: 3Ag+ + PO43- = Ag3PO4↓ |
| CrO42- | Ba2+ |
Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCl: Ba2+ + CrO42- = BaCrO4↓ |
| S2- | Pb2+ |
Выпадение черного осадка: Pb2+ + S2- = PbS↓ |
| CO32- |
1) Ca2+ 2) H+ |
1) Выпадение белого осадка, растворимого в кислотах: Ca2+ + CO32- = CaCO3↓ 2) Выделение бесцветного газа («вскипание»), вызывающее помутнение известковой воды: CO32- + 2H+ = CO2↑ + H2O Ca(OH)2 + CO2 = CaCO3↓ + H2O |
| CO2 | Известковая вода Ca(OH)2 |
Выпадение белого осадка и его растворение при дальнейшем пропускании CO2: Ca(OH)2 + CO2 = CaCO3↓ + H2O CaCO3 + CO2 + H2O = Ca(HCO3)2 |
| SO32- | H+ |
Выделение газа SO2 с характерным резким запахом (SO2): 2H+ + SO32- = H2O + SO2↑ |
| F− | Ca2+ |
Выпадение белого осадка: Ca2+ + 2F− = CaF2↓ |
| Cl− | Ag+ |
Выпадение белого творожистого осадка, не растворимого в HNO3, но растворимого в NH3·H2O(конц.): Ag+ + Cl− = AgCl↓ AgCl + 2(NH3·H2O) = [Ag(NH3)+ + Cl− + 2H2O |
| Br− | Ag+ | Выпадение светло-желтого осадка, не растворимого в HNO3:
Ag+ + Br− = AgBr↓ (осадок темнеет на свету) |
| I− | Ag+ | Выпадение желтого осадка, не растворимого в HNO3 и NH3·H2O(конц.):
Ag+ + I− = AgI↓ (осадок темнеет на свету) |
| OH− (щелочная среда) |
Индикаторы: — лакмус — фенолфталеин |
— синее окрашивание — малиновое окрашивание |
Качественные реакции
Качественные реакции – реакции, с помощью которых можно отличить одно вещество (или ион) от другого.
Реагент – вещество, с помощью которого проводят качественную реакцию.
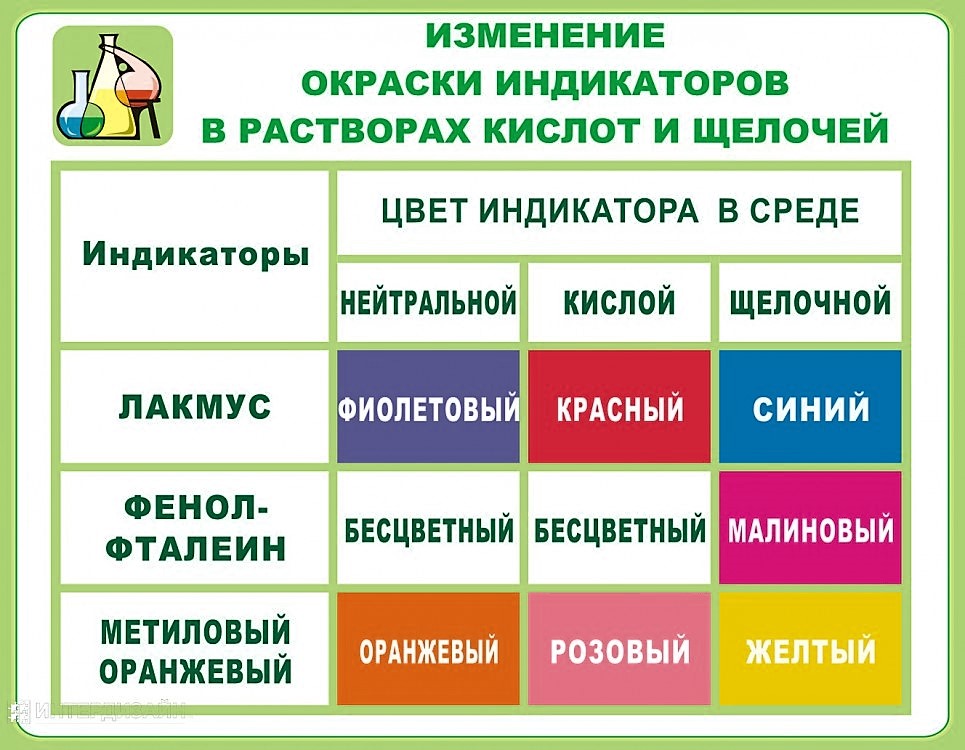
Для определения кислотности среды можно использовать индикаторы, которые приобретают различную окраску в кислой, нейтральной или щелочной среде.
Наиболее часто встречаются лакмус и метиловый оранжевый.
Встречается еще один индикатор – фенолфталеин. Но он меняет свой цвет на малиновый только в щелочной среде!
С точки зрения наблюдаемых эффектов качественные реакции можно разделить на несколько групп:
-
Выпадение осадка
-
Выделение газа
-
Растворение твердого вещества
-
Изменение (появление) окраски
-
Появление запаха
-
Окрашивание пламени
| Качественные реакции на анионы | ||
|---|---|---|
| Ион | Реагент | Признак реакции |
| Cl— | Ag+ | Белый творожистый осадок |
| Br— | Ag+ | Светло-желтый творожистый осадок |
| I— | Ag+ | Желтый творожистый осадок |
| SO42- | Ba2+ | Белый осадок |
| S2- | H+ | Газ с запахом тухлых яиц |
| Pb2+ | Черный осадок | |
| SO32- | H+ | Газ с резким запахом |
| CO32- | H+ | Выделение газа |
| PO43- | Ag+ | Желтый осадок |
*
| Качественные реакции на катионы | ||
|---|---|---|
| Ион | Реагент | Признак реакции |
| Na+ | — | Желтое пламя |
| K+ | — | Фиолетовое пламя |
| Ca2+ | — | Кирпично-красное пламя |
| Fe2+ | K3[Fe(CN)6] | Синий осадок |
| Fe3+ | K4[Fe(CN)6] | Синий осадок |
| NH4SCN | Кроваво-красный раствор | |
| Zn2+, Al2+ | OH— | Белый студенистый осадок, растворяющийся в избытке щелочи |
| Pb2+ | I— | Желтый осадок |
| Cu2+ | OH— | Студенистый осадок голубого цвета |
| NH4+ | OH— | Газ с резким запахом |
*
| Качественные реакции на вещества | ||
|---|---|---|
| Вещество | Реагент | Признак реакции |
| CO2 | Ca(OH)2 | Помутнение раствора |
| O2 | — | Вспыхивание тлеющей лучинки |
| H2 | — | «Лающий» хлопок при поджигании |
Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе.
В задании 18 ОГЭ по химии мы демонстрируем знания индикаторов и pH, а также качественные реакции на ионы в растворе.
Теория к заданию №18 ОГЭ по химии
Индикаторы
Индикатор — химическое вещество, меняющее окраску в зависимости от pH среды.
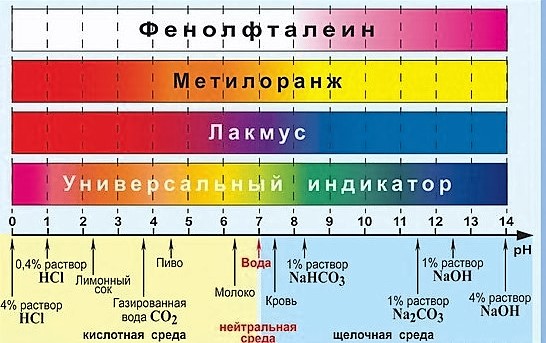
Самые известные индикаторы — фенолфталеин, метилоранж, лакмус и универсальный индикатор. Их цвета в зависимости от среды на картинке ниже:
А вот ещё цвета индикаторов более подробно с жизненными примерами:
С индикаторами мы разобрались, перейдем к качественным реакциям на ионы.
Качественные реакции на ионы
Качественные реакции на катионы и анионы представлены в таблице ниже.
Как правильно справиться с заданием 18 в тесте ОГЭ по химии?
Для этого необходимо выбрать качественную реакцию на один из предоставленных вариантов и убедится, что данный реактив не вступает в реакцию со вторым веществом.
Разбор типовых вариантов задания №18 ОГЭ по химии
Первый вариант задания
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
Вещества:
А) Na2CO3 и Na2SiO3
Б) К2CO3 и Li2CO3
В) Na2SO4 и NaOH
Реактив:
1) CuCl2
2) HCl
3) MgO
4) K3PO4
Рассмотрим каждый случай.
Na2CO3 и Na2SiO3
- с хлоридом меди реакция не идет в обоих случаях, так как карбонат и силикат меди разлагается в водном растворе
- с соляной кислотой в случае карбоната натрия выделяется газ, а в случае силиката выпадает осадок — это качественная реакция на силикаты
- с оксидом магния данные вещества не реагируют, и оксид магния не вступает в реакции ионного обмена
- с фосфатом также нет качественных реакций на натрий
К2CO3 и Li2CO3
- с хлоридом меди данные вещества не реагируют (на самом деле выпадает осадок гидроксида меди, но этой реакцией не отличить два реагента)
- с соляной кислотой оба реагируют с выделением углекислого газа
- с оксидом магния данные вещества не реагируют, и оксид магния не вступает в реакции ионного обмена
- с фосфатом выпадает литий в виде фосфата, а калий нет
Na2SO4 и NaOH
У нас остался последний вариант — это хлорид меди. Действительно, с гидроксидом натрия выпадает гидроксид меди, а с сульфатом реакция не идет.
Ответ: 241