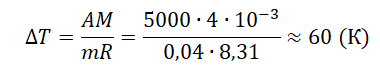Первый закон термодинамики .
( Q=Delta U+A )
(Q) — Количество теплоты, полученное газом
Если (; Q>0 ; ,) то газ получает тепло
Если (; Q < 0 ; , ) то газ отдает тепло
( Delta U )-Изменение внутренней энергии газа
(A) — Работа газа
(A=P Delta V )
( Delta V )- Изменение объема газа
Если изменение объема газа равно нулю (( Delta V =0) ), то и работа газа равна нулю
Если газ расширяется , то (; A>0 ; ,) (газ совершает положительную работу)
Если газ сужается , то (; A < 0 ; , ) и говорят:»Внешние силы совершают работу над газом »
или » Работа газа отрицательна »
Задача 1.
Внутренняя энергия идеального газа возрастает на 300 Джоулей ((Delta U=300 Дж) ; , )
при этом газ совершает работу (A=200 Дж ; . )
Какое количество теплоты получил газ?
Показать ответ
Показать решение
Видеорешение
Задача 2.
Газ получает из внешней среды (Q=500 Дж ; , ) при этом газ совершает работу (A=200 Дж ; . )
Найти изменение внутренней энергии ( Delta U ; .)
Показать ответ
Показать решение
Видеорешение
Задача 3.
Газ получает из внешней среды (Q=700 Дж ; , ) при этом внутренняя энергия газа возрастает
на 150 Джоулей ( (Delta U=150 Дж) ; .)
Какую работу совершает газ?
Показать ответ
Показать решение
Видеорешение
Задача 4.
Газ получает из внешней среды (Q=1700 Дж ; , ) при этом внутренняя энергия газа возрастает
на 250 Джоулей ( (Delta U=250 Дж) ; .)
Какую работу совершает газ?
Показать ответ
Показать решение
Видеорешение
Задача 5.
Внутренняя энергия идеального газа уменьшается на 300 Джоулей ((Delta U=-300 Дж) ; , )
при этом газ совершает работу (A=500 Дж ; . )
Какое количество теплоты получил газ?
Показать ответ
Показать решение
Видеорешение
Задача 6.
Внутренняя энергия идеального газа уменьшается на 400 Джоулей ((Delta U=-400 Дж) ; , )
при этом газ совершает работу (A=450 Дж ; . )
Какое количество теплоты получил газ?
Показать ответ
Показать решение
Видеорешение
Задача 7.
Внутренняя энергия идеального газа уменьшается на 500 Джоулей ((Delta U=-500 Дж) ; , )
при этом газ совершает работу (A=500 Дж ; . )
Какое количество теплоты получил газ?
Показать ответ
Показать решение
Видеорешение
Задача 8.
Внутренняя энергия идеального газа уменьшается на 500 Джоулей ((Delta U=-500 Дж) ; , )
при этом газ совершает работу (A=200 Дж ; . )
Какое количество теплоты получил(или отдал) газ?
Показать ответ
Показать решение
Видеорешение
Задача 9.
Внутренняя энергия идеального газа уменьшается на 1200 Джоулей ((Delta U=-1200 Дж) ; , )
при этом газ совершает работу (A=400 Дж ; . )
Какое количество теплоты получил(или отдал) газ?
Показать ответ
Показать решение
Видеорешение
Задача 10.
Газ отдал во внешнюю среду 40 Джоулей ( (Q=-40 Дж ) ; , ) при этом
внутренняя энергия газа уменьшается на 120 Джоулей ((Delta U=-120 Дж) . )
Найти совершенную газом работу.
Показать ответ
Показать решение
Видеорешение
Задача 11.
Газ отдал во внешнюю среду 85 Джоулей ( (Q=-85 Дж ) ; , ) при этом
внутренняя энергия газа уменьшается на 135 Джоулей ((Delta U=-135 Дж) . )
Найти совершенную газом работу.
Показать ответ
Показать решение
Видеорешение
Задача 12.
Газ отдал во внешнюю среду 180 Джоулей ( (Q=-180 Дж ) ; , ) при этом
внутренняя энергия газа уменьшается на 100 Джоулей ((Delta U=-100 Дж) . )
Найти совершенную газом работу.
Показать ответ
Показать решение
Видеорешение
Задача 13.
Работа внешних сил над газом равна 200 Дж ( (A=-200 Дж) )
при этом
внутренняя энергия газа увеличивается на 300 Джоулей ((Delta U=300 Дж) . )
Какое количество теплоты получил газ?
Показать ответ
Показать решение
Видеорешение
Задача 14.
Внешние силы совершают над газом работу 800 Дж ( (A=-800 Дж) )
при этом
внутренняя энергия газа увеличивается на 800 Джоулей ((Delta U=800 Дж) . )
Какое количество теплоты получил газ?
Показать ответ
Показать решение
Видеорешение
Задача 15.
Газ получает количество теплоты 500 Джоулей, при этом его внутрення энергия возрастает на 500 Джоулей.
Какую работу совершает газ?
Показать ответ
Показать решение
Видеорешение
Первое начало термодинамики (первый закон термодинамики) представляет собой закон сохранения энергии в тепловых процессах.
Первое начало термодинамики
Внутренняя энергия идеального газа изменяется двумя способами: за счет теплопередачи или при совершении работы.
±ΔU=±Q±A‘
Пояснение:
- +∆U — внутренняя энергия газа увеличивается.
- –∆U — внутренняя энергия газа уменьшается.
- +Q — газ нагревают (газу передают количество теплоты).
- –Q — газ охлаждается (газ отдает тепло окружающей среде).
- +A’ — газ сжимает внешняя сила.
- –A’ — газ расширяется, совершая работу.
Внимание! Знак перед работой показывает, как процесс совершения работы влияет на изменение внутренней энергии газа.
Пример №1. В некотором процессе внутренняя энергия газа уменьшилась на 300 Дж, а газ совершил работу 500 Дж. Какое количество теплоты было сообщено газу?
Чтобы рассчитать количество теплоты, сообщенное газу, нужно найти разность между изменением внутренней энергии и работой, совершенным газом. Для этого нужно правильно определить их знаки. Так как внутренняя энергия уменьшилась, она отрицательна. Но работа положительна. Поэтому газу было сообщено следующее количество теплоты:
Q = A – U = 500 – 300 = 200 (Дж)
Зависимость физических величин
Выясним, от чего зависят величины, входящие в формулу первого начала термодинамики. Изменение внутренней энергии идеального газа зависит от изменения температуры:
ΔU=32νRΔT
Работа идеального газа зависит от изменения его объема:
A‘=pΔV
Первое начало термодинамики для изопроцессов
| Изотермический процесс (T = const) |
ΔU=0, Q=A‘ |
| Изохорный процесс (V = const) |
A‘=0, ΔU=Q |
| Изобарное расширение газа (p = const) |
ΔU=Q−pΔV ΔU=Q−νRΔT |
| Адиабатный (система не получает тепло извне и не отдает его окружающей среде, или Q = 0) |
Q=0, ΔU=A‘ |
Пример №2. Идеальный одноатомный газ находится в сосуде с жесткими стенками объемом 0,6 куб. м. При нагревании его внутренняя энергия увеличилась на 18 кДж. На сколько возросло давление газа?
18 кДж = 18000 Дж
Внутреннюю энергию газа можно определить по формуле:
ΔU=32νRΔT
Отсюда изменение температуры равно:
ΔT=2ΔU3νR
Уравнение состояния идеального газа для 1 и 2 состояния:
p1V=νRT1
p2V=νRT2
Отсюда давления равны:
p1=νRT1V
p2=νRT2V
Разность давлений:
p2−p1=νRT2V−νRT1V=νRVΔT=νRV·2ΔU3νR=2ΔU3V
p2−p1=2·180003·0,6=20000 (Па)=20 (кПа)
Графические задачи на первое начало термодинамики
Рассмотрим графический способ решения задачи на первое начало термодинамики на конкретном примере.
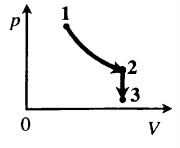
Задача: Один моль идеального одноатомного газа сначала изотермически расширился (T1 = 300 К). Затем газ охладили, понизив давление в 3 раза (см. рисунок). Какое количество теплоты отдал газ на участке 2–3?
Порядок решения:
1. Определить температуры для всех указанных точек, учитывая графики процессов, масштаб и условие задачи.
T1 = T2 = 300 К; T3 = 100 К
2. Определить, к какому изопроцессу относится тот участок графика, о котором спрашивают в задаче.
Участок 2–3 на графике — это изохорный процесс, так как давление остается постоянным.
3. Записать для него первое начало термодинамики.
В данном процессе:
ΔU=Q
4. Учитывая характер изменения величин, правильно расставить знаки: −ΔU=−Q.
5. Подставляя в первое начало термодинамики формулы для расчета изменения внутренней энергии и работы газа, решить задачу.
Формула изменения внутренней энергии газа:
ΔU=32νRΔT
Формула работы газа:
A‘=pΔV
Так как процесс изохорный, работа газа равна нулю. Поэтому количество теплоты, отданное газом на участке 2–3, равно изменению внутренней энергии газа:
Изменение внутренней энергии равно:
Q23=32νRΔT23=32·1·8,31·200=2493 (Дж)
Задание EF17492
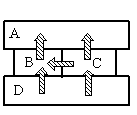
- A
- B
- C
- D
Алгоритм решения
- Определить тип теплопередачи.
- Вспомнить, как происходит этот тип теплопередачи.
- Сделав анализ рисунка, установить, какой брусок имеет указанную в задаче температуру.
Решение
Так как это твердые тела, поверхности которых соприкасаются друг с другом, и перенос тепла происходит без переноса вещества, то этот вид теплопередачи является теплопроводностью. Тепло всегда направлено от более нагретого тела к менее нагретому.
На рисунке видно, что самым нагретым телом является нижний брусок, так как он только отдает тепло, но не принимает его. Средний брусок справа менее нагрет, чем нижний, так как принимает от него тепло. Но он более теплый по сравнению со средним бруском слева, так как он делится с ним теплом. И оба этих бруска отдают свою энергию верхнему бруску, который сам только принимает тепло, но не отдает его. Следовательно, именно он имеет температуру +40 оС.
Ответ: A
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17758
Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅105 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение состояния идеального газа.
3.Записать формулу для расчета внутренней энергии газа.
4.Используя первое начало термодинамики, выполнить общее решение задачи.
5.Подставив известные данные, вычислить неизвестную величину.
Решение
Запишем исходные данные:
• Начальная температура газа: T1 = 600 К.
• Начальное давление: p1 = 4∙105 Па.
• Конечное давление: p2 = 105 Па.
• Работа, совершенная газом: A = 2493 Дж.
Аргон является одноатомным газом. Поэтому для него можно использовать уравнение состояния идеального газа:
pV=νRT
Внутренняя энергия одноатомного идеального газа пропорциональна температуре:
U=32νRT
Внутренняя энергия аргона до расширения и после него:
U1=32νRT1
U2=32νRT2
Согласно условию задачи, температура при расширении обратно пропорциональна объёму. Следовательно:
T=constV
T1V1=T2V2
Выразим конечную температуру:
T2=T1V1V2
Составим уравнение состояния газа для состояний аргона 1 и 2:
p1V1=νRT1
p2V2=νRT2
Отсюда:
νR=p1V1T1=p2V2T2
Отсюда отношение объема аргона в состоянии 1 к объему газа в состоянии 2 равно:
V1V2=p2T1p1T2
Подставим это отношение в формулу для конечной температуры:
T2=T1V1V2=p2T12p1T2
Отсюда:
T2=T1√p2p1
Отсюда внутренняя энергия газа в состоянии 2 равна:
U2=32νRT1√p2p1
Уменьшение внутренней энергии аргона составило (изначально она была выше):
ΔU=U1−U2=32νRT1−32νRT1√p2p1=32νRT1(1−√p2p1)
В соответствии с первым началом термодинамики уменьшение внутренней энергии равно сумме совершённой работы и количества теплоты, отданного газом:
ΔU=Q+A
Следовательно, газ отдал следующее количество теплоты:
Q=ΔU−A=32νRT1(1−√p2p1)−A
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17562
Газу передали изохорно количество теплоты 300 Дж. Как изменилась его внутренняя энергия в этом процессе?
Ответ:
а) увеличилась на 300 Дж
б) уменьшилась на 300 Дж
в) увеличилась на 600 Дж
г) уменьшилась на 600 Дж
Алгоритм решения
1.Записать исходные данные.
2.Записать первое начало термодинамики.
3.Установить, как меняется внутренняя энергия идеального газа.
Решение
Запишем исходные данные:
• Количество теплоты, переданное газу: Q = 300 Дж.
Первое начало термодинамики:
ΔU=Q+A
Так как по условию задачи это изохорный процесс, то работа равна 0. Следовательно, изменение внутренней энергии газа равно количеству теплоты:
ΔU=Q=300 (Дж)
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17597
Находясь в цилиндре двигателя, газ получил от нагревателя количество теплоты, равное 10 кДж. Затем он расширился, совершив работу 15 кДж. В результате всех этих процессов внутренняя энергия газа уменьшилась на
Ответ:
а) 5 кДж
б) 10 кДж
в) 15 кДж
г) 25 кДж
Алгоритм решения
1.Записать исходные данные.
2.Записать первое начало термодинамики.
3.Установить, как меняется внутренняя энергия идеального газа.
Решение
Запишем исходные данные:
• Количество теплоты, переданное газу: Q = 10 кДж.
• Работа, совершенная газом: A = 15 кДж.
Первое начало термодинамики:
ΔU=Q+A
В этой формуле за работу принимается та работа, что совершается над газом. Но в данном случае газ сам совершает работу. Поэтому первое начало термодинамики примет вид:
ΔU=Q−A=10−15=−5 (кДж)
Знак «–» указывает на то, что внутренняя энергия газа уменьшилась на 5 кДж.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17579
При постоянном давлении гелий нагрели, в результате чего он совершил работу 5 кДж? Масса гелия 0,04 кг. Насколько увеличилась температура газа?
Ответ:
а) 60 К
б) 25 К
в) 15 К
г) 3 К
Алгоритм решения
1.Записать исходные данные и перевести единицы измерения величин в СИ.
2.Записать первое начало термодинамики.
3.Записать формулу для расчета работы газа.
4.Выполнить решение задачи в общем виде.
5.Подставить известные данные и выполнить вычисления искомой величины.
Решение
Запишем исходные данные:
• Газ совершил работу: A = 5 кДж.
• Масса гелия: m = 0,04 кг.
5 кДж = 5000 Дж
Первое начало термодинамики:
ΔU=Q+A
Учтем, что не над газом совершают работу, а сам газ совершает ее:
Отсюда:
ΔU=Q−A
Так как газ нагревали изобарно, часть тепла ушла на изменение внутренней энергии газа, а часть — на совершение этим газом работы.
Работа, совершенная газом, равна:
A=pΔV=mMRΔT
Молярная масса гелия равна 4∙10–3 кг/моль.
Отсюда:
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 3.9k
Определить количество теплоты, необходимое для перевода одного моля одноатомного идеального газа из состояния 1 в состояние 3. В состоянии 1 температура газа T1 = 300 К.
Спрятать решение
Решение.
При изобарном процессе Изменение внутренней энергии одноатомного газа
По первому закону термодинамики
При изохорном процессе Изменение внутренней энергии
Количество теплоты равно
Тогда при переходе получено количество теплоты
Из уравнения Клапейрона-Менделеева откуда количество теплоты, полученное газом, равно
Ответ: 13,7 кДж.
Источник: Кирик Л. А. Самостоятельные и контрольные работы для 10 класса, Х.: «Гимназия», 2002 (№ 1 (высок.) стр. 44)
1. Вспоминай формулы по каждой теме
2. Решай новые задачи каждый день
3. Вдумчиво разбирай решения
Первое начало термодинамики
В процессе эксперимента внутренняя энергия газа увеличилась на (4,7) Дж, при этом газ отдал окружающей среде количество теплоты, равное (39) Дж. Какую работу совершили над газом внешние силы в данном эксперименте? Ответ дать в Дж.
По первому закону термодинамики: [Q=Delta U + A,] где (Q) — количество теплоты (т.к. по условию газ отдает количество теплоты, то при подстановке значений мы будем писать его со знаком “(-)”), (Delta U) — изменение внутренней энергии газа, а (A) — работа, совершенная газом.
Отсюда: [A=Q-Delta U~~~(1)] Известно, что: [A=-A_{text{вн}},] где (A_{text{вн}}) — работа внешних сил над газом. Подставим сюда (1) и выразим (A_{text{вн}}): [A_{text{вн}}=-A=-(Q-Delta U)=-Q+Delta U=-(-39text{ Дж})+4,7text{ Дж}=39text{ Дж}+4,7text{ Дж}=43,7text{ Дж }]
Ответ: 43,7
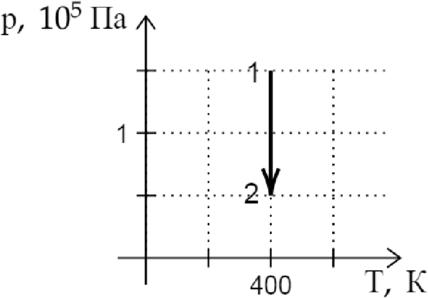
На (pT)-диаграмме показан процесс изменения состояния постоянной массы идеального газа. В этом процессе газ совершает работу, равную 3 кДж. Каково количество теплоты, полученное газом? (Ответ дайте в кДж.)
По первому закону термодинамики: [Q=Delta U + A,~~~(1)] где (Q) — количество теплоты, полученное газом, (Delta U) — изменение внутренней энергии газа, а (A) — работа, совершенная газом. [Delta U=dfrac{3}{2}nu R Delta T.] По графику находим, что (Delta T = 0), значит (Delta U = 0). Подставим это в (1): [Q=A=3text{ кДж }]
Ответ: 3
Идеальный газ совершил работу 161 кДж и при этом внутренняя энергия газа уменьшилась на 140 кДж. Какое количество теплоты получил газ в этом процессе? (Ответ дать в кДж)
По первому закону термодинамики: [Q=Delta U + A,] где (Q) — количество теплоты, полученное газом, (Delta U) — изменение внутренней энергии газа, а (A) — работа, совершенная газом.
[Q=-140text{ кДж}+ 161text{ кДж}=-140cdot 10^3text{ Дж}+ 161cdot 10^3text{ Дж}=21000text{ Дж}=21text{ кДж }]
Ответ: 21
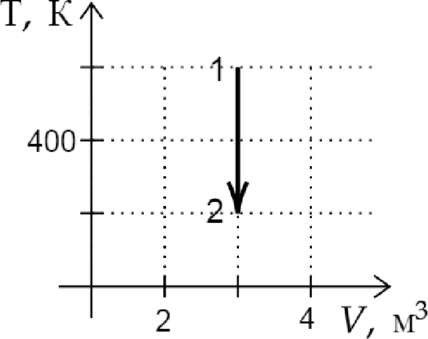
На рисунке показан график изменения состояния постоянной массы идеального газа. В этом процессе газ принял количество теплоты, равное 4 кДж. На сколько увеличилась внутренняя энергия газа? Ответ дайте в кДж.
Из графика видно, что данный процесс является изохорным. Поскольку объем газа не изменялся, газ не совершал работы. Следовательно, согласно первому началу термодинамики: [Q=Delta U=4text{ кДж }]
Ответ: 4
В некотором процессе газ получает количество теплоты 97 Дж, внутренняя энергия газа увеличивается, причём изменение его внутренней энергии составляет 4/7 от работы газа. Какую работу совершает газ в этом процессе? Ответ дать в Дж и округлить до целых.
По первому закону термодинамики: [Q=Delta U + A,] где (Q) — количество теплоты, полученное газом, (Delta U) — изменение внутренней энергии газа, а (A) — работа, совершенная газом.
По условию (Delta U=dfrac{4}{7}A). Отсюда: [Q=dfrac{4}{7}A + A=dfrac{11}{7}A] [A=dfrac{7}{11}Q=dfrac{7}{11}cdot 97text{ Дж}approx 62text{ Дж }]
Ответ: 62
В процессе адиабатного расширения четырех молей идеального одноатомного газа газ совершил работу 100 Дж. Определите изменение внутренней энергии газа в этом процессе.
По первому закону термодинамики: [Q=Delta U + A] В адиабатном процессе газ не получает теплоты от внешней среды: [0=Delta U + A Rightarrow Delta U=-A=-100text{ Дж }]
Ответ: -100
В некотором процессе идеальный газ совершает работу 140 Дж, причем полученное газом количество теплоты составляет 16/7 от изменения внутренней энергии газа (внутреняя энергия увеличивается). Чему равно изменение внутренней энергии газа в этом процессе? Ответ округлить до целых.
По первому закону термодинамики: [Q=Delta U + A,] где (Q) — количество теплоты, полученное газом, (Delta U) — изменение внутренней энергии газа, а (A) — работа, совершенная газом.
По условию (Q=dfrac{16}{7} Delta U). Отсюда: [dfrac{16}{7} Delta U=Delta U + A] [A=dfrac{9}{7}Delta URightarrow Delta U=dfrac{7}{9}A=dfrac{7}{9}cdot 140text{ Дж}approx 109text{ Дж }]
Ответ: 109

Как готовиться к сочинению за 2 дня до ЕГЭ? Четко и без воды
Как готовиться к сочинению за 2 дня до ЕГЭ? Четко и без воды
Данная тема будет посвящена решению задач с применением первого
начала термодинамики.
Задача 1. При изотермическом расширении идеальным
одноатомным газом была совершена работа 100 Дж. Какое количество теплоты
сообщено газу?
|
ДАНО: |
РЕШЕНИЕ Согласно первому закону термодинамики, количество теплоты, Внутренняя энергия идеального газа представляет собой Так как T = Следовательно |
|
|
Ответ: количество теплоты, сообщенное
газу, равно 100 Дж.
Задача 2. При адиабатном сжатии 4 моль идеального
одноатомного газа была совершена работа внешней силы 1 кДж. Определите, на
сколько поднялась температура газа.
|
ДАНО: |
СИ |
РЕШЕНИЕ Согласно первому началу термодинамики, изменение внутренней Искомое изменение температуры |
|
|
Ответ: температура повысилась на 20 К.
Задача 3. Объем одноатомного идеального газа при
изобарном расширении увеличился на 2 л. Какое количество теплоты получил газ в
ходе расширения, если его давление равно 200 кПа?
|
ДАНО: |
СИ |
РЕШЕНИЕ Запишем уравнение, выражающее математическую запись первого Внутренняя энергия идеального газа представляет собой Работа связана с изменением объема формулой: Запишем уравнения Менделеева — Клапейрона для начального и Следовательно, изменение внутренней энергии равно Тогда количество теплоты, которое получил газ равно |
|
|
Ответ: газ получил 1 кДж теплоты.
Задача 4. Тепловой процесс, график которого изображен
на рисунке, совершают над идеальным газом, масса которого остается постоянной.
Определите, как изменялась температура газа на участках 1 — 2, 2 — 3 и 3 — 1.
На каких участках газ получал некоторое количество теплоты, а на каких отдавал?
РЕШЕНИЕ
Рассмотрим процесс 1–2. Как видно, давление газа, на этом
участке, прямо пропорционально его объему. В качестве коэффициента
пропорциональности выступает некоторая постоянная величина a.
Запишем для данного участка графика уравнение Менделеева —
Клапейрона в общем виде.
Из формулы следует, что
Так как газ расширяется, то работа больше нуля
Согласно первому закону термодинамики
Рассмотрим процесс 2–3. В этом происходит уменьшение давления
газа при неизменном объеме, то есть процесс 2–3 — изохорный. А как известно,
при изохорном процессе газ работы не совершает.
Согласно закону Шарля
Поскольку
Из первого закона термодинамики можно заключить
Рассмотрим процесс 3–1. Как видно из графика, этот процесс
характеризуется уменьшением объема газа при постоянном давлении. Значит, данный
процесс — изобарный.
Согласно закону Гей-Люссака для изобарного процесса
Поскольку
и
Согласно первому закону термодинамики
Задача 5. В теплоизолированном высоком цилиндрическом
сосуде на расстоянии h от дна висит на нити
поршень массой m. Под поршнем находится 1 моль
идеального газа. Давление под поршнем в начальный момент времени равно внешнему
давлению, температура газа Т1. Газ нагревается спиралью.
Какое количество теплоты нужно подвести к газу, чтобы поршень поднялся до
высоты 2h от дна? Трения нет, а внутренняя
энергия моля газа U = cT.
|
ДАНО: |
РЕШЕНИЕ Запишем первый закон термодинамики Работу газа можно определить, как произведение Сила внешнего давления Тогда Уравнение состояния идеального газа в начальном состоянии Давление газа после нагревания Уравнение состояния идеального газа после нагревания Температура газа после нагревания Изменение внутренней энергии газа Тогда |
|
|