Внутренняя энергия газа может изменяться в результате совершения газом работы и сообщения ему теплоты. Поэтому принято говорить о двух формах передачи энергии от одних тел к другим: о теплоте и работе.
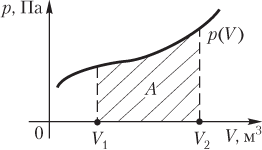
Работа газа при произвольном процессе рассчитывается как площадь криволинейной трапеции под графиком p(V). На рис. 6.1 показана произвольная зависимость давления газа p от его объема V (объем газа в начальном состоянии V 1; объем газа в конечном состоянии V 2). Площадь заштрихованной фигуры совпадает с работой, совершенной газом.
Если зависимость p(V) представляет собой прямую линию, то работа численно равна площади прямолинейной трапеции.
В Международной системе единиц работа, совершаемая газом, измеряется в джоулях (1 Дж).
Работа газа при изобарном процессе (p = const) может быть вычислена по одной из формул:
A = p∆V, или A = νR∆T,
где p — давление газа; ΔV — изменение объема газа при переходе из начального в конечное состояние, ΔV = V 2 − V 1; V 1 — объем газа в начальном состоянии; V 2 — объем газа в конечном состоянии; ν — количество вещества (газа); R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К); ΔT — соответствующее изменение температуры газа, ΔT = T 2 − T 1; T 1 — абсолютная температура начального состояния; T 2 — абсолютная температура конечного состояния.
Работа газа при изохорном процессе (V = const) не совершается:
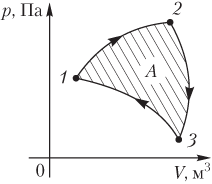
Работа газа при круговом (циклическом) процессе рассчитывается как площадь фигуры, ограниченной графиком функции p(V). На рис. 6.2 показан график произвольного кругового процесса; цифрами обозначены: 1 — исходное состояние идеального газа (оно совпадает с конечным); 2, 3 — промежуточные состояния газа.
Площадь заштрихованной фигуры совпадает с работой, совершенной газом при циклическом процессе.
Работа, совершаемая газом за цикл, может быть:
· положительной (прямой цикл);
· отрицательной (обратный цикл).
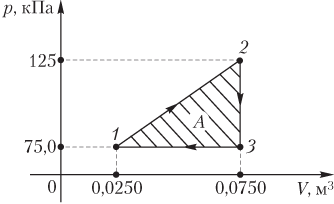
Пример 3. График циклического процесса, происходящего с некоторой массой идеального газа, в координатах p(V) имеет вид прямых, соединяющих точки (0,0250 м 3 ; 75,0 кПа), (0,0750 м 3 ; 125 кПа), (0,0750 м 3 ; 75,0 кПа). Определить абсолютную величину работы, совершаемой газом за цикл.
Решение. На рисунке изображен график циклического процесса в указанных термодинамических координатах p(V).
Величина искомой работы равна площади треугольника, ограниченного прямыми, соединяющими указанные точки:
A=12(125−75,0)⋅103⋅(0,0750−0,0250)=1,25⋅103 Дж=1,25 кДж.
Газ за цикл совершает работу 1,25 кДж.
Пример 4. Газ, состоящий из смеси 2,0 г водорода и 4,2 г гелия, при изобарном нагревании совершил работу 46 кДж. Во сколько раз увеличился объем газа, если его начальная температура была равна 300 К? Молярные массы водорода и гелия равны 2,0 и 4,0 г/моль соответственно.
Решение. Запишем формулу для расчета работы смеси газов при изобарном процессе:
где p — давление смеси газов (постоянная величина), p = const; V 1 — объем смеси газов в начальном состоянии; V 2 — объем смеси газов в конечном состоянии.
Давление смеси газов определяется законом Дальтона:
где p 1 — парциальное давление водорода; p 2 — парциальное давление гелия.
Давления указанных газов в смеси определяются следующими выражениями:
· парциальное давление водорода
где m 1 — масса водорода; M 1 — молярная масса водорода; T 1 — температура смеси газов в начальном состоянии; V 1 — объем смеси газов в начальном состоянии; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К);
· парциальное давление гелия
где m 2 — масса гелия; M 2 — молярная масса гелия.
Подстановка закона Дальтона и явного вида выражений для парциальных давлений водорода и гелия в формулу для работы, совершаемой смесью указанных газов, дает
Преобразование данного уравнения к виду
позволяет выразить искомое отношение объемов
Следовательно, при совершении указанной работы объем смеси увеличился в 10 раз.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 9364 – 

78.85.5.224 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Условие задачи:
Задача №5.3.22 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
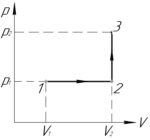
(V_1=2) л, (V_2=3) л, (p_1=400) кПа, (p_2=600) кПа, (A-?)
Решение задачи:
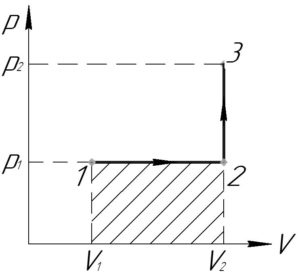
Процесс 1-2 — изобарный, поэтому работу газа (A_<1 — 2>) в этом процессе следует искать по такой формуле (численно работа равна площади фигуры под графиком процесса, на схеме к решению — заштриховано):
Процесс 2-3 — изохорный, работа газа (A_<2 — 3>) в этом процессе равна нулю, так как газ не изменяет своего объема (площадь фигуры под графиком этого процесса в координатах p-V также равна нулю).
В итоге формула (1) примет такой вид:
Переведём объемы газа (V_1) и (V_2) в систему СИ:
Ответ: 400 Дж.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Какую работу совершает газ при переходе из состояния 1 в состояние 3? (Ответ дайте в кДж.)
На диаграмме p—V работе, совершаемой газом при переходе из начального состояния в конечное, соответствует площадь под линией, изображающей процесс перехода.
Для процесса 1—2—3 эта площадь показана на рисунке штриховкой. Таким образом, при переходе из состояния 1 в состояние 3 газ совершает работу
Какую работу совершает газ при переходе из состояния 1 в состояние 3? (Ответ дайте в кДж.)
На диаграмме p—V работе, совершаемой газом при переходе из начального состояния в конечное, соответствует площадь под линией, изображающей процесс перехода. Для процесса 1—2—3 эта площадь показана на рисунке штриховкой. Таким образом, при переходе из состояния 1 в состояние 3 газ совершает работу
Поясните,почему умножение идет 2х10^5 ,когда газ совершает работу от 1 до 2, вроде должно быть 1х10^5,а по ответу получается от 0 до 2.
На участке 1-2 вообще не совершается работа, так как объем газа на этом этапе не изменяется. Вся работа совершается на участке 2-3. Общее правило следующее, если процесс изображен на диаграмме , то работа равна площади под графиком со знаком плюс, если объем увеличивается, и со знаком минус, если уменьшается. Для тепловой машины, работающей по циклу, полезная работа равна площади ограниченной этим циклом, это укладывается в ранее озвученное правило. Когда мы идем по «верхней» части цикла, работа идет в +, потом возвращаемся по «нижней» в исходную точку, работа теперь идет в -, в результате остается только кусок внутри.
Алексей, вот Вы сказали, что «на участке 1-2 вообще не совершается работа, так как объем газа на этом этапе не изменяется.»
а на участке 2-3 ведь не меняется давление.Так почему работа там совершается? Разве не A=pV ?
Не, не так. Давайте разбираться.
Будем выводить формулу, по которой можно посчитать работу совершенную газом. Когда газ работает? Когда он что-то перемешает. Для этого должен как-то меняться его объем. Например, газ расширяется и толкает поршень вверх, а с ним и какой-то груз, вот Вам и работа. То есть без изменения объема нет работы.
Чтобы вывести формулу, рассмотрим модельную задачу. Рассмотрим цилиндрический сосуд с газом. Пусть сосуд закрыт подвижным поршнем площади . Давление газа равно
. Определим, какую работу совершит газ, когда поршень сдвинется на малое расстояние
. Так как это работа на малом перемещении, то назовем ее элементарной работой и обозначим через
. Работа газа равна произведению силы, с которой он давит на поршень, на перемещение поршня (газ давит нормально, поэтому косинуса не возникает):
. Но сила, с которой газ давит на поршень связана с давлением газа соотношением:
. Если перемещение поршня мало, то можно считать, что давление газа не изменяется сильно и что оно остается постоянным. Тогда:
. Но
— это как раз изменение объема газа
. Окончательно имеем:
.
Получив эту формулу, можно забыть о том, как она выводилась (про сосуд и поршень), она оказывается верной для любого малого изменения объема.
Теперь, чтобы найти работу на конечном изменении объема нужно просуммировать работы по малым изменения, в математике это делается при помощи интеграла: Если внимательно приглядеться, то тут можно как раз увидеть площадь под линией процесса на диаграмме
. Вот почему говорят, что для поиска работы надо искать площадь под графиком на этой диаграмме.
Для частных случаев формула приобретает вид:
1) при изобарном процессе давление выносится за знак интеграла и получаем:
2) при изохорном объем не изменяется, поэтому пределы интегрирования совпадают, интеграл равен нулю, работа равна нулю.
3) при изотермическом процессе, давление уже изменяется с объемом, поэтому надо добавить в рассмотрение уравнение Клапейрона-Менделеева: . Следовательно,
. А значит работа при изотермическом процессе равна:
Первый закон термодинамики
-
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
-
Работа газа в изобарном процессе
-
Работа газа в произвольном процессе
-
Работа, совершаемая над газом
-
Применение первого закона термодинамики к изопроцессам
-
Адиабатный процесс
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
Начнём с обсуждения работы газа.
Газ, находящийся в сосуде под поршнем, действует на поршень с силой , где
— давление газа,
— площадь поршня. Если при этом поршень перемещается, то газ совершает работу.
При расширении газа эта работа будет положительной (сила давления газа и перемещение поршня направлены в одну сторону). При сжатии работа газа отрицательна (сила давления газа и перемещение поршня направлены в противоположные стороны).
к оглавлению ▴
Работа газа в изобарном процессе
Предположим, что газ расширяется при постоянном давлении . Тогда сила
, с которой газ действует на поршень, также постоянна. Пусть поршень переместился на расстояние
(рис. 1).
Рис. 1.
Работа газа равна:
Но — изменение объёма газа. Поэтому для работы газа при изобарном расширении мы получаем формулу:
(1)
Если и
— начальный и конечный объём газа, то для работы газа имеем:
. Изобразив данный процесс на
-диаграмме, мы видим, что работа газа равна площади прямоугольника под графиком нашего процесса (рис. 2).
Рис. 2. Работа газа как площадь
Пусть теперь газ изобарно сжимается от объёма до объёма
. С помощью аналогичных рассуждений приходим к формуле:
Но , и снова получается формула (1).
Работа газа опять-таки будет равна площади под графиком процесса на -диаграмме, но теперь со знаком минус.
Итак, формула выражает работу газа при постоянном давлении — как в процессе расширения газа, так и в процессе сжатия.
к оглавлению ▴
Работа газа в произвольном процессе
Геометрическая интерпретация работы газа (как площади под графиком процесса на -диаграмме) сохраняется и в общем случае неизобарного процесса.
Действительно, рассмотрим малое изменение объёма газа — настолько малое, что давление
будет оставаться приблизительно постоянным. Газ совершит малую работу
. Тогда работа
газа во всём процессе найдётся суммированием этих малых работ:
Но данный интеграл как раз и является площадью криволинейной трапеции (рис. 3):
Рис. 3. Работа газа как площадь
к оглавлению ▴
Работа, совершаемая над газом
Наряду с работой , которую совершает газ по передвижению поршня, рассматривают также работу
, которую поршень совершает над газом.
Если газ действует на поршень с силой , то по третьему закону Ньютона поршень действует на газ с силой
, равной силе
по модулю и противоположной по направлению:
(рис. 4).
Рис. 4. Внешняя сила , действующая на газ
Следовательно, работа поршня равна по модулю и противоположна по знаку работе газа:
Так, в процессе расширения газ совершает положительную работу ; при этом работа, совершаемая над газом, отрицательна
. Наоборот, при сжатии работа газа отрицательна
, а работа, совершаемая поршнем над газом, положительна
0 right )’ class=’tex’ alt=’left ( {A}’ > 0 right )’ />.
Будьте внимательны: если в задаче просят найти работу, совершённую над газом, то имеется в виду работа .
Как мы знаем, существует лишь два способа изменения внутренней энергии тела: теплопередача и совершение работы.
Опыт показывает, что эти способы независимы — в том смысле, что их результаты складываются. Если телу в процессе теплообмена передано количество теплоты , и если в то же время над телом совершена работа
, то изменение внутренней энергии тела будет равно:
(2)
Нас больше всего интересует случай, когда тело является газом. Тогда (где
, как всегда, есть работа самого газа). Формула (2) принимает вид:
, или
(3)
Соотношение (3) называется первым законом термодинамики. Смысл его прост: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа и на совершение газом работы.
Напомним, что величина может быть и отрицательной: в таком случае тепло отводится от газа. Но первый закон термодинамики остаётся справедливым в любом случае. Он является одним из фундаментальных физических законов и находит подтверждение в многочисленных явлениях и экспериментах.
к оглавлению ▴
Применение первого закона термодинамики к изопроцессам
Напомним, что в изопроцессе остаётся неизменным значение некоторой величины, характеризующей состояние газа — температуры, объёма или давления. Для каждого вида изопроцессов запись первого закона термодинамики упрощается.
1. Изотермический процесс, .
Внутренняя энергия идеального газа зависит только от его температуры. Если температура газа не меняется, то не меняется и внутренняя энергия: . Тогда формула (3) даёт:
Всё подведённое к газу тепло идёт на совершение газом работы.
2. Изохорный процесс, .
Если объём газа остаётся постоянным, то поршень не перемещается, и потому работа газа равна нулю: . Тогда первый закон термодинамики даёт:
Всё тепло, переданное газу, идёт на изменение его внутренней энергии.
3. Изобарный процесс, .
Подведённое к газу тепло идёт как на изменение внутренней энергии, так и на совершение работы (для которой справедлива формула (1)). Имеем:
к оглавлению ▴
Адиабатный процесс
Процесс называется адиабатным, если он идёт без теплообмена с окружающими телами.
Адиабатный процесс совершается газом, находящимся в теплоизолированном сосуде. Такой сосуд препятствует всем видам теплопередачи: теплопроводности, конвекции, излучению. Пример теплоизолированного сосуда — термос.
Приблизительно адиабатным будет всякий процесс, протекающий достаточно быстро: в течение процесса теплообмен просто не успевает произойти.
При адиабатном процессе . Из первого закона термодинамики получаем:
, или
.
В процессе адиабатного расширения газ совершает положительную работу, поэтому (работа совершается за счёт убыли внутренней энергии). Следовательно, газ охлаждается. Если заставить газ совершить достаточно большую работу, охладить его можно весьма сильно. Именно на этом основаны методы сжижения газов.
Наоборот, в процессе адиабатного сжатия будет , поэтому
: газ нагревается. Адиабатное нагревание воздуха используется в дизельных двигателях для воспламенения топлива.
Кривая, изображающая ход адиабатного процесса, называется адиабатой. Интересно сравнить ход адиабаты и изотермы на -диаграмме (рис. 5).
Рис. 5. Сравнительный ход изотермы и адиабаты
В обоих процессах давление убывает с увеличением объёма, но в адиабатном процессе убывание идёт быстрее. Почему?
При изотермическом расширении давление падает потому, что уменьшается концентрация частиц газа, в результате чего удары частиц по стенкам сосуда становятся реже. Однако интенсивность этих ударов остаётся прежней: ведь температура газа не меняется — значит, не меняется и средняя кинетическая энергия его частиц.
А при адиабатном расширении, наряду с уменьшением концентрации частиц, падает также и температура газа. Удары частиц становятся не только более редкими, но и более слабыми. Вот почему адиабата убывает быстрее изотермы.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Первый закон термодинамики» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023
Как найти работу газа
Работа газа осуществляется при изменении его объема. Именно при изменении объема газа приходят в движение узлы тепловых двигателей, будь то двигатель внутреннего сгорания или пуля в стволе ружья. При различных процессах работа газа вычисляется по-разному.

Вам понадобится
- — манометр;
- — термометр.
Инструкция
Если работа газа осуществляется при изобарном процессе (при постоянном давлении), то для того чтобы найти работу газа с помощью манометра, измерьте давление газа. После этого замерьте его объем перед выполнением работы и после. Найдите изменение объема газа, отняв от конечного значения начальное. После этого найдите произведение давления газа на изменение его объема. Это и будет работа газа при постоянном давлении A=p•ΔV.
Для идеального газа вычислить работу при постоянном давлении можно, применив уравнение Клапейрона-Менделеева. Найдите работу газа, умножив его массу на число 8,31 (универсальную газовую постоянную) и изменение температуры при выполнении работы. Результат поделите на молярную массу газа A=m•R•ΔT/M. При расчетах учитывайте то, что если работа выполняется газом (он расширяется), то она положительна. Если же работа выполняется над газом (его сжимают сторонние силы), то работа отрицательна.
Если работа выполняет при изотермическом расширении (когда температура постоянна), узнайте изменение объема газа и значение его температуры. Для того чтобы найти работу газа, умножьте его массу на число 8,31 (универсальную газовую постоянную) и температуру при выполнении работы. Результат поделите на молярную массу газа. Получившееся число умножьте на логарифм натуральный из отношения конечного и начального объемов газа A=m•R•T•ln(V2/V1)/M.
В общем случае, чтобы найти работу газа возьмите интеграл из функции давления по объему. Границы интеграла – от начального до конечного объема ∫pdV. Если есть график газового процесса в координатах (V,p), как правило, он представляет собой прямую линию, найдите площадь трапеции ограниченной по бокам линиями перпендикулярными оси Vв точках V1 и V2, снизу осью V, а сверху графиком функции. В более сложных случаях ищется площадь криволинейной трапеции.
Полезный совет
Если объем газа не изменяется, работа им не выполняется.
Источники:
- как изменяется объем газа
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Числом степеней свободы механической системы называют количество независимых величин, с помощью которых может быть задано положение системы.
Внутренняя энергия идеального газа представляет собой сумму только кинетической энергии всех молекул, а потенциальной энергией взаимодействия можно пренебречь:
U=∑Ek0=NEk0=mNAM·ikT2=i2·mMRT=i2νRT=i2pV
i — степень свободы. i = 3 для одноатомного (или идеального) газа, i = 5 для двухатомного газа, i = 6 для трехатомного газа и больше.
Изменение внутренней энергии идеального газа в изопроцессах
| Основная формула |
ΔU=32·mMRT=32νRT=32νR(T2−T1) |
| Изотермический процесс |
ΔU=0 Температура при изотермическом процессе — величина постоянная. Так как внутренняя энергия идеального газа постоянной массы в замкнутой системе зависит только от изменения температуры, то она тоже остается постоянной. |
| Изобарное расширение |
ΔU=32νR(T2−T1)=32(pV2−pV1)=32pΔV |
| Изохорное увеличение давления |
ΔU=32νR(T2−T1)=32(p2V−p1V)=32VΔp |
| Произвольный процесс |
ΔU=32νR(T2−T1)=32(p2V2−p1V1) |
Пример №1. На рисунке показан график циклического процесса, проведенного с идеальным газом. На каком из участков внутренняя энергия газа уменьшалась?
Внутренняя энергия газа меняется только при изменении температуры. Так как она прямо пропорциональная температуре, то уменьшается она тогда, когда уменьшается и температура. Температура падает на участке 3.
Работа идеального газа
Если газ, находящийся под поршнем, нагреть, то, расширяясь, он поднимет поршень, т.е. совершит механическую работу.
Механическая работа вычисляется по формуле:
A=Fscosα
Перемещение равно разности высот поршня в конечном и начальном положении:
s=h2−h1
Также известно, что сила равна произведению давления на площадь, на которое это давление оказывается. Учтем, что направление силы и перемещения совпадают. Поэтому косинус будет равен единице. Отсюда работа идеального газа равна произведению давления на площадь поршня:
Работа идеального газа
F=pS
p — давление газа, S — площадь поршня
Работа, необходимая для поднятия поршня — полезная работа. Она всегда меньше затраченной работы, которая определяется изменением внутренней энергии идеального газа при изобарном расширении:
A‘=p(V2−V1)=pΔV>0
Внимание! Знак работы определяется только знаком косинуса угла между направлением силы, действующей на поршень, и перемещением этого поршня.
Работа идеального газа при изобарном сжатии:
A‘=p(V2−V1)=pΔV<0
Работа идеального газа при нагревании газа:
A‘=νRΔT=νR(T2−T1)=mMνRΔT
Внимание! В изохорном процессе работа, совершаемая газом, равна нулю, так как работа газа определяется изменением его объема. Если изменения нет, работы тоже нет.
Геометрический смысл работы в термодинамике
В термодинамике для нахождения работы можно вычислить площадь фигуры под графиком в осях (p, V).
Примеры графических задач
| Изобарное расширение:
A‘=p(V2−V1) A‘>0 |
 |
| Изобарное сжатие:
A‘=p(V2−V1) A‘<0 |
 |
| Изохорное охлаждение:
V=const A‘=0 |
 |
|
Изохорное охлаждение и изобарное сжатие: 1–2: A‘=0 2–3: A‘=pΔV<0 |
 |
| Замкнутый цикл:
1–2: A‘>0 2–3: A‘=0 3–4: A‘<0 4–1: A‘=0 A‘=(p1−p3)(V2−V1) |
 |
| Произвольный процесс:
A‘=p1+p22(V2−V1) |
 |
Пример №2. На pV-диаграмме показаны два процесса, проведенные с одним и тем же количеством газообразного неона. Определите отношение работ A2 к A1 в этих процессах.
Неон — идеальный газ. Поэтому мы можем применять формулы, применяемые для нахождения работы идеального газа. Работа равна площади фигуры под графиком. С учетом того, что в обоих случаях изобарное расширение, получим:
A2=p(V2−V1)=4p(5V−3V)=4p2V=8pV
A1=p(V2−V1)=p(5V−V)=4pV
Видно, что работа, совершенная во втором процессе, вдвое больше работы, совершенной газом в первом процессе.
Задание EF17505

Для каждой величины подберите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
- Определить по графику, как меняется давление.
- Определить, как меняется объем.
- Определить, отчего зависит внутренняя энергия газа, и как она меняется в данном процессе.
Решение
На графике идеальный одноатомный газ изотермически сжимают, так как температура остается неизменной, а давление увеличивается. При этом объем должен уменьшаться. Но внутренняя энергия идеального газа определяется его температурой. Так как температура постоянна, внутренняя энергия не изменяется.
Ответ: 123
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17758
Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅105 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение состояния идеального газа.
3.Записать формулу для расчета внутренней энергии газа.
4.Используя первое начало термодинамики, выполнить общее решение задачи.
5.Подставив известные данные, вычислить неизвестную величину.
Решение
Запишем исходные данные:
• Начальная температура газа: T1 = 600 К.
• Начальное давление: p1 = 4∙105 Па.
• Конечное давление: p2 = 105 Па.
• Работа, совершенная газом: A = 2493 Дж.
Аргон является одноатомным газом. Поэтому для него можно использовать уравнение состояния идеального газа:
pV=νRT
Внутренняя энергия одноатомного идеального газа пропорциональна температуре:
U=32νRT
Внутренняя энергия аргона до расширения и после него:
U1=32νRT1
U2=32νRT2
Согласно условию задачи, температура при расширении обратно пропорциональна объёму. Следовательно:
T=constV
T1V1=T2V2
Выразим конечную температуру:
T2=T1V1V2
Составим уравнение состояния газа для состояний аргона 1 и 2:
p1V1=νRT1
p2V2=νRT2
Отсюда:
νR=p1V1T1=p2V2T2
Отсюда отношение объема аргона в состоянии 1 к объему газа в состоянии 2 равно:
V1V2=p2T1p1T2
Подставим это отношение в формулу для конечной температуры:
T2=T1V1V2=p2T12p1T2
Отсюда:
T2=T1√p2p1
Отсюда внутренняя энергия газа в состоянии 2 равна:
U2=32νRT1√p2p1
Уменьшение внутренней энергии аргона составило (изначально она была выше):
ΔU=U1−U2=32νRT1−32νRT1√p2p1=32νRT1(1−√p2p1)
В соответствии с первым началом термодинамики уменьшение внутренней энергии равно сумме совершённой работы и количества теплоты, отданного газом:
ΔU=Q+A
Следовательно, газ отдал следующее количество теплоты:
Q=ΔU−A=32νRT1(1−√p2p1)−A
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17966
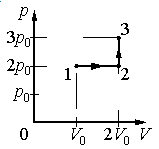
Ответ:
а) р0V0
б) 2р0V0
в) 4р0V0
г) 6р0V0
Алгоритм решения
1.Определить, на каком участке графика совершается работа.
2.Записать геометрический смысл работы.
3.Извлекая данные из графика, вычислить работу, совершенную газом.
Решение
Работа совершается только тогда, когда газ меняет объем. Поэтому работа совершается только на участке 1–2.
Работа идеального газа равна площади фигуры, заключенной под графиком термодинамического процесса в координатах (p, V).
Давление газа при этом равно 2p0, а объем равен разности 2V0 и V0. Следовательно, работа, совершенная газом, будет равна произведению:
A=2p0(2V0−V0)=2p0V0
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 15.2k
Принято считать,
что если система совершает работу против
действия внешних сил, то эта работа
положительная.
Если внешние силы
совершают работу над системой, то работа
отрицательная.
Рассмотрим идеальный
газ, находящийся под поршнем в цилиндре
(рис. 11.6). Газ расширяется, и поршень
поднимается на бесконечно малую высоту
.
Силу,
действующую со стороны газа на поршень,
находим по формуле
,
где
– давление газа на поршень;
– площадь поршня. Бесконечно малую
работу, совершаемую газом, можно найти
по формуле
,
где
– бесконечно малое изменение объёма
газа. Окончательно
(11.6)
|
|
|
Рис. |
Элементарной
работой газа называется величина
.
(11.7)
Это выражение
остается справедливым для элементарной
работы произвольной физически однородной
и изотропной термодинамической системы
в равновесном процессе.
Работа
A12
термодинамической системы в равновесном
процессе перехода из начального состояния
с объёмом V1
в конечное состояние с объёмом V2
(работа в конечном процессе) вычисляется
интегрированием.
При конечном
изменении объёма газа от
до
работа

(11.8)
Изобразим процесс
перехода системы из начального состояния
1
в конечное состояние 2,
построив график зависимости P(V).
Элементарная работа
численно равна площади прямоугольника
с длинами сторон P
и dV.
Работа в конечном процессе, когда объём
изменяется от
до
,
работа равна площади фигуры, ограниченной
отрезкомоси абсцисс, соответствующим этому
отрезку участком графика функцииP(V)
и проходящими через концы отрезка
параллельными оси ординат прямыми.
|
Рис. |
Работа – это
Работа является |
Работа идеального газа при изопроцессах
В
работу идеального газа при изопроцессах.
I.
Рассмотрим изобарический процесс
(рис. 11.8).
П
Рис.
11.8
ри изобарическом процессе.
Если в результате этого процесса объём
газа изменился отдо
,
то работа газа

Построим график
процесса в координатах
.
Работаграфически выражается площадью
заштрихованного прямоугольника.
I
изохорический процесс (рис. 11.9).
При изохорическом процессе
и изменение объёма газаdV = 0
равно нулю. Следовательно, согласно
формулам (11.6) и (11.9) работа
газа при изохорическом процессе равна
нулю.
III.
Рассмотрим
изотермический процесс.
При изотермическом процессе
и внутренняя энергия газа
. (11.10)
Изменение внутренней
энергии
,
т.к..
Если в результате
этого процесса объём газа изменился от
до
,
то работа газа равна: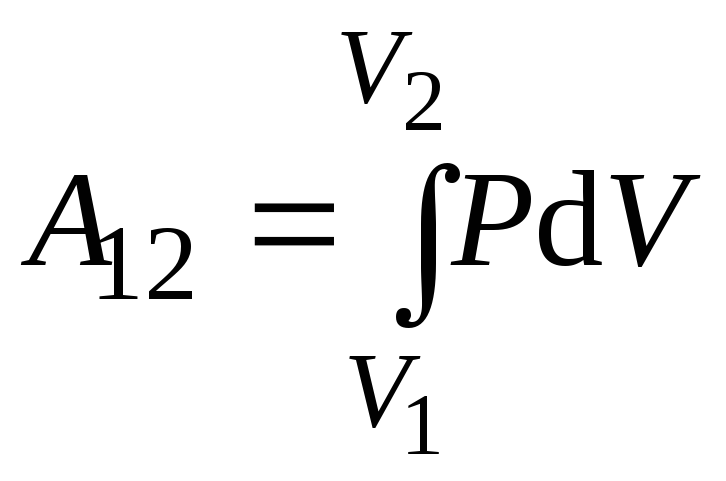
Но здесь
.
Найдём давлениеиз уравнения Менделеева – Клапейрона:

Тогда
,
и

Итак, при
изотермическом процессе:
. (11.11)
Строим график
процесса в координатах
.
Работа
графически выражается заштрихованной
площадью под изотермой.
11.3. Первое начало термодинамики
Рассмотрим газ в
теплоизолированном цилиндре
(теплоизолированную термодинамическую
систему), рис.
11.11. Цилиндр
разделен жесткой теплопроводящей
перегородкой на два отсека C
и
D.
Объём отсека С
поддерживается постоянным, над этой
частью газа не может быть совершена
работа. Объём отсека D
может меняться при помощи подвижного
поршня. За счет теплопроводящей
перегородки отсеки могут обмениваться
внутренней энергией.
Если в результате
совершения над системой C+D
внешними силами работы
,
система перешла из произвольного
состояния1
в произвольное состояние 2,
то при этом изменилась внутренняя
энергия системы. Тогда
.
Т
,
изменение внутренней энергии газа в
отсекеС
произошло за счет теплообмена без
совершения работы и равно количеству
теплоты Q,
полученному газом через жёсткую
перегородку. Обозначим
изменение внутренней энергии газа в
отсекеD.
Тогда получим:
.
Это равенство является математическим
выражениемпервого
начала термодинамики.
Оно подразумевает, что полученное
термодинамической системой количество
теплоты Q
равно приращению её внутренней энергии
за вычетом работы над системой внешних
сил.
Если переход
системы из состояние 1
в состояние 2
является равновесным, то
=
–A,
где А
– работа системы против внешних сил.
В таком случае
. (11.12)
Это выражение
представляет собой интегральную форму
записи первого начала термодинамики.
Равенство
подразумевает, что полученное
термодинамической системой в равновесном
процессе количество теплоты Q
идет на приращение его внутренней
энергии
и совершение работы над внешними телами.
Для бесконечно
малого (элементарного) равновесного
процесса уравнение принимает вид:
. (11.13)
Это выражение
представляет собой дифференциальную
форму записи первого начала термодинамики.
Первое начало
термодинамики – это закон сохранения
и превращения энергии. I
начало термодинамики – частный случай
всеобщего закона сохранения энергии:
полная энергия замкнутой системы может
изменяться только качественно,
количественно оставаясь неизменной.
Таким образом,
первое начало термодинамики является
фундаментальным постулатом, утверждающим
собой закон сохранения энергии. Оно
устанавливает закон взаимопревращения
теплоты, энергии и работы. За всю историю
развития науки не обнаружено опытных
фактов, которые противоречили бы этому
постулату.
Дифференциальная
форма записи закона подчеркивает важные
свойства теплоты, энергии и работы.
Обратим на это внимание.
Внутренняя энергия
термодинамической системы (или тела) –
это сумма всех видов энергии (энергии
теплового движения атомов или молекул,
потенциальная энергия их взаимодействия
и т.п.), заключающихся в данной системе,
за исключением энергии, которой система
обладает в результате взаимодействия
с другими телами. Внутреннюю энергию
можно изменить двумя способами.
1.
Газ находится под поршнем. Вдвигая
поршень, совершаем работу. Газ
сжимается и нагревается, его внутренняя
энергия изменяется. Совершение работы
– первый способ изменения внутренней
энергии тела.
2. Но можно изменить
внутреннюю энергию тела и другим
способом, не совершая работы А,
а только подводя к телу тепло. Газ
находится под поршнем. Пусть поршень
закреплён. При подведении тепла к газу,
его внутренняя энергия меняется.
Подведение
некоторого количества теплоты – второй
способ изменения внутренней энергии
тела. Но тогда теплота и работа должны
быть эквивалентными формами передачи
энергии.
Работа – способ
передачи энергии. В процессе работы
происходит переход энергии из одного
вида энергии в другой.
Теплота – тоже
способ передачи энергии.
Внутренняя энергия
является функцией состояния системы
(или тела, если система состоит из одного
тела). Это означает, чтооднозначно определяется термодинамическим
состоянием тела, т.е. каждому состоянию
тела соответствует одно значение.
Если тело в состоянии
1
имеет энергию
,
а в состоянии2
– энергию
,
то изменение энергиине зависит от того, каким путём совершается
переход из одного состояния в другое.
Следовательно, бесконечно малое изменениевнутренней энергии является полным
дифференциалом (11.13).
Количества теплоты
и работы зависят от пути перехода системы
из начального в конечное состояние, они
не являются функциями состояния системы,
их бесконечно малые изменения
и
не являются полными дифференциалами,
что подчёркивается в записи этих величин
в формуле (11.13).
В
СИ количество теплоты, энергия и работа
измеряются в джоулях (Дж).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #