| Карбонат меди (II) | |
|---|---|
 |
|
| Систематическое наименование |
Карбонат меди (II) |
| Традиционные названия | Углекислая медь |
| Хим. формула | CuCO3 |
| Состояние | твёрдое |
| Молярная масса | 123,555 г/моль |
| Плотность | 3,9 г/см³ |
| Температура | |
| • разложения | 290 °C |
| Растворимость | |
| • в воде | вещество нерастворимо в воде |
| ГОСТ | ГОСТ 8927-79 |
| Рег. номер CAS | 1184-64-1 |
| PubChem | 14452 |
| Рег. номер EINECS | 214-671-4 |
| SMILES |
C(=O)([O-])[O-].[Cu+2] |
| InChI |
1S/CH2O3.Cu/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 GEZOTWYUIKXWOA-UHFFFAOYSA-L |
| ChemSpider | 13799 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Карбонат меди (II) — CuCO3, соль меди и угольной кислоты, внешняя составная часть патины.
Физические свойства
Карбонат меди (II) — белое кристаллическое вещество со слабым зеленоватым оттенком (вследствие гидролиза), почти нерастворим в воде.
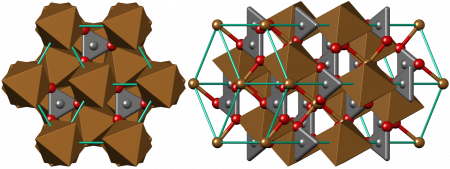
Кристаллическая структура карбоната меди (II)
Получение
Непосредственно обменными реакциями в водных растворах между солями Cu (II) и растворимыми карбонатами других металлов карбонат меди получить нельзя. Вследствие сильного гидролиза выделяются гидроксокарбонаты (основные карбонаты) составов: CuCO3·Cu(OH)2 и 2CuCO3·Cu(OH)2, в зависимости от температуры и концентраций реагентов:
- 2Cu(NO3)2 + 2Na2CO3 + H2O ⟶ CuCO3 ⋅ Cu(OH)2↓ + 4NaNO3 + CO2↑
Средний карбонат меди СuCO3 получают обработкой основных карбонатов углекислым газом под давлением 4,6 МПа при 180 °C:
- CuCO3 ⋅ Cu(OH)2 + CO2 →4.6MPa,180oC 2CuCO3 + H2O↑
Химические свойства
Карбонат меди (II) неустойчив и при нагревании разлагается:
- CuCO3 →290oC CuO + CO2↑
Как и все карбонаты легко реагируют с кислотами с образованием соответствующих солей меди (II) и выделением диоксида углерода:
- CuCO3 + H2SO4 ⟶ CuSO4 + CO2↑ + H2O
Водный раствор аммиака и цианидов металлов растворяют карбонат меди с образованием аммиакатов или цианокомплексов Cu (II):
- CuCO3 + 4NH3 ⋅ H2O ⟶ [Cu(NH3)4]CO3 + 4H2O
- CuCO3 + 4KCN ⟶ K2[Cu(CN)4] + K2CO3
Применение
Нормальный карбонат меди не нашёл какого-либо заметного применения, однако получили широкое применение более доступные и дешёвые гидроксокарбонаты меди. Их используют для получения других соединений меди; плотный малахит — ценный поделочный камень, землистый малахит и мелкие скопления чистого минерала используют для изготовления краски «малахитовая зелень», а также для получения меди (в случае окисленных и смешанных руд). Азурит применяют для получения меди, как компонент пиротехнических составов, изготовления синей краски.

Содержание
- Физические свойства
- Получение
- Применение
Карбонат меди(II) — CuCO3, соль меди и угольной кислоты, внешняя составная часть патины.
| Карбонат меди(II) | |
|---|---|
| Общие | |
| Систематическое наименование |
Kарбонат меди(II) |
| Традиционные названия | Углекислая медь |
| Хим. формула | CuCO3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 123,555 г/моль |
| Плотность | 3,9 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 290 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | вещество нерастворимо в воде |
| Классификация | |
| Рег. номер CAS | 1184-64-1 |
| PubChem | 14452 |
| Рег. номер EINECS | 214-671-4 |
| SMILES |
C(=O)([O-])[O-].[Cu+2] |
| InChI |
1S/CH2O3.Cu/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 GEZOTWYUIKXWOA-UHFFFAOYSA-L |
| ChemSpider | 13799 |
Физические свойства
Карбонат меди(II) — белое кристаллическое вещество со слабым зеленоватым оттенком (вследствие гидролиза), почти нерастворим в воде.
Кристаллическая структура карбоната меди (II)
Получение
Непосредственно обменными реакциями в водных растворах между солями Cu(II) и растворимыми карбонатами других металлов карбонат меди получить нельзя. Вследствие сильного гидролиза выделяются гидроксокарбонаты (основные карбонаты) составов: CuCO3·Cu(OH)2 и 2CuCO3·Cu(OH)2, в зависимости от температуры и концентраций реагентов:
Применение
Нормальный карбонат меди не нашёл какого-либо заметного применения, однако получили широкое применение более доступные и дешёвые гидроксокарбонаты меди. Их используют для получения других соединений меди; плотный малахит — ценный поделочный камень, землистый малахит и мелкие скопления чистого минерала используют для изготовления краски «малахитовая зелень», а также для получения меди (в случае окисленных и смешанных руд). Азурит применяют для получения меди, как компонент пиротехнических составов, изготовления синей краски.
Карбонат меди — неорганическое соединение, 
Задача получить истинный карбонат меди стоит редко. Простыми способами, с помощью химических реакций обмена между растворимыми солями меди и карбонатами других металлов, получение невозможно, т.к. карбонат меди под воздействием гидролиза тут же переходит в осно́вный карбонат. Истинный карбонат получают из осно́вного карбоната — его обрабатывают двуокисью углерода при повышенной температуре и давлении в несколько атмосфер.
Осно́вные карбонаты получают разными способами. Один из них: воздействие соды (гидрокарбоната натрия) на растворимые в воде соли двухвалентной меди. Частично осно́вную углекислую медь получают из природного малахита.
Осно́вные карбонаты встречаются в природе в виде ценных поделочных камней: малахита (зеленого цвета) и азурита (синего цвета со стеклянным блеском).
Свойства
Светло-зеленый мелкокристаллический порошок, без запаха. Его можно наблюдать на старых медных изделиях, например, на монетах. Верхний слой патины как раз и является карбонатом меди, до которого окисляется медь под действием влажного воздуха. В воде практически не растворим. При нагревании разлагается. В воде гидролизируется и превращается в осно́вный карбонат.
Карбонат вступает в реакции с кислотами, выделяя двуокись углерода. Реагирует с раствором аммиака в воде и цианидами металлов.
Меры предосторожности
Осно́вные карбонаты токсичны. Проглатывание приводит к серьезному отравлению. Контакт порошка и пыли с кожей, слизистыми оболочками, дыхательными путями вызывает раздражение, особенно опасно попадание в глаза. При отравлении обязательно следует вызвать скорую помощь.
Все работники, имеющие дело с реактивом, должны использовать средства защиты: резиновые перчатки, защитные очки, респираторы с противопылевым фильтром и спецодежду с длинными рукавами. Помещение должно быть оборудовано принудительной вентиляцией. В лабораториях эксперименты с веществом проводят в вытяжном шкафу.
Транспортировать карбонат меди можно любыми видами транспорта. Хранить в герметичной упаковке (бумажные мешки с полиэтиленовыми вкладышами), на сухих и прохладных складах, защищенных от солнечных лучей, от соседства с кислотами, вдали от нагревательных приборов.
Применение
- В сельском хозяйстве для приготовления минеральных микродобавок в корма для животных. В качестве фунгицида (бургундская жидкость) для борьбы с грибковыми болезнями растений (применяется для опрыскивания аналогично бордосской жидкости); для предпосевной обработки семян.
- При изготовлении красителей на основе меди (зеленых, синих, голубых).
- В химпроме — для получения меди и ее соединений; как катализатор при дегидрировании нефтепродуктов и спиртов; в органическом синтезе ацетальдегида.
- В металлургии для приготовления
электролитов для гальваники; для оксидирования деталей из латуни.
- Для создания на поверхностях металлических деталей фосфатных покрытий, стойких к коррозии, повышающих износостойкость.
- Для приготовления электролитов на основе кремнефтористой кислоты для меднения.
- В радиоэлектронике для производства печатных плат.
- Добавка в пиротехнические составы для придания пламени синего цвета.
| Карбонат меди(II) | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Kарбонат меди(II) |
| Традиционные названия | Углекислая медь |
| Химическая формула | CuCO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 123,555 г/моль |
| Плотность | 3,9 г/см³ |
| Термические свойства | |
| Температура разложения | 290 °C |
| Химические свойства | |
| Растворимость в воде | вещество нерастворимо в воде |
Карбонат меди(II) — CuCO3, соль меди и угольной кислоты.
Физические свойства
Карбонат меди(II) — белое кристаллическое вещество, с слабым зеленоватым оттенком (вследствие гидролиза).
Получение
Непосредственно обменными реакциями в водных растворах между солями Cu(II) и растворимыми карбонатами других металлов карбонат меди получить нельзя. Вследствие сильного гидролиза выделяются гидроксокарбонаты (основные карбонаты) составов: CuCO3·Cu(OH)2 и 2CuCO3·Cu(OH)2, в зависимости от температуры и концентраций реагентов:
Нормальный карбонат меди СuСО3 получают обработкой основных карбонатов углекислым газом под давлением 4,6 МПа при 180 °C:
Химические свойства
Карбонат меди(II) неустойчив и при нагревании разлагается:
Как и все карбонаты легко реагируют с кислотами с образованием соответствующих солей меди(II) и выделением диоксида углерода:
Водный раствор аммиака и цианидов металлов растворяют карбонат меди с образованием аммиакатов или цианокомплексов Cu(II):
Применение
Нормальный карбонат меди не нашёл какого-либо заметного применения, однако получили широкое применение более доступные и дешёвые гидроксокарбонаты меди. Их используют для получения других соединений меди; плотный малахит — ценный поделочный камень, землистый малахит и мелкие скопления чистого минерала используют для изготовления краски «малахитовая зелень», а также для получения меди (в случае окисленных и смешанных руд). Азурит применяют для получения меди, как компонент пиротехнических составов, изготовления синей краски.
См. также
- Малахит
- Азурит
- Медь
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Соединения меди |
|---|
|
Азид меди(II) (Cu(N3)2) • Арсенат меди(II) (Cu3(AsO4)2) • Ацетат меди(I) (СН3СООCu) • Ацетат меди(II) ((СН3СОО)2Cu) • Ацетиленид меди(I) (Cu2C2) • Ацетиленид меди(II) (CuC2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромат меди(II) (Cu(BrO3)2) • Гексафторокупрат(III) калия (K3[CuF6]) • Гексафторосиликат меди(I) (Cu2[SiF6]) • Гексафторосиликат меди(II) (Cu[SiF6]) • Гидрид меди(I) (CuH) • Гидроксид меди(I) (CuOH) • Гидроксид меди(II) (Cu(OH)2) • Дигексателлуратокупрат(III) натрия (Na9[Cu(TeO6)2]) • Дигидроксодикарбонат меди(II) (Cu3(OH)2(CO3)2) • Дигидроксокарбонат меди(II) ((CuOH)2CO3) • Диортопериодатокупрат(III) калия (K7[Cu(IO6)2]) • Дифосфид тримеди (Cu3P2) • Иодид меди(I) (CuI) • Иодат меди(II) (Cu(IO3)2) • Карбонат меди(II) (CuCO3) • Купрат(III) калия (KCuO2) • Метаборат меди(I) (CuBO2) • Метаборат меди(II) (Cu(BO2)2) • Нитрат меди(I) (CuNO3) • Нитрат меди(II) (Cu(NO3)2) • Нитрид меди (Cu3N) • Оксалат меди(II) (CuC2O4) • Оксид меди(I) (Cu2O) • Оксид меди(II) (CuO) • Оксид меди(III) (Cu2O3) • Ортофосфат меди(II) (Cu3(PO4)2) • «Парижская зелень» (Cu(CH3COO)2•3Cu(AsO2)2) • Периодады меди(II) • Полииодиды меди(II) (CuIn) • Роданид меди(I) (CuSCN) • Роданид меди(II) (Cu(SCN)2) • Селенат меди(II) (CuSeO4) • Селенид меди(I) (Cu2Se) • Селенид меди(II) (CuSe) • Силицид димеди (Cu2Si) • Силицид пентамеди (Cu5Si) • Силицид тетрамеди (Cu4Si) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфид меди(I) (Cu2S) • Сульфид меди(II) (CuS) • Сульфит меди(I) (Cu2SO3) • Теллурид меди(I) (Cu2Te) • Фенилмедь (CuC6H5) • Фосфат меди(I) (Cu3PO4) • Фосфаты меди(II) • Фосфид димеди (Cu2P) • Фосфид тримеди (Cu3P) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Хлорат меди(II) (Cu(ClO3)2) • Хлорид меди(I) (CuCl) • Хлорид меди(II) (CuCl2) • Цианид меди(I) (CuCN) • Цианид меди(II) (Cu(CN)2) • Этилмедь (CuC2H6) • |
В этой статье мы поговорим о том, что собой представляет карбонат меди, как его получают, зачем он вообще нужен, а также узнаем, к какой группе солей относится карбонат меди.
Получение карбоната меди
Карбонат меди является неорганическим соединением, средней солью угольной кислоты и меди. Иначе это соединение называют углекислой медью. Формула — CuCO3. Стоит отметить, что соединение является неустойчивым. По этой причине оно не используется в промышленности. Однако, довольно широкое применение получили гидроксокарбонаты меди или осно́вные карбонаты меди):
- CuCO3•Cu(OH)2
- 2CuCO3•Cu(OH)2.
Истинные карбонаты меди получают очень редко. Простым способом, при помощи обменных химических реакций между растворимыми солями меди и карбонатами прочих металлов, получить истинный карбонат меди не получится, поскольку он под действием гидролиза сразу же превращается в осно́вный карбонат.
Истинный карбонат можно получить из осно́вного карбоната при помощи обработки последнего двуокисью углерода. Протекает реакция в условиях высокой температуры и давлении в несколько атмосфер.
Осно́вные карбонаты можно встретить и в природе в форме ценных поделочных камней: малахита (имеет зеленый цвет) и азурита (имеет синий цвет со стеклянным блеском).
Свойства карбоната меди
Карбонат меди представляет собой светло-зеленый мелкокристаллический порошок, который не имеет запаха. Образование такого вещества можно увидеть на старых медных предметах, к примеру, монетах. Фактически, верхний слой патины это и есть карбонат меди, который образуется вследствие окисления меди под действием влажного воздуха. В воде он практически не растворяется. Нагревание карбоната меди приводит к его разложению. В присутствии воды происходит реакция гидролиза и дальнейшее превращение в осно́вный карбонат.
Карбонат меди активно взаимодействует с кислотами. Продуктом таких реакций является выделение двуокиси углерода. Также вступает в реакции с раствором аммиака в присутствии воды и цианидами металлов. Прокаливание карбоната меди приводит к образованию порошка черного цвета, который является оксидом меди (II).
Вследствие разложения основы карбоната меди (II) образуется углекислый газ, поскольку наблюдается помутнение известковой воды. Пробирку нужно держать под наклоном, поскольку третьим продуктом реакции помимо оксида меди (II) и углекислого газа является вода.
Техника безопасности
Осно́вные карбонаты являются токсичными веществами. Результатом проглатывания станет серьезное отравление. Вследствие контакта порошка и пыли с кожей человека, слизистыми оболочками, а также дыхательными путями будет сильное раздражение. Крайне опасно попадание порошка на слизистую глаза. В случае попадания вещества внутрь организма, необходимо немедленно обратиться за медицинской помощью.
Всем работникам, которые имеют дело с реактивом, необходимо выдавать средства индивидуальной защиты, такие как
- резиновые перчатки
- защитные очки
- респираторы, имеющие фильтр от пыли
- спецодежду, имеющую длинные рукава.
В помещении, где ведется работа с данным соединением, обязательно должна присутствовать принудительная вентиляция. В лабораторных условиях любые эксперименты с веществом должны проводиться в вытяжном шкафу.
Перевозка карбоната меди может быть осуществлена любыми видами транспорта. Хранение обязательно в герметичной упаковке. Самым правильным вариантом хранения являются бумажные мешки с полиэтиленовыми вкладышами. Склад для хранения должен быть сухим и прохладным, защищенным от солнечных лучей, от соседства с кислотами. Отметим, что данное вещество должно храниться вдали от нагревательных приборов.
Использование
Карбонат меди применяется в различных сферах человеческой жизнедеятельности. В сельском хозяйстве он незаменим в процессе приготовления минеральных микродобавок для кормов животных. Также его используют как фунгицид (бургундская жидкость) в борьбе с грибковыми заболеваниями растений. Его применяют также, как и бордосскую смесь, опрыскивают семена перед посадкой.
Из карбоната меди создают красители зеленого, синего, голубого оттенка.
В химической промышленности из карбоната получают медь и ее соединения. Это вещество используется в качестве катализатора в процессе дегидрирования нефтепродуктов и спиртов, в органическом синтезе для получения ацетальдегида.
В металлургической отрасли из карбоната меди создают электролиты для гальваники, а также оксидируют им детали из латуни. В результате некоторых превращений из карбоната меди на поверхности металлических деталей формируется фосфатное покрытие, которое является стойким к коррозии и повышает износостойкость.
Из карбоната меди готовят электролиты на базе кремнефтористой кислоты для реализации процесса меднения.
Специалисты по радиоэлектронике создают из карбоната меди печатные платы.
Добавление его в пиротехнические составы придает пламени красивый синий оттенок.
Кроме этого, давно известно, что карбонат меди основной – это противоглистное средство неорганических солей меди. Препарат характеризуется выраженным противоцестодозным свойством. Высокий уровень эффективности наблюдается при использовании его в качестве средства от гименолепидоза у уток в дозах 0,1-0,2 г/ кг массы птицы.
Еще меди карбонат используют для лечения мониезиоза у овец. Его перемешивают с кормом в соотношении 1:100. Применяют один раз или два раза с интервалом в 1-3 дня. Возможно изготовление брикетов с солью в соотношении 1:9. Такие брикеты скармливают на протяжении 10-15 дней, после чего нужно сделать перерыв на 20 дней.
Гидролиз карбоната меди (II)
Разложение карбоната меди методом гидролиза происходит по катиону и аниону. Реакция разложения карбоната меди протекает в нейтральной среде. Уравнение гидролиза выглядит таким образом:
- CuCO3↔ Cu2+ + CO32- (диссоциация соли);
- CO32- + HOH ↔ HCO3— + OH— (гидролиз по аниону);
- Cu2+ + HOH ↔CuOH+ + H+ (гидролиз по катиону);
- Cu2+ + CO32- + HOH ↔ CuOH+ + HCO3—(ионное уравнение)
- CuCO3+ H2O ↔ Cu(OH)HCO3 (молекулярное уравнение).


 электролитов для гальваники; для оксидирования деталей из латуни.
электролитов для гальваники; для оксидирования деталей из латуни.



![~mathsf{ CuCO_3 + 4NH_3cdot H_2O longrightarrow [Cu(NH_3)_4]CO_3 + 4H_2O}](https://dic.academic.ru/dic.nsf/ruwiki/7277431e4192aedcae4f17ea0005544c.png)
![~mathsf{ CuCO_3 + 4KCN longrightarrow K_2[Cu(CN)_4] + K_2CO_3}](https://dic.academic.ru/dic.nsf/ruwiki/aff138c66afaa32585e86f56b4b57398.png)