Катионы и анионы
Что такое катионы и анионы:
Катионы и анионы — это типы ионов, то есть атомы, которые приобрели или потеряли электроны через химические связи.
Атом, имеющий одинаковое количество протонов (положительный заряд) и электронов (отрицательный заряд), считается электрически нейтральным. Когда этот атом принимает или передает электроны, он называется ионом, который, в свою очередь, может быть:
- Катион: атом, который потерял (или прогнулся) электроны и поэтому заряжен положительно.
- Ânion: атом, который получил (или принял) электроны и, следовательно, заряжен отрицательно.
катион
Катион — это атом, который имеет положительный заряд, потому что в нем больше протонов, чем электронов.
Щелочные металлы (литий, натрий, калий, рубидий, цезий и францио), как правило, образуют катионы, поскольку в их валентном слое имеется только 1 электрон. Это означает, что энергия, необходимая для удаления этого электрона, очень мала, что делает эти элементы очень реактивными.
Катион представлен символом +, следующим за именем элемента. Количество потерянных электронов указывает на тип катиона:
- Катионы с зарядом +1 называются одновалентными.
- Катионы с зарядом +2 называются бивалентами.
- Катионы с зарядом +3 называются трехвалентными.
Типы катионов также можно определить по количеству знаков +. Таким образом, элемент, представленный только +, является одновалентным катионом, в то время как другой элемент, представленный +++, является трехвалентным катионом.
Примеры катионов
- Al + 3 (алюминий)
- Ca + 2 (кальций)
- Mg + 2 (магний)
- Na + 1 (натрий)
- К + 1 (калий)
- Zn + 2 (цинк)
- Pb + 4 (свинец)
анион
Анион — это атом с отрицательным зарядом, потому что в нем больше электронов, чем протонов. Элементы семейства азота, калькогенов и галогенов имеют тенденцию образовывать анионы, потому что они легко принимают электроны.
Анион представлен символом — после имени элемента. Количество полученных электронов указывает на тип аниона:
- Анионы с зарядом -1 называются одновалентными.
- Анионы с зарядом -2 называются бивалентами.
- Анионы с зарядом -3 называются трехвалентными.
Как и в катионах, анионы также могут быть идентифицированы по количеству сигналов. Таким образом, элемент, представленный только — это одновалентный анион, а другой элемент, представленный -, является двухвалентным анионом.
Примеры анионов
- O-2 (кислород)
- N-3 (азид)
- F-1 (фтор)
- Br-1 (бромид)
- С-2 (сера)
- Cl-1 (хлорид)
Ионные Связи
Ионные или электовалентные связи представляют собой связи, которые возникают между катионами и анионами.
Элементы могут принимать, давать или делить электроны таким образом, чтобы их последний энергетический слой имел 8 электронов. Это известно как теория октетов .
Согласно теории октетов, атомы имеют тенденцию стабилизироваться, когда в валентном слое (последнем электронном слое) находится 8 электронов. Таким образом, будучи положительно заряженными, катионы связываются с отрицательно заряженными анионами. Таким образом, атомы дают или принимают электроны для достижения равновесия.
Связи, образованные между катионами и анионами, очень прочны и имеют тенденцию иметь следующие признаки:
- являются твердыми и ломкими при нормальных условиях температуры и давления;
- очень точка кипения и кипения;
- ваш лучший растворитель — вода;
- при растворении в жидкости проводить электрический ток.
Ионные связи образуют ионные соединения, такие как хлорид натрия (поваренная соль), образованный связью Na + (катион натрия) + Cl- (хлорид-анион) → NaCl.
Примеры ионных соединений
Некоторые примеры ионных соединений:
- NaCl — Хлорид натрия (поваренная соль)
- Na 2 SO 4 — сульфат натрия
- CaCO 3 — карбонат кальция
- NaNO 3 — Нитрат натрия
Катионный стол
| Li + | литий | Fe + 2 | железистый |
|---|---|---|---|
| Na + | натрий | Со + 2 | cobaltoso |
| К + | калий | Ni + 2 | Niqueloso |
| Rb + | рубидий | Sn + 2 | содержащий двухвалентное олово |
| Cs + | цезий | Pb + 2 | Plumboso |
| (NH 4 ) + | аммоний | Mn + 2 | марганцевых |
| Ag + | серебро | Pt + 2 | относящийся к платине |
| Cu + | медь | Би + 3 | висмут |
| Hg + | Ртути | Al + 3 | Нержавеющая сталь |
| Au + | Auroso | Cr + 3 | хром |
| Mg + 2 | магний | Au + 3 | золотоносный |
| Ca + 2 | кальций | Fe + 3 | трехвалентного железа |
| Sr + 2 | стронций | Со + 3 | кобальтовые |
| Ба + 2 | барий | Ni + 3 | Niquélico |
| Zn + 2 | цинк | Sn + 4 | оловянный |
| CD + 2 | кадмий | Pb + 4 | свинцовый |
| Cu + 2 | двухвалентной | Мн + 4 | марганца |
| Hg + 2 | содержащий двухвалентную ртуть | Pt + 4 | платина |
Таблица анионов
| F- | фторид | P 2 O 7 -4 | пирофосфат |
|---|---|---|---|
| Cl | хлорид | (№ 2 ) — | нитрит |
| бром | бромид | (№ 3 ) — | нитрат |
| I- | йодид | S-2 | сульфид |
| (ClO) — | гипохлорит | (SO4) -2 | сульфат |
| (CLO 2 ) — | хлорит | (SO 3 ) -2 | сульфит |
| (CLO 3 ) — | хлорат | (S 2 O 3 ) -2 | тиосульфат |
| (CLO 4 ) — | перхлорат | (S 4 O 6 ) -2 | персульфат |
| (BrO) — | гипобромит | (MnO 4 ) — | перманганат |
| (BrO3) — | бромат | (MnO 4 ) -2 | манганат |
| (IO) — | гипоиодит | (SiO3) -2 | метасиликат |
| (IO 3 ) — | йодат | (SiO 4 ) -4 | ортосиликат |
| (IO 4 ) — | периодатное | (CrO 4 ) -2 | хромат |
| (CN) — | цианид | (CrO 7 ) -2 | дихромат |
| (CNO) — | цианат | (AsO3) -3 | арсенит |
| (ЦНС) — | тиоцианат | (AsO 4 ) -3 | мышьяковокислый |
| (C 2 H 3 O 2 ) — | ацетат | (SbO3) -3 | Antimônito |
| (СО 3) -2 | карбонат | (SbO 4 ) -3 | антимонат |
| (С2-4) -2 | оксалат | (BO 3 ) -3 | борат |
| [Fe (CN) 6 ] -3 | гексационоферрата | (SnO 3 ) -2 | станнат |
| [Fe (CN) 6 ] -4 | железистосинеродистый | (SnO 2 ) -2 | станнин |
| (PO 3 ) — | метафосфат | (AlO 2 ) — | алюминат |
| (H 2 PO 2 ) — | гипофосфит | (PbO 2 ) -2 | Plumbito |
| (HPO 3 ) -2 | фосфит | (ZnO 2 ) -2 | zincato |
| (ПО 4 ) -3 | ортофосфат |
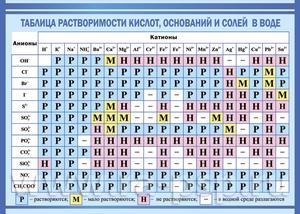
…
Оглавление:
- Показатели растворимости в воде
- Электролиты
- Теория электролитической растворимости
- Ионы
- Катионы
- Анионы
Показатели растворимости в воде
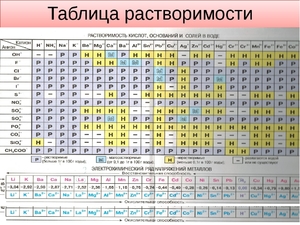
Она помогает при решении химических уравнений, где участвуют ионные реакции. Если результатом будет получение нерастворимого вещества, то реакция возможна. Существует несколько вариантов:
- Вещество хорошо растворяется;
- Малорастворимо;
- Практически не растворяется;
- Нерастворимо;
- Гидрализуется и не существует в контакте с водой;
- Не существует.
Это интересно: металлы и неметаллы в периодической таблице Менделеева.
Электролиты
Это растворы или сплавы, проводящие электрический ток. Электропроводность их объясняется мобильностью ионов. Электролиты можно поделить на 2 группы:
- Сильные. Растворяются полностью, независимо от степени концентрации раствора.
- Слабые. Диссоциация проходит частично, зависит от концентрации. Уменьшается при большой концентрации.
Теория электролитической растворимости
Одновременно с диссоциацией проходит противоположный процесс – соединение ионов в молекулы. Кислоты – это такие электролиты, при распаде которых образуется катион – ион водорода. Основания – анионы – это гидроксид ионы. Щелочи – это основания, которые растворяются в воде. Электролиты, которые способны образовывать и катионы и анионы, называются амфотерными.
Ионы
Это такая частица, в которой больше протонов или электронов, он будет называться анион или катион, в зависимости от того, чего больше: протонов или электронов. В качестве самостоятельных частиц они встречаются во многих агрегатных состояниях: газах, жидкостях, кристаллах и в плазме. Понятие и название ввёл в обиход Майкл Фарадей в 1834 году. Он изучал воздействие электричества на растворы кислот, щелочей и солей.
Простые ионы несут на себе ядро и электроны. Ядро составляет почти всю атомную массу и состоит из протонов и нейтронов. Количество протонов совпадает с порядковым номером атома в периодической системе и зарядом ядра. Ион не имеет определённых границ из-за волнового движения электронов, поэтому невозможно измерить их размеры.
Отрыв электрона от атома требует, в свою очередь, затрат энергии. Она называется энергия ионизации. Когда присоединяется электрон, происходит выделение энергии.
Катионы
Это частицы, носящие положительный заряд. Могут иметь разную величину заряда, например: Са2+ — двузарядный катион, Na+ — однозарядный катион. Мигрируют к отрицательному катоду в электрическом поле.
Анионы
Это элементы, имеющие отрицательный заряд. А также обладает различным количеством величины зарядов, например, CL- — однозарядный ион, SO42- — двухзарядный ион. Такие элементы входят в состав веществ, обладающих ионной кристаллической решёткой, в поваренной соли и многих органических соединениях.
- Натрий. Щелочной металл. Отдав один электрон, находящийся на внешнем энергетическом уровне, атом превратится в положительный катион.
- Хлор. Атом этого элемента принимает на последний энергетический уровень один электрон, он превратится в отрицательный хлорид анион.
- Поваренная соль. Атом натрия отдаёт электрон хлору, вследствие этого в кристаллической решётке катион натрия окружён шестью анионами хлора и наоборот. В результате такой реакции образуется катион натрия и анион хлора. Благодаря взаимному притяжению формируется хлорид натрия. Между ними образуется прочная ионная связь. Соли — это кристаллические соединения с ионной связью.
- Кислотный остаток. Это отрицательно заряженный ион, находящийся в сложном неорганическом соединении. Он встречается в формулах кислот и солей, стоит обычно после катиона. Практически для всех таких остатков есть своя кислота, например, SO4 – от серной кислоты. Кислот некоторых остатков не существует, и их записывают формально, но они образуют соли: фосфит ион.
Химия – наука, где возможно творить практически любые чудеса. Катион вы можете узнать по ссылке.

Ион
Ион — это заряженная частица, образованная из молекулы или атома путём потери или приобретения одного электрона.
Отсюда следует, что в ионе количество протонов не равно количеству электронов.
После изучения статьи Вы узнаете, какими бывают заряженные частицы, что такое ионы, катионы и анионы, также
Вы сможете по номеру элемента узнать, каким зарядом он может обладать.
Число электронов в ионе
Количество электронов в нейтральном атоме равно количеству протонов в ядре, например, у хрома (24Cr)
24 протона, соответствено, вокруг ядра вращается 24 электрона. Как было рассказано в статье
«электронная конфигурация атома», каждый
электрон двигается по некой орбитали, то есть обладает заданным количеством энергии.
Если ион образован из-за потери электрона, то заряд иона становится положительным (электрон имеет отрицательный
заряд), схема для запоминания:
24Cr — e— = 24Cr + e+ = 24Cr+
24Cr — 3e— = 24Cr + 3e+ = 24Cr3+
Аналогично при присоединении электрона:
24Cr + e— = 24Cr — e+ = 24Cr—
24Cr + 3e— = 24Cr — 3e+ = 24Cr3-
Энергия ионизации
Если электрону сообщить достаточное количество энергии, то электрон «оторвётся» от атома. Чем ближе электрон
к ядру — тем сложнее его отрывать, а значит, больше энергии необходимо передать. Энергия, необходимая для отрыва
электрона, называется энергией ионизации или ионизационный потенциал (I). Значения I затабулированы и могут быть
найдены в различных справочниках.
| # | Элемент | Название | кДж/моль |
|---|---|---|---|
| 1 | H | Водород | 1312 |
| 2 | He | Гелий | 2373 |
| 3 | Li | Литий | 520 |
| 4 | Be | Бериллий | 899.5 |
| 5 | B | Бор | 801 |
| 6 | C | Углерод | 1086 |
| 7 | N | Азот | 1402 |
| 8 | O | Кислород | 1314 |
| 9 | F | Фтор | 1681 |
| 10 | Ne | Неон | 2080.7 |
| 11 | Na | Натрий | 495 |
| 12 | Mg | Магний | 738 |
| 13 | Al | Алюминий | 578 |
| 14 | Si | Кремний | 787 |
| 15 | P | Фосфор | 1012 |
| 16 | S | Сера | 1000 |
| 17 | Cl | Хлор | 1251 |
| 18 | Ar | Аргон | 1520.6 |
| 19 | K | Калий | 418.8 |
| 20 | Ca | Кальций | 590 |
| 21 | Sc | Скандий | 633.1 |
| 22 | Ti | Титан | 658.8 |
| 23 | V | Ванадий | 650.9 |
| 24 | Cr | Хром | 652.9 |
| 25 | Mn | Марганец | 717.3 |
| 26 | Fe | Железо | 762.5 |
| 27 | Co | Кобальт | 760.4 |
| 28 | Ni | Никель | 737.1 |
| 29 | Cu | Медь | 745.5 |
| 30 | Zn | Цинк | 906.4 |
| 31 | Ga | Галлий | 578.8 |
| 32 | Ge | Германий | 762 |
| 33 | As | Мышьяк | 947 |
| 34 | Se | Селен | 941 |
| 35 | Br | Бром | 1142 |
| 36 | Kr | Криптон | 1350.8 |
| 37 | Rb | Рубидий | 403 |
| 38 | Sr | Стронций | 549 |
| 39 | Y | Иттрий | 600 |
| 40 | Zr | Цирконий | 640.1 |
| 41 | Nb | Ниобий | 652.1 |
| 42 | Mo | Молибден | 684.3 |
| 43 | Tc | Технеций | 702 |
| 44 | Ru | Рутений | 710.2 |
| 45 | Rh | Родий | 719.7 |
| 46 | Pd | Палладий | 804.4 |
| 47 | Ag | Серебро | 731 |
| 48 | Cd | Кадмий | 867.8 |
| 49 | In | Индий | 558.3 |
| 50 | Sn | Олово | 709 |
| 51 | Sb | Сурьма | 834 |
| 52 | Te | Теллур | 869 |
| 53 | I | Иод | 1008 |
| 54 | Xe | Ксенон | 1170.4 |
| 55 | Cs | Цезий | 375.7 |
| 56 | Ba | Барий | 503 |
| 57 | La | Лантан | 538.1 |
| 58 | Ce | Церий | 534.4 |
| 59 | Pr | Празеодим | 527 |
| 60 | Nd | Неодим | 533.1 |
| 61 | Pm | Прометий | 540 |
| 62 | Sm | Самарий | 544.5 |
| 63 | Eu | Европий | 547.1 |
| 64 | Gd | Гадолиний | 593.4 |
| 65 | Tb | Тербий | 565.8 |
| 66 | Dy | Диспрозий | 573 |
| 67 | Ho | Гольмий | 581 |
| 68 | Er | Эрбий | 589.3 |
| 69 | Tm | Тулий | 596.7 |
| 70 | Yb | Иттербий | 603.4 |
| 71 | Lu | Лютеций | 523.5 |
| 72 | Hf | Гафний | 658.5 |
| 73 | Ta | Тантал | 761 |
| 74 | W | Вольфрам | 770 |
| 75 | Re | Рений | 760 |
| 76 | Os | Осмий | 840 |
| 77 | Ir | Иридий | 880 |
| 78 | Pt | Платина | 870 |
| 79 | Au | Золото | 890.1 |
| 80 | Hg | Ртуть | 1007.1 |
| 81 | Tl | Таллий | 589.4 |
| 82 | Pb | Свинец | 715.6 |
| 83 | Bi | Висмут | 703 |
| 84 | Po | Полоний | 812.1 |
| 85 | At | Астат | 890 |
| 86 | Rn | Радон | 1037 |
| 87 | Fr | Франций | 380 |
| 88 | Ra | Радий | 509.3 |
| 89 | Ac | Актиний | 499 |
| 90 | Th | Торий | 587 |
| 91 | Pa | Протактиний | 568 |
| 92 | U | Уран | 597.6 |
| 93 | Np | Нептуний | 604.5 |
| 94 | Pu | Плутоний | 584.7 |
| 95 | Am | Америций | 578 |
| 96 | Cm | Кюрий | 581 |
| 97 | Bk | Берклий | 601 |
| 98 | Cf | Калифорний | 608 |
| 99 | Es | Эйнштейний | 619 |
| 100 | Fm | Фермий | 627 |
| 101 | Md | Менделевий | 635 |
| 102 | No | Нобелий | 642 |
| 103 | Lr | Лоуренсий | 470 |
| 104 | Rf | Резерфордий | 580 |
| Таблица 1. Энергия ионизации, справочные данные |
Энергия сродства электрону
Также электроны могут присоединяться к атому, в процессе присоединения электрон выделяет энергию, такая энергия
называется энергией сродства электрону, для каждого электрона конкретного атома энергия сродства численно равна
и противоположна по знаку энергии ионизации, например, 17Cl, что бы оторвать 17й электрон у атома
хлора, необходимо сообщить ему 13 эВ, любой другой электрон, который присоединится на место 17го электрона
также выделит 13 эВ.
Катионы и анионы
Атомы, в которых количество протонов не равно количеству электронов называются ионами, поскольку электрон имеет
отрицательный заряд, то если электронов больше протонов, то суммарный заряд отрицательный: S2-
означает, что в данном атоме серы количество электронов больше чем протонов на два электрона. Соответственно,
если электронов меньше чем протонов, то суммарный заряд положительный и обозначается H+.
Отрицательно заряженные атомы называются анионами, положительно заряженные атомы — катионами.
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за
пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Вернёмся к устройству электронной оболочки. Вокруг атома электроны сгруппированы по энергетическим уровням,
каждый заполненный уровень экранирует ядро и является более стабильным, нежели не до конца заполненный
уровень. То есть электронная конфигурация стремиться к состоянию заполненного подуровня: если на p-оболочке
находится 5 электронов, то вероятнее атом примет один электрон, нежели отдаст пять. Так, например, у атома
хлора, пять электронов на 3p-подуровне, энергия сродства хлора — 3.61 эВ, энергия ионизации — 13 эВ. У натрия
на последнем подуровне один электрон, энергия сродства — 0,78 эВ, потенциал ионизации — 0,49 эВ, поэтому
вероятнее натрий отдаст один электрон, нежели примет его.
Зная потенциал ионизации и энергию сродства мы можем сделать предположение о взаимодействии веществ. Если
смешать натрий и хлор, и сообщить им энергию, то вероятнее всего Na будет отдавать один электрон Cl и
в результате получится смесь ионов Na+ и Cl—.
Пример
Так можно по номеру элемента предположить, какой заряд он будет иметь, например, 19й элемент, электронная
конфигурация — 1s 22s 22p 63s 23p64s 1,
вероятнее всего, такой элемент может либо отдать, либо принять один электрон.
У 27го элемента электронная конфигурация выглядит так:
1s 22s 22p 63s 23p64s 23d7,
у d-подуровня всего может быть 10 атомов, т.е. либо атом примет 1,2 или 3 электрона, либо отдаст
1,2,3…7 электронов, так, вероятнее, он примет 3, т.е. возможные состояния — это +1, +2 и +3,
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять
окислительно-восстановительные реакции!
Вам понравилась статья?
/
Просмотров: 12 899
Урок-практикум
«Качественные реакции обнаружения
некоторых катионов и анионов»
Цели
урока:
Обучающие:
- Дать
понятия «качественная реакция», сформировать понимание учащихся
о возможности использования качественных реакций для анализа образцов
воды, продолжить формирование умения записывать уравнения химических
реакций в ионном виде.
Воспитывающие:
- Способствовать
формированию умения применять приемы логического мышления, способствовать
развитию грамотной устной и письменной химической речи.
Развивающие:
- Создать
условия для развития коммуникативной культуры, диалогической речи
учащихся, прививать навыки работы с веществами.
Оборудование:
·
Растворы
индикаторов (метилоранжа, лакмуса, фенолфталеина), растворы нитрата серебра,
хлорида бария, сульфата натрия, серной кислоты, гидроксида натрия (калия).
Набор реактивов должен быть рассчитан на пару учащихся, в наборе каждой парте
стоят три пробирки с прозрачными растворами: серной кислоты (пробирка №1),
гидроксида калия (пробирка №2) и хлорида бария (пробирка №3).
·
При
возможности урок лучше сопровождать электронной презентацией.
Ход
урока
1.
Организационный момент (1-2 мин).
Учитель организует
внимание учащихся.
2.
Овладение содержанием учебного материала (20 мин).
А) Понятие
качественных реакций.
Качественные
реакции — характерные реакции, используемые для идентификации различных
веществ.
Для определения
присутствия веществ, анионов, катионов используются различные химические
реакции. Эти реакции широко используются при проведении качественного анализа,
целью которого является определение наличия веществ или ионов в растворах или
смесях.
Качественные
реакции можно разделить на два вида: качественные реакции на катионы и анионы.
Качественные
реакции на катионы
Это реакции, с
помощью которых можно определить наличие того или иного катиона в растворе.
Основные качественные реакции на катионы представлены в таблице 1.
Таблица 1.
Качественные
реакции на катионы.
|
Катион |
Воздействие |
Наблюдаемая |
|
|
Пламя |
Карминово-красное |
|
|
Пламя |
Желтое |
|
К+ |
Пламя |
Фиолетовое |
|
Са2+ |
Пламя |
Кирпично-красное |
|
Sr2+ |
Пламя |
Карминово-красное |
|
Ва2+ |
Пламя S042- |
Желто-зеленое |
|
Сu2+ |
Вода |
Гидратированные |
|
РЬ2+ |
S2- |
Выпадение |
|
Аg+ |
Cl— |
Выпадение Аg+ +Cl— |
|
Fe2+ |
гексациано-феррат |
Выпадение К++ |
|
Fe3+ |
1) K4[Fe(CN)6] 2) |
Выпадение К+ + Fe3+ Появление |
|
Al3+ |
щелочь |
Выпадение |
|
NH4+ |
щелочь, |
Запах |
|
Н+ (кислая |
Индикаторы: |
красное красное окрашивание |
Качественные
реакции на катионы основаны на протекании химической реакции и на изменении
цвета пламени, то есть на физическом процессе.
Определить наличие
в растворе таких ионов как Li+, Na+, К+, Са2+,
Sr2+ с помощью химического взаимодействия невозможно, так
как эти ионы не могут быть связаны в растворе с образованием нерастворимого
вещества. Ионы, которые можно связать в растворе с образоваием осадка можно
обнаружит с помощью химических реакций, так например ионы серебра дают белый
осадок хлорида серебра с ионоами хлора: Аg+ +Cl—=AgCl.
Некоторые ионы
можно определить двумя способами и по химическому взаимодействию, и по цвету
пламени. Например, ионы Ba2+ окрашивают пламя в желто-зеленый цвет,
но также ионы Ba2+ вступают в реакцию с анионами SO42-
с образованием сульфата бария: SO42- + Ba2+ =
BaSO4.
Таким образом
определить наличие в растворе катионов можно как с помощью химических реакций,
так по окраски пламени.
Качественные реакции на анионы
Это реакции, с
помощью которых можно определить наличие того или иного аниона в растворе.
Основные качественные реакции на анионы представлены в таблице 2.
Таблица 2.
Качественные
реакции на катионы.
|
Анион |
Реактив |
Наблюдаемая реакция |
|
S042- |
Ва2+ |
Выпадение Ва2+ |
|
N03— |
1) |
Образование Возникновение |
|
РО43- |
ионы Ag+ |
Выпадение |
|
СrO42- |
ионы Ва2+ |
Выпадоние |
|
S2- |
ионы РЬ2+ |
Выпадение |
|
СО32- |
ионы Са2+ |
выпадение |
|
CO2 |
известковая |
Са(ОН)2 |
|
SO32- |
ионы Н+ |
Появление |
|
F— |
ионы Са2+ |
Выпадение-белого |
|
Cl— |
ионы Аg+ |
Выпадение |
|
Br— |
ионы Аg+ |
Выпадение |
|
I— |
ионы Аg+ |
Выпадение |
|
ОН— |
индикаторы: фенолфталеин |
синее |
Качественные
реакции на анионы основаны на химическом взаимодействии, то есть определить
наличие того или иного иона можно, только проведя химическую реакцию. Например,
что бы определить наличие в растворе ионов хлора, необходимо провести
химическое взаимодействие изучаемого объекта с растворимой солью серебра, тогда
сущность реакции будет отражаться следующим ионным уравнением:
Аg+ +CI—=
AgCl
В своей работе я
буду использовать качественные реакции для изучения воды различного
происхождения.
Таким
образом,
проведя качественные реакции можно подтвердить однозначно их наличие
определенных ионов в растворе.
Б)
Использование качественных реакций.
Данный этап урока
посвящен тому, где можно использовать качественные реакции. Ученик, выполнявший
исследовательскую работу рассказывает о практической части своей работы, где
проводилось исследование различных образцов воды.
Экспериментальная
часть работы состояла из двух опытов по изучению качественного состава образцов
водопроводной и природной воды.
Цель:
исследование состава воды (водопроводного и природного происхождения) с помощью
качественных реакций (на ионы H+, OH—, Cl—, SO42-).
а) Первый опыт:
Характеристика
изучаемых образцов воды:
Водопроводная вода(село);
Водопроводная вода
(территория школы);
Растаявший снег
(около школы);
Фильтрованная,
водопроводная вода из территории школы(фильтр «Аквафор»).
Опыт проводился следующим
образом: каждый образец воды был разделен на четыре части. К каждой части
соответственно добавлялся соответствующий реактив, полученные наблюдения
представлены в таблице, а ход опыта на рисунке. В случае определения проведения
качественных реакций на кислоту и щелочь, по мимо изучаемых образцов
использовались контрольные образцы, содержащие соответственно соляную кислоту и
гидроксид калия. Это необходимо, для того чтобы лучше увидеть изменение цвета
индикатора.
|
Реактив |
№ образца |
|||
|
1 |
2 |
3 |
4 |
|
|
Метилоранж |
Цвет не |
Цвет не |
Цвет не |
Цвет не |
|
Фенолфталеин |
Раствор |
Раствор |
Раствор |
Раствор |
|
Нитрат |
Появился |
Раствор |
Цвет не |
Цвет не |
|
Хлорид |
Изменений |
Изменений |
Изменений |
Изменений |
В
первом опыте исследовались четыре образца воды (водопроводная вода и Красного
Села; водопроводная вода с территории гимназии; растаявший снег,
собранный около гимназии; фильтрованная вода), наблюдения представлены в
таблице, откуда видно, что в исследуемых образцах нет кислоты, щелочей и
сульфат ионов. Опыт показал, что в водопроводной воде из Красного Села
содержится значительное количество хлорид ионов, а в водопроводной воде с
территории гимназии содержание хлорид ионов не значителен. Вода, полученная при
таянии снега, и фильтрованная вода не содержат хлорид ионов в обнаруживаемых
количествах.
б) Второй опыт:
Характеристика
изучаемых образцов воды:
- Образец
воды с магистрали - Снег
из малопосещаемого места - Снег
из дворовой территории - Дистиллированная
вода
Данный опыт
проводился аналогично первому опыту, ход опыта представлен на рисунке 2, а
результаты наблюдений в таблице.
|
Реактив |
№ образца |
|||
|
1 |
2 |
3 |
4 |
|
|
Метилоранж |
Цвет не |
Цвет не |
Цвет не |
Цвет не |
|
Фенолфталеин |
Раствор |
Раствор |
Раствор |
Раствор |
|
Нитрат |
Появился |
Цвет не |
Цвет не |
Цвет не |
|
Хлорид |
Появился |
Изменений |
Изменений |
Изменений |
Во
втором опыте исследовались четыре образца воды (снег с магистрали, снег с
малопосещаемого места, снег из дворовой территории и дистиллированная вода).
Наблюдения представлены в таблице, откуда видно, что в исследуемых образцах нет
кислоты и щелочи. Опыт показал, что снег с магистрали содержит значительное
количество хлорид ионов и небольшое количество сульфат ионов. Другие образцы не
содержат в обнаруживаемых количествах ни сульфат, ни хлорид ионов.
Если предположить,
что изучаемые образцы воды могут содержать хлорид ионы в виде хлорид магния, а
сульфат-ионы в составе сульфата натрия, то можно записать следующие уравнения
реакций:
Качественная
реакция на хлорид-ионы:
2AgNO3
+ MgCl2 = 2AgCl + Mg(NO3)2
2Ag+ + 2NO3- +
Mg2+ + 2Cl- = 2AgCl + Mg2+ + 2NO3-
2Ag+ + 2Cl-= 2AgCl
Ag+ + Cl-= AgCl
Качественные
реакции на сульфат-ионы:
BaCl2 +
Na2SO4 = BaSO4 + 2NaCl
Ba2+ +
2Cl— + 2Na+ + SO42- = BaSO4
+ 2Na+ + 2Cl—
Ba2+ +
SO42- = BaSO4
Таким
образом,
используя образцы природной и водопроводной воды, с помощью качественных
реакций, я определила содержание ионов хлорида и бария, кислотность воды.
Опыты показали,
что водопроводная вода из Красного Села определяемые с помощью качественной
реакции, количества хлорид ионов, а водопроводная вода из гимназии — нет.
3.
Закрепление знаний учебного материала (10 мин).
На данном этапе
учащимся предлагается выполнить практическое задание по проведению качественных
реакций.
Задание:
С помощью
качественных реакций доказать, что выданные вам вещества — растворы серной
кислоты (пробирка №1), гидроксида калия (пробирка №2) и хлорида бария (пробирка
№3). Записать наблюдения и уравнения соответствующих реакций. Учащиеся
выполняют задания в парах и заполняют таблицу:
|
ФИО |
|||
|
Уравнение |
|||
|
Качественная |
Необходимый |
Наблюдения |
Уравнение |
|
Качественная |
Необходимый |
Наблюдения |
Уравнение |
|
Вывод |
Домашнее задание
обычно отсутствует.
4.
Завершение урока (1-2 мин).
Учитель благодарит
учащихся за урок, оценивает деятельность учащихся в целом и отдельных учащихся
индивидуально. Собирает таблицы с выполненным заданием.
План урока:
Основные понятия
Распознавание катионов щелочных металлов
Распознавание ионов щелочноземельных металлов
Качественные реакции на анионы
Основные понятия
Качественная реакция – это реакция, обладающая определенными признаками для того или иного соединения. К таким процессам предъявляется ряд требований: низкий порог чувствительности, специфичность, селективность.
Определять можно ионы. Это заряженные частицы. Если ион заряжен положительно – это катион, если отрицательно – анион. Ионы могут быть простыми и сложными, но у каждого есть специфическая качественная реакция.
Индикаторы
Индикаторы – вещества, которые дают специфический продукт реакции (осадок, газ, соль определенного цвета) с тем или иным ионом.
Определять можно не только конкретное соединение, но и класс, к которому оно относится. Одним из первых индикаторов являются индикаторы среды: фенолфталеин, метилоранж и лакмус. Молекулы этих веществ меняют свою конфигурацию в зависимости от кислотности раствора, на чем основана их индикаторная значимость.
В лабораториях и на производстве часто используют не сам раствор, а бумажку, пропитанную им – индикаторную бумагу. Существует несколько типов таких бумаг:
- Универсальная;
- Фенолфталеиновая;
- Лакмусовая;
- Свинцовая и т.д.
Для каждого вида индикаторных бумажек есть шкала цвета, по которому можно определить значение того или иного результата.
Распознавание катионов щелочных металлов
Для некоторых ионов есть несколько способов их идентификации. Например, ионы щелочных металлов определяются сухим способом – окрашиванием пламени и реакциями в растворах.
Каждый ион щелочного металла окрашивает пламя в определенный цвет:
- натрий – ярко-желтый,
- калий – розово-фиолетовый,
- литий – карминово-красный,
- рубидий – темно-фиолетовый.
Для определения наличия катиона щелочного металла можно провести качественную реакцию. Для каждого катиона используется определенный реактив.
Таблица. Характеристика качественных реакций на ионы щелочных металлов.
Распознавание ионов щелочноземельных металлов
Щелочно-земельные металлы расположены во второй группе таблицы Менделеева. Они, так же, активны, но меньше щелочных. Их распространенность в природе намного выше. К этим металлам относятся: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra).
Раньше первые два металла не относили к группе щелочно-земельных. Последние научные исследования подтвердили их принадлежность к этому ряду.
Эти металлы можно определять окрашиванием пламени, но различить правильный оттенок у некоторых из них довольно трудно:
- Be – красный;
- Mg – ярко-белый (сильное выделение тепла);
- Ca – оранжево-красный;
- Sr – карминово-красный;
- Ba – желтовато-зеленый;
- Ra – темно-красный.
Определение катионов бериллия
Бериллий имеет специфическое строение атома. Его электронная конфигурация больше свойственная инертным газам. Обычных химических реакций для определения этого катиона нет. Бериллий определяют электрометрическим титрованием. При этом, производится титрование (по каплям) бериллия фторидом аммония в кислой среде. Бериллий образует аквафторокомплексы [BeF4]2—, удерживая до четырех молекул воды.
Еще одним инновационным способом определения бериллия является нефелометрический метод с применением гидроксида аммиака. При этом получают мутные спеси с дальнейшим определением оптической плотности.
Описанные методы основаны не на химической реакции, а на процессе образования комплексных соединений.
Определение катионов магния
Для определения магния используют сильные щелочи, карбонат аммония или гидрофосфат натрия в присутствии солей аммония.
В первых двух случаях выпадает белый аморфный осадок. Его кристаллы настолько малы, что практически не оседаю на дно, оставаясь взвешенными в водном растворе.
Mg2+ + 2OH— → Mg(OH)2↓
2Mg2+ + 4NН4+ + 2CO32- + Н2O → Mg2+(OH)2CO3↓ + 4NН4+ + CO2
Во втором случае образуется, так же, белый осадок, но крупнокристаллический:
Mg2+ + NН4OH + НРО42- → MgNН4РО4↓ + Н2O
Определение катионов кальция
Для определения кальция чаще всего используют угольную или сернистую кислоту. Образующиеся соли белого цвета и не растворимы в вод. При этом, они хорошо растворимы в других кислотах:
CaCl2 + (NH4)2CO3 → CaCO3 ↓+ 2NH4Cl
Еще один способ – микрокристаллоскопическая реакция с серной кислотой. Образуются белые кристаллы игольчатой формы.
4Ca + 5H2SO4 → 4CaSO4↓ + 4H2O + H2S
Определение ионов стронция
Стронций образует белые нерастворимые осадки с серной кислотой, карбонатом аммония:
Sr + H2SO4 = SrSO4↓+ H2
Sr(NO3)2 + (NH4)2CO3 = SrCO3↓ + NH4NO3
Также, для индикации используют оксалат аммония. Образующийся белый осадок растворяется во всех кислотах:
Sr+ + C2O4— = Sr(C2O4) ↓
Одной из самых ярких реакций на ион стронция является реакция с родизонатом натрия. При этом образуется красно-бурый осадок:
Определение катионов бария
В растворе ионы бария определяют с помощью серной кислоты или ее растворимых солей.
Ba(NO3)2 + Na2SO4 = BaSO4↓ + 2NaNO3
При реакции образуется белый нерастворимый в кислотах осадок. Это микрокристаллоскопическая реакция, можно рассмотреть форму кристаллов под микроскопом.
Определение ионов меди
Для обнаружения ионов меди в растворе соли в него добавляют концентрат аммиачного раствора.
Cu2+ + 4NН3 → [Cu(NH3)4]2+
При этом, медь образует комплексную соль ярко-синего цвета.
еще один способ — реакция с гидроксидом натрия. В результате реакции образуется синий студенистый осадок.
Cu2+ + 2OH— = Cu(OH)2 ↓
При его нагревании происходит разложение с образованием черного оксида меди.
Cu(OH)2 → CuO + H2O
Медь можно определить сухим способов в пламени горелки. Она приведет к окрашиванию пламени в зеленый цвет.
Определение ионов двух- и трехвалентного железа
Железо имеет два основных иона: Fe2+ и Fe3+.
Ионы Fe3+ можно идентифицировать с помощью трех реактивов. Первый из них – щелочь. При этом образуется красно-бурый нерастворимый осадок:
FeCl₃ + 3NaOH = Fe(OH)₃↓+ 3NaCl.
Другой вариант – желтая кровяная соль K₃[Fe(CN)₆], при взаимодействии с которой трехвалентное железо образует комплексное соединение синего цвета.
Третий вариант – роданид калия (ядовитое вещество). При реакции образуется красная густая соль. Это соединение часто использовали в кинематографе в качестве искусственной крови.
Для определения Fe2+используют красную кровяную соль K₄[Fe(CN)₆]. В результате образуется соединение синего цвета (берлинская лазурь).
Определение катионов аммония
Катион аммония необычен тем, что состоят из молекулы аммиака с присоединенным за счет донорно-акцепторной связи водородом. Так, ион имеет вид NH4+. Соли аммония применяются в сельском хозяйстве, медицине.
Определить наличие этого катиона можно с помощью индикаторной бумаги. Над раствором соли аммония она синеет.
Значения цветов индикаторной бумаги
Гидроксид аммония – слабое соединение, которое распадается на аммиак и воду. Аммиак обладает характерным запахом (нашатырный спирт), по которому, так же, определяют наличие катиона аммония.
Качественная реакция на катион аммония: NH4Cl + NaOH → NaCl + NH3↑ + H2O
Другой способ индикации – с помощью реактива Несслера– K2[HgI4]. При взаимодействии с солями аммония образуется бурый цвет:
NH3 + 2[HgI4]2- + 3ОН— → [NH2Hg2O]I + 7I— + 2Н2О
Реакция очень чувствительная. При малом содержании катионов аммония, цвет будет желтый.
Качественные реакции на анионы
Сульфат-ион и сульфит-ион
Ионы серной и сернистой кислот дают одинаковую реакцию с растворимыми солями бария – образуется белый осадок:
BaCl2 + Na2SO3 = BaSO3↓ + 2NaCl
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Различить их можно добавлением к полученному раствору азотной кислоты. Осадок сульфита бария растворится с образованием газа, а сульфата – нет.
BaSO3+ 2HNO3 = Ba(NO3)2 +SO2 ↑ +H2O
Хлорид-, бромид-, йодид-ион
Для определения этих ионов используют один реактив – нитрат серебра. Во всех трех случаях выпадает творожистый осадок, но цвет у каждого – свой. Фторид-ион осадок с этим реактивом не дает.
Для индикации фторида используют нитрат кальция. При этом образуется белый осадок:
2NaF + Ca(NO3)2 → 2NaNO3 + CaF2↓
Карбонат-ион
Карбонат-ион определяется в две стадии. Первая – получение угольной кислоты:
CaCO3 + 2HCl⟶CaCl2 + H2O + CO2↑
Эта кислота слабая и быстро диссоциирует с образованием воды и углекислого газа.
Вторая реакция – пропускание выделяемого газа через известковую воду. Углекислый газ приводит к ее помутнению из-за образования нерастворимого карбоната кальция:
Ca(OH)2 + CO2 ⟶CaCO3↓ + H2O
Фосфат-ион
Фосфат-ион определяется с помощью нитрата серебра. При взаимодействии образуется ярко-желтый осадок:
Na3PO4 + 3AgNO3= Ag3PO4↓ +3NaNO3














