3) Анализ катионов IV аналитической группы.
В IV группе находятся
катионы Cr3+, Al3+,
Zn2+, As3+,
As5+, Sn2+,
Sn4+. Катионы IV
группы осаждаются из растворов гидроксидом
натрия, осадки растворяются в избытке
реактива. NaOH – групповой
реагент на катионы IV
группы. При действии NaOH
образуются осадки гидроксидов катионов
IV группы (кроме мышьяка):
зеленый Cr(OH)3,
белые Al(OH)3,
Zn(OH)2,
Sn(OH)2,
H2[Sn(OH)6].
Осадки гидроксидов проявляют амфотерные
свойства и растворяются в избытке NaOH,
образую соли соответствующих кислот:
NaAlO2, NaCrO2,
Na2ZnO2,
Na2SnO2,
Na2[Sn(OH)6],
с кислотами они образуют соли катионов
(схема 4).
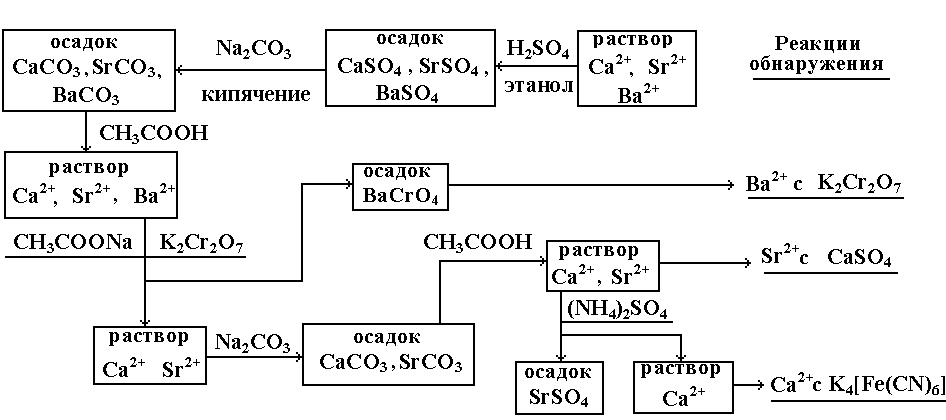
4. Схема анализа катионов IV группы.
Систематический анализ катионов IV
группы проводят следующим образом:
В растворе дробными реакциями обнаруживают
мышьяк, хром и олово, затем пероксидом
водорода в щелочной среде переводят
все катионы в высшую степень окисления
(As3+ → As5+,
Cr3+ → Cr6+,
Sn2+ → Sn4+).
Добавлением NH4Cl
до слабощелочной среды осаждают Al(OH)3
и Sn(OH)4,
осадок растворяют в HCl и
анализируют. Фильтрат после отделения
Al3+ и Sn4+
анализируют на присутствие мышьяка,
хрома, цинка
4) Анализ катионов V аналитической группы.
В V группу входят Fe3+,
Fe2+, Mn2+,
Bi3+, Sb3+,
Sb5+, Mg2+.
Групповым реактивом на катионы V
группы являются растворы щелочей,
которые осаждают гидроксиды: зеленый
Fe(OH)2,
темно-бурый Fe(OH)3,
белые Mn(OH)2,
Bi(OH)3,
Sb(OH)3,
SbO(OH)3,
Mg(OH)2.
Осадки гидроксида желена (II)
и марганца (II) на воздухе
быстро буреют вследствие окисления
кислородом воздуха до Fe(OH)3
и MnO(OH)2.
Осадок Bi(OH)3
при нагревании желтеет, образуя гидроксид
оксовисмута BiOOH. Гидроксид
сурьмы (V) превращается в
тригидроксид оксосурьмы (V)
SbO(OH)3.
(схема 5)
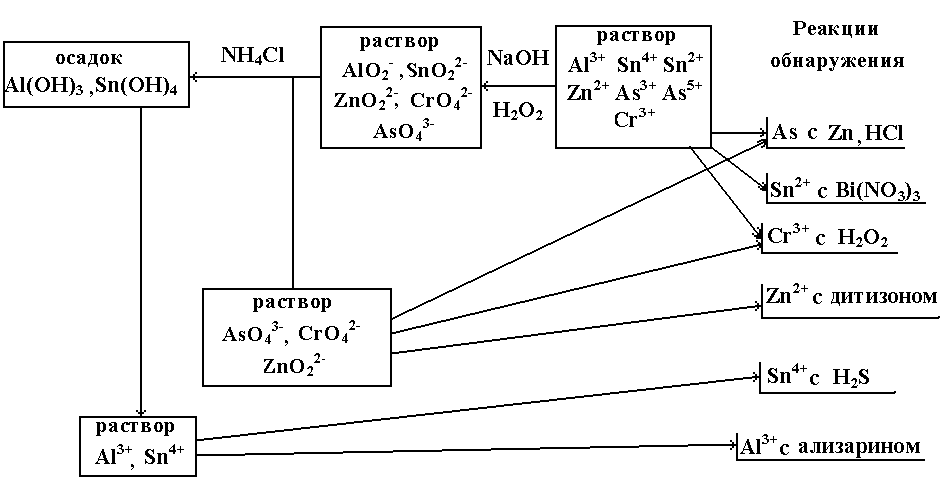
5. Схема анализа катионов V группы.
Растворимость осадков гидроксидов
различна для разных катионов V
группы. В воде и щелочах они нерастворимы,
за исключением свежеосажденного Sb(OH)3,
который переходит в растворимый
K[Sb(OH)4].
В солях аммония несколько растворим
Fe(OH)2.
Mn(OH)2
растворим в солях аммония вследствие
способности NH4+
связывать OH─ в
малодиссоциированное соединение
NH3∙H2O.
Все гидроксиды катионов V
группы растворимы в сильных кислотах,
образуя соответствующие соли.
Анализ смеси солее катионов V
группы проводят, предварительно
обнаруживая в отдельных пробах раствора
Fe2+ и Fe3+.
Разводя раствор водой, осаждают основные
соли сурьмы и висмута, которые затем
разделяют, используя растворимость
солей сурьмы в винной кислоте. Из
оставшегося после отделения сурьмы и
висмута фильтрата добавлением NaOH
и H2O2
осаждают Mg(OH)2,
MnO(OH)2
и Fe(OH)3,
которые затем разделяют, растворяя
Mg(OH)2
в NH4Cl,
а Fe(OH)3
– в HCl.
5) Анализ катионов VI аналитической группы.
В VI аналитическую группу
включены катионы Cu2+,
Cd2+, Hg2+,
Ni2+, Co2+.
Групповой реагент на эти катионы —
раствор аммиака. При воздействии
эквивалентных количеств NH3
образуются осадки различного состава:
синий (CuOH)2SO4,
белые Cd(OH)2
и [Hg(NH2)]Cl,
зеленый NiOHCl, синий CoOHCl.
В избытке гидроксида аммония осадки
растворяются с образованием комплексный
солей: синей [Cu(NH3)4]SO4,
бесцветных [Cd(NH3)4]Cl2
и [Hg(NH3)4]Cl,
сине-красной [Ni(NH3)6]Cl2,
желтой [Co(NH3)6]Cl2.
Желтый [Co(NH3)6]Cl2
под действием кислорода воздуха
постепенно переходит в вишнево-красный
[Co(NH3)5Cl]Cl2.
Эта реакция проходит мгновенно в
присутствии H2O2.
В присутствии NaOH катионы
VI группы осаждаются в
виде гидроксидов, за исключением ртути
(II) (Hg –
желтого цвета) и кобальта (II)
(основная соль CoOHCl). В
избытке NaOH гидроксиды не
растворяются.
Анализ смеси катионов VI
группы можно провести дробным путем.
Систематический анализ проводят, осаждая
при нагревании с раствором аммиака
CoOHCl и HgNH2Cl,
основную соль кобальта растворяют в
H2SO4.
Фильтрат после осаждения Co2+
и Hg2+ обрабатывают
Na2S2O3
(осадок Cu2S)
и анализируют в присутствии Ni2+
и Cd2+. (схема 6).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Анализ катионов
При систематическом анализе принято деление катионов и анионов на аналитические группы. Наиболее удобная, применяемая и в настоящее время классификация катионов, разработана Н.А. Меншуткиным в 1871 г. Все существующие ныне классификации предусматривают разделение катионов на 5 или 6 аналитических групп на основании следующих их свойств:
1.На различии растворимости хлоридов, карбонатов, сульфатов или гидроксидов.
2. На амфотерных свойствах некоторых гидроксидов.
3. На способности ряда гидроксидов образовывать комплексные аммиакаты.
Классификация катионов на аналитические группы
| № | Катионы | Групповая
характеристика |
Групповой
реактив |
Получаемые
соединения |
| 1 | К+, Na+, NH4+,Mg2+ | Соли и гидроксиды растворимы в воде | ||
| 2 | Ca2+, Ba2+, Sr2+ | Карбонаты не растворимы в воде, но растворимы в кислотах. Сульфаты не растворимы в воде и в кислотах. | (NН4)2СО3 2н.
раствор |
СаСO3↓, ВаСОз↓, SrO3↓
Аморфные осадки белого цвета. |
| 3 | Al3+, Fe2+,Fe3+, Mn2+, Zn2+, Cr2+. | Сульфиды не растворимы в воде, но растворимы в кислотах. Гидроксиды не -растворимы в воде, но могут растворятся в кислотах | (NH4)2S 6н.
раствор |
FeS↓, Fе2S3↓- черные, MnS↓-розоватый, ZnS↓- белый, Аl(ОН)3↓- белый, Сr(ОН)3↓-серо-зеленый. |
| 4 | Ag+, Pb2+, Hg22+ | Хлориды не растворимы в воде. | НСl 2н. раствор | AgCl↓, PbC12↓, Hg2C12↓- осадки белого цвета. |
| 5 | Сu2+, Co2+, Ni2+,Cd2+, Bi3+ | Гидроксиды и основные соли не растворимы в воде, но растворимы в избытке аммиака. | NH4ОH 2н. раствор в избытке | Раствор Сu(NН3)42+— синий, Со(NН3)42+— грязно-желтый, Ni(NН3)42+ — синий, Сd(NН3)42+ — бесцветный, Вi(0Н)2Сl↓ — белый. |
| 6 | Sn2+, Sn4+, Sb3+,
Sb5+, (Аs3+, As5+) |
Гидроксиды амфотерны. Сульфиды нерастворимы в воде, но растворимы в cульфидах Na, К и аммония. | NaOH, КОН, NH40H, 3н. растворы | H4Sn04↓, Sn(ОН)2↓, НSb02↓, НSbО3↓- белые осадки, растворимые в избытке щелочей. |
Первая аналитическая группа катионов: К+, Na+, NН4+, Mg2+
Почти все соли калия, натрия, аммония и большинство солей магния хорошо растворимы в воде. Поэтому группового реактива, осаждающего все четыре катиона, нет.
Калий и натрий относятся к 1 группе периодической системы элементов и образуют сильные щелочи. Гидроксид аммония является слабым основанием, но катион аммония близок по свойствам к катиону калия и образует несколько аналогичных малорастворимых солей. Соли аммония разлагаются при нагревании и могут быть удалены прокаливанием. Гидроксид магния — слабое основание, плохо растворимое в воде. Труднорастворимы также фосфат магния и карбонат. Гидроксокарбонат магния растворяется в избытке солей аммония и при действии карбонатом аммония в присутствии хлорида аммония в осадок не выпадает. Поэтому при систематическом анализе ион магния остается в растворе с катионами 1 группы. По этой причине он и отнесен к этой группе.
При систематическом анализе катионы калия, натрия и магния обнаруживают в последнюю очередь, так как катионы других групп мешают их обнаружению и должны быть удалены. В водных растворах катионы 1 группы бесцветны, образуемые ими соли имеют окраску только в тех случаях, когда в их состав входят окрашенные анионы, например: перманганат, хромат или дихромат -ионы.
Катионы 1 аналитической группы содержатся в почвах как в подвижном, доступном для усвоения растениями состоянии, так и в связанном. Они вносятся в почву в виде минеральных удобрений. Калий в виде -калийной селитры, сульфата, хлорида и других солей. Натрий — составная часть чилийской селитры (NаNО3). Магний входит в состав доломита СаСОЗ•МgСО3 . Ион аммония содержится в аммонийной селитре, сульфате и хлориде аммония, в аммофосе NH4H2PО4 и диаммофосе (NН4)2HPО4.
Ионы калия, магния, аммония необходимы для минерального питания растений. Большое содержание солей натрия указывает на засоленность почв.
Анализ водных вытяжек из почвы на наличие этих катионов используют для определения пригодности почв для возделывания различных культур.
Оценка качества природных вод включает пробы на присутствие ионов аммония. Наличие в воде аммиака и солей аммония служит признаком загрязненности, так как эти соединения образуются при гниении белков.
Продукты детского и диетического питания также подвергаются обязательному исследованию на содержание натрия, калия и магния.
Вторая аналитическая группа катионов: Ca2+, Ba2+, Sr2+
Катионы 2 группы, в отличии от катионов 1 группы, образуют малорастворимые в воде карбонаты. Поэтому их осаждают действием карбоната аммония, который является групповым реактивом.
Осадки карбонатов кальция, бария и стронция могут быть получены и при действии на раствор карбонатами натрия и калия. Но при систематическом анализе пользоваться этими реактивами невозможно, так как вместе с ними в исследуемый раствор вводятся ионы Na+ и К+. Использование карбоната аммония оправдано тем, что ион NH4+ можно предварительно открыть дробным методом.
Из солей кальция, бария и стронция также не растворимы сульфаты, фосфаты и оксалаты. Однако осаждение серной кислотой проводится редко, так как сульфаты не растворимы в сильных кислотах и щелочах и с большим трудом снова переводятся в раствор. Осаждение фосфорной и щавелевой кислотой не проводят по той причине, что присутствие в растворе фосфат — и оксалат -ионов усложняет анализ.
Сульфиды этих элементов, в отличие от катионов 3,4 и 5 групп, хорошо растворимы в воде.
В водных растворах катионы 2 группы бесцветны.
Соли кальция используют для улучшения почв: в сильно кислые почвы для нейтрализации вводят известняк СаСО3; а в солонцеватые — гипс CaS04•2H2O. Кальций входит в состав минеральных удобрений: фосфоритной муки Са3(РО4)2, суперфосфата Са(Н2РО4)2 + CaS04, кальциевой селитры Са(НСО3)2 и т.д.
Растворимый гидрокарбонат кальция Са(НСО3)2 находится в природных водах, сообщая им временную жесткость. Арсенит и арсенат кальция используют как сельскохозяйственные яды.
Ионы бария ядовиты. Карбонат и хлорид бария используют в сельском хозяйстве как яды. Поэтому обнаружение ионов бария проводят при распознавании ядохимикатов.
Радиоактивный изотоп стронция 90Sr, образующийся при ядерных реакциях, представляет большую опасность для здоровья и жизни.
Реакции катионов второй группы
| Реактивы | Катионы | ||
| Са2+ | Ba2+ | Sr2+ | |
| (NH4 )2СО3, Nа2СО3, К2СО3 | СаСО3↓ белый | ВаСО3↓ белый | SrСО3↓ белый |
| Na2HP04 | СаНРО4↓ белый | ВаНРО4↓ белый | SrHP04↓ белый |
| (NH4)2C204 | СаС2Н4↓ белый | ВаС2О4↓ белый | SrC204↓ белый |
| H2S04 и растворимые сульфаты | CaS04↓ белый | BaS04↓ белый | SrS04↓ белый |
| К4[Fe(CN)6]+NH4Cl | Ca(NH4)2 [Fe(CN)6] ↓
белый |
Ba(NH4)2•Fe(CN)6]↓, белый | ──── |
| CaS04 | BaS04↓ выпадает сразу | SrS04↓
выпадает не сразу |
|
| К2Сr207 | ВаСrО4↓ желтый | ───── | |
| Окрашивание
пламени |
Кирпично- красное | Желто-зеленое | Карминово-красное |
Катионы третьей аналитической группы: Al3+, Fe2+, Fe3+, Mn2+, Zn2+, Cr2+
К третьей аналитической группе относят катионы алюминия, железа(II), железа(III), марганца (II), цинка, хрома(III). Они характеризуются большим разнообразием свойств.
Алюминий и цинк проявляют постоянную валентность. Гидроксиды этих элементов и хрома обладают амфотерными свойствами; это свойство используется для отделения алюминия, хрома и цинка от других катионов третьей аналитической группы. Алюминий образует ионы АI3+ и АlО2-, цинк — ионы Zn2+ и ZnO22-, хром ионы Сr3+ и СrО2—.
Железо, марганец и хром проявляют переменную валентность. Железо образует ионы Fe2+, Fe3+, FeO42-, марганец — ионы Mn2+, Mn3+, Mn4+, MnО42- и MnO4—, хром ионы Cr3+, CrO42-, Cr2072-.
Изменение валентности этих элементов осуществляется сравнительно легко, поэтому для них характерны окислительно-восстановительные реакции.
Гидроксиды железа и марганца обладают слабоосновными свойствами, растворяются в кислотах, но не растворяются в щелочах. Гидроксиды всех катионов третьей группы не растворимы в воде, но могут переходить в коллоидное состояние.
Соли большинства элементов этой группы образуют окрашенные растворы.
Окраска растворов солей элементов третьей аналитической группы
| Ион | А13+, Zn2+ | Cr3+ | СrО42- | Сr2О72- | Fe3+ | Fe2+ | Mn2+ | MnO4— | МnО42- |
| Окраска раствора | Бесцвет-ная | Зеленая или фио-летовая | Желтая | Оранже-вая | Красно-
бурая |
Бледно-
зеленая |
Бледно-розовая | Малиново-
фиолетовая |
Зеленая |
Катионы третьей аналитической группы образуют сульфиды, нерастворимые в воде, но растворимые в кислотах. В отличие от них сульфиды первой и второй группы растворимы в воде, а сульфиды четвертой и пятой группы катионов нерастворимы в кислотах. Поэтому в качестве группового реактива используют сульфид аммония. Другие растворимые сульфиды, так же осаждающие катионы третьей группы, не могут быть использованы как групповой реактив, так как с ними в раствор будут введены катионы первой и второй групп. Присутствие катиона аммония в ходе систематического анализа определяется до введения сульфида аммония, а в дальнейшем катион аммония легко удаляется из раствора в виде аммиака. Катионы третьей группы в зависимости от воздействия на них гидр оксида аммония в присутствии хлорида аммония подразделяют на две подгруппы:
1 подгруппа:
катионы аллюминия, хрома(III), железа (III), осаждаемые водным аммиаком в присутствии хлорида аммония.
2 подгруппа:
катионы железа(II), марганца(II), цинка не осаждаемые таким образом.
Катионы третьей группы, подобно катионам второй группы и магния, образуют труднорастворимые карбонаты и гидрофосфаты. Кроме того, они обладают способностью образовывать комплексные соединения.
Обнаружение и количественное определение катионов третьей группы связано главным образом с анализом почв, микроудобрений, растительного и животного материала, продовольственного сырья и продуктов питания (особенно детских и диетических), так как эти катионы имеют важнейшее биологическое значение.
Алюминий в больших количествах содержится в кислых подзолистых почвах, снижая урожайность многих культур. Соли алюминия применяют для очистки природных вод.
Железо содержится в тканях всех растений и животных. Оно входит в состав гемоглобина крови животных, участвует в синтезе хлорофилла зеленых растений. При недостатке железа в почве у растений развивается хлороз, т.е. отсутствие зеленой окраски из-за пониженного содержания хлорофилла. Избыток железа в почве так же вреден для растений. Многие соли железа (лактат, сульфат, глицерофосфат) применяют в ветеринарии как антианемические средства.
Марганец, цинк, хром — микроэлементы, необходимые для нормального течения обменных процессов у растений и животных. Недостаток марганца в почве способствует развитию у них различных заболеваний; в крови — приводит к возникновению „марганцевого рахита”. Нехватка цинка ведет к нарушению синтеза хлорофилла, витаминов, ауксинов у растений, витаминов и ферментов у животных и человека.
Избыток цинка в почвах, продуктах питания, сырье является токсичным для человека, животных и растений. Согласно гигиеническим нормативам качества и безопасности продовольственных продуктов и сырья предельно допускаемое содержание цинка: в мясе- 70,0 мг/кг., в молоке — 5,0 мг/кг., в яйце-50,0 мг/кг.
Реакции катионов третьей группы
| Реактивы | Катионы | |||||
| A13+ | Cr3+ | Fe3+ | Fe2+ | Mn2+ | Zn2+ | |
| (NH4)2S в щелочной среде | Аl(ОН)3 | Сr(ОН)3↓ | ↓Fе2S3 | ↓FeS | ↓MnS | ↓ZnS |
| NaOH, КОН, NН4ОH | АI(ОН)3 | Сr(ОН)3↓ | ↓Fе(ОН)3 | ↓Fе(ОН)2 | ↓Мn(OН)2 | ↓Zn(ОН)2 |
| NaOH, КОН | Р-р А102— | Р-р Cr02— | ↓Fе(ОН)3 | ↓Fе(ОН)2 | ↓Мn(ОН)2 | р-р ZnО22- |
| NH4Cl в щел. среде | ↓Аl(ОН)3 | ↓Сr(ОН)3 | ↓Fе(ОН)3 | |||
| Na2HP04 | ↓AlP04 | ↓CrPО4 | ↓FePО4 | ↓Fе3(РО4) | ↓Мn3(РО4) | ↓Zn3(РО4) |
| K4[Fe(CN)6] | ↓Fe4[Fe(CN)6]3 | ↓Fe2[Fe(CN)6] | ↓Мn2[Fе(CN)6] | ↓К2Zn3[Fе(CN)6]2 | ||
| К3[Fе(СN)6] | ↓Fe3[Fe(CN)6] | ↓Мn3[Fе(CN)6]2 | Zn3[Fе(CN)6]2 | |||
| KCNS | Fе(СNS)3 | |||||
| Алюминон | Красный | Красный | Красный | |||
| (NH4)2S208 | Cr2072- р-р | МnО4— р-р | ||||
| Дитизон | Красный | |||||
| Cо(NО3)2 | CoZn02 | |||||
| Н2О2 в щелочной среде | Cr204 р-р | Fе(ОН)3 |
Катионы четвертой аналитической группы: Ag+, Pb2+,Hg22+
Четвертая аналитическая группа объединяет катионы серебра, свинца, и ртути(I). Общим свойством этих катионов является способность осаждаться под действием разбавленной соляной кислоты и ее солей в виде хлоридов-осадков белого цвета. Поэтому соляная кислота является групповым реактивом для катионов этой группы.
Кроме того, катионы четвертой аналитической группы образуют нерастворимые сульфиды черного цвета, которые в отличие от катионов 5 группы, не растворяются в сульфидах натрия, калия, аммония. Мало растворимы в воде также фосфаты и карбонаты катионов четвертой группы. Растворимые соли подвергаются гидролизу и их растворы имеют кислую реакцию. В окислительно-восстановительных реакция катионы четвертой группы выступают в роли окислителей и восстанавливаются до свободных металлов. В водных растворах катионы серебра, свинца и ртути (I) бесцветны.
Соединения ртути (I) содержат группировку -Нg-Hg-, в которой одна из двух связей каждого атома ртути используется на соединения с другим. Соли ртути(I) имеют строение CI-Hg — Hg-Cl или O3N-Hg — Hg-NO3. В этих соединениях на два атома ртути приходится два положительных заряда. Ртуть в этих соединениях является электрохимически одновалентной. При диссоциации этих соединений образуется сложный ион Hg22+.
Соединения катионов четвертой группы имеют важное биологическое значение. Ионы серебра обладают бактерицидным действием. Нитрат серебра применяют в медицине и ветеринарии при эрозиях, язвах, экземах, а также в офтальмологии и стоматологии. Металлическая ртуть и большинство ее соединений очень ядовиты. Наиболее токсичны для животных и человека: хлорид (сулема) и йодид ртути (II) и органические ртутные препараты, применяемые для протравливания семян: гранозан, этилмеркурхлорид, этилмеркурфосфат. Эти соединения нарушают углеводный и кальциевый обмен, функции почек, печени, эндокринных желез, центральной нервной системы вследствие блокады сульфгидрильных групп ферментов. Хлорид ртути (I) или каломель (Hg2CI2) не ядовита и используется в медицине и ветеринарии как слабительное, антисептическое и мочегонное средство.
Соединения свинца также ядовиты. К наиболее токсичным относятся нитрат, ацетат и гидроксохлорид свинца, а так же тетраэтилсвинец. Загрязнение воздуха, почвы и воды соединениями свинца происходит в результате выброса их промышленными предприятиями, выхлопными газами автотранспорта. В соответствии с санитарными нормами содержание свинца в 1 л воды не должно превышать 0.1 мг. В основных сельскохозяйственных продуктах допускается следующее содержание свинца и ртути:
Гигиенические нормативы содержания свинца и ртути в основных продовольственных продуктах, (в мг/кг)
| Мясо | Молоко | Яйца | |
| Свинец | 0,5 | 0,1 | 0.3 |
| Ртуть | 0,03 | 0,005 | 0,02 |
Ацетат свинца и оксид свинца используются в медицине, ветеринарии как вяжущие и противовоспалительные средства в форме примочек, компрессов, мазей и пластырей.
Реакции катионов четвертой группы
| Реактивы | Катионы | |||
| Ag+ | Pb2+ | Нg22+ | ||
| HCl и хлориды | AgCl↓ — белый,
растворимый в NH4ОH |
PbC12↓- белый, растворимый в горячей воде | Hg2C12↓ — белый,
чернеющий в NH4ОH |
|
| KOH, NaOH | Аg2O↓ — бурый | Pb(OH)2↓- белый, растворимый в кислотах и избытке щелочей. | Hg2О↓- черный | |
| NH40H (избыток) | [Аg(NН3)2]+ раствор | Рb(ОН)↓-белый | (NН2Нg)NО3↓- белый + ↓Hg | |
| K2Cr04 | Аg2СrО4↓ кирпично- красный | PbCr04↓ — желтый | Hg2CrО4↓ — красный | |
| H2S04 | ───── | PbS04↓ — белый | ───── | |
| Na2HP04 | Аg3РО4↓ — желтый | ───── | ───── | |
| НI, (KI) | AgI↓- желтый | РbI2↓- желтый, растворимый в горячей воде, NaOH, избытке КI | Hg2I2↓- грязно-зеленый,
растворимый в избытке КI |
|
| Сu металлич. | ───── | ───── | Hg↓ |
Пятая аналитическая группа катионов: Cu2+, Co2+, Ni2+, Cd2+, Bi3+
Катионы пятой группы образуют нерастворимые в воде сульфиды, гидроксиды и основные соли. Гидроксид аммония, который используется как групповой реактив, образует с катионами пятой группы, ярко окрашенные основные соли, которые, кроме солей висмута, растворимы в избытке аммиака. Образующиеся при этом комплексные соли — аммиакаты, также имеют характерную окраску.
Катионы меди, кадмия и висмута, кроме того, образуют комплексные соединения с цианидами и йодидами. В реакциях окисления-восстановления катионы пятой группы ведут себя как окислители и восстанавливаются до свободных металлов.
В водных растворах почти все катионы пятой группы окрашены.
Окраска растворов солей катионов пятой аналитической группы
| Ион | Cu2+ | Co2+ | Ni2+ | Cd2+ | Bi3+ |
| Окраска
раствора |
голубая | розовая | зеленая | бесцветная | бесцветная |
Объектом качественного анализа на присутствие катионов меди, кобальта, никеля, кадмия и висмута являются удобрения, почвы, растения, биологические жидкости, сельскохозяйственное сырье, продовольственные продукты. Медь входит в состав удобрений и сельскохозяйственных ядов, например: медного купороса, парижской зелени Сu(СН3СОО)23Сu(АsО2)2, бордосской жидкости. Медь необходима для нормальной жизнедеятельности растений и животных, так как входит в состав ферментов, влияет на белковый и углеводный обмен. Сульфат и карбонат меди используют в ветеринарии как антгельминтики. Медь отнесена к токсичным элементам. Предельно допустимое содержание меди в некоторых продуктах питания приведено в таблице N29. Кобальт входит в состав витамина В12. Пониженное содержание этого микроэлемента в почвах, растениях, кормах и пищевых продуктах отрицательно сказывается на росте сельскохозяйственных культур, продуктивности животных и развитии человека. Избыточное содержание кобальта, как и меди, и кадмия считается токсичным.
Гигиенические нормативы содержания меди и кадмия в основных продовольственных продуктах, (в мг/кг)
| Мясо | Молоко | Яйца | |
| Медь | 5.0 | 1.0 | 3.0 |
| Кадмий | 0.05 | 0.03 | 0.01 |
Шестая аналитическая группа катионов: Sn2+, Sn4+, Sb3+, Sb5+, As3+, As5+
Олово, мышьяк и сурьма расположены в 4-5 группах периодической системы и обладают неметаллическими свойствами. В то же время положение этих элементов в 4-5 периодах также отражается на их свойствах и позволяет в некоторых реакциях давать соединения, характерные для металлов. В частности, сурьма, мышьяк, и олово образуют амфотерные гидроксиды. В щелочной среде эти гидроксиды диссоциируют с образованием анионов: AsO33-, АsО43-, SbO43-, SbО33-,SnО33-. В кислой среде образуются катионы : АsЗ+, As5+, Sn2+, Sn4+, Sb3+, Sb5+. Растворы солей этих катионов, образованных сильными кислотами, имеют кислую реакцию.
Мышьяк /III/, сурьма/III/ и олово /III/ в щелочной среде ведут себя как восстановители. Мышьяк /V/, cурьма /V/ в кислой среде проявляют свойства окислителей.
Характерной реакцией для катионов 6 группы является образование нерастворимых в воде сульфидов при взаимодействии с сероводородом в кислой среде. Сульфиды катионов 6 группы растворяются в сульфидах натрия, калия, аммония, образуя сульфосоли (тиосоли). Например:
↓Аs2S3 + ЗNа2S = 2Nа3АsS3 тиомышьяковский натрий.
Сульфосоли по своему составу подобны кислородосодержащим кислотам тех же элементов с той разницей, что роль кислорода здесь играет элемент, ему аналогичный — сера.
Использование сероводорода в качестве группового реактива сопряжено с многочисленными трудностями.
Бессероводородный метод качественного анализа предусматривает осаждение катионов 6 группы (олова и сурьмы) едкими щелочами. При этом образуются соединения нерастворимые в воде, обладающие способностью растворяться в избытке щелочей.
В водных растворах сурьма образует ионы SbЗ+, Sb5+, олово Sn2+, Sn4+, мышьяк АsЗ+, ( в кислой среде); арсенит ион AsO33- и арсенат-ион AsO43- (в щелочной среде). Все эти ионы бесцветны. Соединения мышьяка сильно ядовиты. Мышьяк входит в состав сельскохозяйственных ядов: парижской зелени Сu(СН3СОО)23Сu(АsО2)2, арсенита натрия, арсенита и арсената кальция. У животных и человека при попадании больших доз мышьяка внутрь наблюдаются острые отравления, сопровождающиеся сильной болезненностью органов брюшной полости, коликами, рвотой, поносом, слюнотечением, ослаблением сердечной деятельности, резким падением кровяного давления, параличом.
В ветеринарии соединения мышьяка применяют в качестве противопаразитарных средств и веществ, улучшающих обмен (осарсол, новарсенол, натрия арсенат).
Продовольственные продукты и сельскохозяйственное сырье подлежат обязательному анализу на присутствие мышьяка. Предельно допустимое содержание мышьяка составляет: в мясе- 0.1 мг/кг, в молоке- 0.05 мг/кг, в яйце — 0.1 мг/кг.
Биологическая роль сурьмы и олова выяснена недостаточно. В ветеринарии используют сульфиты сурьмы /III/ и /V/ в качестве отхаркивающих средств, арсенат олова как антгельминтик.
Общие сведения о качественном анализе
Для установления химического состава анализируемого объекта используется качественный анализ. Другими словами, он позволяет установить, из каких химических элементов состоит анализируемое вещество и какие ионы, атомы или молекулы входят в его состав. С помощью качественного анализа в неорганических веществах исследуются катионы и анионы. При этом используются такие понятия, как аналитические сигналы и аналитические реакции.
Определение 1
Аналитические сигналы — это фиксируемые изменения, выявляемые в ходе реакции (появление или изменение окраски раствора, выделение или растворение осадка, выделение газа, окрашивание пламени).
Аналитическая реакция представляет собой такое химическое превращение анализируемого вещества под действием аналитического реагента, в результате которого образуется продукт с наличием аналитического сигнала.
Аналитические реакции делятся на групповые, селективные и специфические:
- селективные реакции предназначены для обнаружения ограниченного числа ионов в смеси без ее предварительного разделения;
- для специфических реакций характерным является наличие аналитического сигнала только у одного иона в присутствии многих других;
- в групповых реакциях аналитические сигналы одинаковы для нескольких ионов, что позволяет использовать их для обнаружения конкретной группы ионов. На основе данных реакций разработана аналитическая классификация катионов и анионов.
Аналитическая классификация катионов
Классификация связана с разделением катионов на аналитические группы при последовательном действии на смесь катионов групповыми реагентами.
Выделяют сероводородную, аммиачно-фосфатную и кислотно-основную (кислотно-щелочную) классификации.
Рисунок 1. Аналитическая классификация катионов. Автор24 — интернет-биржа студенческих работ
«Группы катионов 1-3» 👇
Рассмотрим кислотно-основную классификацию более подробно.
Катионы первой аналитической группы
К данной группе относятся катионы щелочных металлов ($mathrm{K^+, Na^{+}, Li^{+}}$) и $mathrm{NH_4^{+}}$. Представленные катионы не имеют группового реактива, так как почти все соли натрия, калия и аммония растворимы в воде, в отличие от катионов других групп.
$mathrm{K^+, Na^{+}, NH_4^{+}}$ бесцветны, окраска их соединений определяется окраской аниона.
Рассмотрим реакции обнаружения катионов первой аналитической группы.
Реакции ионов калия $mathrm{K^+}$
Окрашивание пламени в бледно-фиолетовый цвет. Для реакции берут чистую нихромовую проволоку, которую погружают в раствор соли калия и вносят ее в несветящуюся часть пламени.
Реакция с гексанитрокобальтом (III) натрия. В результате реакции образуется жёлтый кристаллический осадок.
$mathrm{2KCl + Na_3[Co(NO_2)_6] longrightarrow K_2Na[Co(NO_2)_6] downarrow + 2NaCl}$
Реакция с гидротартратом натрия или винной кислотой. При достаточной концентрации ионов калия образуется белый кристаллический осадок гидротартрата калия.
$mathrm{K^{+} + HC_4H_4O_6^{-} longrightarrow KHC_4H_4O_6downarrow}$
Микрокристаллоскопическая реакция с гексанитрокупратом (II) натрия-свинца. Образуются чёрные или коричневые кубические кристаллы гексанитрокупрата (II) калия-свинца.
$mathrm{2KCl + Na_2Pb[Cu(NO_2)_6] longrightarrow K_2Pb[Cu(NO_2)_6] downarrow + 2NaCl}$
Реакция с тетрафенилборатом натрия, в результате которой образуется белый кристаллический осадок тетрафенилбората калия, нерастворимый в кислотах.
$mathrm{KCl + Na[B(C_6H_5)_4] longrightarrow K[B(C_6H_5)_4] downarrow + NaCl}$
Реакция с платинохлористоводородной кислотой. Образуется жёлтый кристаллический осадок хлороплатината калия.
$mathrm{2K^{+} + [PtCl_6]^{-} longrightarrow K_2[PtCl_6]downarrow}$
Реакции ионов натрия $mathrm{Na^+}$
Реакция с дигидроантимонатом калия. В результате реакции образуется белый кристаллический осадок дигидроантимоната натрия.
Замечание 1
Реакцию нельзя проводить в кислой среде, так как в этом случае выделяется белый аморфный осадок метасурьмяной кислоты.
$mathrm{NaCl + KH_2SbO_4 longrightarrow NaH_2SbO_4downarrow + KCl}$
Окрашивание пламени. Соли натрия окрашивают пламя в ярко-жёлтый цвет.
Микрокристаллоскопическая реакция с цинкуранилацетатом. Образуется желтоватый кристаллический осадок.
$mathrm{NaCl + CH_3COOH + Zn(CH_3COO)_2 cdot 3UO_2(CH_3COO)_2 cdot 9H_2O longrightarrow CH_3COONa cdot Zn(CH_3COO)_2 cdot 3UO_2(CH_3COO)_2 cdot 9H_2O downarrow + HCl}$
Реакции ионов аммония $mathrm{NH_4^+}$
Реакция со щелочью. В результате выделяется газообразный аммиак.
$mathrm{NaOH + NH_4Cl longrightarrow NH_3uparrow + H_2O + NaCl}$
Выделяющийся аммиак можно обнаружить по запаху, с помощью смоченной лакмусовой бумажки, которая будет окращиваться в синий цвет, а также по образованию «дыма» вокруг палочки, смоченной концентрированной соляной кислотой.
Реакция с реактивом Несслера. Образуется красно-бурый осадок иодида оксодимеркураммония.
Рисунок 2. Реакция ионов аммония с реактивом Несслера
Катионы второй аналитической группы
Ко второй аналитической группе катионов относятся $mathrm{Ag^+, Hg_2 ^{2+}, Pb^{2+}}$. Групповым реактивом является соляная кислота, при взаимодействии с которой катионы образуют малорастворимые в воде и в разбавленных кислотах белые осадки: $mathrm{AgCl, Hg_2Cl_2, PbCl_2}$.
Замечание 2
Все растворимые соединения свинца и ртути ядовиты.
Перейдём к реакциям обнаружения данных катионов.
Реакции ионов серебра $mathrm{Ag^+}$.
Взаимодействие с щелочами, в результате которого образуется бурый осадок $mathrm{Ag_2O}$, так как происходит разложение неустойчивого белого гидроксида серебра.
$mathrm{AgNO_3 + NaOH longrightarrow AgOH downarrow + NaNO_3}$
$mathrm{2AgOH downarrow longrightarrow Ag_2O downarrow + H_2O}$
Реакция с галогенами. $mathrm{AgCl}$ — белый осадок, $mathrm{AgBr}$ — бледно-жёлтый осадок, $mathrm{AgI}$ — жёлтый осадок.
$mathrm{AgNO_3 + KCl longrightarrow AgCl downarrow + KNO_3}$
$mathrm{AgNO_3 + KBr longrightarrow AgBr downarrow + KNO_3}$
$mathrm{AgNO_3 + KI longrightarrow AgI downarrow + KNO_3}$
Взаимодействие с хроматом калия приводит к образованию кирпично-красного осадка хромата серебра.
$mathrm{2AgNO_3 + K_2CrO_4 longrightarrow Ag_2CrO_4 downarrow + 2KNO_3}$
Реакция «серебряного зеркала». Происходит образование блестящей зеркальной плёнки в результате восстановления ионов серебра до металлического серебра при взаимодействии с формальдегидом в аммиачном растворе.
$mathrm{2Ag^{+} + 3NH_4OH + HCOH longrightarrow 2Agdownarrow + HCOO^{-} + 3NH_4^{+} + 2H_2O}$
Взаимодействие с гидрофосфатом с образованием жёлтого осадка фосфата серебра.
$mathrm{3Ag^{+} + HPO_4^{2-} longrightarrow Ag_3PO_4downarrow + H^{+}}$
Реакции ионов ртути $mathrm{Hg_2^{2+}}$
Реакция с соляной кислотой и растворимыми хлоридами. Образуется белый осадок — $mathrm{Hg_2Cl_2}$. На свету он чернеет с выделением тонкодисперсной металлической ртути.
$mathrm{Hg_2Cl_2 downarrow longrightarrow Hg downarrow + HgCl_2}$
Взаимодействие со щелочами приводит к образованию чёрного осадка оксида ртути (I)
$mathrm{Hg_2^{2+} + 2OH^{-} longrightarrow Hg_2Odownarrow + H_2O}$
Реакция с водным раствором аммиака:
$mathrm{Hg_2Cl_2 + 2NH_3 cdot H_2O longrightarrow [Hg_2NH_2]Cl + NH_4Cl + 2H_2O}$
$mathrm{[Hg_2NH_2]Cl longrightarrow HgNH_2Cldownarrow + Hgdownarrow }$
Реакция хромата калия с ионами ртути, в результате которой образуется красный осадок хромата ртути.
$mathrm{Hg_2(NO_3)_2 + K_2CrO_4 longrightarrow Hg_2CrO_4 downarrow + 2KNO_3}$
Восстановление ионов ртути до металлической ртути с помощью вытеснения её из соединений более активным металлом.
$mathrm{Hg_2(NO_3)_2 + Cu longrightarrow 2Hg downarrow + Cu(NO_3)_2}$
Взаимодействие с йодидом калия приводит к образованию зеленоватого осадка йодида ртути
$mathrm{Hg_2(NO_3)_2 + 2KI longrightarrow Hg_2I_2 downarrow + 2KNO_3}$
Реакции иона свинца $mathrm{Pb^{2+}}$
Реакция со щелочами ведёт к образованию белого осадка.
$mathrm{Pb(NO_3)_2 + 2NaOH longrightarrow Pb(OH)_2 downarrow + 2NaNO_3}$
Реакция с серной кислотой и растворимыми сульфатами приводит к образованию белого осадка сульфата свинца
$mathrm{Pb(NO_3)_2 + 2NaOH longrightarrow Pb(OH)_2 downarrow + 2NaNO_3}$
Взаимодействие с хроматом калия, при котором выпадает жёлтый осадок, который плохо растворим в разбавленной азотной кислоте, легко растворим в щелочах и не растворим в растворе аммиака и уксусной кислоте.
$mathrm{Pb(NO_3)_2 + K_2CrO_4 longrightarrow PbCrO_4 downarrow + 2KNO_3}$
$mathrm{PbCrO_4 + 4KOH longrightarrow K_2CrO_4 + K_2[Pb(OH)_4]}$
Реакция с раствором йодида калия (реакция «золотого дождя»). Выделяется ярко-жёлтый осадок
$mathrm{Pb(NO_3)_2 + 2KI longrightarrow PbI_2 downarrow + 2KNO_3}$
Катионы третьей аналитической группы
К третьей группе катионов относятся ионы двух валентных металлов $mathrm{Ba^{2+}, Ca^{2+}, Sr^{2+}}$. Катионы данной группы образуют труднорастворимые сульфаты, фосфаты, карбонаты, оксалаты, хроматы и сульфиды с хлоридами, которые легко растворимы. Групповым реагентом является раствор серной кислоты.
Реакции иона кальция $mathrm{Ca^{2+}}$
Микрокристаллоскопическая реакция с серной кислотой. В разбавленных растворах образуется малорастворимый белый осадок $mathrm{CaSO_4cdot 2H_2O}$ (гипс), который выделяется при медленной кристаллизации в виде игольчатых кристаллов, которые могут быть представлены в виде снежинок или звёздочек.
Взаимодействие с оксалатом аммония приводит к образованию белого мелкокристаллического осадка (оксалата кальция)
$mathrm{CaCl_2 + (NH_4)_2C_2O_4 longrightarrow CaC_2O_4downarrow + 2NH_4Cl}$
Реакция с гидрофосфатом натрия. Образуется белый аморфный осадок, растворимый в кислотах
$mathrm{CaCl_2 + Na_2HPO_4 longrightarrow CaHPO_4downarrow + 2NaCl}$
Реакция с гексацианоферратом (II) калия (жёлтой кровяной солью)
$mathrm{CaCl_2 + K_4[Fe(CN)_6] + NH_4Cl longrightarrow (NH_4)KCa[Fe(CN)_6]downarrow + 3KCl}$
Взаимодействие с растворимыми карбонатами приводит к выпадению белого осадка
$mathrm{CaCl_2 + (NH_4)_2CO_3 longrightarrow CaCO_3downarrow + 2NH_4Cl}$
Ионы кальция окрашивают пламя в кирпично-красный цвет.
Реакции иона бария $mathrm{Ba^{2+}}$
Реакция с серной кислотой, выделяется белый кристаллический осадок
$mathrm{BaCl_2 + H_2SO_4 longrightarrow BaSO_4downarrow + 2HCl}$
Взаимодействие с карбонатом аммония
$mathrm{BaCl_2 + (NH_4)_2CO_3 longrightarrow BaCO_3downarrow + 2NH_4Cl}$
Реакция с дихроматом калия, в ходе которой выпадает жёлтый мелкокристаллический осадок
$mathrm {2BaCl_2 + K_2Cr_2O_7 + 2CH_3COONa + H_2O longrightarrow 2BaCrO_4downarrow + 2KCl + 2CH_3COOH + 2NaCl}$
Реакция с оксалатом аммония, выпадает белый мелкокристаллический осадок
$mathrm {BaCl_2 + (NH_4)_2C_2O_4 longrightarrow BaC_2O_4downarrow + 2NH_4Cl}$
Реакция с родизонатом натрия, в результате которой образуется соединения красного цвета. При дальнейшем добавлении соляной кислоты соединение становится розовым.
Рисунок 3. Реакция родизоната натрия с ионами бария
Ионы бария окрашивают пламя в жёлто-зелёный цвет
Реакции иона стронция $mathrm{Sr^{2+}}$
Действи сульфат-ионов на ионы стронция приводит к выпадению белого осадка — $mathrm{SrSO_4downarrow}$
При взаимодействии с оксалатом аммония выпадает белый осадок — $mathrm{SrC_2O_4downarrow}$
Реакция с гидрофосфатом натрия
$mathrm {SrCl_2 + Na_2HPO_4 longrightarrow SrHPO_4downarrow + 2NaCl}$
Реакция с родизонатом натрия с образованием красно-бурого соединения
Рисунок 4. Реакция с родизонатом натрия. Автор24 — интернет-биржа студенческих работ
Ионы стронция окрашивают пламя в карминово-красный цвет.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Анализ катионов второй и третьей аналитических групп
Оглавление
- 1. Общая характеристика катионов II аналитической группы
- 2. Реакции обнаружения катионов II аналитической группы
- 2.1 Реакции Ag+ — ионов
- 2.2 Реакции Pb2+ — ионов
- 3. Общая характеристика катионов III аналитической группы
- 4. Реакции обнаружения катионов III аналитической группы
- 4.1 Реакции Ba2+ — ионов
- 4.2 Реакции Ca2+ — ионов
- 4.3 Реакции Sr2+ — ионов
1. Общая характеристика катионов II аналитической группы
Ионы Ag+, Hg22+ и Pb2+ осаждаются хлороводородной кислотой с образованием малорастворимых хлоридов белого цвета. Это отличает их от всех остальных катионов и поэтому эти ионы в рамках кислотно-основной классификации выделяют в самостоятельную аналитическую группу под номером два (групповой реагент на II аналитическую группу – HCl). Большинство солей II аналитической группы мало растворимы в воде; растворимы только нитраты и ацетаты.
При действии разбавленной HCl на катионы II аналитической группы образуются белые малорастворимые хлориды AgCl, Hg2Cl2, PbCl2. Они нерастворимы в воде и разбавленных HNO3 и H2SO4, однако могут частично растворяться в избытке HCl с образованием комплексных хлоридных ионов. Следовательно, при осаждении катионов II аналитической группы не следует сильно повышать концентрацию хлороводородной кислоты, которая является групповым реагентом.
Осадок PbCl2 хорошо растворим в горячей воде, что используется для отделения PbCl2 от хлоридов серебра и ртути в систематическом ходе анализе.
Хлорид серебра, который представляет собой аморфный творожистый осадок, на свету чернеет из-за разложения:
2AgCl + h → 2Ag↓ + Cl2
Хлорид серебра легко растворим в водных растворах NH3, (NH4)2СО3 и KCN с образованием комплексных ионов [Ag(NH3)2]+ и [Ag(CN)2]—, а также в растворе Na2S2O3 c образованием [Ag(S2O3)2]3-. Например:
AgCl + 2NH4OH → [Ag(NH3)2]+ + Cl— + 2H2O
Действие NH4OH используется в ходе анализа для отделения AgCl от Hg2Cl2.
При действии NH4OH белый осадок Hg2Cl2 превращается в белый комплексный амид ртути(I):
Hg2Cl2 + 2NH4OH → [NH2Hg2]Cl↓ + NH4+ + Cl— + 2H2O,
который быстро разлагается с образованием мелкодисперсной металлической ртути, что приводит к почернению осадка:
[NH2Hg2]Cl → NH2HgCl + Hg↓
Амидосоединение ртути(II) NH2HgCl белого цвета. Эту реакцию обычно используют для обнаружения ртути (I) в ходе анализа.
2. Реакции обнаружения катионов II аналитической группы
Цель работы: Изучение реакций обнаружения катионов II аналитической группы.
В ходе работы студенты получают практические навыки выполнения аналитических реакций, характерных для катионов II аналитической группы, осуществления контроля за кислотностью реакционной среды и температурными условиями протекания реакций, правильного и безопасного использования центрифуги для отделения осадков, проведения микро- кристаллоскопического анализа.
Полученные знания и умения необходимы при проведении анализа образца неизвестного состава, в частности, при выполнении контрольной работы № 1.
2.1 Реакции Ag+ — ионов
Катионы серебра образуют с галогенид-ионами (Cl—, Br—, I—) нерастворимые в азотной кислоте осадки – AgCl (белый), AgBr (бледно-желтый) и AgI (желтый) соответственно.
Осадок AgCl полностью растворяется в водном растворе аммиака (NH4OH) с образованием аммиачного комплекса [Ag(NH3)2]+. В отличие от хлорида серебра, бромид серебра незначительно растворим в растворе аммиака, а AgI не растворяется в NH4OH.
1. Реакция с растворимыми хлоридами.
Растворимые хлориды (HCl, NaCl, KCl и т.д.) образуют с ионами серебра белый творожистый осадок хлорида серебра:
Ag+ + Cl— → AgCl↓
Если осадок AgCl растворить в водном растворе аммиака и полученный раствор подкислить азотной кислотой, то снова выпадает белый осадок хлорида серебра:
AgCl + 2NH4OH → [Ag(NH3)2]+ + Cl— + 2H2O
[Ag(NH3)2]+ + Cl— + 2H+ → AgCl↓ + 2NH4+
При действии на аммиачный раствор хлорида серебра иодида калия образуется желтый осадок AgI:
[Ag(NH3)2]+ + I— + 2H2O → AgI↓ + 2NH4OH
Выполнение реакции:
4-5 капель раствора нитрата серебра помещают в коническую пробирку и добавляют 2-3 капли раствора хлорида натрия. Наблюдают образование белого творожистого осадка. Затем осторожно по каплям при перемешивании добавляют 6М раствор NH4OH до полного растворения осадка.
Половину полученного раствора переносят в чистую коническую пробирку и добавляют 3-4 капли 6М раствора азотной кислоты. Наблюдают образование белого осадка, который отделяют от раствора на центрифуге.
К оставшейся части раствора добавляют 3-4 капли раствора иодида калия. Наблюдают образование желтого осадка, который отделяют от раствора на центрифуге.
2. Реакция с хроматом калия.
Хромат калия K2CrO4 в нейтральной среде образует с ионами серебра кирпично-красный осадок хромата серебра:
2Ag+ + CrO42- → Ag2CrO4↓
Осадок растворяется в азотной кислоте и гидроксиде аммония, но весьма трудно растворяется в уксусной кислоте.
Выполнение реакции:
2-3 капли раствора нитрата серебра помещают в пробирку и добавляют 1-2 капли раствора хромата калия. Наблюдают образование кирпично-красного осадка. Реакцию следует проводить при рН = 7. В щелочной среде выпадает осадок окиси серебра (Ag20). В аммиачной среде и в сильнокислой среде осадок не образуется.
3. Едкие щелочи NaOH и КОН дают с Ag+ бурый осадок Аg2О, который образуется вследствие распада получающейся в первый момент неустойчивой гидроокиси серебра:
2Ag+ + 20Н— →2AgOH↓
2AgOH↓ →Ag20↓ + H20
Растворение осадка в NH4OH обусловлено образованием аммиачного комплекса серебра:
Ag2O↓ + 4NH4OH → 2[Ag(NH3)2]+ + 20Н—+ 3H20
Растворение Ag20 в NH4OH необходимо вести в присутствии соли аммония, так как иначе возможно образование азида серебра Ag3N, взрывающегося от малейшего сотрясения.
При действии NH4OH на растворы солей серебра может также выпасть осадок Ag20, который, однако, сейчас же растворяется в избытке реагента.
4. Гидрофосфат натрия Na2HP04 образует с Ag+ желтый осадок Ag3P04, растворимый в HN03 и NH4OH:
3Ag+ + 2HP042- → Ag3P04↓+ Н2РО—
5. Растворы бромидов и иодидов (ионы Вr— и I—) дают с Ag+ и бледно-желтый осадок AgBr и желтый AgI:
Ag+ + Br— →AgBr↓(ПР = 5,3 * 10-13)
Ag+ + I— →AgI↓ (ПР = 8,3 *10-17)
В отличие от хлорида серебра (ПР = 1,78*10—10), иодид серебра нерастворим в NH4OH, а бромид серебра растворяется в нем незначительно. Различное отношение их к NH4OH связано с различием их произведений растворимости.
Если, однако, действовать на осадки растворами KCN или Na2S203, образующими с Ag+ комплексы [Ag(CN)2]— и [AgS203]—, менее диссоциированные по сравнению с [Ag(NH3)2]+, то растворяются также AgBr и AgI. В этом можно убедиться на опыте, подействовав на отцентрифугированный осадок избытком раствора тиосульфата натрия Na2S203.
6. Восстановление Ag+ до металлического серебра.
Ион Ag+ имеет сравнительно высокий стандартный потенциал (Е0 = 0,80 в.) и поэтому может быть восстановлен до металлического серебра различными восстановителями.
а) Восстановление формальдегидом НСОН.
Выполнение реакции:
В пробирку, очищенную от жира промыванием хромовой смесью и затем водой, помещают несколько капель раствора соли серебра и разбавляют 10 каплями воды. Туда же добавляют 8—10 капель 2 н. Раствора NH4OH и несколько капель разбавленного раствора формальдегида (формалина). При погружении пробирки в горячую воду на стенках ее образуется блестящее зеркало металлического серебра:
2Ag+ + 3NH4OH + НСОН → 2Ag↓+ НСОО— + 3NH4+ + 2Н20
б) Восстановление ионами Мn2+.
2AgCl↓+ Mn2+ + 40Н—→ 2Ag↓ + 2Сl— + МnО(ОН)2↓+ Н20
Реакцию обнаружения Ag+ проводят капельным методом.
Выполнение реакции:
На полоску бумаги наносят каплю раствора HCl. В центр получившегося влажного пятна помещают капилляр с раствором соли серебра. При этом на бумаге образуется осадок AgCl. Осадок тщательно промывают, поставив в центр пятна капилляр, содержащий столько воды, сколько ее может быть удержано капиллярными силами. Держат капилляр до тех пор, пока диаметр пятна не увеличится в 2-3 раза. Затем промытый осадок смачивают каплей раствора Mn(N03)2 и действуют маленькой каплей концентрированного раствора NaOH. Признаком присутствия Ag+ является моментальное почернение пятна при действии щелочи. Предельное разбавление 1 :25 000.
2.2 Реакции Pb2+-ионов
1. Реакция с иодид-ионами.
Иодид-ионы I— образуют с ионами свинца желтый осадок иодида свинца:
Рb2+ + 2I— → РbI2↓
Осадок PbI2 растворяется при нагревании в воде, в растворе уксусной кислоты, а в избытке иодид-иона образует растворимый тетраиодокомплекс:
РbI2 + 2I— → [PbI4]2-
Выполнение реакции:
2-3 капли раствора нитрата свинца помещают в пробирку и добавляют 1-2 капли раствора иодида калия. Наблюдают образование желтого осадка.
Затем прибавляют 8-10 капель воды и 8-10 капель 2М раствора уксусной кислоты и смесь нагревают на водяной бане до растворения осадка. Быстро охлаждают пробирку с раствором под струей холодной воды и наблюдают выпадение осадка иодида свинца в виде блестящих золотистых кристаллов («золотой дождь»).
2. Реакция с хроматом калия.
Хромат калия K2CrO4 с ионами свинца в нейтральной или слабокислой среде образует желтый осадок хромата свинца:
Pb2+ + CrO42- → PbCrO4↓
Выполнение реакции:
2-3 капли раствора нитрата свинца помещают в пробирку и добавляют 1-2 капли раствора хромата калия. Наблюдают образование желтого осадка.
Осадок легко растворяется в растворах едких щелочей:
PbCr04↓+ 40Н— → РЬО22- + СrО42- + 2Н2О
Осадок РbСr04 мало растворяется в разбавленной азотной кислоте. В аммиаке, уксусной кислоте, ацетате и тартрате аммония он практически нерастворим. Это одна из наиболее важных реакций Рb2+.
3. Щелочи (NaOH, КОН) и NH4OH с Рb2+ образуют белый осадок гидроокиси свинца:
Pb2+ + 20Н— → Рb(ОН)2↓
Осадок обладает амфотерными свойствами, т. е. растворяется в кислотах и щелочах. В последнем случае образуются плюмбиты Na2Pb02 или К2Рb02:
Pb(OH)2↓ + 2Н+ → Рb2+ + 2Н20
Н2Рb02↓+20Н— → РbО22- + 2Н20
В аммиаке осадок РЬ(ОН)2 нерастворим.
4. Серная кислота и растворимые сульфаты (S042--ион) осаждают Рb2+ в виде белого осадка PbS04:
Pb2+ + S02- → PbS04↓
Осадок растворим при нагревании в растворах едких щелочей вследствие образования плюмбитов, например:
PbS04↓+ 4ОН— → РЬО22- + S042- + 2Н2О
Сульфат свинца также растворяется при нагревании с концентрированным (30%-ным) раствором СН3СООNН4 или (NH4)2C4H4O6:
2PbS04↓ + 2СН3СОО— → [Pb(CH3COO)2 • PbS04] + S042-
PbS04↓+ C4H4O62- → PbC4H2062- + S042- + 2H+
Кислоты НС1 и HN03 также значительно повышают растворимость PbS04.
Отсюда следует, что полное отделение Рb2+ в виде PbS04 возможно лишь после удаления из раствора указанных кислот.
Присутствие кислот не вызывает заметного растворения BaS04 вследствие значительно меньшей величины произведения растворимости BaS04 (ПР = 1,1 * 10-10) по сравнению с величиной произведения растворимости PbS04 (ПР = 1,6* 10-8).
5. Гидрофосфат натрия Na2HP04 образует белый осадок Рb3(Р04)2:
3Pb2+ + 4НР02- → Pb3(Р04)2↓ + 2Н2Р04—
Фосфат свинца Рb3(Р04)2 сравнительно мало растворим в разбавленной азотной и в уксусной кислотах, растворим в щелочах.
6. Реакция с бензидином (C12H8(NH2)2).
Выполнение реакции:
Смочив фильтровальную бумагу аммиачным раствором 3%-ной Н202, наносят на увлажненное место каплю исследуемого на Рb2+ раствора. Бумагу выдерживают в парах кипящей водяной бани. При этом образовавшаяся в результате взаимодействия соли свинца с NH4OH гидроокись свинца окисляется перекисью водорода до двуокиси свинца (бурого цвета):
Рb(ОН)2↓ + Н202 → РЬ02↓ + 2Н20
и в то же время разрушается избыток Н2О2.
Если затем влажное пятно на бумаге обработать каплей раствора уксуснокислого бензидина, то реагент окислится образовавшийся РЬ02, и пятно посинеет. Предельное разбавление 1 : 33000.
3. Общая характеристика катионов III аналитической группы
К третьей аналитической группе катионов относятся ионы Ba2+, Sr2+ и Ca2+. Это S2-элементы второй группы периодической системы Д.И. Менделеева. Степень окисления у этих элементов постоянна и равна +2, они имеют устойчивые оболочки типа инертного газа. По сравнению с катионами S1-элементов их заряд больше, а радиусы меньше, что приводит к проявлению ими больших поляризующих свойств. Вследствие этого, катионы бария, стронция и кальция дают ряд малорастворимых соединений с многозарядными анионами — сульфатами, карбонатами, фосфатами и оксалатами. Наиболее приемлемо осаждение катионов третьей аналитической группы в виде сульфатов, что дает возможность практически полного отделения катионов III группы от первой и второй групп.
4. Реакции обнаружения катионов III аналитической группы
Цель работы: Изучение реакций обнаружения катионов III аналитической группы.
В ходе работы студенты получают практические навыки выполнения аналитических реакций, характерных для катионов III аналитической группы, осуществления контроля за кислотностью реакционной среды и температурными условиями протекания реакций, правильного и безопасного использования центрифуги для отделения осадков, проведения микро- кристаллоскопического анализа.
Полученные знания и умения необходимы при проведении анализа образца неизвестного состава, в частности, при выполнении контрольной работы № 1.
4.1 Реакции Ba2+-ионов
1. Реакция с дихроматом калия.
Дихромат калия K2Cr2O7 образует с ионами бария желтый осадок BaCrO4. В водном растворе дихромата имеется небольшое количество ионов CrO42-, возникающих в результате равновесия:
Cr2O72- + H2O ↔ 2HCrO4— ↔ 2H+ + 2CrO42-
При рН = 5 концентрация ионов CrO42- достаточна для того, чтобы произведение растворимости для BaCrO4 оказалось превышенным, и реакция протекает по уравнению:
2Ba2+ + Cr2O72- + H2O → 2BaCrO4↓ + 2H+
В результате реакции в растворе накапливаются ионы водорода, что препятствует сдвигу равновесия вправо. Чтобы добиться полного осаждения хромата бария, к раствору следует добавить избыток ацетата натрия. Ацетат-ионы связывают ионы водорода в слабую уксусную кислоту (СН3СОО— + Н+ ↔ СН3СООН), которая с избытком CH3COONa образует ацетатную буферную смесь, поддерживающую слабокислую среду с рН = 5.
В этих условиях ионы Sr2+ и Ca2+ не образуют осадков хроматов и обнаружению Ba2+ не мешают. Реакция также используется для отделения катионов стронция и кальция от ионов бария.
Выполнение реакции:
В пробирку помещают 3 капли раствора соли бария, добавляют 3 капли раствора CH3COONa и 3 капли раствора K2Cr2O7. Наблюдают образование желтого осадка.
Осадок ВаСг04 образуется также при действии на растворы солей бария хроматом калия. Однако К2Сг04 дает с Sr2+ желтый осадок SrCr04, отличающийся от ВаСг04 лишь растворимостью в уксусной кислоте. Поэтому для предупреждения образования SrCr04 реакцию ведут в присутствии СН3СООН или лучше, ацетатной буферной смеси.
2. Реакция образования смешанных кристаллов.
Обнаружение ионов бария в этом случае основано на способности сульфата бария образовывать с перманганатом калия смешанные (изоморфные) кристаллы розового цвета вследствие близости параметров их кристаллических решеток:
Ba2+ + SO42- + K+ + MnO4— → BaSO4 * KMnO4↓
Выполнение реакции:
2-3 капли раствора соли бария помещают в коническую пробирку и добавляют 2-3 капли раствора перманганата калия до образования устойчивой фиолетовой окраски. Затем приливают 8-10 капель 2 н. раствора H2SO4, несколько капель 3 % раствора H2O2 до обесцвечивания реакционной смеси и образовавшийся осадок отделяют от раствора на центрифуге. Наблюдают розовый цвет осадка.
В отличие от Ba2+ ионы стронция смешанных кристаллов не образуют и в результате реакции выделяется белый осадок сульфата стронция. Осадок CaSO4 вследствие его значительной растворимости (KS = 2,5*10-5) не образуется.
3. Реакция окрашивания пламени.
Чистую нихромовую проволочку смочите раствором BaCl2 и внесите в пламя горелки. Пламя окрасится в желто-зеленый цвет.
4. Карбонат аммония, (NH4)2CO3, образует с ионом Ba2+ белый осадок
BaCO3, нерастворимый в NH4Cl (проверьте, это важно!).
5. Серная кислота и растворимые сульфаты (S042- — ионы) образуют с Ва2+ белый осадок BaS04:
Ba2++ S042-→ BaS04↓
Сульфат бария — малорастворимая соль сильной кислоты, нерастворим в кислотах; BaS04 переводят в раствор, превратив его в ВаСО3, который затем растворяют в кислоте:
BaS04↓ + СО32-→ BaC03↓+ S042-
ВаС03↓+ 2СН3СООН → Ва2+ + 2СН3СОО— + Н20 + C02↑
Практически это превращение осуществляют, например, путем нагревания BaS04 с насыщенным раствором карбоната натрия (мокрый способ).
Поскольку, однако, BaS04 менее растворим, чем образующийся при реакции ВаС03, эта реакция обратима и может быть доведена до конца лишь при многократной обработке осадка раствором Na2C03. При такой обработке жидкость (содержащую образовавшиеся при реакции S042--ионы) сливают с осадка и заменяют ее свежей порцией раствора Na2C03 и т. д.
6. Оксалат аммония (NH4)2C204, т. е. соль аммония и щавелевой кислоты, образует с Ва2+ белый осадок Ва2С204:
Bа2+ + C2O42- → BaC204↓
Осадок растворяется в НC1 и НNO3, а при нагревании — также и в концентрированной СН3СООН.
7. Гидрофосфат натрия Na2HP04 образует с Ва2+ белый осадок ВаНР04:
Ва2+ + HPO42- → ВаНР04↓
растворимый в НСl, HN03 и СН3СООН.
Если вести реакцию в присутствии щелочей или аммиака, HPO42-превращается в Р043- и осаждается средняя соль:
НРО42- + ОН— → Р043- + Н2О
3Ва2+ + 2 Р043- → Ва3(Р04)2↓
Отношение этого осадка к кислотам такое же, как и ВаНРО4.
4.2 Реакции Ca2+-ионов
1. Реакция с оксалатом аммония (фармакопейная).
Оксалат аммония (NH4)2C2O4 образует с ионами кальция белый осадок оксалата кальция, растворимый в минеральных кислотах, но не растворимый в уксусной кислоте:
Ca2+ + C2O42- → CaC2O4↓
Выполнение реакции:
В пробирку помещают 2-3 капли раствора соли кальция (не следует брать насыщенный раствор сульфата кальция!!!) и добавляют 2-3 капли раствора оксалата аммония. Наблюдают образование белого кристаллического осадка.
Реакции мешает присутствие ионов Ba2+, Sr2+ и Mg2+, дающие аналогичные осадки. В присутствии ионов бария реакцию на кальций выполняют в уксуснокислой среде при нагревании, т.к. оксалат бария растворим в горячей уксусной кислоте, а оксалат кальция нерастворим.
2. Реакция окрашивания пламени.
Чистую нихромовую проволочку смочите раствором CaCl2 или Ca(NO3)2 и внесите в пламя горелки. Пламя окрасится в кирпично-красный цвет.
3. Карбонат аммония, (NH4)2CO3, образует с ионом Ca2+ белый осадок CaCO3, нерастворимый в NH4Cl (проверьте, это важно!).
4. Микрокристаллоскопическая реакция.
Реакция основана на образовании катионами кальция с сульфат-ионами кристаллов гипса CaSO4*2H2O игольчатой формы:
Ca2+ + SO42- + 2H2O → CaSO4*2H2O↓
Выполнение реакции:
На предметное стекло помещают 1 каплю раствора соли кальция, добавляют 1 каплю 2 н. раствора H2SO4 и осторожно нагревают на плитке до появления белой каемки на границе капли. Затем наблюдают под микроскопом образовавшиеся крупные кристаллы гипса CaSO4*2H2O игольчатой формы, в виде сросшихся пучков.
Реакции мешает присутствие ионов Ba2+ и Sr2+, образующие белые осадки сульфатов бария и стронция.


Рис. Кристаллы гипса CaSO4*2H2O
5. Растворимые сульфаты (SO42--ионы) осаждают белый осадок CaS04 только в сравнительно концентрированных растворах солей кальция:
Са2+ + SO2- → CaS04↓
Осадок растворим в (NH4)2S04 вследствие образования комплексной соли (NH4)2[Ca(S04)2]. Гипсовая вода с растворами солей кальция мути не дает (отличие от Ва2+ и Sr2+).
6. Гексацианоферрат(II) калия K4[Fe(CN)6] дает возможность обнаружить Сa2+ в присутствии Sr2+, а также разделить эти катионы.
Реакцию можно представить уравнением:
Ca2+ + 2NH4+ + [Fe(CN)6]4- → Са(NH4)2[Fe(CN)6]↓
Реакцию ведут при рН= 9, т. е. в присутствии аммонийной буферной смеси.
Выполнение реакции:
к 1—2 каплям исследуемого раствора прибавляют по капле растворов NH4C1 и NH4OH, нагревают и осаждают примерно равным объемом насыщенного раствора K4[Fe(CN)6]. Выпадает белый кристаллический осадок Ca(NH4)2[Fe(CN)6] нерастворимый в уксусной кислоте. Это позволяет отличать его от SrC03, который может образоваться в присутствии (NH4)2C03, содержащемся в аммиаке, применяемом при реакции. Ион Ва2+ при значительной концентрации может также дать осадок с K4[Fe(CN)6]. Поэтому в присутствии Ва2+ применять эту реакцию для обнаружения Са2+ не следует.
7. Гидрофосфат натрия Na2HP04 образует белый осадок гидрофосфата кальция:
Са2+ + HP02- → СаHPO4↓
растворимый в кислотах (в том числе и в уксусной кислоте).
4.3 Реакции Sr2+-ионов
1. Серная кислота и растворимые сульфаты образуют белый осадок SrS04 практически нерастворимый в кислотах (почему?), его можно перевести в раствор так же, как и BaS04. Вследствие меньшей растворимости SrC03 по сравнению с SrS04, сульфат стронция превращается в карбонат несравненно легче, чем BaS04.
2. Реакция с гипсовой водой.
Гипсовая вода (насыщенный раствор CaSO4) образует с ионами стронция белый осадок (муть) SrSO4:
Sr2+ + SO42- → SrSO4↓ (медленно, при нагревании)
Выполнение реакции:
4-5 капель раствора соли стронция (не следует брать насыщенный раствор сульфата стронция!!!) помещают в пробирку, добавляют 4-5 капель гипсовой воды и полученную реакционную смесь нагревают на водяной бане в течение 4-5 минут. Наблюдают появление незначительного помутнения раствора.
Обнаружению стронция по этой реакции мешает присутствие ионов Ba2+, которые с гипсовой водой мгновенно образуют обильный белый осадок сульфата бария.
3. Гидрофосфат натрия Na2HP04 образует с Sr2+ белый осадок гидрофосфата стронция:
Sr2+ + HP02- → SrHPO4↓
растворимый в кислотах (в том числе и в уксусной кислоте).
4. Оксалат аммония (NН4)2С204 осаждает Sr2+ в виде белого осадка SrC204:
Sr2++C2042- → SrC204↓
растворимого в минеральных кислотах, а при нагревании в концентрированной уксусной кислоте.
5. Обнаружение Sr2+ и Ва2+ капельной реакцией с родизонатом натрия Na2C606.
Выполнение реакции:
На фильтровальную бумагу помещают каплю нейтрального раствора соли стронция и действуют каплей водного раствора родизоната натрия. При этом на бумаге появляется красно-бурое пятно осадка родизоната стронция SrC606. При смачивании пятна каплей разбавленной НСl осадок растворяется и пятно исчезает.
С родизонатом Ва2+ образует такой же красно-бурый осадок родизоната бария ВаС6О6, который, однако, легко отличить от родизоната стронция, так как при действии НС1 этот осадок становится розово-красным вследствие превращения в кислый родизонат бария.
Реакция очень удобна для дробного обнаружения Sr2+ и Ва2+ в присутствии всех остальных катионов III, II и I аналитических групп (катионы других групп должны отсутствовать).
Выполнение реакции:
На полоску бумаги помещают каплю нейтрального исследуемого раствора и смачивают каплей раствора родизоната. Рядом наносят на бумагу каплю раствора родизоната и сравнивают окраски. Если они одинаковы, ни Ва2+, ни Sr2+ в растворе нет. Если появляется красно-бурая окраска пятна, его смачивают каплей 0,5 н. раствора[1] НС1. Обесцвечивание пятна указывает на отсутствие Ва2+ и присутствие Sr2+. Если же пятно краснеет (точнее — розовеет), — присутствует Ва2+.
Для обнаружения Sr2+ в этом случае проделывают следующее испытание. Полоску бумаги смачивают раствором К2Сr04 и наносят в центр пятна каплю исследуемого раствора. При этом Ва2+ осаждается в виде ВаСrО4, который с родизонатом не реагирует, тогда как хромат стронция с родизонатом реагирует вследствие большей растворимости.
Чтобы быть уверенным в полноте осаждения, пятно еще раз смачивают К2Сr04, после чего обрабатывают его каплей родизоната. В присутствии Sr2+ пятно легко окрашивается в красновато-бурый цвет, при его отсутствии — в оранжевый (окраска контрольного пятна, образовавшегося при нанесении на бумагу капли реагента).
6. Микрокристаллоскопическая реакция.
Выполнение реакции:
Каплю исследуемого раствора соли стронция досуха выпаривают на предметном стекле. Сухой остаток растворяют в капле 2%-ного раствора Cu(N03)2 и снова выпаривают досуха. После охлаждения прибавляют 2 капли 0,05 н. раствора СН3СООН и в полученный прозрачный раствор вносят кристаллики KN02. Спустя несколько минут (быстрее при слабом подогревании капли) по краям образуются мелкие сине-зеленые кубики тройного нитрита K2SrCu(NO2)6. Предельное разбавление 1 : 10 000.
Ионы Ва2+ Са2+ дают кристаллы зеленого цвета. Форма их отличается от формы кристаллов соли стронция.
7. Реакция окрашивания пламени.
Летучие соли стронция окрашивают бесцветное пламя в характерный карминово-красный цвет.
[1] Следует иметь в виду, что при малых количествах Ва2+ от большего количества или большей концентрации НС1 пятно может исчезнуть и Ва2+ будет «недооткрыт». В сомнительных случаях полезно проделать параллельно реакцию на Ва2+ с раствором К2СrO4.




