1. Общая характеристика катионов I аналитической группы
К катионам I группы относят ионы щелочных металлов (K+, Na+, Li+) и NH4+.
Катионы щелочных металлов имеют законченные 2- или 8-электронные оболочки, подобные оболочкам инертных (благородных) газов. На внешнем электронном уровне находится 1 электрон, поэтому в сложных (гетероатомных) соединениях они проявляют только одну степень окисления +1. Для них характерны соединения с ионной связью (вспомните, NaCl, KNO3) хорошо растворимые в воде, поэтому I группа не имеет группового реагента.
В водных растворах ионы щелочных металлов бесцветны, поскольку они не поглощают кванты света в видимой области спектра. Другое дело атомы щелочных металлов, образующиеся из ионов при нагревании в пламени горелки. Для перехода из основного в возбужденное состояние (переход электрона на более высокий энергетический уровень) атомам щелочных металлов необходима сравнительно небольшая энергия. Примерно через 10−8с, происходит переход в основное состояние (электрон возвращается на нижний энергетический уровень).
За счет выделения избыточной энергии в видимой области спектра пламя становится карминово-красным (Li+), желтым (Na+) или фиолетово-розовым (K+).
Большинство образуемых этими элементами солей хорошо растворимы в воде. Особенно важна для анализа растворимость в воде их сульфидов, гидроксидов, карбонатов и хлоридов, что отличает первую группу катионов от всех остальных аналитических групп. Аналогично ведут себя и соли аммония.
Водные растворы солей катионов I группы бесцветны.
2. Реакции обнаружения катионов I аналитической группы
Цель работы: Изучение реакций обнаружения катионов I аналитической группы.
В ходе работы студенты получают практические навыки выполнения аналитических реакций, характерных для катионов I аналитической группы, осуществления контроля за кислотностью реакционной среды и температурными условиями протекания реакций, правильного и безопасного использования центрифуги для отделения осадков, проведения микро- кристаллоскопического анализа.
Полученные знания и умения необходимы при проведении анализа образца неизвестного состава, в частности, при выполнении контрольной работы № 1.
Водные растворы солей катионов I группы бесцветны.
2.1 Реакции К+ — ионов
1. Реакция с гексанитрокобальтиатом (III) натрия
Гексанитрокобальтиат (III) натрия (кобальтинитрит натрия) Na3[Co(NO2)6] образует с ионами калия в нейтральной или слабокислой (рН = 5) среде желтый осадок преимущественного состава K2Na[Co(NO2)6]:
2K+ + Na+ + [Co(NO2)6]3- → K2Na[Co(NO2)6]↓
Выполнение реакции:
1-2 капли раствора соли калия помещают в коническую пробирку и добавляют 1-2 капли раствора кобальтинитрита натрия и, если осадок не выпадет, дают постоять 2-3 минуты. Образуется хорошо различимый осадок желтого цвета, который отделяют от раствора на центрифуге.
ВНИМАНИЕ!!! Для проведения реакции следует использовать только свежеприготовленный раствор реагента (темно-желтого цвета); розовый цвет раствора свидетельствует о том, что реагент разложился и не пригоден для анализа.
При малой концентрации ионов K+ осадок может не образоваться. В этом случае рекомендуется реакционную смесь охладить под струей водопроводной воды и потереть внутренние стенки пробирки стеклянной палочкой. Наличие после центрифугирования на дне пробирки желтого пятна осадка указывает на присутствие ионов калия.
Ион аммония образует аналогичный желтый осадок (NH4)2Na[Co(NO2)6], отличие его от соответствующего соединения калия заключается в том, что он разлагается при нагревании. Реакцию следует проводить при нагревании, или в присутствии NH4+ обнаружение ионов калия проводят по п.2. Остальные катионы первой и второй групп проведению этой реакции не мешают.
2. Обнаружение K+-ионов в присутствии ионов NH4+.
При обнаружении ионов калия в присутствии ионов аммония последние необходимо удалить, переведя их в гексаметилентетрамин (уротропин) действием формальдегида в щелочной среде (рН 10):
4NH4+ + 6HCOH + 4OH— → N4(CH2)6 + 10H2O
Выполнение реакции:
В коническую пробирку помещают по 2-3 капли растворов солей калия и аммония, 5-6 капель формалина (40 % раствор формальдегида) и 1 каплю фенолфталеина. Затем осторожно по каплям добавляют раствор Na2CO3 до появления устойчивой красной окраски индикатора, что указывает на сильно щелочную среду (рН > 10), и полученную реакционную смесь около минуты нагревают на водяной бане. Затем раствор охлаждают под водопроводной водой, подкисляют уксусной кислотой до исчезновения красной окраски (рН = 5) и к 2-3 каплям полученного раствора добавляют 2-3 капли раствора кобальтинитрита натрия. Наблюдают образование желтого осадка по реакции. Если осадок не образуется, то потирают стенки пробирки стеклянной палочкой до помутнения раствора и отделяют выделившийся осадок на центрифуге.
3. Реакция с гидротартратом натрия , NaHC4H4O6.
Гидротартрат натрия, NaHC4H4O6 образует с ионом К+ белый кристаллический осадок КНС4Н4О6, растворимый в НCl, КОН, в воде при нагревании и нерастворимый в СН3СООН. Мешает ион NH4+, образующий белый осадок с аналогичными свойствами.
KCl + NaHC4H4O6 ↔ KHC4H4O6 ↓ + NaCl
K+ + HC4H4O6− ↔ KHC4H4O6 ↓
белый
Выполнение реакции:
В пробирку внесите 5 капель раствора КСl, 5 капель раствора реагента. Для ускорения реакции можно потереть стенки пробирки палочкой с тупым кончиком. Убедитесь, что выпавший осадок кристаллический – быстро оседает на дно пробирки.
Разделите содержимое пробирки на 4 части, перенеся 3 части капилляром в 3 чистые пробирки, и
– к 1-ой добавьте 5 капель воды и поставьте в горячую водяную баню – осадок растворился – почему?
• растворимость большинства веществ с повышением температуры увеличивается.
– ко 2-ой добавьте 5 капель 2М НСl – осадок растворился – почему?
• HCl – кислота более сильная, чем винная H2C4H4O6. Осадок растворяется,
KHC4H4O6 + HCl → H2C4H4O6 + KCl
так из-за образования более слабой кислоты H2C4H4O6 равновесие осадок ↔ раствор смещается вправо.
– к 3-ей добавьте 5 капель 2М CH3COOH – осадок не растворился – почему?
• CH3COOH более слабая кислота, чем H2C4H4O6.
– к 4-ой добавьте 5 капель 2 М KОН – осадок растворился – почему?
• в результате реакции
KHC4H4O6 + KOH → K2C4H4O6 + H2O,
образуется слабый электролит – H2O и равновесие осадок ↔ раствор смещается вправо.
Условия обнаружения иона К+:
а) достаточно большая концентрация К+ в растворе;
б) нейтральная или слабокислая (pH 4- 7) среда;
в) комнатная температура;
г) отсутствие иона NH4+.
4. Микрокристаллоскопическая реакция.
“Тройной нитрит”, Na2PbCu(NO2)6, реагент ярко-зеленого цвета, образует с ионом К+ черные кубические кристаллы. Для ускорения реакции можно добавить несколько кристалликов твердого NaNO2.
2 KCl + Na2PbCu(NO2)6 ↔ K2PbCu(NO2)6↓ + 2 NaCl
черный
Определению мешает NH4+, так как он образует аналогичные черные кубические кристаллы.
Выполнение реакции:
На предметное стекло поместите 1 каплю раствора KCl, на некотором расстоянии от нее 1 каплю раствора NH4Cl, подсушите на воздухе. К обеим каплям прибавьте по 1капле реагента. Рассмотрев под микроскопом края капель, убедитесь, что образовавшиеся кристаллы идентичны.
Рис.1. Кристаллы K2PbCu(NO2)6
Условия обнаружения иона К+: отсутствие иона NH4+.
5. Платинохлористводородная кислота H2[PtCl6]
Платинохлористводородная кислота H2[PtCl6] дает в достаточно концентрированных растворах солей калия желтый кристаллический осадок хлороплатината калия:
2К+ + [PtCl6]2- → К2[PtCl6]↓
желтый
Выполнение реакции:
В пробирку внесите 5 капель раствора КСl и 5 капель раствора реагента. Для ускорения реакции можно потереть стенки пробирки палочкой с тупым кончиком. Убедитесь, что выпавший осадок кристаллический – быстро оседает на дно пробирки.
Ион аммония дает аналогичный осадок.
6. Хлорная кислота HClO4 дает белый осадок перхлората калия:
К+ + ClO4— → КClO4↓
Белый
Выполнение реакции:
1-2 капли раствора соли калия помещают в пробирку, добавляют 3 капли хлорной кислоты. Наблюдают образование белого осадка.
7. Реакция окрашивания пламени.
Выполнение реакции:
Чистую нихромовую проволочку смочите раствором КСl и внесите в пламя горелки (не забудьте, горячая зона пламени находится в верхнем конусе). Пламя окрасится в фиолетовый цвет.
Мешает Na+, окрашивающий пламя в интенсивный желтый цвет, но если рассматривать окраску пламени через индиговую призму (темно-синее стекло), Na+ не мешает.
2.2 Реакции Na+-ионов
1. Реакция с цинкуранилацетатом (микрокристалоскопическая).
Цинкуранилацетат (раствор Zn(UO2)3(CH3COO)8 в разбавленной уксусной кислоте) образует с ионами натрия желтый осадок натрийцинкуранилацетата тетраэдрической и октаэдрической формы:
Na+ + Zn(UO2)3(CH3COO)8 + CH3COO— + 9H2O →
→ NaZn(UO2)3(CH3COO)9 *9H2O↓
Выполнение реакции:
На чистое и сухое предметное стекло помещают 1 каплю раствора хлорида натрия, 1 каплю воды и 1 каплю раствора цинкуранилацетата
Осторожно смешивают капли стеклянной палочкой и через 2-3 минуты рассматривают под микроскопом форму образовавшихся кристаллов, которые представляют собой правильные октаэдры или тетраэдры желтоватого цвета (рис.2).
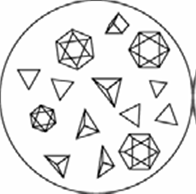

Рис.2. Кристаллы натрийцинкуранилацетата NaZn(UO2)3(CH3COO)9 *9H2O
Эта реакция специфична для ионов натрия, присутствие других катионов I и II аналитических групп не мешает его обнаружению.
2. Реакция с дигидроантимонатом калия.
Дигидроантимонат калия KH2SbO4 (кислая калиевая соль ортосурьмяной кислоты H3SbO4) дает с растворами солей натрия белый кристаллический осадок дигидроантимоната натрия:
Na+ + H2SbO4— → NaH2SbO4↓
Выполнение реакции:
Для выполнения реакции к 2-3 каплям раствора соли натрия нужно прибавить равный объем раствора реагента и потереть стенки пробирки стеклянной палочкой. Убеждаются в том, что осадок кристаллический (Важный признак NaH2SbO4! По выпадению аморфного осадка нельзя делать заключения о присутствии Na+ в растворе). Для этого раствор оставляют на некоторое время, чтобы осадок успел сформироваться, затем закрывают отверстие пробирки пробкой и переворачивают пробирку. На стенках будут заметны крупные кристаллы кубической формы.
При выполнении рассматриваемой реакции должны соблюдаться следующие условия:
а) достаточно большая концентрация соли натрия;
б) нейтральная реакция исследуемого раствора (рН ≈ 7);
в) ведение реакции на холоду, поскольку растворимость NaH2SbO4 сильно возрастает с повышением температуры.
г) отсутствие иона NH4+.
3. Реакция окрашивания пламени.
Выполнение реакции:
Чистую нихромовую проволочку смочите раствором NaCl и внесите в пламя горелки. Появится интенсивная, долго неисчезающая желтая окраска.
2.3 Реакции NH4+-ионов
1. Реакция со щелочью
Едкие щелочи (NaOH, KOH) выделяют из растворов солей аммония при нагревании газообразный аммиак:
NH4+ + OH— → NH3↑ + H2O
Выполнение реакции:
2-3 капли раствора соли аммония вносят в пробирку, осторожно, не касаясь стенок пробирки, добавляют 3-4 капли раствора NaOH или KOH, закрывают пробирку ватным тампоном и кладут сверху полоску универсальной индикаторной бумаги, смоченную дистиллированной водой.
Пробирку с полученной реакционной смесью нагревают на водяной бане, и выделяющийся аммиак обнаруживают по посинению универсальной индикаторной бумаги. Обнаружить аммиак можно также по запаху.
Реакция чувствительна, специфична и позволяет дробно обнаруживать ион аммония в присутствии катионов всех аналитических групп.
2. Реакция с реактивом Несслера.
Реактив Несслера (раствор K2[HgI4] в KOH) в присутствии NH4+-ионов образует характерный красно-бурый осадок:
NH4+ + 2[HgI4]2- + 4OH— → [NH2Hg2O] I↓ +7I— + 3H2O
Выполнение реакции:
1-2 капли раствора соли аммония помещают в пробирку, добавляют 5 капель воды и 2-3 капли реактива Несслера. Наблюдают образование красно-бурого осадка.
Проведению реакции мешают катионы других аналитических групп, образующие окрашенные осадки гидроксидов. Реакция очень чувствительная, однако, менее специфична, чем реакция со щелочью.
3. Отношение NH4+ к действию реагентов на К+ и Na+.
Изучив важнейшие качественные реакции NH4+, выясним как он относится к действию реагентов, применяемых при обнаружении К+ и Na+. Это необходимо для понимания систематического хода анализа смеси катионов I группы.
а) NaHC4H4O6, Na3[Co(NO2)6], Na2PbCu(NO2)6 дают с NH4+ соответствующие осадки, по виду неотличимые от осадков, образуемых К+. Убедитесь в этом на опыте (для выполнения реакции с NaHC4H4O6 следует брать достаточно концентрированный (насыщенный) раствор NH4Cl). Следовательно присутствие NH4+ мешает обнаружению К+.
б) KH2SbO4 при взаимодействии с растворами солей аммония вследствие присущей им (благодаря гидролизу) кислой реакции может выделить белый аморфный осадок HSbO3, образующийся по уравнениям:
NH4+ + Н2О → NH4OH + H+
KH2SbO4 + H+ → H3SbO4 + K+
H3SbO4 → HSbO3↓ + Н2О
Следовательно, присутствие NH4+ мешает также и обнаружению Na+ этой реакцией.
Однако, применяя микрокристаллоскопическую реакцию с цинкуранилацетатом, Na+ можно обнаружить в присутствии NH4+.
Вывод: ион NH4+ мешает обнаружению К+ и Na+, поэтому:
а) присутствие NH4+ в растворе следует установить, прежде чем приступить к обнаружению К+ и Na+;
б) если ион NH4+ обнаружен, он должен быть полностью удален из раствора.
Удаление иона NH4+
Способов удаления NH4+ много. Для удаления иона аммония обычно пользуются летучестью его солей при нагревании. Рассмотрим один из них, простой и надежный.
Анализируемый раствор досуха выпаривают в фарфоровой чашечке на
песочной бане, прибавляют 2-3 капли HNO3 (1:1) и вновь выпаривают досуха.
При повышенной температуре протекает реакция,
NH4NO3 → N2O + 2 H2O
в результате которой, NH4NO3 необратимо разлагается с образованием летучих продуктов – N2O и H2O.
Полагается проверить полноту протекания реакции. Для этого сухой остаток растворяют в небольшом количестве воды и, взяв каплю полученного раствора, выполняют реакцию обнаружения NH4+ с помощью реактива Несслера (см. ниже). Если реакция положительная, раствор в чашечке выпаривают досуха, обрабатывают cухой остаток HNO3 и вновь проверяют полноту удаления NH4+.
Лекция
4. Катионы
1-ой аналитической группы К+, Na+ NH4+
Общая характеристика катионов первой
аналитической группы
К
первой аналитической группе относятся катионы щелочных металлов — К+,
Na+ NH4+.
Большинство солей катионов 1-ой группы представляют собой кристаллические
порошки, хорошо растворимые в воде. Вследствие этого катионы 1-ой аналитической
группы не имеют группового реактива и их открывают с помощью специальных
дробных реакций. Открытию катионов 1-ой аналитической группы мешают катионы
других групп, поэтому при проведении качественного анализа из раствора сначала
необходимо удалить катионы других групп с помощью осадочных реакций.
Калий
и натрий образуют сильные основания КОН и NaОН. Их соли с сильными кислотами
типа соляной, серной, азотной в воде устойчивы и не подвергаются гидролизу.
Гидроксид аммония NH4ОН –
слабое основание, поэтому соли аммония с сильными кислотами в воде легко
гидролизуют. Соли аммония летучи и в отличие от солей щелочных металлов легко
удаляются при нагревании и прокаливании смесей солей. Эти свойством пользуются
при удалении из смеси солей аммония.
Катионы
1-ой аналитической группы широко распространены в природе, являясь важными
составными частями земной коры, океанов, морей, биосферы. Их соли получили
широкое распространение в химии, с.х. и т.д.
Применение в медицине и фармации солей
катионов 1-ой аналитической группы
Катионы
калия и натрия входят в состав протоплазмы, крови, тканей и органов растений и
животных. Поэтому их используют в медицине и фармации.
Хлорид
натрия входит в состав физиологических растворов, кровозаменителей, широко
применяется как вспомогательное средство при приготовлении таблеток, микстур.
Бромид натрия, бромид калия и бромид аммония часто применяют как средства,
действующие на нервную систему, регулирующие ее деятельность. Сульфат натрия
используют как слабительное средство.
Гидрокарбонат
натрия применяют при повышенной кислотности желудочного сока, вводят в состав
кровозаменяющих растворов, ряда лекарственных веществ для регуляции рН.
Гидроксид
аммония в виде 10% раствора используют при обморочных состояниях, как средство,
возбуждающее при вдыхании паров деятельность дыхательных центров, для мытья рук
в хирургической практике.
Хлорид
аммония применяют диуретическое и отхаркивающее средство.
Катионы
калия, натрия и аммония входят в состав многих лекарственных препаратов типа
кислот.
Реакции
катионов натрия Na+
1. Реакция с
дигидроантимонатом калия KH2SbO4
NaCl+ KH2SbO4→NaH2SbO4↓+KCl
Образуется белый мелкокристаллический
осадок дигидроантимоната натрия, растворимый в щелочах и кислотах. Проведению
реакции мешают соли лития.
2. Реакция с
цинкуранилацетатом HZn(UO2)3(CH3COO)9*9H2O:
Na++ HZn(UO2)3(CH3COO)9→NaZn(UO2)3(CH3COO)9↓+H+
Образуется
мелкокристаллический осадок цинкуранилацетата натрия. Осадок растворим в
щелочах и кислотах. Проведению реакции мешают соли лития.
3. Реакция
окрашивания пламени. При внесении солей натрия в пламя газовой горелки
появляется желтая окраска пламени.
Реакции
катионов калия К+
1. Реакция с
гидротартратом NaHC4H4O6:
KCl+ NaHC4H4O6→KHC4H4O6↓+NaCl
Образуется белый
мелкокристаллический осадок гидротартрата калия, растворимый в щелочах и
кислотах. Проведению реакции мешают катионы аммония
2. Реакция с гексанитро(3)
кобальтом натрия Na3[Co(NO2)6]
2KCl+ Na3[Co(NO2)6]→NaK2[Co(NO2)6]↓+3NaCl
Образующийся
осадок желтого цвета растворим в кислотах и щелочах. Проведению реакции мешают
катионы аммония.
3. Реакция с
гексанитро(3) купратом свинца и натрия Na2Pb[Cu(NO2)6]
2KCl+ Na2Pb[Cu(NO2)6]→K2Pb[Cu(NO2)6]↓+2NaCl
Образуется осадок
черного цвета, растворим в кислотах и щелочах.
4. Реакция
окрашивания пламени. При внесении солей калия в пламя окраска пламени
становится фиолетовой.
Реакции
катионов аммония NH4+
1. Реакция со
щелочами:
NH4Cl+NaOH→NH4OH+NaCl
NH4OH→NH3↑+H2O
При проведении
реакции вследствие разложения образующегося гидроксида аммония на аммиак и воду
появляется запах аммиака. Выделение аммиака можно определить с помощью красной
лакмусовой бумажки или фенолфталеиновой бумажки, смоченной водой. При выделении
аммиака лакмусовая бумажка изменяет цвет на синий,а фенолфталеиновая бумажка
краснеет.
2. Реакция с
гидротартратом
натрия.
NH4Cl+ NaHC4H4O6→(NH4)HC4H4O6↓+NaCl
Образуется белый
кристаллический осадок гидротартрата аммония, растворимый в щелочах и кислотах.
Проведению реакции мешают катионы калия.
3. Реакция с
реактивом Несслера (смесь тетрайодо(2) меркурата калия с гидроксидом калия ) K2[HgI4]+KOH:
Hg
NH4Cl+2K2[HgI4]+4KOH→[O
NH2]I+3H2O+KCl+7KI
Hg
Образуется
красно-бурый осадок, растворимый в кислотах и щелочах. Реакция очень
чувствительна и специфична.
4. Реакция с
гексанитро(3) кобальтом натрия Na3[Co(NO2)6]:
2NH4Cl+ Na3[Co(NO2)6]→
Na(NH4)2[Co(NO2)6]↓+2NaCl
Образуется осадок
желтого цвета, растворимый в кислотах и щелочах. Проведению реакции мешают
катионы калия.
5. Реакция с
гексанитро(3) купратом свинца и натрия Na2Pb[Cu(NO2)6]
2NH4++ Na2Pb[Cu(NO2)6]→(NH4)2Pb[Cu(NO2)6]↓+2Na+
Образуется осадок
черного цвета, растворим в кислотах и щелочах. Проведению реакции мешают
катионы калия.
6. Возгонка и
разложение аммониевых солей при нагревании. При нагревании соли аммония
способны возгоняться, образуя белые налеты на охлаждающем предмете.
Анализ
смеси катионов первой аналитической группы.
Смесь
солей, содержащих катионы 1-ой группы, растворяют в воде и проводят
качественные реакции. Ввиду того, что катионы калия и аммония дают одинаковые
реакции, сначала открывают ион аммония специфичными для него реакциями с
реактивом Несслера и со щелочами. В присутствии катиона аммония, калий открыть
нельзя, поэтому для того, чтобы открыть калий. Необходимо удалить катион
аммония. Удаление проводят, упаривая часть раствора и прокаливая осадок в
тигле. Охлаждают тигель и растворяют осадок в воде. Полноту удаления аммония
проверяют реактивом Несслера. Открытие катиона натрия осуществляют, используя
раствор цинкуранилацетата, получившиеся кристаллы рассматривают под микроскопом
Катион
калия открывают реакциями с гидротартратом натрия, гексанитро(3) кобальтом
натрия и гексанитро(3) купратом свинца и натрия.
Анализ катионов
При систематическом анализе принято деление катионов и анионов на аналитические группы. Наиболее удобная, применяемая и в настоящее время классификация катионов, разработана Н.А. Меншуткиным в 1871 г. Все существующие ныне классификации предусматривают разделение катионов на 5 или 6 аналитических групп на основании следующих их свойств:
1.На различии растворимости хлоридов, карбонатов, сульфатов или гидроксидов.
2. На амфотерных свойствах некоторых гидроксидов.
3. На способности ряда гидроксидов образовывать комплексные аммиакаты.
Классификация катионов на аналитические группы
| № | Катионы | Групповая
характеристика |
Групповой
реактив |
Получаемые
соединения |
| 1 | К+, Na+, NH4+,Mg2+ | Соли и гидроксиды растворимы в воде | ||
| 2 | Ca2+, Ba2+, Sr2+ | Карбонаты не растворимы в воде, но растворимы в кислотах. Сульфаты не растворимы в воде и в кислотах. | (NН4)2СО3 2н.
раствор |
СаСO3↓, ВаСОз↓, SrO3↓
Аморфные осадки белого цвета. |
| 3 | Al3+, Fe2+,Fe3+, Mn2+, Zn2+, Cr2+. | Сульфиды не растворимы в воде, но растворимы в кислотах. Гидроксиды не -растворимы в воде, но могут растворятся в кислотах | (NH4)2S 6н.
раствор |
FeS↓, Fе2S3↓- черные, MnS↓-розоватый, ZnS↓- белый, Аl(ОН)3↓- белый, Сr(ОН)3↓-серо-зеленый. |
| 4 | Ag+, Pb2+, Hg22+ | Хлориды не растворимы в воде. | НСl 2н. раствор | AgCl↓, PbC12↓, Hg2C12↓- осадки белого цвета. |
| 5 | Сu2+, Co2+, Ni2+,Cd2+, Bi3+ | Гидроксиды и основные соли не растворимы в воде, но растворимы в избытке аммиака. | NH4ОH 2н. раствор в избытке | Раствор Сu(NН3)42+— синий, Со(NН3)42+— грязно-желтый, Ni(NН3)42+ — синий, Сd(NН3)42+ — бесцветный, Вi(0Н)2Сl↓ — белый. |
| 6 | Sn2+, Sn4+, Sb3+,
Sb5+, (Аs3+, As5+) |
Гидроксиды амфотерны. Сульфиды нерастворимы в воде, но растворимы в cульфидах Na, К и аммония. | NaOH, КОН, NH40H, 3н. растворы | H4Sn04↓, Sn(ОН)2↓, НSb02↓, НSbО3↓- белые осадки, растворимые в избытке щелочей. |
Первая аналитическая группа катионов: К+, Na+, NН4+, Mg2+
Почти все соли калия, натрия, аммония и большинство солей магния хорошо растворимы в воде. Поэтому группового реактива, осаждающего все четыре катиона, нет.
Калий и натрий относятся к 1 группе периодической системы элементов и образуют сильные щелочи. Гидроксид аммония является слабым основанием, но катион аммония близок по свойствам к катиону калия и образует несколько аналогичных малорастворимых солей. Соли аммония разлагаются при нагревании и могут быть удалены прокаливанием. Гидроксид магния — слабое основание, плохо растворимое в воде. Труднорастворимы также фосфат магния и карбонат. Гидроксокарбонат магния растворяется в избытке солей аммония и при действии карбонатом аммония в присутствии хлорида аммония в осадок не выпадает. Поэтому при систематическом анализе ион магния остается в растворе с катионами 1 группы. По этой причине он и отнесен к этой группе.
При систематическом анализе катионы калия, натрия и магния обнаруживают в последнюю очередь, так как катионы других групп мешают их обнаружению и должны быть удалены. В водных растворах катионы 1 группы бесцветны, образуемые ими соли имеют окраску только в тех случаях, когда в их состав входят окрашенные анионы, например: перманганат, хромат или дихромат -ионы.
Катионы 1 аналитической группы содержатся в почвах как в подвижном, доступном для усвоения растениями состоянии, так и в связанном. Они вносятся в почву в виде минеральных удобрений. Калий в виде -калийной селитры, сульфата, хлорида и других солей. Натрий — составная часть чилийской селитры (NаNО3). Магний входит в состав доломита СаСОЗ•МgСО3 . Ион аммония содержится в аммонийной селитре, сульфате и хлориде аммония, в аммофосе NH4H2PО4 и диаммофосе (NН4)2HPО4.
Ионы калия, магния, аммония необходимы для минерального питания растений. Большое содержание солей натрия указывает на засоленность почв.
Анализ водных вытяжек из почвы на наличие этих катионов используют для определения пригодности почв для возделывания различных культур.
Оценка качества природных вод включает пробы на присутствие ионов аммония. Наличие в воде аммиака и солей аммония служит признаком загрязненности, так как эти соединения образуются при гниении белков.
Продукты детского и диетического питания также подвергаются обязательному исследованию на содержание натрия, калия и магния.
Вторая аналитическая группа катионов: Ca2+, Ba2+, Sr2+
Катионы 2 группы, в отличии от катионов 1 группы, образуют малорастворимые в воде карбонаты. Поэтому их осаждают действием карбоната аммония, который является групповым реактивом.
Осадки карбонатов кальция, бария и стронция могут быть получены и при действии на раствор карбонатами натрия и калия. Но при систематическом анализе пользоваться этими реактивами невозможно, так как вместе с ними в исследуемый раствор вводятся ионы Na+ и К+. Использование карбоната аммония оправдано тем, что ион NH4+ можно предварительно открыть дробным методом.
Из солей кальция, бария и стронция также не растворимы сульфаты, фосфаты и оксалаты. Однако осаждение серной кислотой проводится редко, так как сульфаты не растворимы в сильных кислотах и щелочах и с большим трудом снова переводятся в раствор. Осаждение фосфорной и щавелевой кислотой не проводят по той причине, что присутствие в растворе фосфат — и оксалат -ионов усложняет анализ.
Сульфиды этих элементов, в отличие от катионов 3,4 и 5 групп, хорошо растворимы в воде.
В водных растворах катионы 2 группы бесцветны.
Соли кальция используют для улучшения почв: в сильно кислые почвы для нейтрализации вводят известняк СаСО3; а в солонцеватые — гипс CaS04•2H2O. Кальций входит в состав минеральных удобрений: фосфоритной муки Са3(РО4)2, суперфосфата Са(Н2РО4)2 + CaS04, кальциевой селитры Са(НСО3)2 и т.д.
Растворимый гидрокарбонат кальция Са(НСО3)2 находится в природных водах, сообщая им временную жесткость. Арсенит и арсенат кальция используют как сельскохозяйственные яды.
Ионы бария ядовиты. Карбонат и хлорид бария используют в сельском хозяйстве как яды. Поэтому обнаружение ионов бария проводят при распознавании ядохимикатов.
Радиоактивный изотоп стронция 90Sr, образующийся при ядерных реакциях, представляет большую опасность для здоровья и жизни.
Реакции катионов второй группы
| Реактивы | Катионы | ||
| Са2+ | Ba2+ | Sr2+ | |
| (NH4 )2СО3, Nа2СО3, К2СО3 | СаСО3↓ белый | ВаСО3↓ белый | SrСО3↓ белый |
| Na2HP04 | СаНРО4↓ белый | ВаНРО4↓ белый | SrHP04↓ белый |
| (NH4)2C204 | СаС2Н4↓ белый | ВаС2О4↓ белый | SrC204↓ белый |
| H2S04 и растворимые сульфаты | CaS04↓ белый | BaS04↓ белый | SrS04↓ белый |
| К4[Fe(CN)6]+NH4Cl | Ca(NH4)2 [Fe(CN)6] ↓
белый |
Ba(NH4)2•Fe(CN)6]↓, белый | ──── |
| CaS04 | BaS04↓ выпадает сразу | SrS04↓
выпадает не сразу |
|
| К2Сr207 | ВаСrО4↓ желтый | ───── | |
| Окрашивание
пламени |
Кирпично- красное | Желто-зеленое | Карминово-красное |
Катионы третьей аналитической группы: Al3+, Fe2+, Fe3+, Mn2+, Zn2+, Cr2+
К третьей аналитической группе относят катионы алюминия, железа(II), железа(III), марганца (II), цинка, хрома(III). Они характеризуются большим разнообразием свойств.
Алюминий и цинк проявляют постоянную валентность. Гидроксиды этих элементов и хрома обладают амфотерными свойствами; это свойство используется для отделения алюминия, хрома и цинка от других катионов третьей аналитической группы. Алюминий образует ионы АI3+ и АlО2-, цинк — ионы Zn2+ и ZnO22-, хром ионы Сr3+ и СrО2—.
Железо, марганец и хром проявляют переменную валентность. Железо образует ионы Fe2+, Fe3+, FeO42-, марганец — ионы Mn2+, Mn3+, Mn4+, MnО42- и MnO4—, хром ионы Cr3+, CrO42-, Cr2072-.
Изменение валентности этих элементов осуществляется сравнительно легко, поэтому для них характерны окислительно-восстановительные реакции.
Гидроксиды железа и марганца обладают слабоосновными свойствами, растворяются в кислотах, но не растворяются в щелочах. Гидроксиды всех катионов третьей группы не растворимы в воде, но могут переходить в коллоидное состояние.
Соли большинства элементов этой группы образуют окрашенные растворы.
Окраска растворов солей элементов третьей аналитической группы
| Ион | А13+, Zn2+ | Cr3+ | СrО42- | Сr2О72- | Fe3+ | Fe2+ | Mn2+ | MnO4— | МnО42- |
| Окраска раствора | Бесцвет-ная | Зеленая или фио-летовая | Желтая | Оранже-вая | Красно-
бурая |
Бледно-
зеленая |
Бледно-розовая | Малиново-
фиолетовая |
Зеленая |
Катионы третьей аналитической группы образуют сульфиды, нерастворимые в воде, но растворимые в кислотах. В отличие от них сульфиды первой и второй группы растворимы в воде, а сульфиды четвертой и пятой группы катионов нерастворимы в кислотах. Поэтому в качестве группового реактива используют сульфид аммония. Другие растворимые сульфиды, так же осаждающие катионы третьей группы, не могут быть использованы как групповой реактив, так как с ними в раствор будут введены катионы первой и второй групп. Присутствие катиона аммония в ходе систематического анализа определяется до введения сульфида аммония, а в дальнейшем катион аммония легко удаляется из раствора в виде аммиака. Катионы третьей группы в зависимости от воздействия на них гидр оксида аммония в присутствии хлорида аммония подразделяют на две подгруппы:
1 подгруппа:
катионы аллюминия, хрома(III), железа (III), осаждаемые водным аммиаком в присутствии хлорида аммония.
2 подгруппа:
катионы железа(II), марганца(II), цинка не осаждаемые таким образом.
Катионы третьей группы, подобно катионам второй группы и магния, образуют труднорастворимые карбонаты и гидрофосфаты. Кроме того, они обладают способностью образовывать комплексные соединения.
Обнаружение и количественное определение катионов третьей группы связано главным образом с анализом почв, микроудобрений, растительного и животного материала, продовольственного сырья и продуктов питания (особенно детских и диетических), так как эти катионы имеют важнейшее биологическое значение.
Алюминий в больших количествах содержится в кислых подзолистых почвах, снижая урожайность многих культур. Соли алюминия применяют для очистки природных вод.
Железо содержится в тканях всех растений и животных. Оно входит в состав гемоглобина крови животных, участвует в синтезе хлорофилла зеленых растений. При недостатке железа в почве у растений развивается хлороз, т.е. отсутствие зеленой окраски из-за пониженного содержания хлорофилла. Избыток железа в почве так же вреден для растений. Многие соли железа (лактат, сульфат, глицерофосфат) применяют в ветеринарии как антианемические средства.
Марганец, цинк, хром — микроэлементы, необходимые для нормального течения обменных процессов у растений и животных. Недостаток марганца в почве способствует развитию у них различных заболеваний; в крови — приводит к возникновению „марганцевого рахита”. Нехватка цинка ведет к нарушению синтеза хлорофилла, витаминов, ауксинов у растений, витаминов и ферментов у животных и человека.
Избыток цинка в почвах, продуктах питания, сырье является токсичным для человека, животных и растений. Согласно гигиеническим нормативам качества и безопасности продовольственных продуктов и сырья предельно допускаемое содержание цинка: в мясе- 70,0 мг/кг., в молоке — 5,0 мг/кг., в яйце-50,0 мг/кг.
Реакции катионов третьей группы
| Реактивы | Катионы | |||||
| A13+ | Cr3+ | Fe3+ | Fe2+ | Mn2+ | Zn2+ | |
| (NH4)2S в щелочной среде | Аl(ОН)3 | Сr(ОН)3↓ | ↓Fе2S3 | ↓FeS | ↓MnS | ↓ZnS |
| NaOH, КОН, NН4ОH | АI(ОН)3 | Сr(ОН)3↓ | ↓Fе(ОН)3 | ↓Fе(ОН)2 | ↓Мn(OН)2 | ↓Zn(ОН)2 |
| NaOH, КОН | Р-р А102— | Р-р Cr02— | ↓Fе(ОН)3 | ↓Fе(ОН)2 | ↓Мn(ОН)2 | р-р ZnО22- |
| NH4Cl в щел. среде | ↓Аl(ОН)3 | ↓Сr(ОН)3 | ↓Fе(ОН)3 | |||
| Na2HP04 | ↓AlP04 | ↓CrPО4 | ↓FePО4 | ↓Fе3(РО4) | ↓Мn3(РО4) | ↓Zn3(РО4) |
| K4[Fe(CN)6] | ↓Fe4[Fe(CN)6]3 | ↓Fe2[Fe(CN)6] | ↓Мn2[Fе(CN)6] | ↓К2Zn3[Fе(CN)6]2 | ||
| К3[Fе(СN)6] | ↓Fe3[Fe(CN)6] | ↓Мn3[Fе(CN)6]2 | Zn3[Fе(CN)6]2 | |||
| KCNS | Fе(СNS)3 | |||||
| Алюминон | Красный | Красный | Красный | |||
| (NH4)2S208 | Cr2072- р-р | МnО4— р-р | ||||
| Дитизон | Красный | |||||
| Cо(NО3)2 | CoZn02 | |||||
| Н2О2 в щелочной среде | Cr204 р-р | Fе(ОН)3 |
Катионы четвертой аналитической группы: Ag+, Pb2+,Hg22+
Четвертая аналитическая группа объединяет катионы серебра, свинца, и ртути(I). Общим свойством этих катионов является способность осаждаться под действием разбавленной соляной кислоты и ее солей в виде хлоридов-осадков белого цвета. Поэтому соляная кислота является групповым реактивом для катионов этой группы.
Кроме того, катионы четвертой аналитической группы образуют нерастворимые сульфиды черного цвета, которые в отличие от катионов 5 группы, не растворяются в сульфидах натрия, калия, аммония. Мало растворимы в воде также фосфаты и карбонаты катионов четвертой группы. Растворимые соли подвергаются гидролизу и их растворы имеют кислую реакцию. В окислительно-восстановительных реакция катионы четвертой группы выступают в роли окислителей и восстанавливаются до свободных металлов. В водных растворах катионы серебра, свинца и ртути (I) бесцветны.
Соединения ртути (I) содержат группировку -Нg-Hg-, в которой одна из двух связей каждого атома ртути используется на соединения с другим. Соли ртути(I) имеют строение CI-Hg — Hg-Cl или O3N-Hg — Hg-NO3. В этих соединениях на два атома ртути приходится два положительных заряда. Ртуть в этих соединениях является электрохимически одновалентной. При диссоциации этих соединений образуется сложный ион Hg22+.
Соединения катионов четвертой группы имеют важное биологическое значение. Ионы серебра обладают бактерицидным действием. Нитрат серебра применяют в медицине и ветеринарии при эрозиях, язвах, экземах, а также в офтальмологии и стоматологии. Металлическая ртуть и большинство ее соединений очень ядовиты. Наиболее токсичны для животных и человека: хлорид (сулема) и йодид ртути (II) и органические ртутные препараты, применяемые для протравливания семян: гранозан, этилмеркурхлорид, этилмеркурфосфат. Эти соединения нарушают углеводный и кальциевый обмен, функции почек, печени, эндокринных желез, центральной нервной системы вследствие блокады сульфгидрильных групп ферментов. Хлорид ртути (I) или каломель (Hg2CI2) не ядовита и используется в медицине и ветеринарии как слабительное, антисептическое и мочегонное средство.
Соединения свинца также ядовиты. К наиболее токсичным относятся нитрат, ацетат и гидроксохлорид свинца, а так же тетраэтилсвинец. Загрязнение воздуха, почвы и воды соединениями свинца происходит в результате выброса их промышленными предприятиями, выхлопными газами автотранспорта. В соответствии с санитарными нормами содержание свинца в 1 л воды не должно превышать 0.1 мг. В основных сельскохозяйственных продуктах допускается следующее содержание свинца и ртути:
Гигиенические нормативы содержания свинца и ртути в основных продовольственных продуктах, (в мг/кг)
| Мясо | Молоко | Яйца | |
| Свинец | 0,5 | 0,1 | 0.3 |
| Ртуть | 0,03 | 0,005 | 0,02 |
Ацетат свинца и оксид свинца используются в медицине, ветеринарии как вяжущие и противовоспалительные средства в форме примочек, компрессов, мазей и пластырей.
Реакции катионов четвертой группы
| Реактивы | Катионы | |||
| Ag+ | Pb2+ | Нg22+ | ||
| HCl и хлориды | AgCl↓ — белый,
растворимый в NH4ОH |
PbC12↓- белый, растворимый в горячей воде | Hg2C12↓ — белый,
чернеющий в NH4ОH |
|
| KOH, NaOH | Аg2O↓ — бурый | Pb(OH)2↓- белый, растворимый в кислотах и избытке щелочей. | Hg2О↓- черный | |
| NH40H (избыток) | [Аg(NН3)2]+ раствор | Рb(ОН)↓-белый | (NН2Нg)NО3↓- белый + ↓Hg | |
| K2Cr04 | Аg2СrО4↓ кирпично- красный | PbCr04↓ — желтый | Hg2CrО4↓ — красный | |
| H2S04 | ───── | PbS04↓ — белый | ───── | |
| Na2HP04 | Аg3РО4↓ — желтый | ───── | ───── | |
| НI, (KI) | AgI↓- желтый | РbI2↓- желтый, растворимый в горячей воде, NaOH, избытке КI | Hg2I2↓- грязно-зеленый,
растворимый в избытке КI |
|
| Сu металлич. | ───── | ───── | Hg↓ |
Пятая аналитическая группа катионов: Cu2+, Co2+, Ni2+, Cd2+, Bi3+
Катионы пятой группы образуют нерастворимые в воде сульфиды, гидроксиды и основные соли. Гидроксид аммония, который используется как групповой реактив, образует с катионами пятой группы, ярко окрашенные основные соли, которые, кроме солей висмута, растворимы в избытке аммиака. Образующиеся при этом комплексные соли — аммиакаты, также имеют характерную окраску.
Катионы меди, кадмия и висмута, кроме того, образуют комплексные соединения с цианидами и йодидами. В реакциях окисления-восстановления катионы пятой группы ведут себя как окислители и восстанавливаются до свободных металлов.
В водных растворах почти все катионы пятой группы окрашены.
Окраска растворов солей катионов пятой аналитической группы
| Ион | Cu2+ | Co2+ | Ni2+ | Cd2+ | Bi3+ |
| Окраска
раствора |
голубая | розовая | зеленая | бесцветная | бесцветная |
Объектом качественного анализа на присутствие катионов меди, кобальта, никеля, кадмия и висмута являются удобрения, почвы, растения, биологические жидкости, сельскохозяйственное сырье, продовольственные продукты. Медь входит в состав удобрений и сельскохозяйственных ядов, например: медного купороса, парижской зелени Сu(СН3СОО)23Сu(АsО2)2, бордосской жидкости. Медь необходима для нормальной жизнедеятельности растений и животных, так как входит в состав ферментов, влияет на белковый и углеводный обмен. Сульфат и карбонат меди используют в ветеринарии как антгельминтики. Медь отнесена к токсичным элементам. Предельно допустимое содержание меди в некоторых продуктах питания приведено в таблице N29. Кобальт входит в состав витамина В12. Пониженное содержание этого микроэлемента в почвах, растениях, кормах и пищевых продуктах отрицательно сказывается на росте сельскохозяйственных культур, продуктивности животных и развитии человека. Избыточное содержание кобальта, как и меди, и кадмия считается токсичным.
Гигиенические нормативы содержания меди и кадмия в основных продовольственных продуктах, (в мг/кг)
| Мясо | Молоко | Яйца | |
| Медь | 5.0 | 1.0 | 3.0 |
| Кадмий | 0.05 | 0.03 | 0.01 |
Шестая аналитическая группа катионов: Sn2+, Sn4+, Sb3+, Sb5+, As3+, As5+
Олово, мышьяк и сурьма расположены в 4-5 группах периодической системы и обладают неметаллическими свойствами. В то же время положение этих элементов в 4-5 периодах также отражается на их свойствах и позволяет в некоторых реакциях давать соединения, характерные для металлов. В частности, сурьма, мышьяк, и олово образуют амфотерные гидроксиды. В щелочной среде эти гидроксиды диссоциируют с образованием анионов: AsO33-, АsО43-, SbO43-, SbО33-,SnО33-. В кислой среде образуются катионы : АsЗ+, As5+, Sn2+, Sn4+, Sb3+, Sb5+. Растворы солей этих катионов, образованных сильными кислотами, имеют кислую реакцию.
Мышьяк /III/, сурьма/III/ и олово /III/ в щелочной среде ведут себя как восстановители. Мышьяк /V/, cурьма /V/ в кислой среде проявляют свойства окислителей.
Характерной реакцией для катионов 6 группы является образование нерастворимых в воде сульфидов при взаимодействии с сероводородом в кислой среде. Сульфиды катионов 6 группы растворяются в сульфидах натрия, калия, аммония, образуя сульфосоли (тиосоли). Например:
↓Аs2S3 + ЗNа2S = 2Nа3АsS3 тиомышьяковский натрий.
Сульфосоли по своему составу подобны кислородосодержащим кислотам тех же элементов с той разницей, что роль кислорода здесь играет элемент, ему аналогичный — сера.
Использование сероводорода в качестве группового реактива сопряжено с многочисленными трудностями.
Бессероводородный метод качественного анализа предусматривает осаждение катионов 6 группы (олова и сурьмы) едкими щелочами. При этом образуются соединения нерастворимые в воде, обладающие способностью растворяться в избытке щелочей.
В водных растворах сурьма образует ионы SbЗ+, Sb5+, олово Sn2+, Sn4+, мышьяк АsЗ+, ( в кислой среде); арсенит ион AsO33- и арсенат-ион AsO43- (в щелочной среде). Все эти ионы бесцветны. Соединения мышьяка сильно ядовиты. Мышьяк входит в состав сельскохозяйственных ядов: парижской зелени Сu(СН3СОО)23Сu(АsО2)2, арсенита натрия, арсенита и арсената кальция. У животных и человека при попадании больших доз мышьяка внутрь наблюдаются острые отравления, сопровождающиеся сильной болезненностью органов брюшной полости, коликами, рвотой, поносом, слюнотечением, ослаблением сердечной деятельности, резким падением кровяного давления, параличом.
В ветеринарии соединения мышьяка применяют в качестве противопаразитарных средств и веществ, улучшающих обмен (осарсол, новарсенол, натрия арсенат).
Продовольственные продукты и сельскохозяйственное сырье подлежат обязательному анализу на присутствие мышьяка. Предельно допустимое содержание мышьяка составляет: в мясе- 0.1 мг/кг, в молоке- 0.05 мг/кг, в яйце — 0.1 мг/кг.
Биологическая роль сурьмы и олова выяснена недостаточно. В ветеринарии используют сульфиты сурьмы /III/ и /V/ в качестве отхаркивающих средств, арсенат олова как антгельминтик.
Первая группа катионов
Хорошая растворимость
большинства солей натрия, калия, аммония
обуславливает отсутствие для них общих
реакций с групповым реагентом. Нерастворимы
только те соли, в которые входят крупные
анионы, типа гексанитрокобальта (III),
уранилацетата и другие. Все соли этих
металлов и катиона аммония бесцветны,
если они не являются производными
окрашенных анионов. Наиболее характерное
свойство атомов щелочных металлов –
лёгкость возбуждения свечения. Их
летучие соединения окрашивают пламя в
характерный цвет: натрий даёт жёлтую
окраску, калий – фиолетовую.
Реакции
катиона КАЛИЯ
1. Реакция с гидротартратом натрия.
Гидротартрат
натрия NaHC4H4O6
и винная кислота H2C4H4O6
образуют с солями калия белый
мелкокристаллический осадок:
K+
+ HC4H4O6–
= ↓ KHC4H4O6
Осадок растворим
в горячей воде, сильных кислотах и
щелочах, нерастворим в уксусной кислоте,
поэтому реакцию проводят на холоду, в
нейтральном или слабокислом растворе
(рН 5-7). В случае применения винной кислоты
для предотвращения растворения осадка
выделяющиеся ионы водорода связывают
добавлением ацетата натрия:
K+
+ H2C4H4O6
= ↓ KHC4H4O6
+ Н+;
Н+
+ СН3СОО–
СН3СООН
Образование осадка
можно ускорить, создавая центры
кристаллизации.
В ы п о л н е н и е
р е а к ц и и. К трём каплям раствора соли
калия прибавить равный объём раствора
NaHC4H4O6.
Если осадок выпадает не сразу, то
перемешать содержимое пробирки стеклянной
палочкой и слегка потереть ею о стенки
пробирки. Изучить действие на осадок
нагревания, НCl,
NaOH
и СН3СООН.
Результаты занести в таблицу.
2. Реакция с гексанитрокобальтатом (III) натрия.
Na3[Co(NO2)6]
с растворами солей калия при рН 4-5
образует жёлтый кристаллический осадок
двойной соли гексанитрокобальтат (III)
калия-натрия по уравнению:
2K+
+ Na+
+ [Co(NO2)6]3–
= ↓K2Na[Co(NO2)6].
Раствор реагента
Na3[Co(NO2)6]
должен быть свежеприготовленным, так
как при стоянии он разрушается. Реакция
имеет более низкий предел обнаружения,
чем предыдущая. Осадок растворим в
сильных кислотах, разлагается при
действии щелочей с образованием
тёмно-бурого осадка:
↓K2Na[Co(NO2)6]
+ 12Н+
=
2K+
+ Na+
+ Co2+
+ 3NO2
+ 3H2O
+ 3NO;
↓K2Na[Co(NO2)6]
+ 3OH–
= ↓Co(OH)3
+ 6NO2–
+ 2K+
+ Na+
Ионы натрия
проведению реакции не мешают. Ионы
аммония образуют аналогичный жёлтый
осадок. Катионы других аналитических
групп также мешают открытию катионов
калия этой реакцией.
В ы п о л н е н и е
р е а к ц и и. К 2-3 каплям раствора соли
калия добавить 2-3 капли разбавленного
раствора уксусной кислоты до рН 4-5 и 2-3
капли реагента. Наблюдать образование
жёлтого осадка. Изучить действие HCl,
CH3COOH,
NaOH.
Результаты наблюдений и уравнения
реакций занести в таблицу.
3. Окрашивание пламени.
Летучие соли калия
(KCl,
KNO3)
окрашивают бесцветное пламя горелки в
фиолетовый цвет. В присутствии даже
небольших количеств натрия фиолетовый
цвет маскируется жёлтым, поэтому
наблюдать надо через синее стекло,
поглощающее жёлтую окраску.
Реакции
катиона НАТРИЯ
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

