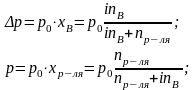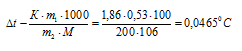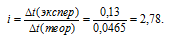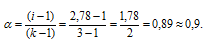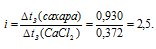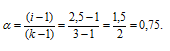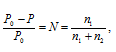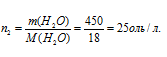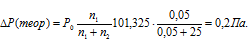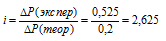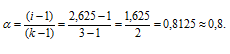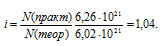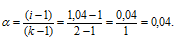Кажущаяся степень диссоциации,формула
(Здравствуйте уважаемый читатель.Наше настоятельное пожелание-посетите главную страницу сайта.)
Электрическая проводимость растворов связывается с наличием в них подвижных заряженных частиц-ионов.Объяснение этому даёт теория электролитической диссоциации предложенная
С.Аррениусом.Аррениус пришел к выводу,что в растворе в отсутствии электрического тока существует равновесие между активной частью электролита,возникающей в результате его диссоциации на ионы,способные переносить электрический ток,и недиссоциированной неактивной частью,не проводящей тока.Эта разница приводит к понятию кажущаяся степень диссоциации,формула (см.ниже,2.)
Степень диссоциации α равна отношению числа молекул,распавшихся на ионы,к общему числу молекул растворенного вещества.
Для электролита,диссоциирующего на два иона, например
HF(p-p)↔H+(p-p)+F-(p-p)
при общей аналитической молярной концентрации фтороводорода,равной C,степень диссоциации α равна
α=Ch+/Cf-/C
Понятие степени электролитической диссоциации дало возможность разделить электролиты на слабые и сильные,но это несколько условно,так как степень диссоциации зависит от концентрации.Сильные электролиты практически полностью диссоциируют в растворе,степень их диссоциации близка к единице.В случае слабых электролитов степень диссоциации мала-существенно меньше единицы.Условно принято относить к слабым электролиты с α меньше 5% при концентрации около 0,1 моль/л,к сильным — с α больше 30%,а между ними-электролиты средней силы.
2.Так как у сильных электролитов степень диссоциации α приближается к единице,но не равна ей,то появляется понятие кажущаяся степень диссоциации,формула.
К сильным электролитам принадлежат твердые вещества с ионной кристаллической решёткой(гидроксиды щелочных металлов,большинство солей),вещества ,состоящие из молекул с полярной ковалентной связью-HCL,H2SO4,HNO3,HCLO4,в процессе растворения которых под воздействием растворителя образуются ионы.
К слабым электролитам принадлежат органические кислоты(HCOOH,CH3COOH и т.д),некоторые неорганические кислоты,например HCN,и основания (NH3,Zn(OH)2 и др.).Промежуточный тип электролита азотистая кислота HNO2 и др.
Кажущаяся степень диссоциации. Изотонический коэффициент. Законы Рауля и Вант-Гоффа для растворов электролитов.
Все
свойства раствора электролита, зависящие
от концентрации
ионов, проявляются так, как если бы число
ионов в растворе было меньше, чем это
соответствует полной диссоциации
электролита.
В
связи с этим, определяемое по электрической
проводимости
(или другими методами) значение степени
диссоциации сильных
электролитов называется кажущейся
степенью диссоциации
(αкаж<1).
Отношение числа ионных частиц в растворе
электролита, полученное по данным
электропроводности и меньшее их истинного
значения, к общему числу молекул
электролита, введенных в раствор,
называется изотоническим коэффициентом
и обозначается i:
i=число
ионов в р-ре + число недиссоциированных
молекулчисло молекул электролита,
введённых в р-р.
Изотонический коэффициент связан с
кажущейся степенью диссоциации сильного
электролита соотношением:
i=(nαk+n-nα)/n=α(k-1)+1,
где
n-
число молекул электролита, введенных
в раствор; nα-
число молекул в растворе, которые
продиссоциировали на ионы;
n-nα
– число оставшихся недиссоциированных
молекул (или число ассоциатов);
nαk-число
ионов в растворе.
Отсюда
α
= i-1k-1
где k
– суммарное число ионов, на которые
диссоциирует одна молекула электролита.
Для
NaCl-k
=2 (Na= Na++Cl—),
CaCl2-k=3
(CaCl2=Ca2++2
Cl—)
, Al2(SO4)3-k
=5 (Al2(SO4)3=
2 Al3++3
SO42-)
и
т.д.
Аррениус
обратил внимание
на тесную связь между способностью
растворов солей, кислот
и оснований проводить электрический
ток и отклонениями растворов
этих веществ от законов Вант-Гоффа и
Рауля. Он показал,
что по электрической проводимости
раствора можно рассчитать
его осмотическое давление, а следовательно,
и поправочный коэффициент i.
Значения
i,
вычисленные
им из электрической проводимости
хорошо совпали с величинами, найденными
для тех же растворов
иными методами.
Причиной
чрезмерно высокого осмотического
давления растворов электролитов
является диссоциация электролитов
на ионы. Вследствие этого, с одной
стороны, увеличивается
общее число частиц в растворе, а
следовательно, возрастают осмотическое
давление, понижение давления пара и
изменения температур
кипения и замерзания, с другой, — ионы
обусловливают
способность раствора проводить
электрический ток.
Поскольку
физико-химические свойства растворов
зависят от концентрации частиц
растворенного
вещества, в расчетные формулы
физико-химических свойств электролитов
вводится изотонический коэффициент,
позволяющий учесть диссоциацию молекул.
Законы
Рауля и Вант-Гоффа для растворов
электролитов.
π
= iCBRT
Δtзам.
= iKTCm(B);
Δtкип.
= iЭТСm(B)
Ионное произведение воды. РН растворов. Произведение растворимости.
Вода
является слабым электролитом, поэтому
справедливо равновесие H2O
<=> H+
+ OH—.
K
H2O
= [H+]
x [OH—]
[H2O].
K
H2O
x [H2O]
= const = Kw
= [H+]
x [OH—]
= 1 x 10-14
при
25С.
Kw
– ионное произведение воды, она не
зависит от концентрации водорода и
группы ОН. Кислотность р-ра выражают в
единицах рН. шкала рН, как правило,
изменяется от 1 до 14. Если рН=7, то
концентрация ионов [H+]
= [OH—]
= 10-7
мольл и такая среда называется
нейтральной. Если 0<рН<7, то среда
называется кислой, если рН>7, то среда
называется щелочной. рН измеряется
приборным методом (прибор называется
рН-метр) или визуально по окраске
индикаторной бумаги. Все оттенки красного
на индикаторной бумаге говорят о кислой
среде, все оттенки зелёного и синего
говорят о щелочной среде. В нейтральной
среде универсальная индикаторная бумага
имеет жёлтый цвет. Как рассчитывать: рН
= -lgCH+
pOH
= -lgCOH—
pH
+ pOH
= 14
Произведение
растворимости (ПР). ПР – это произведение
концентрций ионов электролитав его
насыщенном растворе. Пример: MgF2
MgF2(k)
<=> MgF2(ж)
<=> Mg2+
+ 2F—
В задачах на ПР ионы магния и фтора (к
примеру) находятся в равновесии с твёрдой
фазой. ПР MgF2
= [Mg2+]
x
[F—]2.
Стехиометрические индексы в формуле
входят в показатели степени. Пример:
определить произведение растворимости
MgF2,
если его растворимость в воде равна
1,17 х 10-3
мольл. 1)
MgF2(k)
<=> Mg2+
+ 2F—
2)ПРMgF2
= [Mg2+]
x
[F—]2
= (1,17 х 10-3)
x
(2 x1,17
х 10-3
)2
мольл. Если в задачах на ПР известно
численное значение растворимости, то
она равна концентрации того иона, который
образуется при диссоциации один.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Решение задач по химии на вычисление кажущейся степени диссоциации кислоты и соли
Задача 518.
Раствор, содержащий 0,53 г карбоната натрия в 200 г воды, кристаллизуется при -0,13°С. Вычислить кажущуюся степень диссоциации соли.
Решение:
M(Na2CO3) = 106 г/моль.
Теперь определим понижение температуры кристаллизации 
Здесь m1 — масса растворённого вещества, m2 — масса раствора, М – молярная масса растворённого вещества, К – криоскопическая константа.
Сравнивая найденное значение 

Рассчитаем кажущуюся степень диссоциации (
Здесь K — общее число ионов, образующихся при диссоциации электролита.
Ответ: 0,9.
Задача 519.
В равных количествах воды растворено в одном случае 0,5 моля сахара, а в другом — 0,2 моля СаСI2. Температуры кристаллизации обоих растворов одинаковы. Определить кажущуюся степень диссоциации СаСI2.
Решение:
Из уравнения 



Теперь, учитывая, что температуры кристаллизации обоих растворов одинаковы и, сравнивая найденные значения 
Рассчитаем кажущуюся степень диссоциации (
здесь K — общее число ионов, образующихся при диссоциации электролита.
Ответ: 0,9.
Задача 520.
При 100°С давление пара раствора, содержащего 0,05 моля сульфата натрия в 450 г воды, равно 100,8 кПа (756,2 мм рт. ст.). Определить кажущуюся степень диссоциации Na2SO4.
Решение:
Понижение давления пара над раствором вычисляем по уравнению:
где Р0 – давление насыщенного пара над растворителем, 101,325 кПа; Р – давление насыщенного пара над раствором, 100,800 кПа; N – мольная доля растворённого вещества; n1, n2 – количества растворённого вещества и раствора. Находим количество воды в растворе:
Тогда:
Находим экспериментальное значение:

Рассчитаем изотонический коэффициент из соотношения:
Рассчитаем кажущуюся степень диссоциации (
Здесь K — общее число ионов, образующихся при диссоциации электролита.
Ответ: 0,8.
Задача 521.
В 1 л 0,01М раствора уксусной кислоты содержится 6,26 . 10-21 ее молекул и ионов. Определить кажущуюся степень диссоциации уксусной кислоты.
Решение:
В 1 моль любого вещества содержится 6,02 . 10-23 молекул. Определим количество молекул, содержащееся в 0,01 моле уксусной кислоты из пропорции:
1 : 6,02 . 10-23 = 0,01 : x; x = (0,01 . 6,02 . 10-23)/1 = 6,02 . 10-21
Изотонический коэффициент рассчитаем из сравнения теоретического и практического количеств молекул уксусной кислоты:
Рассчитаем кажущуюся степень диссоциации (
здесь K — общее число ионов, образующихся при диссоциации электролита.
Ответ: 0,04.