-
Типы задач в задании С5.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Ответы и комментарии к задачам для самостоятельного решения.
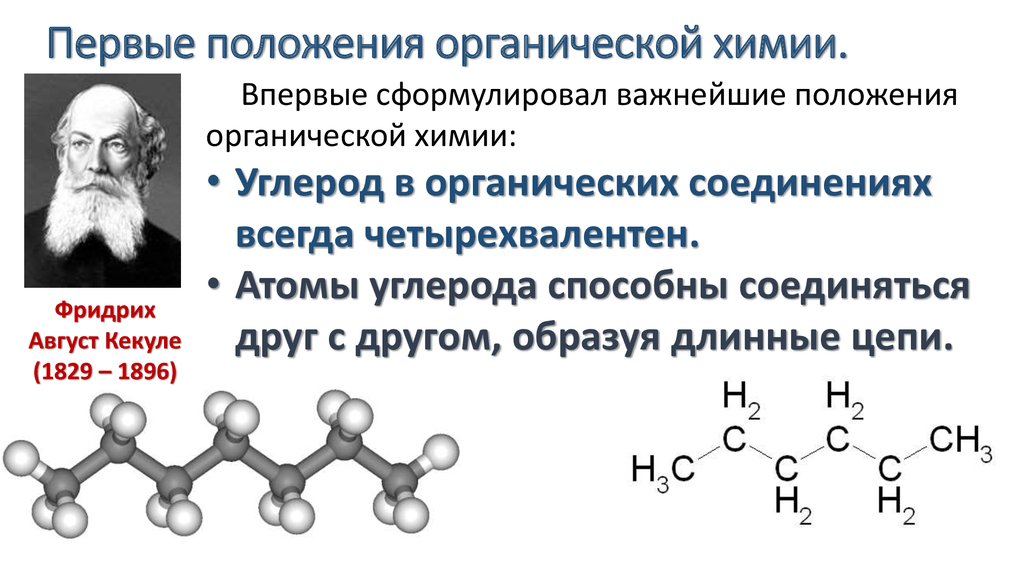
Задачи на определение формулы органического вещества бывают нескольких видов. Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют баллы на этой задаче. Причин бывает несколько:
- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
к оглавлению ▴
Типы задач в задании С5.
- Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
- Определение формулы вещества по продуктам сгорания;
- Определение формулы вещества по химическим свойствам.
Необходимые теоретические сведения.
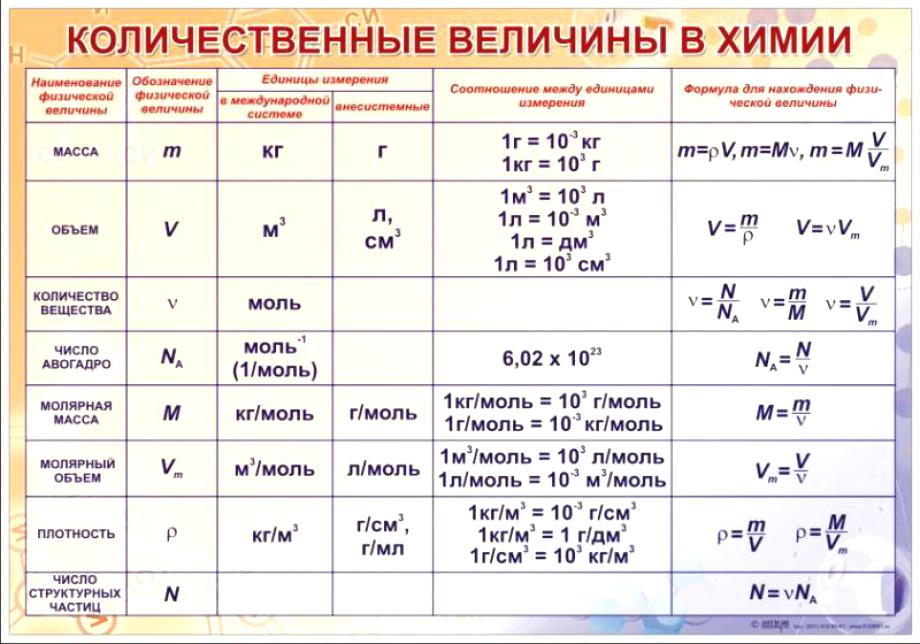
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)Если записать эту формулу в общем виде, то получится следующее выражение:
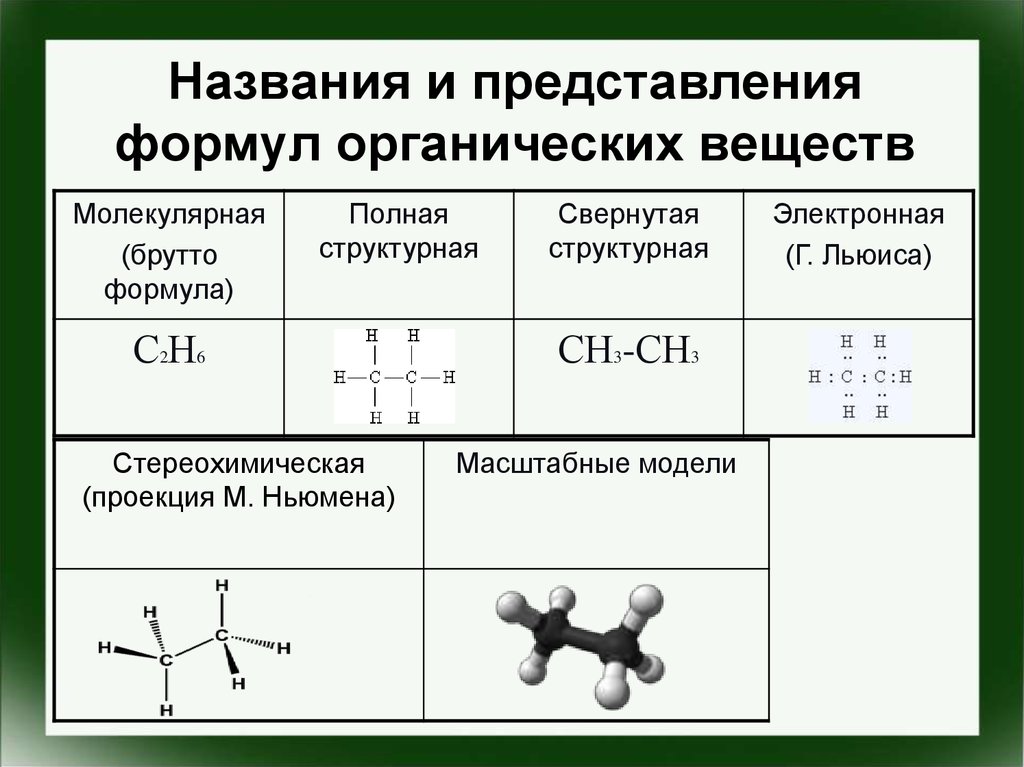
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол С2Н6О С:Н:О = 2:6:1 С2Н6О Бутен С4Н8 С:Н = 1:2 СН2 Уксусная кислота С2Н4О2 С:Н:О = 1:2:1 СН2О Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа Х по газу У — DпоУ(Х).
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому:
Dпо возд. = М(газа Х) / 29 - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm,
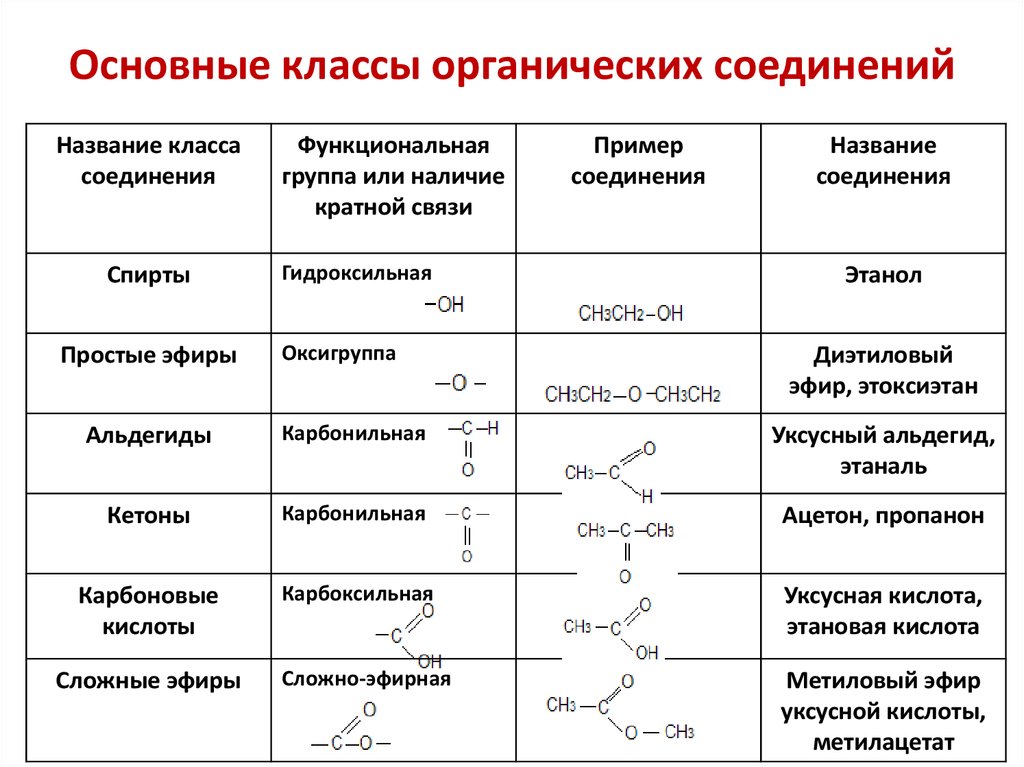
а молярную массу газа можно найти, умножая плотность на молярный объём. - Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы CnH2n+2 — Алкены CnH2n CnH2n+1–CH=CH2 Алкины CnH2n−2 CnH2n+1–C≡CH Диены CnH2n−2 — Гомологи бензола CnH2n−6 С6Н5–СnH2n+1 Предельные одноатомные спирты CnH2n+2O CnH2n+1–OH Многоатомные спирты CnH2n+2Ox CnH2n+2−x(OH)x Предельные альдегиды CnH2nO Кетоны CnH2nO O // CnH2n+1– C– O–CmH2m+1 Фенолы CnH2n−6O С6Н5(СnH2n)–OH Предельные карбоновые кислоты CnH2nO2 Сложные эфиры CnH2nO2 O // CnH2n+1– C– O–CmH2m+1 Амины CnH2n+3N СnH2n+1NH2 Аминокислоты (предельные одноосновные) CnH2n+1NO2 O // NH2– CH– C– OH C nH 2n+1
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует соотношению числа их атомов в молекуле:
х : у = n(A) : n(B); - затем, используя молярную массу вещества, определяют его истинную формулу.
-
Пример 1.
Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93.
Решение примера 1.
- Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
- Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль. - Определяем мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9. - По относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу (114 г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
m(C) = 114 • 0,8421 = 96; т.е. число атомов С 96/12 = 8
m(H) = 114 • 0,1579 = 18; т.е число атомов Н 18/1 = 18.
Формула вещества — С8Н18.
Ответ: С8Н18.
-
Пример 2.
Определить формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Решение примера 2.
Общая формула алкина СnH2n−2
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность ρ — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность ρ) • (молярный объём Vm) = 2,41 г/л • 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 • n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Ответ: С4Н6.
-
Пример 3.
Определить формулу предельного альдегида, если известно, что 3•1022 молекул этого альдегида весят 4,3 г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02•1023 (молекул).
Значит, можно найти количество вещества альдегида:
ν = N / Na = 3•1022 / 6,02•1023 = 0,05 моль,
и молярную массу:
М = m / n = 4,3 / 0,05 = 86 г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Ответ: С5Н10О, пентаналь.
-
Пример 4.
Определить формулу дихлоралкана, содержащего 31,86 % углерода.
Решение примера 4.
Общая формула дихлоралкана: СnH2nCl2, там 2 атома хлора и n атомов углерода.
Тогда массовая доля углерода равна:
ω(C) = (число атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана)
0,3186 = n • 12 / (14n + 71)
n = 3, вещество — дихлорпропан.
Ответ: С3Н6Cl2, дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль. - При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Масса осадка карбоната кальция — 8 г, молярная масса карбоната кальция 100 г/моль.
Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль. - Количество углекислого газа в 4 раза больше чем алкана, значит формула алкана С4Н10.
Ответ: С4Н10.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна 2. При сжигании 9,8 г этого соединения образуется 15,68 л углекислого газа (н. у) и 12,6 г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов С, Н и, возможно, О. Поэтому его общую формулу можно записать как СхНуОz.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
СхНуОz + О2 → CO2 + H2O
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду. - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = V / Vm = 15,68 / 22,4 = 0,7 моль.
На одну молекулу CO2 приходится один атом С, значит, углерода столько же моль, сколько CO2.ν(C) = 0,7 моль
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.В одной молекуле воды содержатся два атома Н, значит количество водорода в два раза больше, чем воды.
ν(H) = 0,7 • 2 = 1,4 моль. - Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы С и Н.
m(C) = 0,7 • 12 = 8,4 г, m(H) = 1,4 • 1 = 1,4 г
Масса всего вещества 9,8 г.
m(O) = 9,8 − 8,4 − 1,4 = 0, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов. - Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
С : Н = 0,7 : 1,4 = 1 : 2
Простейшая формула СН2. - Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул N2 и его молярная масса 28 г/моль):
Mист. = Dпо N2 • M(N2) = 2 • 28 = 56 г/моль.
Истиная формула СН2, её молярная масса 14.
56 / 14 = 4.
Истинная формула С4Н8.
Ответ: С4Н8.
-
Пример 7.
Определите молекулярную формулу вещества, при сгорании 9 г которого образовалось 17,6 г CO2, 12,6 г воды и азот. Относительная плотность этого вещества по водороду — 22,5. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы С,Н и N. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения:
СхНуNz + O2 → CO2 + H2O + N2 - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = m / M = 17,6 / 44 = 0,4 моль.
ν(C) = 0,4 моль.
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.
ν(H) = 0,7 • 2 = 1,4 моль. - Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы С и Н.m(C) = 0,4 • 12 = 4,8 г,
m(H) = 1,4 • 1 = 1,4 гМасса всего вещества 9,8 г.
m(N) = 9 − 4,8 − 1,4 = 2,8 г ,
ν(N) = m /M = 2,8 / 14 = 0,2 моль. - C : H : N = 0,4 : 1,4 : 0,2 = 2 : 7 : 1
Простейшая формула — С2Н7N.
Истинная молярная масса
М = Dпо Н2 • М(Н2) = 22,5 • 2 = 45 г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
Ответ: С2Н7N.
-
Пример 8.
Вещества содержит С, Н, О и S. При сгорании 11 г его выделилось 8,8 г CO2, 5,4 г Н2О, а сера была полностью переведена в сульфат бария, масса которого оказалась равна 23,3 г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как CxHySzOk. При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
ν(CO2) = m/M = 8,8/44 = 0,2 моль.
ν(C) = 0,2 моль.
ν(Н2О) = m / M = 5,4 / 18 = 0,3 моль.
ν(H) = 0,6 моль.
ν(BaSO4) = 23,3 / 233 = 0,1 моль.
ν(S) = 0,1 моль. - Рассчитываем предполагаемую массу кислорода в исходном веществе:
m(C) = 0,2 • 12 = 2,4 г
m(H) = 0,6 • 1 = 0,6 г
m(S) = 0,1 • 32 = 3,2 г
m(O) = mвещества − m(C) − m(H) − m(S) = 11 − 2,4 − 0,6 − 3,2 = 4,8 г,
ν(O) = m / M = 4,8 / 16 = 0,3 моль - Находим мольное соотношение элементов в веществе:
C : H : S : O = 0,2 : 0,6 : 0,1 : 0,3 = 2 : 6 : 1 : 3
Формула вещества C2H6SO3.
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы (С4Н12S2O6) получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
Ответ: C2H6SO3.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветить 80 г 2%-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2 → СnH2n−2Br4 - Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
m(Br2) = mраствора • ω = 80 • 0,02 = 1,6 г
ν(Br2) = m / M = 1,6 / 160 = 0,01 моль. - Так как количество брома, вступившего в реакцию, в 2 раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
0,005 0,01 СnH2n−2 + 2Br2 → СnH2n−2Br4 Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через n:
14n − 2 = 68
n = 5.Это пентадиен С5Н8.
Ответ: C5H8.
-
Пример 10.
При взаимодействии 0,74 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 112 мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта — CnH2n+1OH. Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
2CnH2n+1OH + 2Na
→
2CnH2n+1ONa + H2
C3H6 + H2→
C3H8
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
ν(C3H6) = V / Vm = 0,112 / 22,4 = 0,005 моль => ν(H2) = 0,005 моль,
νспирта = 0,005 • 2 = 0,01 моль. - Находим молярную массу спирта и n:
Mспирта = m / ν = 0,74 / 0,01 = 74 г/моль,
14n + 18 = 74
14n = 56
n = 4.Спирт — бутанол С4Н7ОН.
Ответ: C4H7OH.
-
Пример 11.
Определить формулу сложного эфира, при гидролизе 2,64 г которого выделяется 1,38 г спирта и 1,8 г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
CnH2n+1COOCmH2m+1
Соответственно, спирт будет иметь формулу
CmH2m+1OH,
а кислота
CnH2n+1COOH.
Уравнение гидролиза сложного эфира:
CnH2n+1COOCmH2m+1 + H2O → CmH2m+1OH + CnH2n+1COOH - Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:mH2O = (масса кислоты) + (масса спирта) − (масса эфира) = 1,38 + 1,8 − 2,64 = 0,54 г
νH2O = m / M = 0,54 / 18 = 0,03 мольСоответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:Мкислоты = m / ν = 1,8 / 0,03 = 60 г/моль,
Мспирта = 1,38 / 0,03 = 46 г/моль.Получим два уравнения, из которых найдём m и n:
MCnH2n+1COOH = 14n + 46 = 60, n = 1 — уксусная кислота
MCmH2m+1OH = 14m + 18 = 46, m = 2 — этанол.Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Ответ: CH3COOC2H5.
-
Пример 12.
Определить формулу аминокислоты, если при действии на 8,9 г её избытком гидроксида натрия можно получить 11,1 г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
NH2–CH(R)–COOH.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно. - Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
NH2–CH(R)–COOH + NaOH → NH2–CH(R)–COONa + H2O
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:M(аминокислоты NH2–CH(R)–COOH) = 74 + МR
M(соли NH2–CH(R)–COONa) = 96 + МR
νаминокислоты = 8,9 / (74 + МR),
νсоли = 11,1 / (96 + МR)
8,9 / (74 + МR) = 11,1 / (96 + МR)
МR = 15Легко увидеть, что R = CH3.
Можно это сделать математически, если принять, что R — CnH2n+1.
14n + 1 = 15, n = 1.
Это аланин — аминопропановая кислота.
Ответ: NH2–CH(CH3)–COOH.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна 1,964 г/л. Массовая доля углерода в нем равна 81,82%. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна 48,65%, массовая доля азота равна 37,84%. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4,07. Выведите молекулярную формулу карбоновой кислоты.
1–4. 2 л алкадиена при н.у. имеет массу, равную 4,82 г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит 30,77 % кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна 2. При сжигании 19,2 г этого вещества образуется 52,8 г углекислого газа (н.у.) и 21,6 г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой 1,78 г в избытке кислорода получили 0,28 г азота, 1,344 л (н.у.) СО2 и 1,26 г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится 1,204•1022 молекул.
2–3. Углекислый газ, полученный при сгорании 3,4 г углеводорода, пропустили через избыток раствора гидроксида кальция и получили 25 г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего С, Н и хлор, выделилось 6,72 л (н.у.) углекислого газа, 5,4 г воды, 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось 0,448 л (н.у.) углекислого газа, 0,495 г воды и 0,056 л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он 5,6 г его при присоединении воды образуют 7,4 г спирта.
3–2. Для окисления 2,9 г предельного альдегида до кислоты потребовалось 9,8 г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой 3 г с избытком бромоводорода образует 6,24 г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой 2,7 г с избытком калия выделилось 0,672 л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили 9,73 г альдегида, 8,65 г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1. С3Н8
1–2. С3Н6(NH2)2
1–3. C2H4(COOH)2
1–4. C4H6
1–5. (HCOO)2Ca — формиат кальция, соль муравьиной кислоты
2–1. С8Н16О
2–2. С3Н7NO
2–3. С5Н8 (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. C3H7Cl (не забудьте, что атомы водорода содержатся не только в воде, но и в HCl)
2–5. C4H11N
3–1. С4Н8
3–2. С3Н6О
3–3. С2Н5NO2
3–4. C4H8(OH)2
3–5. C4H9OH
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Химия, часть С. Задача С5. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.05.2023
Вывод молекулярной формулы вещества по продуктам сгорания.
Задача 1.
При полном сгорании 4,6 г газообразного органического вещества получено 8,8 г СО2 и 5,4 г Н2О. Относительная плотность паров вещества по воздуху равна 1,589. Определите молекулярную формулу вещества и дайте названия всем его изомерам.
Решение.
в-во+ О2→ СО2+Н2О
в состав сгораемого вещества обязательно входят углерод и водород, но возможно наличие кислорода. Поэтому, необходимо сделать проверку на кислород:
ν(СО2)=m/M=8,8 г/44 г/моль=0,2 моль; ν(С)=0,2 моль;m(С)=2,4 г
ν(Н2О)=m/M=5,4 г/18 г/моль=0,3 моль; ν(Н)=0,6моль; m(Н)=0,6 г
m(C)+m(H)=2,4 г + 0,6 г=3 г
а вещества сгорело 4,6 г, следовательно, имеется кислород.
m(О)=4,6 г-3 г=1,6 г
ν(О)=1,6 г/16 г/моль=0,1моль
СхНyОz х:y:z= ν(C): ν(Н): ν(О)=0,2:0,6:0,1
Находим среди этих цифр самое маленькое и все делим на него, получая: х:y:z= 2:6:1
С2Н6О-простейшая формула.
D(воздуху)=M(в-ва)/М(воздуха)
М (в-ва)= D(воздуху)×М(воздуха)=1,589×29 г/моль=46 г/моль
M(С2Н6О)=12×2+6+16=46 г/моль,
что соответствует действительности.
^ Ответ: С2Н6О. Это либо этиловый спирт, либо диметиловый эфир.
Задача 2.
При сгорании углеводорода получено 0,2 моль СО2 и 0,2 моль Н2О. Определите молекулярную формулу углеводорода, если известно, что 3,64 г этого вещества занимают объем 1,456 л (н.у.).
Решение.
СхНy + (х+0,25y)О2→ хСО2 +0,5yН2О
(здесь конкретно указано, что горит углеводород).
х,y- коэффициенты перед формулами веществ в правой части — это индексы при углероде и водороде в сгоревшем веществе.
ν(СО2):ν(Н2О)=х:0,5y (по уравнению), а на самом деле как 0,2:0,2 (по условию)
ν(СО2): ν(Н2О)=х:0,5y =0,2:0,2
0,2х=0,1y, х=0,5y (1)
Раз имеется два неизвестных, то должна быть система уравнений. Второе уравнение даст молярная масса вещества:
m=М× ν
V=Vm× ν
Через объем найдем количество углеводорода, а затем его молярную массу:
ν= V/Vm=1,456 л/22,4 л/моль=0,065 моль
M=m/ν=3,64 г/0,065 моль=56 г/моль
составляем уравнение:
12х+y=56
Вместо (х) подставляем его значение из уравнения (1)
12×0,5y+y=56
7y=56, y=8, х=4
^ Ответ: С4Н8
Задача 3.
В состав вещества входят С,Н,О,S. При сжигании его навески массой 0,222 г были получены 0,396 г СО2, 0,162 г Н2О, а сера переведена в сульфат бария массой 0,3495 г. Относительная плотность паров вещества по водороду равна 74. Определить истинную формулу вещества.
Решение:
в-во+ О2→ СО2+Н2О +SО2 (любое вещество, содержащее серу, дает при сгорании диоксид серы),
SО2→ ВаSО4 (через какие реакции осуществлен данный переход — неважно, из сульфата бария надо найти массу и количества серы).
ν(СО2)=m/M=0,396 г/44 г/моль=0,009 моль;ν(С)=0,009 моль; m(С)=0,108 г;
ν(Н2О)=m/M=0,162 г/18 г/моль=0,009 моль;ν(Н)=0,018 моль; m(Н)=0,018 г;
ν(ВаSО4)=m/M=0,3495 г/233 г/моль=0,0015 моль; ν (S)=0,0015 моль; m(S)=0,048 г;
m(О)=0,222-0,108-0,018-0,048 г=0,048 г;
ν(О)=0,048 г/16 г/моль=0,003 моль;
СхНyОzSq х:y:z:q= ν(C): ν(Н): ν(О): ν (S)=0,009:0,018:0,003:0,0015
Находим среди этих цифр самое маленькое и все делим на него, получая: х:y:z:q= 6:12:2:1
С6Н12О2S-простейшая формула.
D(по водороду)=M(в-ва)/М(Н2)
М (в-ва)= D(по водороду)×М(Н2)=74×2 г/моль=148 г/моль
M(С6Н12О2S)=12×6+12+16×2+32=148 г/моль,
что соответствует действительности.
^ Ответ: С6Н12О2S.
Задача 4.
При сгорании газообразного органического вещества, не содержащего кислород, выделилось 2,24 л (н.у.) углекислого газа, 1,8 г воды и 3,65 г хлороводорода. Установите формулу сгоревшего вещества, рассчитайте его объем и массу.
Решение.
В задаче сказано, что вещество не содержит кислород, следовательно, оно состоит только из углерода, водорода и хлора:
СхНyClz + О2→ СО2 +Н2О+ НCl
в этой задаче необходимо найти количество углерода, перешедшего в углекислый газ, количество водорода, перешедшего как в воду, так и в хлороводород, количество хлора из хлороводорода:
х:y:z= ν (C): ν (Н): ν (Cl)
ν(СО2)=V/Vm=2,24 л/22,4 л/моль=0,1 моль; ν(С)=0,1 моль;
ν (Н2О)=m/M=1,8 г/18 г/моль=0,1 моль; ν (Н)=0,2 моль;
ν (НCl)=m/M=3,65 г/36,5 г/моль=0,1 моль; ν (Cl)=0,1 моль;
ν (Н)=0,1 моль
ν (Н)общее=0,1 моль+0,2 моль=0,3 моль
х:y:z= ν (C): ν (Н): ν (Cl)=0,1:0,3:0,1
Находим среди этих цифр самое маленькое и все делим на него, получая: х:y:z= 1:3:1
СН3Сl-истинная формула.
СН3Сl+ 1,5О2→ СО2 +Н2О+ НCl
Для нахождения массы и объема сгоревшего вещества, необходимо составить количественные соотношения между хлорметаном и любым продуктом реакции:
ν (СН3Сl): ν (СО2)=1:1 (по уравнению), ν (CН3Сl)=0,1 моль
m(СН3Сl)=М× ν =50,5 г/моль×0,1 моль=5,05 г
V(СН3Сl)=Vm× ν =22,4 л/моль×0,1 моль=2,24 л
^ Ответ: СН3Сl, m(СН3Сl)=5,05 г, V(СН3Сl)=2,24 л.
Задача 5.
Неизвестное органическое вещество массой 0,4 г сожгли и продукты сгорания пропустили через трубку с безводным сульфатом меди (II) и сосуд, содержащий избыток баритовой воды. Масса трубки увеличилась на 0,36 г, в сосуде образовался осадок массой 5,91 г. Установить формулу вещества.
Решение.
в-во+ О2→ СО2+Н2О
В состав сгораемого вещества обязательно входят углерод и водород, но возможно наличие кислорода. Поэтому необходимо сделать проверку на кислород.
Масса трубки с сульфатом меди (II) увеличилась за счет поглощенной воды (CuSО4 + nН2О→CuSО4×nН2О), откуда делаем вывод, что масса выделившейся воды равна 0,36 г.
С баритовой водой (Ва(ОН)2) взаимодействует СО2):
Ва(ОН)2+ СО2→ВаСО3↓+Н2О
ν(ВаСО3)=m/M=5,91 г/197 г/моль=0,03 моль;
ν(ВаСО3): ν(СО2)=1:1 (по уравнению), сл-но, ν(СО2)=0,03 моль;
ν(С)=0,03 моль, m(С)=0,36 г
ν(Н2О)=m/M=0,36 г/18 г/моль=0,02 моль; ν(Н)= 0,04 моль;
m(Н)=0,04 г
m(C)+m(H)=0,36+0,04=04 г
следовательно, кислорода нет.
СхНy х:y= ν(C): ν(Н)=0,03:0,04 (можно умножить все на 100)
х:y= 3:4
^ Ответ: С3Н4.
Задача 6*.
Смесь газов, образовавшихся при сжигании образца органического соединения Х массой 2,7 г, была пропущена последовательно через склянки с концентрированной серной кислотой и известковой водой. При этом масса первой склянки увеличилась на 3,78 г, во второй склянке образовалось 12 г осадка, а объем непоглощенного газаY составил 733 мл (250С и нормальное давление). При одновременном добавлении к такому же образцу вещества Х избытка раствора нитрита натрия и соляной кислоты выделяется вдвое больший объем газа Y. Определите неизвестное вещество Х и приведите его структурную формулу.
Решение.
Газ, который не поглощается известковой водой — это азот. Следовательно, в состав неизвестного вещества обязательно входят углерода, водород, азот и возможно, кислород.
в-во+ О2→ СО2+Н2О+ N2
Масса склянки с конц. Н2SО4 увеличивается за счет поглощения кислотой воды, m(Н2О)=3,78 г
С известковой водой взаимодействует углекислый газ:
СО2 + Са(ОН)2→СаСО3↓+Н2О
ν(СаСО3)=m/M=12 г/100 г/моль=0,12 моль;
ν(СаСО3): ν(СО2)=1:1, ν(СО2)=0,12 моль;
Проверка на кислород:
ν(СО2)=0,12 моль; ν(С)=0,12 моль;m(С)=1,44 г
ν(Н2О)=m/M=3,78 г/18 г/моль=0,21 моль; ν(Н)=0,42 моль;
m(Н)=0,42 г.
Приведем объем азота к н.у., учитывая, что Т=(273 +25)К=298 К
По «объединенному газовому закону»
V0=Р×V×Т0/Р0×Т
V0=(101,3×0,733×273)/(101,3×298)=0,672 л
ν(N2)=V/Vm=0,672 л/22,4 л/моль=0,03 моль, ν(N)=0,06 моль,
m(N)=0,84 г;
m(C)+m(H)+m(N)=1,44 г + 0,42 г+0,84=2,7 г
кислорода нет, так как вещества сгорело тоже 2,7 г.
СхНyNz х:y:z= ν(C): ν(Н): ν(N)=0,12:0,42:0,06
Находим среди этих цифр самое маленькое и все делим на него, получая: х:y:z= 2:7:1
С2Н7N-амин. Это может быть либо первичный амин С2Н5NН2, либо вторичный амин (СН3)2NН.
Установить его структуру поможет реакция с азотистой кислотой. Только первичные амины вступают в реакцию с НNО2 по уравнению:
С2Н5NН2 + NаNО2 + НCl→С2Н5ОН + N2 +NаCl+Н2О
^ Ответ: Х- C2Н2NН2— этиламин, Y-N2.
Задачи для самостоятельного решения.
1.При сжигании 3,7 г монофункционального органического вещества было получено 2,7 г воды и 3,36 л (н.у.) диоксида углерода. Какое это вещество, если при взаимодействии его с натрием выделяется водород, а водный раствор продукта реакции окрашивает лакмус в синий цвет? Составить уравнение реакции взаимодействия с натрием.
2. Относительная плотность паров органического соединения по гелию равна 25,5. При сжигании 15,3 г этого вещества образовалось 20,16 л (н.у.) углекислого газа и 18,9 г воды. Выведите молекулярную формулу органического соединения. К каким классам органических соединений может относиться данное вещество?
3.При полном сгорании 4,8 г органического вещества, плотность паров которого по водороду равна 16, получили 6,6 г диоксида углерода и 5,4 г воды. Каковы формула и названия этого вещества?
Составить не менее трех уравнений реакций получения данного вещества.
4.При полном сгорании 0,88 г органического соединения образовалось 896 мл СО2 (н.у.) и 0,72 г воды. Выведите молекулярную формулу этого вещества, если плотность паров по водороду равна 44. Укажите, к каким классам может относиться это вещество. Найти все изомеры данного вещества.
5. При сжигании вещества массой 10,7 г получили 30,8 г углекислого газа, 8,1 г воды и 1,4 г азота. Плотность паров этого вещества по воздуху равна 3,69. Определите молекулярную формулу вещества.Составить уравнение реакции данного вещества с хлороводородом, дать название образующемуся продукту.
6.При сгорании 0,9 г газообразного органического вещества выделилось 0,896 л (н.у.) углекислого газа, 1,26 г воды и 0,224 л (н.у.) азота. Плотность газообразного вещества по азоту 1,607. Установите молекулярную формулу органического вещества и приведите одно из возможных названий. Привести не менее трех уравнений реакций получения данного вещества.
7.При сгорании 0,45 г газообразного органического вещества выделилось 0,448 л углекислого газа, 0,63 г воды и 0,112 л азота.Объемы газов измерялись при нормальных условиях. Плотность газообразного вещества по азоту 1,607. Установите его молекулярную формулу и приведите одно из возможных названий этого соединения. С какими из перечисленных соединений может взаимодействовать это вещество: а) метаном; б) гидроксидом бария; в) водой; г) кислородом; д) бензолом; е) азотной кислотой. Составить уравнения данных реакций.
8.При полном сгорании 0,62 г газообразного органического вещества выделилось 0,448 л углекислого газа, 0,9 г воды и 0,224 л азота (объемы газов измерены при нормальных условиях). Плотность вещества по водороду 15,50. Установите его молекулярную формулу и назовите это соединение. Это вещество может быть получено при взаимодействии:
а) СН4 и НNО3 б) СН3NО2 и Н2 в) СН3ОН и N2
г) СН3ОН и NН3 д) CН3NН3Cl и КОН е) СН3-СН3 и NН3
Составить уравнения осуществимых реакций.
9.Сожгли 6 г вещества и получили 6,72 л углекислого газа (н.у.) и 7,2 г воды. Относительная плотность паров вещества по воздуху равна 2,07. Определить молекулярную формулу вещества. Для этого вещества характерны реакции:
а) этерификации б) поликонденсации в) нейтрализации
г) окисления д) дегидратации е) гидратации.
10.Относительная плотность паров органического вещества по водороду равна 30. При сжигании 24 г вещества образовались 35,2 г оксида углерода (IV) и 14,4 г воды. Определить молекулярную формулу вещества. Составить уравнения реакций получения данного вещества в лаборатории и промышленности.
11.Относительная плотность паров органического соединения по сернистому газу равна 2. При сжигании 19,2 г этого вещества образуется 52,8 г углекислого газа (н.у.) и 21,6 г воды. Выведите молекулярную формулу органического соединения. К каким классам органических соединений оно может относиться?
12.При сгорании вещества массой 8,5 г образовались оксид углерода (IV) массой 26,4 г и вода массой 11,7 г. Плотность паров вещества по воздуху равна 5,862. Определите формулу вещества.
Задача 1
При сгорании органического вещества массой 4,8 г образовалось 3,36 л. CO2 (н.у.) и 5,4 г воды. Плотность паров органического вещества по водороду равна 16. Определите молекулярную формулу исследуемого вещества.
Решение:
Продукты сгорания вещества состоят из трех элементов: углерода, водорода, кислорода. При этом очевидно, что в состав этого соединения входил весь углерод, содержащийся в CO2, и весь водород, перешедший в воду. А вот кислород мог присоединиться во время горения из воздуха, а мог и частично содержаться в самом веществе. Для определения простейшей формулы соединения нам необходимо знать его элементный состав. Найдем количество продуктов реакции (в моль):
n(CO2) = V(CO2) / VM = 3,36 л : 22,4 л/моль = 0,15 моль
n(H2O) = m(H2O) / M(H2O) = 5,4 г : 18 г/моль = 0,3 моль
Следовательно, в состав исходного соединения входило 0,15 моль атомов углерода и 0,6 моль атомов водорода: n(H) = 2n(H2O), так как в одной молекуле воды содержатся два атома водорода. Вычислим их массы по формуле:
m = n х M
m(H) = 0,6 моль х 1 г/моль = 0,6 г
m(С) = 0,15 моль х 12 г/моль = 1,8 г
Определим, входил ли кислород в состав исходного вещества:
m(O) = 4,8 — (0,6 + 1,8) = 2,4 г
Найдем число моль атомов кислорода:
n(O) = m(O) / M(O) = 2,4 г : 16 г/моль = 0,15 моль
Соотношение числа атомов в молекуле исходного органического соединения пропорционально их мольным долям:
n(CO2) : n(H) : n(O) = 0,15 : 0,6 : 0,15 = 1 : 4 : 1
Самую маленькую из этих величин (0,15) принимаем за 1, а остальные делим на нее.
Итак, простейшая формула исходного вещества CH4O. Однако по условию задачи требуется определить молекулярную формулу, которая в общем виде такова: (CH4O)х. Найдем значение x. Для этого сравним молярные массы исходного вещества и его простейшей формулы:
x = M(CH4O)х / M(CH4O)
Зная относительную плотность исходного вещества по водороду, найдем молярную массу вещества:
M(CH4O)х = M(H2) х D(H2) = 2 г/моль х 16 = 32 г/моль
x = 32 г/моль / 32 г/моль = 1
Есть и второй вариант нахождения x (алгебраический):
12x + 4x + 16x = 32; 32 x = 32; x = 1
Ответ: Формула исходного органического вещества CH4O.
Задача 2
В лабораторной установке из 120 л ацетилена (н.у.) получили 60 г бензола. Найдите практический выход бензола.
Решение:
3C2H2 (650 оС, активированный уголь) = C6H6
n(C2H2) = V(C2H2)/ VM = 120 л : 22,4 л/моль = 5,35 моль
n(C6H6)теор = 1/3 х n(C2H2) = 1/3 х 5,35 моль = 1,785 моль
n(C6H6)практ = m(C6H6)/ M(C6H6) = 60 г : 78 г/моль = 0,77 моль
h = (nпракт : nтеор) х 100% = (0,77 : 1,785) х 100% = 43%
Ответ: 43%.
Задача 3
Какой объем водорода (н.у.) получится при взаимодействии 2 моль металлического натрия с 96%-ным (по массе) раствором этанола в воде (V = 100 мл, плотность d = 0,8 г/мл).
Решение:
В условии задачи даны количества обоих реагентов — это верный признак того, что какой-нибудь из них находится в избытке. Найдем массу этанола, введенного в реакцию:
m(раствора) = V х d = 100 мл х 0,8 г/мл = 80 г
m(C2H5OH) = {m(раствора) х w%} : 100% = 80 г х 0,96 = 76,8 г
Найдем заданное количество этанола в моль:
n(C2H5OH) = m(C2H5OH) / M(C2H5OH) = 76,84 г : 46 г/моль = 1,67 моль
Поскольку заданное количество натрия составляло 2 моль, натрий в нашей задаче присутствует в избытке. Поэтому объем выделенного водорода будет определяться количеством этанола:
n1(H2) = 1/2 n(C2H5OH) = 1/2 х 1,67 моль = 0,835 моль
V1(H2) = n1(H2) х VM = 0,835 моль х 22,4 л/моль = 18,7 л
Но это еще не окончательный ответ. Будьте внимательны! Вода, содержащаяся в растворе спирта, тоже реагирует с натрием с выделением водорода.
Найдем массу воды:
m(H2O) = {m(раствора) х w%} : 100% = 80 г х 0,04 = 3,2 г
n(H2O) = m(H2O)/M(H2O) = 3,2 г : 18 г/моль = = 0,178 моль
Количество натрия, оставшееся неизрасходованным после реакции с этанолом, составит:
n(Na, остаток) = 2 моль — 1,67 моль = 0,33 моль
Таким образом, и по сравнению с заданным количеством воды (0,178 моль) натрий все равно оказывается в избытке.
Найдем количество и объем водорода, выделившегося по реакции:
n2(H2) = 1/2 n(H2O) = 1/2 х 0,178 моль = 0,089 моль
V2(H2) = n2(H2) х VM = 0,089 моль х 22,4 л/моль = 1,99 л
Общий объем водорода:
V(H2) = V1(H2) + V2(H2) = 18,7 л+ 1,99 л = 20,69 л
Ответ: V(H2) = 20,69 л.
Задача 4
Какой объем воздуха (н.у.) потребуется для сжигания смеси, состоящей из 5 л метана и 15 л ацетилена?
Решение:
1) CH4 + 2O2 = CO2 + 2H2O
на 1 моль CH4 — 2 моль 2O2
2) 2C2H2 + 5O2 = 4CO2 + 2H2O
на 2 моль 2C2H2 — 5 моль 2O2
Объем кислорода, который пойдет на сжигание заданного объема метана V1(O2) и ацетилена V2(O2), составит:
V1(O2) = 2V(CH4) = 2 х 5 = 10 л
V2(O2) = 5/2 V(C2H2) = 5/2 х 15 = 37,5 л
V(O2) = V1(O2) + V2(O2) = 10 л + 37,5 л = 47,5 л
Отсюда рассчитаем объем воздуха на сжигание (содержание кислорода в воздухе принимаем равным 21% по объему):
V(воздуха) = V(O2) : 0,21 = 47,5 л : 0,21 = 226 л
Ответ: V(воздуха) = 226 л
Задача 5
Смесь этана и этилена объемом 200 мл (нормальные условия) обесцветила бромную воду массой 25 г. Рассчитайте объемную долю этанола в смеси, если массовая доля брома в бромной воде равна 3,2%.
Решение:
С бромной водой легко взаимодействует только этилен с образованием 1,2 – дибромэтана:
C2H4 + Br2 → C2H4Br2
Определяем массу и количество вещества молекулярного брома, содержащегося в бромной воде:
m (Br2) = m*ω(Br2)/100 ;
m (Br2) = 25*3,2/100 = 0,8 г.
n (Br2) =m(Br2)/M(Br2) ;
n (Br2) = 0,8/160 = 0, 005 моль.
Из уравнения реакции следует:
n (C2H4) = n (Br2) ;
n (C2H4) = 0,005 моль.
Вычисляем объем этилена при нормальных условиях:
V (C2H4) = n (C2H4)*Vm ;
V (C2H4) = 0,005*22,4 = 0,112 л = 112 мл.
Рассчитываем объемную долю этилена в исходной газовой смеси:
ω (C2H4) = V(C2H4)/ V( Cсмеси) ;
ω (С2Н4) = 112/200 = 0,56 или 56%.
Ответ: 0,56 или 56%.
Задача 6
Смесь бензола с циклогексеном массой 5 г обесцвечивает бромную воду массой 125 г ( массовая доля брома 3,2 %). Определите массу воды, которая образуется при сжигании в кислороде той же смеси массой 20 г.
Решение:
С бромной водой взаимодействует только один компонент смеси – циклогексен:
C6H10 + Br2 → C6H10Br2 (а)
Определяем массу и количество вещества брома вступившего в реакцию:
m (Br2) = m( бромной воды) *ω (Br2)/100;
m (Br2) = 125*3,2/100 = 4 г ;
n (Br2) = m(Br2)/M(Br2);
n (Br2) = 4/160 = 0,025 моль.
Вычисляем массу и массовую долю циклогексена ( обозначаем его буквой Ц), вступившего в реакцию с бромом. Из уравнения реакции (а) следует
n (Ц) = n(Br2) ;
n(Ц) = 0,025 моль.
Рассчитываем массу и массовую долю циклогексена в смеси:
m(Ц) = n(Ц) * M(Ц);
m(Ц) = 0,025 * 82 = 2,05 г.
ω(Ц) = m(Ц)/m смеси;
ω(Ц) = 0,025/5 = 0,41
Массовая доля бензола (Б) в смеси двух веществ равна
ω(Б) = 1 – ω(Ц);
ω(Б) = 1 – 0,41 = 0,59.
Определяем массу и количество вещества бензола в образце смеси массой m= 20 г.
m*(Б) = m* * ω(Б);
m*(Б) = 20 * 0,59 = 11,8 г;
n*(Б) = m*(Б)/M(Б);
n*(Б) = 11,8/78 = 0,15 моль.
Аналогично для циклогексена получаем:
m*(Ц) = 8,2 г и n*(Ц) = 0,1 моль.
Составляем уравнения реакции горения бензола и циклогексена:
2 C6H6 + 15 O2 → 12 CO2 + 6 H2O (б)
2 C6H10 + 17 O2 → 12 CO2 + 10 H2O (в)
На основании уравнения реакции (б) записываем
n*(Б)/n(H2O) = 2/6 =1/3;
n(H2O) = 3 n*(Б);
n(H2O) = 3*0,15 = 0,45 моль.
Используя уравнение реакции (в) находим
n(H2O) = 5 n(Ц);
n(H2O) = 5 *0,1 =0,5 моль.
Общее количество вещества воды, выделившейся при горении смеси массой 20 г , составляет
n(H2O) = (0,45 + 0,5) = 0,95 моль.
Вычисляем массу полученной воды:
m(H2O) = n(H2O) * M(H2O);
m(H2O) = 0,95 * 18 = 17,1 г.
Ответ: 17,1 г.
Задача 7
При сжигании углеводорода, количество вещества которого равно 0,1 моль, образовались оксид углерода (IV) объемом 6,72 л (нормальные условия) и вода массой 7,2 г. Определите формулу углеводорода.
Решение:
Вычисляем количество вещества оксида углерода (IV), полученного при горении углеводорода:
n(CO2) = V(CO2) / Vm ;
n(CO2) = 6,72/22,4 = 0,3 моль.
Количество вещества углерода, содержащегося в сожженном образце углеводорода, равно
n(C) = n(CO2);
n(C) = 0,3 моль.
Рассчитываем количество вещества воды, полученной при сжигании углеводорода:
n(H2O) = m(H2O)/M(H2O);
n(H2O) = 7,2/18 = 0,4 моль.
Определяем количество вещества водорода, содержащегося в образце углеводорода:
n(H) = 2n(H2O);
n(H) = 2*0,4 = 0,8 моль.
Таким образом, образец углеводорода количеством вещества 0,1 моль содержит 0,3 моль углерода и 0,8 моль водорода. Следовательно, 1 моль углеводорода содержит 3 моль углерода и 8 моль водорода. Таким образом, формула углеводорода C3H8. Это пропан.
Ответ: C3H8
Задача 8
Органическое вещество имеет относительную плотность паров по водороду 46. Образец этого вещества массой 13,8 г сожгли, получив оксид углерода (IV) объемом 23,52 л (нормальные условия) и воду массой 10,8 г. Определите формулу органического вещества, учитывая, что оно является ароматическим.
Решение:
Вычисляем молярную массу органического вещества (В), используя относительную плотность его паров по водороду:
M(B) = 2DH2;
M(B) = 2 *46 = 92 г/моль.
Определяем количество вещества В, которое сожгли:
n(B) = m(B)/M(B) ;
n(B) = 13,8/92 = 0,15 моль.
Рассчитываем количество вещества образовавшегося оксида углерода (IV) CO2
n(CO2) = V(CO2)/Vm ;
n(CO2) = 23,54/22,4 = 0,15 моль.
Вычисляем количество вещества углерода в сожженном веществе равно
n(C) = n(CO2);
n(C) = 1,05 моль.
Вычисляем количество вещества воды и количество вещества атомного водорода в сожженном веществе:
n(H2O) = m(H2O)/M(H2O) ;
n(H2O) = 10,8/18 = 0,6 моль.
n(H) = 2n(H2O);
n(H) = 2 * 0,6 = 1,2 моль.
Определяем массу атомных углерода и водорода:
m(C) = n(C)*M(C);
m(C) = 1,05 * 12 = 12,6 г.
m(H) = n(H)*M(H);
m(H) = 1,2 * 1 = 1,2 г.
m(C) + m(H) = (12,6 + 1,2) = 13,8 г.
Сумма масс углерода и водорода равна массе сожженного вещества, следовательно, других элементов оно не содержит. Таким образом, вещество В – ароматический углеводород, формулу которого можно представить в виде CxHy .
Мы определили, что образец CxHy, количество вещества которого равно 0,15 моль, содержит 1,05 моль С и 1,2 моль Н.
Вычисляем коэффициенты x и y.
x = n(C)/n(B); x = 1,05/0,15 = 7;
y = n(H)/n(B); y = 1,2/0,15 = 8;
Ответ: Формула ароматического углеводорода С7Н8 или С6Н5 – СН3. Это толуол.
Задача 9
Этанол объемом 30 мл (плотностью 0,79 г/мл) нагрели с избытком бромида натрия и серной кислоты. Из реакционной среды выделили бромэтан массой 42,3 г. Определите массовую долю выхода бромэтана.
Решение:
При нагревании смеси этанола с бромидом калия и серной кислотой происходят реакции:
2KBr + H2SO4 ↔ 2HBr + K2SO4 (a)
C2H5OH + HBr ↔ C2H5Br + H2O (б)
Вычисляем массу и количество вещества этанола, взятого для реакции:
m(C2H5OH) = V(C2H5OH) * p(C2H5OH);
m(C2H5OH) = 30 * 0,79 = 23,7 г.
n(C2H5OH) = m(C2H5OH)/M(C2H5OH);
n(C2H5OH) = 23,7/46 = 0,515 моль.
Из уравнения (б) следует:
n(C2H5Br) = n(C2H5OH);
n(C2H5Br) = 0,515 моль.
Рассчитываем массу бромэтана, который мог бы образоваться при 100% — ном выходе:
m(C2H5Br) = n(C2H5Br) * M(C2H5Br);
m(C2H5Br) = 0,515 * 109 = 56,1 г.
Вычисляем массовую долю выхода бромэтана:
ω(C2H5Br) = mp(C2H5Br)*100/m(C2H5Br);
ω(C2H5Br) = 42,3 * 100/56,1 = 75,4%.
Ответ: 75,4%.
Задача 10
Как, исходя из этана, получить этилацетат? Напишите уравнения соответствующих реакций.
Решение:
Бромированием этана вначале получаем бромэтан:
C2H6 + Br2 → C2H5Br + HBr
Проводя гидролиз бромэтана в присутствии щелочи, получаем этанол:
C2H5Br + H2O → C2H5OH + HBr
(щелочь необходима для смещения равновесия в сторону спирта).
Из спирта можно получить альдегид двумя путями:
а) дегидрированием спирта
Cu, t
C2H5OH → CH3CHO + H2
б) окислением спирта
Cu, t
2C2H5OH → 2CH3CHO + 2H2O
Окисляя альдегид (любым окислителем), можно получить уксусную кислоту:
5CH3CHO + 2KMnO4 + 3H2SO4 →
5CH3COOH + 2MnSO4 + K2SO4 + 3H2O
Сложный эфир – этилацетат – получаем из этанола и уксусной кислоты по реакции этерификации в присутствии катализатора – концентрированной серной кислоты:
H+
С2Н5OH + CH3COOH ↔ C2H5OCOCH3 + H2O.
Задача 11
Одноосновная карбоновая кислота имеет следующий состав: углерод (массовая доля 40,0%), кислород (53,3%), водород (6,7%). Определите формулу этой кислоты. Рассчитайте объем раствора гидроксида натрия (массовая доля NaOH 15% , плотность 1,16 г/мл), который потребуется для нейтрализации образца этой кислоты массой 12 г.
Решение:
Формулу одноосновной карбоновой кислоты можно представить в виде CxHyCOOH или Cx+1Hy+1O2. Выбираем для расчетов образец кислоты массой 100 г. Вычисляем массы и количества вещества С, Н и О в этом образце:
m(C) = m(кислоты) * ω(C)/100;
m(C) = 100*40,0/100 = 40 г.
n(C) = m(C)/M(C);
n(C) = 40/12 = 3,33 моль.
Аналогично получаем, что n(H) = 6,7 моль, n(O) = 3,33 моль.
Коэффициенты в формуле кислоты будут равны:
(x + 1) : (y + 1) : 2 = n(C) : n(H) : n(O);
(x + 1) : (y + 1) : 2 = 3,33 : 6,7 : 3,33 = 2 : 4 : 2.
Отсюда следует, что (x + 1) = 2, x = 1; (y + 1) = 4, y = 3, то есть формула кислоты CH3COOH. Это уксусная кислота.
Записываем уравнение реакции нейтрализации этой кислоты гидроксидом натрия:
CH3COOH + NaOH → CH3COONa + H2O
Из условия задачи следует, что для нейтрализации взят образец кислоты массой 12 г, то есть m(CH3COOH) = 12 г.
Определяем количество вещества кислоты:
n(CH3COOH) = m(CH3COOH)/M(CH3COOH);
n(CH3COOH) = 12/60 = 0,2 моль
Из уравнения реакции следует:
n(NaOH) = n(CH3COOH);
n(NaOH) =0,2 моль.
Вычисляем массу гидроксида натрия, которая реагирует с кислотой:
m(NaOH) = n(NaOH) * M(NaOH) ;
m(NaOH) = 0,2*40 = 8 г.
Рассчитаем массу и объем раствора NaOH , который потребуется для нейтрализации кислоты:
m = m(NaOH)*100/ω(NaOH) ;
m = 8 * 100/15 = 53,3 г.
V = m/ρ;
V = 53,3/1,16 = 46 мл.
Ответ: 46 мл., CH3COOH
Задача 12
Какой объем 15%-ного раствора гидроксида калия (плотность 1,14 г/мл) потребуется для нейтрализации аминоуксусной кислоты, полученной из 12,8 г карбида кальция?
Решение:
Составляем уравнения реакции синтеза аминоуксусной кислоты из карбида кальция:
а) получение ацетилена из карбида кальция
CaC2 + 2H2O → Ca(OH)2 + C2H2
б) получение ацетальдегида (реакция Кучерова)
Hg2+
C2H2 + H2O → CH3COH
в) окисление ацетальдегида любым окислителем
CH3COH + [O] → CH3COOH
г) хлорирование уксусной кислоты
CH3COOH + Cl2 → CH2ClCOOH + HCl
д) взаимодействие хлоруксусной кислоты с аммиаком
CH2ClCOOH + 2NH3 → H2NCH2COOH + NH4Cl
Определяем количество вещества карбида кальция CaC2:
n(CaC2) = m(CaC2)/M(CaC2);
n(CaC2) = 12,8/64 = 0,2 моль.
Из уравнения реакций (а – д) следует, что
n(H2NCH2COOH) = n(CaC2);
n(H2NCH2COOH) = 0,2 моль.
Из уравнения реакции нейтрализации кислоты:
H2NCH2COOH + KOH → H2NCH2COOK + H2O
Следует, что:
n(KOH) = n(H2NCH2COOH) ;
n(KOH) = 0,2 моль
Определяем массу требуемого КОН:
m(KOH) = n(KOH) * M(KOH);
m(KOH) = 0,2 * 56 = 11,2 г.
Вычисляем массу и объем раствора гидроксида калия:
m = m(KOH) * 100/ω(KOH);
m = 11,2 * 100/15 = 74, 67 г.
V = m/ρ ;
V = 74,67/1,14 = 65,5 мл.
Ответ: 65,5 мл.
Задача 13
Как можно получить анилин, исходя из метана и не используя другие органические соединения. Укажите условия протекания реакций.
Решение:
Проводя пиролиз метана, можно получить ацетилен:
t
2CH4 → C2H2 + 3H2
В присутствии угольного катализатора из ацетилена можно получить бензол:
t, C
3С2H2 → C6H6
Под действием нитрирующей смеси ( смесь концентрированных азотной и серной кислот) на бензол образуется нитробензол:
C6H6 + HNO3 → C6H5NO2 + H2O
Из нитробензола можно получить анилин по реакции Н.Н. Зинина, используя в качестве восстановителя сульфид аммония , железо в кислой среде или водород в присутствии катализаторов, например:
C6H5NO2 + 3H2 → C6H5NH2 + 2H2O
Задача 14
Определите молярную массу (гмоль) алкана, содержащего 16 атомов водорода. Составьте структурную формулу. Назовите вещество
Решение:
1) Запишем общую формулу гомологического ряда алканов: СnН2n+2
2) Запишем формулу алкана с 16 атомами водорода:
Если водорода 16 атомов, то углерода соответственно 7.
3) Учитывая, что молярная масса – масса одного моля вещества – численно равна относительной молекулярной массе , а последняя равна сумме атомных масс элементов, входящих в вещество, с учетом индексов, запишем выражение для определения молярной массы заданного алкана с 16 атомами водорода.
М(С7Н16)= 12*7+16*1=100гмоль
4) Составим структурную формулу:
СН3 – СН2 – СН2 – СН2 – СН2 – СН2 –СН3
5) Назовем вещество: гептан.
Ответ: 100 г/моль
Задача 15
Молекулярная масса алкина равна 54 .Определите, сколько атомов водорода он содержит? Составьте структурную формулу. Назовите вещество.
Решение:
1) Запишем общую формулу гомологического ряда алкинов: СnН2n-2
2) Учитывая, что молярная масса – масса одного моля вещества – численно равна относительной молекулярной массе , а последняя равна сумме атомных масс элементов, входящих в вещество, с учетом индексов, запишем выражение для определения молярной массы заданного алкина ,зная что она равна 54.
М=12*n+1*(2n -2);
54=12*n+1*(2n -2);
3 Найдем n:
54= 12 n+2 n-2
14 n=56;
n=4
3) Найдем число атомов водорода в молекуле, если n=4.
Атомов водорода соответственно 6.
4) Составим структурную формулу:
СН≡С — СН2 – СН3
5) Назовем вещество:
Бутин – 1 .
Задача 16
Какими способами можно распознать бутен , бутанол, бутановую кислоту? Составьте план решения, опишите наблюдения, составьте уравнения реакций.
Решение:
1 Рассмотрим функциональные особенности веществ:
а ) бутен СН2=СН – СН2– СН3 относится к ненасыщенным углеводородам, содержащим двойную связь.
б ) бутанол СН3— СН 2– СН2– СН2ОН относится к насыщенным одноатомным спиртам.
в) бутановая кислота СН3— СН 2– СН2– СООН относится к насыщенным одноатомным кислотам, содержит карбоксильную группу.
2 Рассмотрим качественные реакции:
а ) Качественной реакцией на алкены является пропускание их через бромную воду или раствор перманганата калия.
б ) Качественной реакцией на насыщенные одноатомные спирты является взаимодействие с металлическим натрием.
в) Качественной реакцией на карбоновые кислоты является изменение окраски индикатора в их среде и взаимодействие их со спиртами.
3 Опишем наблюдения и составим уравнения реакций.
а ) При пропускании бутена через бромную воду происходит обесцвечивание раствора.
СН2=СН – СН2– СН3 + Br2 = СН2— СН – СН2– СН3
Br Br
СН2=СН – СН2– СН3 + 2 [O]= СН2 — СН – СН2– СН3
ОН ОН
б ) При действии на спирты металлического натрия наблюдается выделение газа и образование студенистой массой алкоголята.
2СН3— СН 2– СН2– СН2ОН +2 Na=2 СН3— СН 2– СН2– СН2О Na + Н2
в) При добавлении к раствору бутановой кислоты индикатора лакмуса или метилового оранжевого наблюдается красное окрашивание.
При нагревании кислоты со спиртом в присутствии концентрированной серной кислоты появляется «эфирный запах» и образование слоя эфира, не смешивающегося с водой.
СН3— СН 2– СН2– СООН + С2Н5ОН = СН3— СН 2– СН2– СОО С2Н5 + Н2О.
Задача 17
Органическое вещество содержит углерод(массовая доля 84,21%) и водород (15,79%).Плотность паров вещества по воздуху составляет 3,93. Определите формулу этого вещества.
Решение :
W(С)= 84,21%.| 1 Пусть масса вещества 100г.
W(Н)= 15,79%.| 2 Тогда m(С)=84,21г, m(Н)=15,79г.
D(возд) = 3,93.| 3 Найдем соотношение количеств веществ:
____________|_υ(С): υ(Н)=84,2112 :15,79/1=7,0175:15,79=1:2,25=4:9.
Сx Нy С4Н9 — простейшая формула.
Найдем молярную массу простейшей формулы:
М(С4Н9)=57гмоль.
Найдем молярную массу истиной формулы:
Мист=3,93*29=114гмоль.
Найдем соотношение истиной и простейшей молярных масс:
Ми = 114 = 2.
Мпр 57
Ответ: С8Н18 – истинная формула.
Задача 18
Сколько граммов пропанола-2 с выходом 80% от теоретически возможного получится из 200г пропилена.
Решение:
m(С3Н6)= 200г.|
1 Составим уравнение реакции получения пропанола-2.
W(С3Н7ОН)= | СН2=СН – СН3 + Н2О= СН3 – СН – СН3
80% | |
____________ | ОН
m(С3Н7ОН)=?
2 Найдем количество вещества пропена, вступившего в реакцию:
υ(С3Н6)= mМ
υ(С3Н6)= 20042=4,76моль.
3 Найдем по уравнению, что количество вещества пропанола -2 равно количеству вещества пропена, вступившего в реакцию:
υ(С3Н7 ОН)=4,76 моль.
4 Найдем массу теоретическую образовавшегося пропанола-2
m = υ*М;
m = 4,76*60=285,7г
5 Учитывая, что выход вещества составляет 80%, найдем массу практическую продукта.
m пр= mтеор* W100%
m пр= 285,7*80100=228,6г.
Ответ: 228,6г.
Задача 19
Какой объем (при нормальных условиях) займет метан, образовавшийся из 100г ацетата натрия.
Решение:
m (СН3СООNa)= 100г.|
1 Составим уравнение реакции получения метана:
CH3COONa+NaOH=CH4+Na2CO3
VCH4 =?
2 Найдем количество вещества ацетата натрия, вступившего в реакцию:
υ(CH3COONa)= mМ
υ(CH3COONa)= 10082=1,22моль.
3 Найдем по уравнению, что количество вещества метана равно количеству вещества ацетата натрия, вступившего в реакцию.
υ(CH4)=1,22моль.
4 Найдем объем метана, образовавшегося в результате реакции:
V=Vm* υ;
Vm=22,4 лмоль.
V=22,4*1,22=27,3л
Ответ: 22,4л.
Задача 20
Сколько литров (н.у.) образуется из 50г 60% -ного карбида кальция.
Решение:
m(СаС2)= 50г |
1 Составим уравнение реакции получения ацетилена:
W(СаС2)=60% | СаС2+2Н2О=С2Н2+Са(ОН)2
VC2H2=?
2 Найдем массу чистого карбида кальция:
m(СаС2)=50*60100=30г.
3 Найдем количество вещества карбида кальция, вступившего в реакцию:
υ(СаС2)= mМ
υ(СаС2)=3064=0,47 моль.
4 Найдем по уравнению, что количество вещества ацетилена равно количеству вещества карбида кальция, вступившего в реакцию:
υ(С2Н2)=0,47 моль.
5 Найдем объем ацетилена, образовавшегося в результате реакции:
V=Vm* υ;
Vm=22,4 лмоль.
V=22,4* 0,47=10,5л.
Ответ: 10,5л.
Задача 21
Определить выход эфира в процентах от теоретически возможного , если из 300г уксусной кислоты и соответствующего количества спирта получено 400г этилацетата.
Решение :
m(СН3СООН)=300г |
1 Составим уравнение реакции
m (СН3СООС2Н5)= 400г.| СН3СООН+ С2Н5ОН= СН3СООС2Н5 +Н2О
W (СН3СООС2Н5)= ? |
2 Найдем количество вещества уксусной кислоты, вступившей в реакцию:
υ(СН3СООН)= mМ
υ(СН3СООН)=30060=5 моль.
3 Найдем по уравнению, что количество вещества этилацетата равно количеству вещества уксусной кислоты, вступившей в реакцию:
υ(СН3СООС2Н5)=5моль.
4 Найдем теоретическую массу образовавшегося этилацетата
m = υ*М;
m(СН3СООС2Н5)=5*88=440г
5 Учитывая, что масса практическая этилацетата 400г, найдем массовую долю выхода продукта:
W= mпр mтеор *100% ;
W=400440*100=90%.
Ответ: 90%.
Задача 22
Определить содержание примесей (в процентах)в карбиде кальция , если из 170г карбида кальция получено 50г ацетилена.
Решение :
m(СаС2)= 170г |
1 Составим уравнение реакции получения ацетилена:
m (C2H2)= 50г | СаС2+2Н2О=С2Н2+Са(ОН)2
W(прим)= ?
2 Найдем количество вещества ацетилена, образовавшегося в результате реакции:
υ(С2Н2)= mМ
υ(С2Н2)=5026=1,92моль.
3 Найдем по уравнению, что количество вещества карбида кальция равно количеству вещества ацетилена, образовавшегося в результате реакции:
υ(СаС2)= 1,92моль.
4 Найдем массу чистого карбида кальция:
m = υ*М;
m (СаС2)=1,92*64=123г
5 Найдем массу примесей:
m (прим)= m(загряз. в-ва)— m(чист. в-ва)
m (прим) =170-123=47г
6 Найдем массовую примесей в карбиде:
W(прим)= m (прим) m(загряз. в-ва) *100%
W(прим)= 47170*100=27,6%
Ответ : 27,6%
Задача 23
Сколько граммов этилового спирта нужно взять для получения 200г диэтилового эфира , если выход продукта равен 80% от теоретически возможного.
Решение :
m ( С2Н5ОС2Н5) =200г|
1 Составим уравнение реакции
W=80% | С2Н5ОН+ С2Н5ОН= С2Н5ОС2Н5 +Н2О
m ( С2Н5ОН)= ?
2 Найдем теоретическую массу образовавшегося продукта:
m теор= mпр* 100% W
m теор=200*10080=250г.
3 Найдем количество вещества диэтилового эфира, образовавшегося в результате реакции:
υ(С2Н5ОС2Н5)= mМ
υ(С2Н5ОС2Н5)=25074=3,38моль.
4 Найдем по уравнению, что количество вещества этанола в 2 раза больше количеств вещества диэтилового эфира , вступившего в реакцию.
υ(С2Н5ОН)=3,38*2=6,76моль.
5 Найдем массу этанола, вступившего в реакцию:
m = υ*М;
m =6,76*46=310,8г
Ответ: 310,8 г
Задача 24
Сколько грамм 8% раствора уксусной кислоты необходимо для получения водорода объемом 2,8л при взаимодействии ее с магнием.
Решение:
V(Н2)=2,8л |
1 Составим уравнение реакции
W(СН3СООН)=8% | 2 СН3СООН+Мg= (СН3СОО)2 Мg +Н2
m (р-ра)= ?
2 Найдем количество вещества водорода, образовавшегося в результате реакции :
υ = V Vm;
Vm=22,4 лмоль
υ =2,822,4=0,125моль.
3 Найдем по уравнению, что количество вещества водорода в 2 раза меньше количеств вещества уксусной кислоты, вступившей в реакцию:
υ (СН3СООН)= 0,125*2=0,25моль.
4 Найдем массу уксусной кислоты:
m = υ*М;
m = 0,25*60=15г
5 Найдем массу раствора уксусной кислоты:
W= m в-ва m р-ра*100%
m р-ра = m в-ва* 100 W.
m р-ра = 15*1008=187,5 г
Ответ: 187,5 г
Задача 25
Сколько граммов этилацетата можно получить при взаимодействии 100г уксусной кислоты с 50г этанола.
Решение :
m(СН3СООН)=100г|
1 Составим уравнение реакции
m (С2Н5ОН)= 50г. | СН3СООН+ С2Н5ОН= СН3СООС2Н5 +Н2О
m (СН3СООС2Н5)= ?|
2 Найдем количество веществ уксусной кислоты и этанола, вступившей в реакцию:
υ= mМ
υ(СН3СООН)= 10060=1,67моль.
υ(С2Н5ОН)= 5046=1,09 моль.
3 Так как по уравнению реакции уксусная кислота и этанол реагирует 1:1, то из найденных значений видно, что в избытке находится уксусная кислота и часть ее останется после реакции, а этанол прореагирует полностью. Решаем по недостатку.
4 Найдем по уравнению, что количество вещества этанола равно количеству вещества этилацетата, образовавшегося в результате реакции:
υ(СН3СООС2Н5 )=1,09моль.
5 Найдем массу этилацетата:
m = υ*М;
m = 1,09*88=95,7г ответ : 95,7г
Ответ: 95,7 г.
при полном сгорании 8,8 г органического вещества образовалось 17,6 г углекислого газа и 7,2 г воды. Относительная плотность вещества по водороду равна 36. Определи молекулярную формулу вещества.
1. Определим количества углерода в углекислом газе и водорода в воде:
n(C)=n(CO2)=17,6г44г/моль=0,4моль;
n(H)=2n(H2O)=2⋅7,2г18г/моль=0,8моль.
2. Определим, содержится ли в веществе кислород:
m(O)=m(в−ва)−m(C+H)=8,8−(0,4⋅12+0,8⋅1)=3,2г.
Значит, в сгоревшем веществе есть кислород и формулу можно записать так:
CxHyOz
.
3. Найдём количество кислорода:
n(O)=3,2г16 г/моль=0,2моль.
4. Отношение индексов в молекуле:
x:y:z=0,4моль:0,8моль:0,2моль=4:8:1.
Значит, простейшая формула вещества —
C2H4O
.
5. Определим относительную молекулярную массу вещества по его плотности и сравним с массой
C2H4O
:
Mr(CxHyOz)=DH2⋅Mr(H2)=36
·2=72.
Mr(C2H4O)=2⋅12+4⋅1+1⋅16=72.
Следовательно, простейшая и молекулярная формулы совпадают.
I. Нахождение формулы органического вещества по массовой доле химических элементов и относительной плотности газов
1. Выпишите в тетрадь основные формулы
D2 = Mr(1)/Mr(2)
D — относительная плотность первого газа по второму (безразмерная величина).
Например:
D(O2) = Mr(газа)/Mr(O2)=Mr(газа)/32;
D(H2) = Mr(газа)/Mr(H2)=Mr(газа)/2;
D(воздуха)=Mr(газа)/Mr(воздуха)=Mr(газа)/29
Wэлемента = (n * Ar (элемента) * 100%) / Mr (вещества),
где n – индекс, число атомов;
W – массовая доля элемента (%).
2. Разберите образец решения задачи
Этиловый спирт содержит 52,18% углерода:13,04% водорода: 34,78% кислорода. Плотность паров спирта по водороду 23. Определите формулу этилового спирта.
Решение:
1. Определим молекулярную массу искомого вещества:
Mr(CxHyOz) = D(H2) · Mr(H2)=23· 2 =46
2.По формуле n = (Wэлемента * Mr(вещества)) / Ar элемента * 100% вычислим число атомов C, H, O
n(C)=(52,18% · 46) / 12· 100% = 2
n(H)=( 13,04% · 46) /1· 100% =6
n(O)=( 34,78% · 46) / 16· 100% =1
Получаем x:y:z =2:6:1, следовательно, вещество C2H6O
Проверка, Mr(C2H6O)= 46
II. Нахождение формулы органического вещества по массовой доле химических элементов и плотности вещества при нормальных условиях
1. Выпишите в тетрадь основные формулы
M = ρ * Vm
где Vm =22,4 л/моль (при н.у.);
M – молярная масса вещества (г/моль);
ρ = m/V (плотность)
Wэлемента = (n * Ar (элемента) * 100%) / Mr (вещества),
где n – индекс, число атомов;
W – массовая доля элемента (%)
2. Разберите образец решения задачи
Углеводород содержит 81,82% углерода. Масса 1 л этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу этого углеводорода.
Решение:
1. Определим молярную массу искомого вещества:
ρ = m/V, следовательно М(СхНу) = ρ· Vm = 1,964 г/л · 22,4 л/моль = 44
2. По формуле: n = (Wэлемента * Mr(вещества)) / Ar элемента * 100%
вычислим число атомов C, H.
Здесь Мr=M
n(C)=(81,82% · 44) / (12 · 100%) = 3
n(H)=(18,18% · 44) / (1· 100%) = 8
Получаем x:y =3 : 8, следовательно, вещество C3H8
Проверка, Mr(C3H8)= 44
III. Определение формулы по продуктам сгорания
Разберите образец решения задачи
При сгорании 10,5 г органического вещества получили 16,8 л углекислого газа (н.у.) и 13,5 г воды. Плотность этого вещества при н.у. равна 1,875 г/л. Определите молекулярную формулу вещества.
Решение:
1. Находим молярную массу вещества и его количество вещества:
Если в условии задачи дана относительная плотность органического вещества, то его молекулярную массу определяем согласно формулам:
D(O2) = Mr(газа)/Mr(O2)=Mr(газа)/32;
D(H2) = Mr(газа)/Mr(H2)=Mr(газа)/2;
D(воздуха)=Mr(газа)/Mr(воздуха)=Mr(газа)/29.
M(вещества) = ρ· Vm = 1.875 г/л · 22,4 л/моль = 42 г/моль
υ(вещества ) = m / M = 10,5 г / 42 г/моль = 0,25 моль
2. Найдём количества вещества C, H по формулам:
υ = V/Vm или υ = m/M
υ(C) = υ(CO2)= V/Vm =16,8 л/22,4 л/моль=0,75 моль
υ(H) = 2 · υ(H2O) = 2 · m/M = (2 · 13,5 г)/18 г/моль = 1,5 моль
3. Определим наличие кислорода в формуле вещества:
m(C) = υ(C) · M(C) = 0,75 моль · 12 г/моль = 9 г
m(H) = υ(H) · M(H) = 1,5 моль · 1 г/моль = 1,5 г
m(O) = m(вещества) – (m(C) + m(H)) = 10.5 г – (9 г + 1,5 г) = 0 г, следовательно кислород отсутствует и это углеводород — CxHy
4. Находим формулу
υ(CxHy) : υ(С) : υ(Н) = 0,25 : 0,75 : 1,5 = 1 : 3 : 6
(здесь к целым числам пришли путём деления всех чисел на меньшее из них, т.е. на 0,25)
Следовательно, 1 моль вещества содержит 3 моль углерода и 6 моль водорода, таким образом, искомая формула С3Н6.
IV. Решите задачи
Задача №1. В углеводороде массовая доля углерода равна 84%. Относительная плотность паров углеводорода по воздуху равна 3,45. Определите формулу углеводорода.
Задача №2. Массовая доля углерода в углеводороде составляет 83,33%. Плотность паров углеводорода по водороду равна 36. Определите формулу.
Задача №3. Массовая доля углерода в углеводороде составляет 85,7%. Плотность паров углеводорода по воздуху равна 1,931. Определите формулу.
Задача №4. Углеводород содержит 16,28% водорода. Плотность этого вещества при нормальных условиях 3,839 г/л. Найдите молекулярную формулу этого углеводорода.
Задача №5. Углеводород содержит 82,76% углерода. Масса 1 л этого углеводорода (н.у.) составляет 2.589 г. Найдите молекулярную формулу этого углеводорода.
Задача №6. При сгорании вещества массой 4,25 г образовались оксид углерода (IV) массой 13,2 г и вода массой 5,85 г. Относительная плотность паров этого вещества по воздуху равна 5,862. Определите формулу вещества.