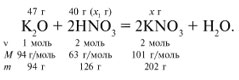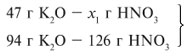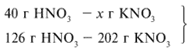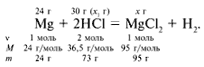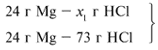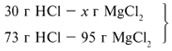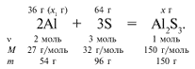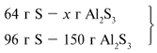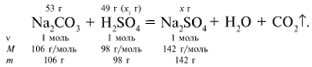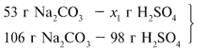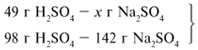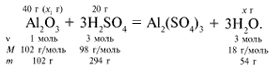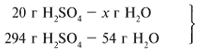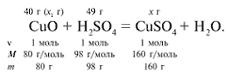Методика решения задач
на «избыток–недостаток»
в курсе основной
общеобразовательной школы
Умение решать химические задачи –
важная составляющая знаний по предмету. Согласно
государственному стандарту образования по химии
учащиеся, оканчивающие школу, должны уметь
решать более десятка типов стандартных задач.
Среди них и задачи на «избыток–недостаток».
Предлагаю свой вариант подачи материала по
решению таких задач в курсе химии 9-го класса.
На изучение этой темы отвожу 2–2,5 урока, в
зависимости от уровня способностей учеников
класса. Ознакомление с алгоритмом решения задач
данного типа происходит в рамках изучения темы
«Теория электролитической диссоциации». Однако
если класс сильный, то в рамках эксперимента этот
тип задач иногда изучаем и в конце 8-го класса в
главе «Галогены», а высвободившееся время можно
потратить на изучение органической химии в курсе
9-го класса.
На первом уроке разбираю два типа задач на
«избыток–недостаток»:
одно из двух
вступивших в реакцию веществ дано в избытке;
оба вступивших в
реакцию вещества расходуются на взаимодействие
друг с другом без остатка, т. е. даны в
стехиометрических количествах.
В качестве домашнего задания обязательно
предлагаются две-три задачи, подобные изученным
на уроке.
На втором уроке закрепляю и углубляю изученный
материал, ввожу понятия «процентная
концентрация растворов веществ», вступивших в
реакцию, «плотность растворов». Кроме того,
усложняю задачи, вводя «процентное содержание
примесей в исходном веществе» и т. д. Такой прием
позволяет повторить элементы уже изученного
материала, сэкономить время. В конце второго
урока изучения темы или в начале третьего
провожу небольшую самостоятельную работу на
закрепление изученного материала, включающую
одну-две задачи, причем самостоятельная работа
предлагается в трех уровнях сложности, в
зависимости от способностей ученика.
Урок 1
Решение задач на «избыток–недостаток»
Цели.
- научить алгоритму решения
задач нового типа; - закрепить навыки устного
счета; - повторить правила расчета
относительных молекулярных масс веществ; - закрепить правила грамотного
оформления условия задачи; - формировать навыки
химического мышления, логики, а также
способствовать воспитанию гармоничной,
всесторонне развитой личности.
ХОД УРОКА
Рассмотрим вариант,
когда одно из вступивших в реакцию веществ дано в
избытке, другое – в недостатке.
Решая химические задачи, следует не забывать о
правилах их грамотного оформления по схеме: дано,
найти, решение, ответ.
ЗАДАЧА 1. На 47 г оксида калия
подействовали раствором, содержащим 40 г азотной
кислоты. Найдите массу образовавшегося нитрата
калия.
Дано:
m(K2O) = 47 г,
m(HNO3) = 40 г.Найти:
m(КNO3).
Решение
Рассчитаем относительные молекулярные массы
интересующих нас веществ:
Mr(K2O) = 2Ar(K) + 1Ar(O)
= 2•39 + 1•16 = 94,
Mr(HNO3) = 1Ar(H) + 1Ar(N)
+ 3Ar(O) = 1•1 + 1•14 + 3•16 = 63,
Mr(KNO3) = 1Ar(K) + 1Ar(N)
+ 3Ar(O) = 1•39 + 1•14 + 3•16 = 101.
Для удобства расчета за х1 примем
массу НNО3 и найдем, какое из веществ,
вступивших в реакцию, дано в избытке, какое – в
недостатке.
47/94 = х1/126, х1 = 63 г.
Следовательно, азотная кислота дана в
недостатке, т. к. по условию ее 40 г, а по расчету
необходимо 63 г, поэтому расчет ведем по HNO3:
40/126 = х/202, х = 64 г.
Ответ. m(КNO3) = 64 г.
ЗАДАЧА 2. На 24 г металлического магния
подействовали 100 г 30%-го раствора соляной кислоты.
Найдите массу образовавшегося хлорида магния.
Дано:
m(Mg) = 24 г,
m(р-р HCl) = 100 г,
(HCl) = 30%.
Найти:
m(MgCl2).
Решение
Рассчитаем относительные молекулярные массы
интересующих нас веществ:
Mr(HCl) = 1Ar(H) + 1Ar(Cl)
= 1 + 35,5 = 36,5,
Mr(MgCl2) = 1Ar(Mg) +
2Ar(Cl) = 24 + 2•35,5 = 95.
Для удобства расчета за х1 примем
массу соляной кислоты и найдем, какое из веществ,
вступивших в реакцию, дано в избытке, какое – в
недостатке.
24/24 = х1/73, х1 = 73 г.
Из расчета видно, что соляная кислота дана в
недостатке, т. к. по условию задачи ее дано 30 г, а
для реакции требуется 73 г. Следовательно, расчет
ведем по соляной кислоте:
30/73 = х/95, х = 39 г.
Ответ. m(MgCl2) = 39 г.
Рассмотрим вариант,
когда оба вступивших в реакцию вещества даны в
стехиометрических количествах, т. е. реагируют
друг с другом без остатка.
ЗАДАЧА 1. На 36 г алюминия подействовали
64 г серы. Найдите массу образовавшегося сульфида
алюминия.
Дано:
m(Al) = 36 г,
m(S) = 64 г.Найти:
m(Al2S3).
Решение
Примем массу Al за х1 и найдем, какое
из веществ, вступивших в реакцию, дано в избытке,
какое – в недостатке.
х1/54 = 64/96, х1 = 36 г.
В данном случае вещества, вступившие в реакцию,
взяты в стехиометрических количествах, поэтому
расчет можно вести по любому из них:
64/96 = х/150, х = 100 г.
Ответ. m(Al2S3) = 100 г.
ЗАДАЧА 2. На раствор, содержащий 53 г
карбоната натрия, подействовали раствором,
содержащим 49 г серной кислоты. Найдите массу
образовавшейся соли.
Дано:
m(Na2CO3) = 53 г,
m(H2SO4) = 49 г.Найти:
m(Na2SO4).
Решение
Рассчитаем относительные молекулярные массы
интересующих нас веществ:
Mr(Na2CO3) = 2Ar(Na)
+ 1Ar(C) + 3Ar(O) = 2•23 + 1•12 + 3•16 =
106.
Mr(H2SO4) = 2Ar(H)
+ 1Ar(S) + 4Ar(O) = 2•1 + 1•32 + 4•16 = 98.
Mr(Na2SO4) = 2Ar(Na)
+ 1Ar(S) + 4Ar(O) = 2•23 + 1•32 + 4•16 =
142.
Примем за х1 массу cерной кислоты,
чтобы узнать, какое вещество дано в избытке,
какое – в недостатке.
53/106 = х1/98, х1 = 49 г.
В данном случае оба вещества взяты в
стехиометрических количествах, поэтому расчет
можно вести по любому из них:
49/98 = х/142, х = 71 г.
Ответ. m(Na2SO4) = 71 г.
Однако учитель, подбирая задачи для решения в
классе, должен помнить, что в некоторых случаях
(например, если кислота или кислотный оксид дан в
избытке) решение задачи не ограничивается
расчетом двух пропорций, т. к. реакция будет
протекать дальше с образованием кислой соли. Это
повысит сложность материала. На первых уроках
при решении задач данного типа я не включаю в
материал задачи на прохождение реакций с
образованием кислых или основных солей.
Домашнее задание
ЗАДАЧА 1. На 200 г 10%-го раствора серной
кислоты подействовали 40 г оксида алюминия.
Найдите массу образовавшейся воды.
Дано:
M(р-р H2SO4) = 200 г,
(H2SO4) =
10%,
m(Al2O3) = 40 г.Найти:
m(Н2O).
Решение
Рассчитаем относительные молекулярные массы
интересующих нас веществ:
Mr(Al2O3) = 2Ar(Al)
+ 3Ar(O) = 2•27 + 3•16 = 102,
Mr(H2SO4) = 2Ar(H)
+ 1Ar(S) + 4Ar(O) = 2•1 + 1•32 + 4•16 = 98,
Mr(H2O) = 2Ar(H) + 1Ar(O)
= 2•1 + 1•16 = 18.
m(H2SO4) = 200•10/100 = 20 г.
Найдем, какое из вступивших в реакцию веществ
дано в избытке, а какое – в недостатке.
х1/102 = 20/294, х1 = 6,94 г.
Из расчета видно, что Al2O3 дан в
избытке, следовательно, расчет ведем по кислоте:
20/294 = х/54, х = 3,67 г.
Ответ. m(Н2O) = 3,67 г.
ЗАДАЧА 2. На 40 г оксида меди(II)
подействовали раствором серной кислоты,
содержащим 49 г безводного вещества. Найдите
массу образовавшейся соли.
Дано:
m(CuO) = 40 г,
m(H2SO4) = 49 г.Найти:
M(СuSO4).
Решение
Найдем, какое из веществ, вступивших в реакцию,
дано в избытке, а какое – в недостатке.
х1/80 = 49/98, х1 = 40 г.
Cогласно уравнению данной реакции вещества
взяты в стехиометрических количествах, поэтому
расчет можно вести по любому из них:
40/80 = х/160, х = 80 г.
Ответ. m(CuSO4) = 80 г.
В.А.ДЕМИДОВ,
учитель химии Синегорской
средней школы
(Нагорский р-н,
Кировская обл.)
Решение задач, когда одно из веществ в избытке
(ответы и решения)
Ключевые слова конспекта: расчет массы, объема продукта реакции, если одно из реагирующих веществ дано в избытке; решение задач, когда одно из веществ в избытке.
Вещества реагируют друг с другом в строго определенных количествах. Однако исходные вещества для проведения реакции могут быть взяты в любых количествах. Таким образом, одно из реагирующих веществ может оказаться в избытке, а другое — в недостатке. В этом случае необходимо определить, какое из реагирующих веществ находится в избытке, а какое — в недостатке, и дальнейшие расчеты производить по веществу, находящемуся в недостатке. Это обусловлено тем, что вещество, находящееся в недостатке, прореагирует полностью, таким образом, количество вещества данного реагента нам будет точно известно.
Для того чтобы определить, какое из реагирующих веществ находится в избытке, а какое — в недостатке, необходимо вычислить количества вещества реагентов и сравнить их. Если количества вещества реагентов, участвующих в химической реакции, одинаковы, то в избытке будет то вещество, количество которого больше в соответствии с условиями задачи. Например, если в реакцию, уравнение которой Н2 + Сl2 = 2НСl, взять 0,2 моль водорода и 0,15 моль хлора, то в избытке будет водород, а в недостатке — хлор, так как v(H2) > v(Cl2). Расчет количества образовавшегося водорода в этом случае следует вести по количеству вещества хлора.
Если же вещества реагируют в неравных количествах, то для расчета избытка и недостатка следует учитывать коэффициенты в уравнении реакции. Например, для реакции, уравнение которой 2Н2 + O2 = 2Н2O, отношение количества веществ водорода и кислорода, реагирующих друг с другом, имеет следующий вид:
При использовании количеств веществ, соответствующих условию задачи, это выражение превращается в неравенство, которое и показывает, какое из веществ взято в реакции в избытке. Например, если в рассматриваемой реакции использовать 0,2 моль водорода и 0,15 моль кислорода, в недостатке будет водород, несмотря на то что количество вещества его больше. Это следует из соотношения: 1 • v(H2) < 2 • v(O2), или 1 • 0,2 < 2 • 0,15, учитывающего коэффициенты в уравнении реакции.
Таким образом, расчет количества образовавшейся воды в данном случае следует вести по количеству вещества водорода.
Особые трудности возникают в тех случаях, когда в зависимости от того, какой из реагентов в избытке, образуются различные продукты реакции. Например, если углекислый газ взаимодействует с избытком гидроксида кальция, образуется средняя соль — карбонат кальция:
Са(ОН)2 + СO2 = CaCO3 ↓ + Н2O.
Если же в избытке углекислый газ, то в результате реакции образуется кислая соль — гидрокарбонат кальция:
Са(ОН)2 + 2СO2 = Са(НСO3)2.
Поэтому в ряде случаев определение избытка и недостатка следует проводить еще до составления уравнения химической реакции.
В некоторых случаях вещество, взятое в избытке, взаимодействует с одним из продуктов реакции, например при восстановлении магнием оксида кремния (IV) по реакции:
взятый в избытке магний будет взаимодействовать с образовавшимся кремнием:
Такие превращения нужно также учитывать при решении задач.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
Сколько граммов поваренной соли образуется при сливании растворов, содержащих 24 г гидроксида натрия и 14,6 г хлороводорода?
Посмотреть РЕШЕНИЕ

Ответ. m(NaCl) = 23,4 г.
Задача № 2.
Вычислите массу хлорида железа (III), образующегося при взаимодействии 14 г железа и 5,6 л (н. у.) хлора.
Посмотреть РЕШЕНИЕ

О т в е т. m(FeCl3) = 27,08 г.
Задача № 3.
Водород, полученный при разложении 12,6 г гидрида кальция водой, пропустили над 40 г нагретого оксида меди (II). Определите массу образовавшегося металла.
Посмотреть РЕШЕНИЕ

Ответ. m(Cu) = 32 г.
Задача № 4.
Газ, полученный при взаимодействии 19,8 г сульфата аммония и 32 г 25% -ного раствора гидроксида натрия, смешали с газом, полученным при разложении 24,5 г бертолетовой соли. Газовую смесь пропустили через 73г 5%-ного раствора соляной кислоты. Определите состав смеси газов после прохождения через раствор.
Посмотреть РЕШЕНИЕ

Ответ. V(O2) = 6,72 л, V(NH3) = 2,24 л.
Задача № 5.
Каков состав и какова масса соли, которая образуется при пропускании 26,88 л (н. у.) углекислого газа через 210 г раствора с массовой долей гидроксида калия 24% ?
Посмотреть РЕШЕНИЕ

Ответ. m(КНСO3) = 90 г.
Задача № 6.
Смешали 200 г 14% -ного раствора гидроксида натрия и 392 г 10% -ного раствора серной кислоты. Определите массовые доли солей в образовавшемся растворе.
Посмотреть РЕШЕНИЕ

Ответ. ω(NaHSO4) = 2,03%; ω(Na2SO4) = 7,2%.
Задача № 7.
Вычислите массу осадка, который образуется при прибавлении 280 г 20% -ного раствора гидроксида калия к 160,2 г 25%-ного раствора хлорида алюминия.
Посмотреть РЕШЕНИЕ
Ответ. m(А1(ОН)3) = 15,6 г.
ЗАДАЧИ с КРАТКИМ ОТВЕТОМ
- Сколько граммов осадка образуется при взаимодействии 340 г 17,5%-ного раствора нитрата серебра и 109,5 г 20% -ной соляной кислоты?
Ответ. m(AgCl) = 50,2 г.
- 29,12 л аммиака (н. у.) пропустили через 160,17мл раствора 30%-ной азотной кислоты (р = 1,18 г/мл). Определите массу образовавшейся соли.
Ответ. m(NH4NO3) = 72 г.
- Сколько граммов воды образуется при сжигании смеси, содержащей 56 л водорода (н. у.) и 56 г кислорода?
Ответ. m(Н2O) = 45 г.
- Какой объем газа (н. у.) выделится при взаимодействии 24 г смеси алюминия с кремнием, массовая доля алюминия в которой 45%, с 506,1 мл 10% -ного раствора серной кислоты (р = 1,065 г/мл)?
Ответ. V(H2) = 12,32 л.
- К 280 г 10%-ного раствора гидроксида натрия добавили 75 г медного купороса. Выпавший осадок отделили и прокалили. Определите массу образовавшегося продукта и назовите его.
Ответ. m(CuO) = 24 г, оксид меди (II).
- Через 68 г 4%-ного раствора сероводородной кислоты H2S пропустили газ, образовавшийся при сжигании 0,96 г серы в избытке кислорода. Какова масса образовавшегося осадка?
Ответ. m(S) = 2,88 г.
- Нагрели смесь, содержащую 32,5 г цинка и 11,2 г серы. После этого смесь обработали избытком соляной кислоты. Определите объем выделившегося газа (н. у.).
Ответ. V(газа) = 11,2 л.
- Газ, образовавшийся при обработке 19,2 г меди 22,79мл 94%-ной серной кислотой (р = 1,83 г/мл), пропустили через 1200 г бромной воды с массовой долей брома 4% . Будет ли раствор бесцветным после пропускания газа?
Ответ. Раствор останется окрашенным.
- 10,8 г серебра обработали 72,41 мл 30%-ной азотной кислоты (р = 1,48 г/мл). К полученному раствору добавили 18,72 г 25%-ного раствора хлорида натрия. Найдите массу образовавшегося осадка.
Ответ. m(осадка) = 11,48 г.
- Газ, полученный при обработке 26,4 г сульфида железа (II) 73 г 20%-ной соляной кислоты, пропустили через 198,6 г 25% -ного раствора нитрата свинца (II). Определите массу образовавшегося осадка.
Ответ. m(осадка) = 35,85 г.
- Определите массу и состав соли, которая образуется при пропускании 15,68 л аммиака (н. у.) через 61,25 г 40% -ного раствора серной кислоты.
Ответ. m((NH4)2SO4) = 33 г.
- Какая соль образуется при сливании 177 мл 12%-ного раствора гидроксида натрия (р = 1,13 г/мл) и 194,44 мл 14%-ного раствора фосфорной кислоты (р = 1,08 г/мл)? Какова ее масса?
Ответ. m(Na2HPO4) = 42,6 г.
- В 588 г раствора 10%-ной серной кислоты опустили кусочек цинка массой 52 г. Выделившийся водород пропустили при нагревании над 90 г оксида кобальта (II). Найдите массу образовавшегося металла.
Ответ. m(Со) 35,4 г.
- Через 224 г 20%-ного раствора гидроксида калия пропустили 13,44 л (н. у.) оксида серы (IV). Вычислите массы солей в полученном растворе.
Ответ. m(K2SO3) = 31,6 г, m(KHSO3) = 48 г.
- Какова масса осадка, выделившегося при пропускании 5,6 л (н. у.) углекислого газа через известковую воду, содержащую 11,1 г гидроксида кальция?
Ответ. m(осадка) = 5 г.
- В 200 мл воды растворили 56,8 г оксида фосфора (V). К полученному раствору прибавили
76,9 мл раствора с массовой долей NaOH 40% (р = = 1,43 г/мл). Найдите массовые доли солей в полученном растворе.
Ответ. ω(Na2HPO4) — 11,61%, ω(NaH2PO4) = 10,36%.
- Каковы объемные доли газов, образующихся при прокаливании 28,8 г углерода в присутствии 33,6 л кислорода (н. у.)?
Ответ. φ(СО) = 75%, φ(СO2) = 25%.
- После прокаливания смеси, содержащей 32,4 г алюминия и 64 г оксида железа (III), ее обработали избытком соляной кислоты. Определите объем выделившегося при этом газа (н. у.).
Ответ. V(газа) = 31,36 л.
- Какую массу кремния можно получить, прокаливая 21 г оксида кремния (IV) с 32 г кальция?
Ответ. m(Si) = 8,4 г.
- 32,5 г цинка растворили в 240 г 20%-ного раствора гидроксида натрия. К полученному раствору добавили 204,4 г 25% -ной соляной кислоты. Определите массу полученного осадка.
Ответ. m(осадка) = 39,6 г.
Задачи на количества исходных веществ и продуктов реакции (ответы и решения). Выберите дальнейшие действия:
- Перейти к следующей теме:
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
Методика решения задач
на «избыток–недостаток»
в курсе основной
общеобразовательной школы
Умение
решать химические задачи – важная составляющая знаний по предмету. Согласно
государственному стандарту образования по химии учащиеся, оканчивающие школу,
должны уметь решать более десятка типов стандартных задач. Среди них и задачи
на «избыток–недостаток».
Предлагаю свой вариант подачи материала по решению таких задач в курсе химии
9-го класса.
На изучение этой темы отвожу 2–2,5 урока, в зависимости от уровня способностей
учеников класса. Ознакомление с алгоритмом решения задач данного типа
происходит в рамках изучения темы «Теория электролитической диссоциации».
Однако если класс сильный, то в рамках эксперимента этот тип задач иногда
изучаем и в конце 8-го класса в главе «Галогены», а высвободившееся время можно
потратить на изучение органической химии в курсе 9-го класса.
На первом уроке разбираю два типа задач на «избыток–недостаток»:
одно
из двух вступивших в реакцию веществ дано в избытке;
оба
вступивших в реакцию вещества расходуются на взаимодействие друг с другом без
остатка, т. е. даны в стехиометрических количествах.
В качестве домашнего задания обязательно предлагаются две-три задачи, подобные
изученным на уроке.
На втором уроке закрепляю и углубляю изученный материал, ввожу понятия
«процентная концентрация растворов веществ», вступивших в реакцию, «плотность
растворов». Кроме того, усложняю задачи, вводя «процентное содержание примесей
в исходном веществе» и т. д. Такой прием позволяет повторить элементы уже
изученного материала, сэкономить время. В конце второго урока изучения темы или
в начале третьего провожу небольшую самостоятельную работу на закрепление
изученного материала, включающую одну-две задачи, причем самостоятельная работа
предлагается в трех уровнях сложности, в зависимости от способностей ученика.
Урок 1
Решение задач на «избыток–недостаток»
Цели.
- научить
алгоритму решения задач нового типа; - закрепить
навыки устного счета; - повторить
правила расчета относительных молекулярных масс веществ; - закрепить
правила грамотного оформления условия задачи; - формировать
навыки химического мышления, логики, а также способствовать воспитанию
гармоничной, всесторонне развитой личности.
ХОД УРОКА
Рассмотрим
вариант, когда одно из вступивших в реакцию веществ дано в избытке, другое – в
недостатке.
Решая химические задачи, следует не забывать о правилах их грамотного
оформления по схеме: дано, найти, решение, ответ.
ЗАДАЧА
1. На 47 г оксида калия подействовали раствором, содержащим 40
г азотной кислоты. Найдите массу образовавшегося нитрата калия.
Дано:
m(K2O)
= 47 г,
m(HNO3) = 40 г.
Найти:
m(КNO3).
Решение
Рассчитаем
относительные молекулярные массы интересующих нас веществ:
Mr(K2O) = 2Ar(K)
+ 1Ar(O) = 2•39 + 1•16 = 94,
Mr(HNO3) = 1Ar(H)
+ 1Ar(N) + 3Ar(O) = 1•1 + 1•14 + 3•16 = 63,
Mr(KNO3) = 1Ar(K)
+ 1Ar(N) + 3Ar(O) = 1•39 + 1•14 + 3•16 =
101.
Для
удобства расчета за х1 примем массу НNО3 и
найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в
недостатке.
47/94 = х1/126, х1 =
63 г.
Следовательно,
азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по расчету
необходимо 63 г, поэтому расчет ведем по HNO3:
40/126 = х/202, х = 64 г.
Ответ. m(КNO3)
= 64 г.
ЗАДАЧА
2. На 24 г металлического магния подействовали 100 г 30%-го
раствора соляной кислоты. Найдите массу образовавшегося хлорида магния.
Дано:
m(Mg)
= 24 г,
m(р-р HCl) = 100 г,
(HCl) = 30%.
Найти:
m(MgCl2).
Решение
Рассчитаем
относительные молекулярные массы интересующих нас веществ:
Mr(HCl) = 1Ar(H) + 1Ar(Cl)
= 1 + 35,5 = 36,5,
Mr(MgCl2) = 1Ar(Mg)
+ 2Ar(Cl) = 24 + 2•35,5 = 95.
Для
удобства расчета за х1 примем массу соляной кислоты
и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в
недостатке.
24/24 = х1/73, х1 =
73 г.
Из
расчета видно, что соляная кислота дана в недостатке, т. к. по условию задачи
ее дано 30 г, а для реакции требуется 73 г. Следовательно, расчет ведем по
соляной кислоте:
30/73 = х/95, х = 39 г.
Ответ. m(MgCl2)
= 39 г.
Рассмотрим
вариант, когда оба вступивших в реакцию вещества даны в стехиометрических
количествах, т. е. реагируют друг с другом без остатка.
ЗАДАЧА
1. На 36 г алюминия подействовали 64 г серы. Найдите массу образовавшегося
сульфида алюминия.
Дано:
m(Al)
= 36 г,
m(S) = 64 г.
Найти:
m(Al2S3).
Решение
Примем
массу Al за х1 и найдем, какое из веществ,
вступивших в реакцию, дано в избытке, какое – в недостатке.
х1/54 = 64/96, х1 =
36 г.
В
данном случае вещества, вступившие в реакцию, взяты в стехиометрических
количествах, поэтому расчет можно вести по любому из них:
64/96 = х/150, х = 100 г.
Ответ. m(Al2S3)
= 100 г.
ЗАДАЧА
2. На раствор, содержащий 53 г карбоната натрия, подействовали
раствором, содержащим 49 г серной кислоты. Найдите массу образовавшейся соли.
Дано:
m(Na2CO3)
= 53 г,
m(H2SO4) = 49 г.
Найти:
m(Na2SO4).
Решение
Рассчитаем
относительные молекулярные массы интересующих нас веществ:
Mr(Na2CO3) = 2Ar(Na)
+ 1Ar(C) + 3Ar(O) = 2•23 + 1•12 + 3•16 =
106.
Mr(H2SO4) = 2Ar(H)
+ 1Ar(S) + 4Ar(O) = 2•1 + 1•32 + 4•16 = 98.
Mr(Na2SO4) = 2Ar(Na)
+ 1Ar(S) + 4Ar(O) = 2•23 + 1•32 + 4•16 =
142.
Примем
за х1 массу cерной кислоты, чтобы узнать, какое
вещество дано в избытке, какое – в недостатке.
53/106 = х1/98, х1 =
49 г.
В
данном случае оба вещества взяты в стехиометрических количествах, поэтому
расчет можно вести по любому из них:
49/98 = х/142, х = 71 г.
Ответ. m(Na2SO4)
= 71 г.
Однако
учитель, подбирая задачи для решения в классе, должен помнить, что в некоторых
случаях (например, если кислота или кислотный оксид дан в избытке) решение
задачи не ограничивается расчетом двух пропорций, т. к. реакция будет протекать
дальше с образованием кислой соли. Это повысит сложность материала. На первых
уроках при решении задач данного типа я не включаю в материал задачи на
прохождение реакций с образованием кислых или основных солей.
Домашнее задание
ЗАДАЧА
1. На 200 г 10%-го раствора серной кислоты подействовали 40 г
оксида алюминия. Найдите массу образовавшейся воды.
Дано:
M(р—р H2SO4)
= 200 г,
(H2SO4)
= 10%,
m(Al2O3) = 40 г.
Найти:
m(Н2O).
Решение
Рассчитаем
относительные молекулярные массы интересующих нас веществ:
Mr(Al2O3) = 2Ar(Al)
+ 3Ar(O) = 2•27 + 3•16 = 102,
Mr(H2SO4) = 2Ar(H)
+ 1Ar(S) + 4Ar(O) = 2•1 + 1•32 + 4•16 = 98,
Mr(H2O) = 2Ar(H)
+ 1Ar(O) = 2•1 + 1•16 = 18.
m(H2SO4) = 200•10/100
= 20 г.
Найдем,
какое из вступивших в реакцию веществ дано в избытке, а какое – в недостатке.
х1/102 = 20/294, х1 =
6,94 г.
Из
расчета видно, что Al2O3 дан в избытке,
следовательно, расчет ведем по кислоте:
20/294 = х/54, х = 3,67 г.
Ответ. m(Н2O)
= 3,67 г.
ЗАДАЧА
2. На 40 г оксида меди(II) подействовали раствором серной кислоты,
содержащим 49 г безводного вещества. Найдите массу образовавшейся соли.
Дано:
m(CuO)
= 40 г,
m(H2SO4) = 49 г.
Найти:
M(СuSO4).
Решение
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
х1/80 = 49/98, х1 =
40 г.
Cогласно
уравнению данной реакции вещества взяты в стехиометрических количествах,
поэтому расчет можно вести по любому из них:
40/80 = х/160, х = 80 г.
Ответ. m(CuSO4)
= 80 г.
Урок 2
Закрепление алгоритма решения задач
на «избыток – недостаток»
Продолжение. Начало см. в № 44/2003
Цели.
- повторить
способы решения задач; - закрепить
навыки решения; - повторить
правила расчета молекулярной массы; - закрепить
правила грамотного оформления задачи; - формировать
навыки химического мышления, логики; - повторить
материал о процентной концентрации, плотности растворов, переводе объемов
растворов в граммы.
ХОД УРОКА
ЗАДАЧА
1. На 300 г 20%-го раствора хлорида натрия подействовали 100 г
10%-го раствора нитрата серебра. Найдите массу осадка хлорида серебра.
Дано:
m(р-р
NaCl) = 300 г,
(NaCl) = 20%,
m(р-р AgNO3) = 100 г,
(AgNO3) = 10%.
Найти:
m(AgCl).
Решение
m(NaCl)
= 300•20/100 = 60 г,
m(AgNO3)
= 100•10/100 = 10 г.
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
х1/58,5
= 10/170, х1 = 3,44 г.
Из
расчета видно, что NaCl дан в избытке. Следовательно, дальнейший расчет ведем
по AgNO3:
10/170
= х/143,5, х = 8,44 г.
Ответ. m(AgCl)
= 8,44 г.
ЗАДАЧА
2. На 40 г алюминия, содержащего 10% примесей, подействовали
100 г 10%-й соляной кислоты. Найдите массу образовавшегося хлорида алюминия.
Дано:
m(Al
с прим.) = 40 г,
(прим.) = 10%,
m(р-р HCl) = 100 г,
(HCl) = 10%.
Найти:
m(AlCl3).
Решение
m(прим.)
= 40•10/100 = 4 г,
m(Al)
= 40 – 4 = 36 г,
m(HCl)
= 100•10/100 = 10 г.
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
36/54
= х1/219, х1 = 146 г.
Соляная
кислота дана в недостатке, следовательно, расчет ведем по ней:
10/219
= х/267, х = 12,2 г.
Ответ. m(AlCl3)
= 12,2 г.
ЗАДАЧА
3. На сплав массой 20 г, содержащий 30% алюминия и 70% магния,
подействовали раствором, содержащим 100 г серной кислоты. Найдите массы
образовавшихся солей.
Дано:
m(сплав)
= 20 г,
(Al) = 30%,
(Mg) = 70%,
m(H2SO4) = 100 г.
Найти:
m(Al2(SO4)3),
m(MgSO4).
Решение
m(Al)
= 30•20/100 = 6 г,
m(Mg)
= 20 – 6 = 14 г,
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
6/54
= х1/294, х1 = 33 г.
Кислота
взята в избытке, поэтому расчет ведем по Al:
6/54
= х/342, х = 38 г.
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
14/24
= y1/98, y1 = 57 г.
m‘(H2SO4)
= 100 – 33 = 67 г.
67 г
кислоты достаточно для полного взаимодействия с 14 г Mg, cледовательно, кислота
дана в избытке и расчет ведем по Mg:
14/24
= х/120, х = 70 г.
Ответ. m(Al2(SO4)3)
= 38 г, m(MgSO4) = 70 г.
ЗАДАЧА
4. К 100 мл 10%-го раствора гидроксида калия
плотностью 1,11 г/мл прибавили 200 мл 28%-го раствора азотной кислоты
плотностью 1,21 г/мл. Найдите массу образовавшейся соли.
Дано:
V(р-р
KOH) = 100 мл,
(KOH) = 10%,
(р-р KOH) = 1,11 г/мл,
V(р-р HNO3) = 200 мл,
(HNO3) = 28%,
(р-р HNO3) = 1,21 г/мл.
Найти:
m(KNO3).
Решение
m(р-р
KOH) = •V =
1,11•100 = 111 г,
m(KOH)
= 111•10/100 = 11,1 г,
m(р-р
HNO3) = •V =
1,21•200 = 242 г,
m(HNO3)
= 242•28/100 = 68 г.
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
х1/56
= 68/63, х1 = 60,4 г.
KOH дан
в недостатке, следовательно, расчет ведем по нему:
11,1/56
= х/101, х = 20 г.
Ответ. m(KNO3)
= 20 г.
ЗАДАЧА
5. На 500 мл 10%-го раствора гидроксида калия плотностью
1,11 г/мл подействовали раствором, содержащим 20 г соляной кислоты. Найдите
массу образовавшейся воды.
Дано:
V(р-р
KOH ) = 500 мл,
(KOH) = 10%,
(р-р KOH) = 1,11 г/мл,
m(HCl) = 20 г
Найти:
m(Н2О).
Решение
m(р-р
KOH) = •V =
1,11•500 = 555 г,
m(KOH)
= 555•10/100 = 55,5 г.
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
х1/56
= 20/36,5, х1 = 30,7 г.
KOH дан
в избытке, следовательно, расчет ведем по HCl:
20/36,5
= х/18, х = 9,86 г.
Ответ. m(H2O)
= 9,86 г.
Домашнее задание
ЗАДАЧА
1. К 400 мл 20%-го раствора карбоната натрия с плотностью 1,18
г/мл прибавили раствор, содержащий 40 г соляной кислоты. Найдите массу хлорида
натрия.
Дано:
V(р—р Na2CO3)
= 400 мл,
(Na2CO3)
= 20%,
(р—р Na2CO3)
= 1,18 г/мл,
m(HCl) = 40 г.
Найти:
m(NaCl).
Решение
m(р-р
Na2CO3) = •V = 1,18•400 = 472 г,
m(Na2CO3)
= 20•472/100 = 94,4
Найдем,
какое из вступивших в реакцию веществ дано в избытке, какое – в недостатке.
х1/106
= 40/73, х1 = 58,1 г.
Na2CO3 дан
в избытке, следовательно, расчет ведем по HCl:
40/73
= х/117, х = 64 г.
Ответ. m(NaCl)
= 64 г.
ЗАДАЧА
2. На 40 г оксида цинка, содержащего 20% примесей,
подействовали 100 г 20%-го раствора азотной кислоты. Найдите массу нитрата
цинка.
Дано:
m(ZnO
с прим.) = 40 г,
(прим.) = 20%,
m(р-р HNO3) = 100 г,
(HNO3) = 20%.
Найти:
m(Zn(NO3)2).
Решение
m(прим.)
= 40•20/100 = 8 г,
m(ZnO)
= 40 – 8 = 32 г,
m(безводн.
HNO3) = 100•20/100 = 20 г.
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
32/81
= х1/126, х1 = 50 г.
Азотная
кислота дана в недостатке, расчет ведем по ней:
20/126
= х/189, х = 30 г.
Ответ. m(Zn(NO3)2)
= 30 г.
Урок 3
Самостоятельная
работа
Цель.
Проверить усвоение алгоритма решения типовых задач на «избыток – недостаток».
Вариант на оценку три балла
ЗАДАЧА. На 40 г
оксида магния подействовали 200 г 10%-го раствора азотной кислоты. Найдите
массу нитрата магния.
Дано:
m(MgO) =
40 г,
m(р-р HNO3) = 200 г,
(HNO3) = 10%.
Найти:
m(Mg(NO3)2).
Решение
m(HNO3 безводн.) = 200•10/100 = 20 г.
Найдем, какое из веществ, вступивших в
реакцию, дано в избытке, а какое – в недостатке.
40/40 = х1/126, х1 = 126 г.
HNO3 дана в недостатке, расчет ведем по
ней:
20/126 = х/148, х = 23,5 г.
Ответ. m(Mg(NO3)2)
= 23,5 г.
Вариант на оценку четыре
балла
ЗАДАЧА 1. На
40 г алюминия, содержащего 20% примесей, подействовали 100 г 20%-го раствора
соляной кислоты. Найдите массу хлорида алюминия.
Дано:
m(Al с
прим.) = 40 г,
(прим.) = 20%,
m(р-р HCl) = 100 г,
(HCl) = 20%.
Найти:
m(AlCl3).
Решение
m(прим.)
= 40•20/100 = 8 г,
m(Al) = 40 – 8 = 32 г,
m(HCl) =
100•20/100 = 20 г.
Найдем, какое из веществ, вступивших в
реакцию, дано в избытке, а какое – в недостатке.
32/54 = х1/219, х1 = 129,8 г.
HCl дана в недостатке, расчет ведем по ней:
20/219 = х/267, х = 24,4 г.
Ответ. m(AlCl3)
= 24,4 г.
ЗАДАЧА 2. К 300 г
10%-го раствора гидроксида калия прибавили раствор, содержащий 20 г азотной
кислоты. Найдите массу нитрата калия.
Дано:
m(р-р
KOH) = 300 г,
(KOH) = 10%,
m(HNO3) = 20 г.
Найти:
m(KNO3).
Решение
Для расчета по уравнению реакции найдем
относительные молекулярные массы интересующих нас веществ:
Mr(KOH) = 1Ar(K) + 1Ar(O)
+ 1Ar(H) = 39 + 16 + 1 = 56,
Mr(HNO3) = 1Ar(H)
+ 1Ar(N) + 3Ar(O) = 1 + 14 + 48 = 63,
Mr(KNO3) = 1Ar(K)
+ 1Ar(N) + 3Ar(O) = 39 + 14 + 48 = 101.
Найдем, какое из вступивших в реакцию
веществ дано в избытке, а какое – в недостатке.
х1/56
= 20/63, х1 = 18 г.
Гидроксид калия дан в избытке,
следовательно, расчет ведем по азотной кислоте:
20/63 = х/101, х = 32 г.
Ответ. m(KNO3)
= 32 г.
Вариант на оценку пять баллов
ЗАДАЧА 1. На 40 г
сплава, содержащего 50% натрия и 50% калия, подействовали 200 г воды. Сколько
образовалось граммов гидроксида натрия и гидроксида калия?
Дано:
m(сплав)
= 40 г,
(К) =
(Na) = 50%,
m(H2O)
= 200 г.
Найти:
m(NaOH),
m(KOH).
Решение
Рассчитаем относительные молекулярные массы
интересующих нас веществ:
Mr(H2О) = 2Ar(Н) + 1Ar(O)
= 2•1 + 1•16 = 18,
Mr(KOH) = 1Ar(K) + 1Ar(O)
+ 1Ar(H) = 39 + 16 + 1 = 56,
Mr(NaOH) = 1Ar(Na) + 1Ar(O)
+ 1Ar(H) = 23 + 16 + 1 = 40.
Найдем, какое из вступивших в реакцию
веществ дано в избытке, а какое – в недостатке.
х1/78
= 200/36, х1 = 433 г.
Калий дан в недостатке, расчет ведем по
нему:
20/78 = х/112, х = 29 г.
Найдем, какое из вступивших в реакцию
веществ дано в избытке, а какое – в недостатке.
y1/46
= 200/36, y1 = 256 г.
Натрий дан в недостатке, расчет ведем по
нему:
20/46 = y/80, y =
35 г.
Ответ. m(KOH)
= 29 г, m(NaOH) = 35 г.
ЗАДАЧА 2. К 500
мл 10%-го раствора гидроксида калия плотностью 1,11 г/мл прибавили раствор,
содержащий 10 г серной кислоты. Найдите массу образовавшегося сульфата калия.
Дано:
V(р-р
КОН) = 500 мл,
(КОН) = 1,11 г/мл,
(КОН) = 10%,
m(H2SO4) = 10 г.
Найти:
m(K2SO4).
Решение
Рассчитаем относительные молекулярные массы
интересующих нас веществ:
Mr(KOH) = 1Ar(K) + 1Ar(O)
+ Ar(H) = 39 +
16 + 1 = 56,
Mr(Н2SO4)
= 2Ar(H) + 1Ar(S) + 4Ar(O)
= 2•1 + 1•32 + 4•16 = 98,
Mr(K2SO4) = 2Ar(K)
+ 1Ar(S) + 4Ar(O) = 2•39 + 1•32 + 4•16 =
174.
m(р-р
KOH) = •V = 1,11•500 = 555 г,
m(KOH)
=555 • 10/100 = 55,5
Найдем, какое из вступивших в реакцию
веществ дано в избытке, а какое – в недостатке.
х1/112
= 10/98, х1 = 11,4 г.
Гидроксид калия дан в избытке,
следовательно, расчет ведем по cерной кислоте:
10/98 = х/174, х = 17,7 г.
Ответ. m(K2SO4)
= 17,7 г.
Решение расчетных задач на вычисление массы или количества продукта реакции, если один из реагентов взят в избытке
В условиях задач такого типа указаны массы или объёмы двух реагирующих веществ, одно из которых дано в избытке, поэтому при решении таких задач нужно определить, какое вещество взято в избытке. Расчёт массы или объёма продукта реакции ведётся по данным вещества взятого в недостатке.
I. Алгоритм решения задачи: «Вычисление массы или количества продукта реакции, если один из реагентов взят в избытке»
Пример 1. Смешали два раствора, содержащих соответственно 33,3г хлорида кальция и 16,4г фосфата натрия. Вычислите массу осадка.
|
Последовательность выполнения действий |
Оформление решения задачи |
|
1. Записываем условие задачи |
Дано: m(CaCl2)=33,3г m(Na3PO4)=16,4г _______________ Найти: m(Ca3(PO4)2) =? |
|
2. Вычислим молярные массы для формул, записанных вдано |
M(CaCl2)=111г/моль M(Na3PO4)=164г/моль M(Ca3(PO4)2) =310г/моль |
|
3. Вычислим количества веществ, масса которых дана в условии |
ν(CaCl2)=m/M=33,3г/111г/моль=0,3моль ν(Na3PO4)=16,4г/164г/моль=0,1моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
|
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби. |
CaCl2 – взят в избытке, расчёт ведём по недостатку, т.е. поNa3PO4. |
|
6. Вычислим количество вещества, массу которого нужно найт |
По УХР: ν(Ca3(PO4)2)= (0,1моль∙1моль)/2моль=0,05моль |
|
7.Вычислим искомую массу |
m(Ca3(PO4)2)= ν(Ca3(PO4)2 )∙ M(Ca3(PO4)2) = 0,05моль ∙ 310г/моль =15,5г |
|
8. Запишем ответ |
Ответ: m(Ca3(PO4)2) =15,5г |
Пример 2. Вычислите объём водорода (н.у.), который образуется при взаимодействии 6,5 г цинка с соляной кислотой массой 7,5 г.
|
Последовательность выполнения действий |
Оформление решения задачи |
|
1. Записываем условие задачи |
Дано: m(Zn)=6,5г m(HCl)=7,5г Vm=22,4л/моль _______________ Найти: V(H2) =? |
|
2. Вычислим молярные массы для веществ с известной массой, записанных в дано |
M(Zn)=65г/моль M(HCl)=36,5г/моль |
|
3. Вычислим количества веществ, масса которых дана в условии |
ν(Zn) = m/M= 6,5/65г/моль=0,1моль ν(HCl)=7,5г/36,5г/моль=0,205моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
|
5. Определим, какой из реагентов взят в избытке. Для этого сравним дроби. |
НCl – взят в избытке, расчёт ведём по недостатку, т.е. по Zn. |
|
6. Вычислим количество вещества, объём которого нужно найти |
По УХР: ν(H2) = ν(Zn)=0,1моль |
|
7.Вычислим искомый объём |
V(H2)= ν(H2)∙ Vm = 0,1моль ∙ 22,4л/моль =2,24л |
|
8. Запишем ответ |
Ответ: V(H2)= 2,24л |
II. Алгоритм решения задач на «Избыток — недостаток» (в общем виде)
Расчёты по уравнению реакции, если один из реагентов взят в избытке
Дано: m (ν, V, W) реагентов
Найти: m (ν, V, W) продукта
Решение:
1. Составляем уравнение реакции
2. Нахождение количества вещества реагентов ν(А) и ν(В):
ν = m/M;
ν = V/Vm;
Wвещества = (mвещества •100%)/mраствора;
mвещества= (Wвещества• mраствора)/100%
3. Сравнение дробей – нахождение недостатка:
Если, ν(А)/a > ν(В)/b, то вещество В в недостатке, расчёт ν(С) ведём по ν(В)
Если, ν(А)/a < ν(В)/b, то вещество А в недостатке, расчёт ν(С) ведём по ν(А)
Если, ν(А)/a = ν(В)/b, то расчёт ν(С) ведём по ν(В) или ν(А)
4. Определение ν(С) по УХР путём составления и решения пропорции:
ν(В)/b = ν(С)/с или ν(А)/a = ν(С)/с
5. Нахождение величин, требуемых по условию:
m = ν•M;
V = ν• Vm;
Wвещества = (mвещества •100%)/mраствора
Здесь,
m — масса вещества (г)
ν — количество вещества (моль)
V — объём (л)
W — массовая доля вещества (%)
III. Решите следующие задачи
- Вычислите массу осадка, образующегося при взаимодействии 160 г сульфата железа (III) и 41,6 г хлорида бария.
- Вычислите объем углекислого газа, который можно получить при взаимодействии карбоната кальция массой 7 г с соляной кислоты массой 6 г.
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
Очень часто при проведении реакции между веществами оказывается, что один реагент прореагировал полностью, а другой нет. В таком случае говорят, что вещество, которое полностью израсходовалось, было в недостатке, а то вещество, которое осталось – в избытке. Поскольку избыток реагента не участвует в реакции, количество продукта зависит только от количества вещества, которое было в недостатке.
Предположим, что осуществляется реакция между веществами А и B, которая протекает в соответствии с уравнением:
aA + bB = cC + dD
Для осуществления этой реакции было взято количество вещества A, равное nA, и количество вещества B, равное nB. Определить то, какое вещество в избытке, а какое в недостатке, можно, сравнив выражения:
В зависимости от того, какое выражение окажется меньше, то вещество соответственно и будет в недостатке.
Примечание: распространенной ошибкой является то, что вместо выражений (1) сравнивают просто количества веществ. Так делать категорически не допускается! Если n(A) > n(B), то это еще не значит, что вещество A в избытке!
После того, как будет установлено то, какое вещество было в недостатке, расчеты ведутся по его количеству аналогично рассмотренным в главе 4.3.3.
Пример задачи на избыток и недостаток
Нагрели смесь 54 г алюминия и 80 г серы. Вычислите массу образовавшегося сульфида алюминия.
Решение
Запишем уравнение реакции:
2Al + 3S = Al2S3
Рассчитаем количества веществ алюминия и серы:
n(Al) = m(Al)/M(Al) = 54/27 = 2 моль;
n(S) = m(S)/M(S) = 80/32 = 2,5 моль
Для того чтобы выяснить, какое из исходных веществ в недостатке, разделим количества молей веществ на коэффициенты перед этими веществами в уравнении и сравним рассчитанные выражения:
n(Al)/k(Al) = 2/2 = 1
и n(S)/k(S) = 2,5/3 ≈ 0,833
т.е. n(Al)/k(Al) > n(S)/k(S)
Значит сера в недостатке. Расчеты далее ведем по количеству вещества серы.
Исходя из уравнения реакции
2Al + 3S = Al2S3
следует, что количество прореагировавшей серы и образовавшегося в результате реакции сульфида алюминия связаны выражением:
где 3 и 1 – коэффициенты перед S и Al2S3 соответственно. Отсюда:
n(Al2S3) = n(S)/3 = 2,5/3 ≈ 0,8333 моль
Следовательно, масса сульфида алюминия будет равна:
m(Al2S3) = M(Al2S3) ∙ n(Al2S3) = 150 ∙ 0,8333 = 125 г
Ответ: m(Al2S3) = 125 г
В случае, если в задаче дается масса реагента, содержащего примеси (mр-та с прим.), прежде всего следует рассчитать массу чистого реагента без примесей (mр-та ). Если дается масса реагента с примесями и указана массовая доля этого реагента ωр-та , то масса чистого реагента рассчитывается по формуле:
В случае, если вместо массовой доли чистого вещества дается массовая доля примесей, то учитывая, что:
ωр-та + ωприм. = 100%
мы можем записать, что:
Пример задачи на расчет количества продукта, зная массу реагента с примесями
Какой объем углекислого газа (н.у.) выделится при действии избытка соляной кислоты на технический карбонат кальция массой 150 г, содержащий 10% некарбонатных примесей.
Решение:
Запишем уравнение взаимодействия карбоната кальция с соляной кислотой:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Массовая доля примесей в техническом карбонате кальция составляет 10%, значит массовая доля чистого карбоната кальция будет составлять:
ω(CaCO3) = 100% — ω(прим.) = 100% — 10% = 90%.
Масса чистого карбоната кальция будет равна:
m(CaCO3) = ω(CaCO3) ∙ m(CaCO3 техн.)/100% = 90% ∙ 150 г/100% = 135 г,
Следовательно, количество вещества карбоната кальция равно:
n(CaCO3) = m(CaCO3)/M(CaCO3) = 135 г / 100 г/моль = 1,35 моль
В соответствии с уравнением реакции:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Количества веществ карбоната кальция и углекислого газа равны (одинаковые коэффициенты в уравнении), следовательно:
n(CO2) = n(CaCO3) = 1,35 моль
Тогда, зная, что один моль любого газа при нормальных условиях занимает объем 22,4 л, мы можем рассчитать объем выделившегося CO2:
V(CO2) = n(CO2) ∙ Vm = 1,35 моль ∙ 22,4 л/моль = 30,24 л