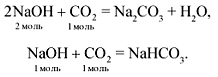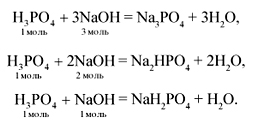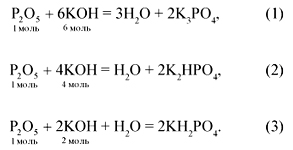Основы деления солей на отдельные группы были заложены в трудах французского химика и аптекаря Г. Руэля ((1703)–(1770)). Именно он в (1754) г. предложил разделить известные к тому времени соли на кислые, основные и средние (нейтральные). В настоящее время выделяют и другие группы этого чрезвычайно важного класса соединений.
Средними называют соли, в состав которых входят металлический химический элемент и кислотный остаток.
В состав солей аммония вместо металлического химического элемента входит одновалентная группа аммония
NH4I
.
Примеры средних солей:
— хлорид натрия;
Al2IIISO4II3
— сульфат алюминия;
NHI4NO3I
— нитрат аммония.
Кислыми называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят атомы водорода.
Кислые соли можно считать продуктом неполной нейтрализации многоосновной кислоты.
Обрати внимание!
Составляя формулы кислых солей, следует иметь в виду, что валентность остатка от кислоты численно равна количеству атомов водорода, входивших в состав молекулы кислоты и замещённых металлом.
При составлении названия такого соединения к названию соли добавляется приставка «гидро», если в остатке от кислоты имеется один атом водорода, и «дигидро», если в остатке от кислоты содержатся два атома водорода.
— гидрокарбонат кальция;
Na2IHPO4⏞II
— гидрофосфат натрия;
NaIH2PO4⏞I
— дигидрофосфат натрия.
Простейшим примером кислых солей может служить пищевая сода, т. е. гидрокарбонат натрия (NaHCO_3).
Основными называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят гидроксогруппы.
Основные соли можно рассматривать как продукт неполной нейтрализации многокислотного основания.
Обрати внимание!
Составляя формулы таких веществ, следует иметь в виду, что валентность остатка от основания численно равна количеству гидроксогрупп, «ушедших» из состава основания.
При составлении названия основной соли к названию соли добавляется приставка «гидроксо», если в остатке от основания имеется одна гидроксогруппа, и «дигидроксо», если в остатке от основания содержатся две гидроксогруппы.
— гидроксохлорид магния;
FeOH⏞IINO32I
— гидроксонитрат железа((III));
FeOH2⏞INO3I
— дигидроксонитрат железа((III)).
Известным примером основных солей может служить налёт зелёного цвета гидроксокарбоната меди((II)) ((CuOH)_2CO_3), образующийся с течением времени на медных предметах и предметах, изготовленных из сплавов меди, если они контактируют с влажным воздухом. Такой же состав имеет и минерал малахит.
Комплексные соединения — разнообразный класс веществ. Заслуга в создании теории, объясняющей их состав и строение, принадлежит лауреату Нобелевской премии по химии (1913) г. швейцарскому учёному А. Вернеру ((1866)–(1919)). Правда, термин «комплексные соединения» в (1889) г. был введён другим выдающимся химиком, лауреатом Нобелевской премии (1909) г. В. Оствальдом ((1853)–(1932)).
В составе катиона или аниона комплексных солей имеется элемент-комплексообразователь, связанный с так называемыми лигандами. Число лигандов, которое присоединяет комплексообразователь, называется координационным числом. Например, координационное число двухвалентной меди, а также бериллия, цинка, равно (4). Координационное число алюминия, железа, трёхвалентного хрома равно (6).
В названии комплексного соединения число лигандов, соединённое с комплексообразователем, отображается греческими числительными: (2) — «ди», (3) — «три», (4) — «тетра», (5) — «пента», (6) — «гекса». В качестве лигандов могут выступать как электрически нейтральные молекулы, так и ионы.
Название комплексного аниона начинается с указания состава внутренней сферы.
Если в качестве лигандов выступают анионы, к их названию добавляется окончание «–о»:
(–Cl) — хлоро-, (–OH) — гидроксо-, (–CN) — циано-.
Если лигандами являются электрически нейтральные молекулы воды, используется название «аква», а если аммиака — название «аммин».
Затем называют комплексообразователь, используя его латинское название и окончание «–ат», после чего без пробела римскими цифрами в скобках указывают степень окисления (если комплексообразователь может иметь несколько степеней окисления).
После обозначения состава внутренней сферы указывают название катиона внешней сферы — той, что в химической формуле вещества находится вне квадратных скобок.
Пример:
— тетрагидроксоцинкат калия,
K3AlOH6
— гексагидроксоалюминат калия,
K4FeCN6
— гексацианоферрат((II)) калия.
В школьных учебниках формулы комплексных солей более сложного состава, как правило, упрощаются. Например, формулу тетрагидроксодиакваалюмината калия
KAlH2O2OH4
принято записывать как формулу тетрагидроксоалюмината.
Если комплексообразователь входит в состав катиона, то название внутренней сферы составляют так же, как в случае комплексного аниона, но используют русское название комплексообразователя и в скобках указывают степень его окисления.
Пример:
— хлорид диамминсеребра,
CuH2O4SO4
— сульфат тетрааквамеди((II)).
Гидратами называют продукты присоединения воды к частичкам вещества (термин образован от греческого hydor — «вода»).
Многие соли выпадают в осадок из растворов в виде кристаллогидратов — кристаллов, содержащих молекулы воды. В кристаллогидратах молекулы воды прочно связаны с катионами или анионами, образующими кристаллическую решётку. Многие соли такого вида по сути являются комплексными соединениями. Хотя многие из кристаллогидратов известны с незапамятных времён, начало систематическому изучению их состава положил голландский химик Б. Розебом ((1857)–(1907)).
В химических формулах кристаллогидратов принято указывать соотношение количества вещества соли и количество вещества воды.
Обрати внимание!
Точка, которая делит химическую формулу кристаллогидрата на две части, в отличие от математических выражений не обозначает действие умножения и читается как предлог «с».
Например, химическая формула
Na2SO4⋅10H2O
читается так:
«натрий-два-эс-о-четыре-с-десятью-аш-два-о».
В названии при помощи греческого числительного (а для числа (9) — латинского) указывается количество вещества воды в моле кристаллогидрата, затем слитно следует слово «гидрат», а за ним (раздельно) — систематическое, т. е. международное, название соли.
Пример:
— дигидрат сульфата кальция;
CuSO4⋅5H2O
— пентагидрат сульфата меди((II)).
Для названия целого ряда кристаллогидратов, кроме систематического, используют и исторические (тривиальные) названия. Например, гемигидрат сульфата кальция
CaSO4⋅0.5H2O
называют жжёным гипсом, пентагидрат сульфата меди((II))
CuSO4⋅5H2O
называют медным купоросом, а декагидрат карбоната натрия
Na2CO3⋅10H2O
— кристаллической содой.
ЭКЗАМЕНЫ НЕ ЗА ГОРАМИ
Подготовка к ЕГЭ по химии
Кислые соли
Задания на применение знаний о кислых
солях встречаются в вариантах работ ЕГЭ
на разных уровнях сложности (А, В и С). Поэтому при
подготовке учащихся к сдаче ЕГЭ
нужно рассмотреть следующие вопросы.
1. Определение и номенклатура.
Кислые соли – это продукты неполного
замещения атомов водорода многоосновных кислот
на металл. Номенклатура кислых солей отличается
от средних только добавлением приставки
«гидро…» или «дигидро…» к названию соли,
например: NaHCO3 – гидрокарбонат
натрия, Са(Н2РО4)2 – дигидрофосфат
кальция.
2. Получение.
Кислые соли получаются при взаимодействии
кислот с металлами, оксидами металлов,
гидроксидами металлов, солями, аммиаком, если
кислота в избытке.
Например:
Zn + 2H2SO4 = H2 + Zn(HSO4)2,
CaO + H3PO4 = CaHPO4 + H2O,
NaOH + H2SO4 = H2O + NaHSO4,
Na2S + HCl = NaHS + NaCl,
NH3 + H3PO4 = NH4H2PO4,
2NH3 + H3PO4 = (NH4)2HPO4.
Также кислые соли получаются при
взаимодействии кислотных оксидов со щелочами,
если оксид в избытке. Например:
CO2 + NaOH = NaHCO3,
2SO2 + Ca(OH)2 = Ca(HSO3)2.
3. Взаимопревращения.
Средняя соль кислая
соль; например:
K2СО3 KНСО3.
Чтобы из средней соли получить кислую, нужно
добавить избыток кислоты или соответствующего
оксида и воды:
K2СО3 + Н2О + СО2 =
2KНСО3.
Чтобы из кислой соли получить среднюю, нужно
добавить избыток щелочи:
KНСО3 + KОН = K2СО3 + Н2О.
Гидрокарбонаты разлагаются с образованием
карбонатов при кипячении:
2KНСО3 K2СО3
+ Н2О + СО2.
4. Свойства.
Кислые соли проявляют свойства кислот,
взаимодействуют с металлами, оксидами металлов,
гидроксидами металлов, солями.
Например:
2KНSO4 + Mg = H2 + MgSO4 + K2SO4,
2KHSO4 + MgO = H2O + MgSO4 + K2SO4,
2KHSO4 + 2NaOH = 2H2O + K2SO4
+ Na2SO4,
2KHSO4 + Cu(OH)2 = 2H2O + K2SO4
+ CuSO4,
2KHSO4 + MgCO3 = H2O + CO2 + K2SO4 + MgSO4,
2KHSO4 + BaCl2 = BaSO4 + K2SO4 + 2HCl.
5. Задачи на кислые соли. Образование одной
соли.
При решении задач на избыток и недостаток нужно
помнить о возможности образования кислых солей,
поэтому сначала составляют уравнения всех
возможных реакций. После нахождения количеств
реагирующих веществ делают вывод о том, какая
соль получится, и решают задачу по
соответствующему уравнению.
З а д а ч а 1. Через раствор, содержащий 60 г NaOH,
пропустили 44,8 л СО2. Найти массу
образовавшейся соли.
| Дано: | Найти: m(соли). |
| m(NaOH) = 60 г, | |
| V(CO2) = 44,8 л. |
Р е ш е н и е
(NaOH) = m/M =
60 (г)/40 (г/моль) = 1,5 моль;
(СО2) = V/Vm
= 44,8 (л)/22,4 (л/моль) = 2 моль.
Поскольку (NaOH) :
(CO2) = 1,5 : 2 = 0,75 : 1,
то делаем вывод, что СО2 в избытке,
следовательно, получится кислая соль:
NaOH + CO2 = NaHCO3.
Количество вещества образовавшейся соли равно
количеству вещества прореагировавшего
гидроксида натрия:
(NaHCO3)
= 1,5 моль.
m(NaHCO3) = M • = 84 (г/моль)•1,5 (моль) = 126 г.
Ответ: m(NaHCO3) = 126 г.
З а д а ч а 2. Оксид фосфора(V) массой 2,84 г
растворили в 120 г 9%-й ортофосфорной кислоты.
Полученный раствор прокипятили, затем к нему
добавили 6 г гидроксида натрия. Найти массу
полученной соли.
| Дано: | Найти: m(соли). |
| m(P2O5) = 2,84 г, | |
| m(р-ра)(H3PO4) = 120 г, |
|
| m(NaOH) = 6 г. |
Р е ш е н и е
(P2O5)
= m/M = 2,84 (г)/142 (г/моль) = 0,02 моль,
следовательно, 1(H3PO4
получ.) = 0,04 моль.
m(H3PO4) = m(р-ра)• = 120 (г)•0,09 = 10,8 г.
2(H3PO4)
= m/M = 10,8 (г)/98 (г/моль) = 0,11 моль,
(H3PO4)
= 1 +
2 = 0,11 + 0,04 = 0,15
моль.
(NaOH) = m/M
= 6 (г)/40 (г/моль) = 0,15 моль.
Поскольку
(H3PO4)
: (NaOH) = 0,15 : 0,15 = 1 : 1,
то получится дигидрофосфат натрия:
(NaH2PO4)
= 0,15 моль,
m(NaH2PO4) = M• = 120 (г/моль)•0,15 (моль) = 18 г.
Ответ: m(NaH2PO4) = 18 г.
З а д а ч а 3. Сероводород объемом 8,96 л пропустили
через 340 г 2%-го раствора аммиака. Назовите соль,
получившуюся в результате реакции, и определите
ее массу.
Ответ: гидросульфид аммония,
m(NH4HS) = 20,4 г.
З а д а ч а 4. Газ, полученный при сжигании 3,36 л
пропана, прореагировал с 400 мл 6%-го раствора
гидроксида калия (
= 1,05 г/мл). Найти состав полученного раствора и
массовую долю соли в полученном растворе.
Ответ: (KНСО3) = 10,23 %.
З а д а ч а 5. Весь углекислый газ, полученный при
сжигании 9,6 кг угля, пропустили через раствор,
содержащий 29,6 кг гидроксида кальция. Найти массу
полученной соли.
Ответ: m(Ca(HCO3)2) = 64,8 кг.
З а д а ч а 6. В 9,8 кг 20%-го раствора серной кислоты
растворили 1,3 кг цинка. Найти массу полученной
соли.
Ответ: m(ZnSO4) = 3,22 кг.
6. Задачи на кислые соли. Образование смеси
двух солей.
Это более сложный вариант задач на кислые соли.
В зависимости от количества реагирующих веществ
возможно образование смеси двух солей.
Например, при нейтрализации оксида фосфора(V)
щелочью в зависимости от молярного соотношения
реагентов могут образоваться следующие
продукты:
P2O5 + 6NaOH = 2Na3PO4 + 3H2O,
(P2O5):
(NaOH) = 1:6;
P2O5 + 4NaOH = 2Na2HPO4 + H2O,
(P2O5):
(NaOH) = 1:4;
P2O5 + 2NaOH + H2O = 2NaH2PO4,
(P2O5):
(NaOH) = 1:2.
Следует помнить, что при неполной
нейтрализации возможно образование смеси двух
соединений. При взаимодействии 0,2 моль Р2О5
с раствором щелочи, содержащим 0,9 моль NaOH,
молярное соотношение находится между 1:4 и 1:6. В
этом случае образуется смесь двух солей: фосфата
натрия и гидрофосфата натрия.
Если раствор щелочи будет содержать 0,6 моль NaOH,
то молярное соотношение будет другим: 0,2:0,6 = 1:3,
оно находится между 1:2 и 1:4, поэтому получится
смесь двух других солей: дигидрофосфата и
гидрофосфата натрия.
Эти задачи можно решать разными способами. Мы
будем исходить из предположения, что
одновременно происходят две реакции.
А л г о р и т м р е ш е н и я
1. Составить уравнения всех возможных
реакций.
2. Найти количества реагирующих веществ и по
их соотношению определить уравнения двух
реакций, которые происходят одновременно.
3. Обозначить количество одного из
реагирующих веществ в первом уравнении как х
моль, во втором – у моль.
4. Выразить через х и у количества
другого реагирующего вещества согласно молярным
соотношениям по уравнениям.
5. Составить систему уравнений с двумя
неизвестными.
З а д а ч а 1. Оксид фосфора(V), полученный при
сжигании 6,2 г фосфора, пропустили через 200 г 8,4%-го
раствора гидроксида калия. Какие вещества и в
каких количествах получаются?
Р е ш е н и е
(P) = m/M
= 6,2 (г)/31 (г/моль) = 0,2 моль,
следовательно, (P2O5)
= 0,1 моль.
m(KOH) = •m(р-ра)
= 0,084•200 (г) = 16,8 г,
(KOH) = m/M
= 16,8 (г)/56 (г/моль) = 0,3 моль.
Уравнения возможных реакций:
(Р2О5):
(KОН) = 0,1:0,3 = 1:3,
следовательно, получится смесь двух солей –
гидрофосфата и дигидрофосфата калия (уравнения 2
и 3).
Обозначим (Р2О5)
в уравнении (2) как х моль, а (Р2О5) в уравнении (3)
как у моль, тогда потребуется: (KОН) = 4х + 2у.
Составим систему уравнений:
х = 0,1 – у,
4(0,1 – у) + 2у = 0,3,
0,4 – 4у + 2у = 0,3,
2у = 0,1, у = 0,05,
х = 0,1 – 0,05 = 0,05.
Поскольку количество вещества образующейся
соли вдвое больше количества вещества
вступившего в реакцию оксида фосфора(V), то
получится по 0,1 моль гидро- и дигидрофосфата
калия:
(P2O5)2
= 0,05 моль —> (K2НРО4)
= 0,1 моль,
(Р2О5)3
= 0,05 моль —> (KН2РО4)
= 0,1 моль.
Ответ: (K2НРО4) = 0,1 моль,
( KН2РО4)
= 0,1 моль.
З а д а ч а 2. Найти массы и массовые доли солей,
полученных при растворении 22,4 л углекислого газа
в 480 г 10%-го раствора гидроксида натрия.
Ответ: m(Na2CO3) = 21,2 г, (Na2CO3) = 4,05%
m(NaHCO3) = 67,2 г, (NaHCO3) = 12,82 %.
З а д а ч а 3. Найти массовые доли солей в
растворе, полученном при пропускании 100 м3 аммиака
через 500 кг 50%-го раствора фосфорной кислоты.
Ответ. ((NH4)2HPO4) = 43,8 %,
(NH4H2PO4)
= 12,8 %.
З а д а ч а 4. К 50 г раствора ортофосфорной
кислоты с массовой долей 11,76 % прибавили 150 г
раствора гидроксида калия с массовой долей
5,6 %. Найти состав остатка, полученного при
выпаривании раствора.
Ответ: m(K3PO4) = 6,36 г,
m(K2HPO4) = 5,22 г.
З а д а ч а 5. Сожгли 5,6 л бутана (н.у.) и
образовавшийся углекислый газ пропустили через
раствор, содержащий 102,6 г гидроксида бария. Найти
массы полученных солей.
Ответ: m(BaCO3) = 39,4 г,
m(Ba(HCO3)2) = 103,6 г.
Г.С.ОСНОВСКАЯ,
учитель химии средней школы № 7
(г. Великие Луки, Псковская обл.)
Кислые и средние соли
09-Дек-2014 | комментария 4 | Лолита Окольнова
Задания на соли встречаются в ЕГЭ не только в части А, но и в части С.
Давайте разберем основные примеры задач на
кислые и средние соли
1. Определите, какое вещество, и в каком количестве образуется, если прореагировали (н.у.):
а) 0,2 моль Н2S и 0,2 моль КОН;
б) 2,24 л SO2 и 4 г NaOH;
в) 4,48 л СО2 и 7,4 г Са(ОН)2;
г) 4,48 л аммиака и 19,6 г серной кислоты;
д) 0,3 моль гидроксида натрия и 0,3 моль фосфорной кислоты;
е) 4,48 л аммиака и 100 г 9,8 %-ного раствора фосфорной кислоты;
ж) 14,2 г Р2О5 и 0,4 моль КОН;
з) 5,6 г оксида кальция и 0,2 моль серной кислоты.
Итак, как образуются кислые и средние соли?
Обычно это взаимодействие основного оксида или основания с кислотой или кислотным оксидом.
Какая соль образуется — зависит от соотношения реагентов
LiOH + H2SO3 = LiHSO3 + H2O (образовалась кислая соль)
(1 моль щелочи : 1 моль кислоты)
2LiOH + H2SO4 = Li2SO4 + 2H2O (образовалась средняя соль)
(2 моль щелочи : 1 моль кислоты)
Вывод:
- если в избытке основание, то образуется средняя соль;
- при эквимолярном соотношении — кислая соль
Обратите внимание — сравнивать нужно именно количества веществ — моли!
В нашем задании:
а) соотношение сероводорода и гидроксида калия 1:1, значит, получится кислая соль KHS;
б) 0,1 моль SO2 и 0,1 моль NaOH (формулы: n=mMr и т=VV м). Соль — NaHSO3
в) 0,2 моль CO2 и 0,1 моль Ca(OH)2:
CO2 + Ca(OH)2 = CaCO3 + H2O
Т.к. реагируют двухвалентный кальций и кислотный остаток имеет заряд -2, то образуется карбонат кальция — средняя соль
г) 0,2 моль NH3 и 0.2 моль H2SO4. Соотношение 1:1, значит, получится соль — NH4HSO4 — гидросульфат аммония;
д) NaOH и H3PO4. Соотношение 1:1. Получится NaH2PO4 — дигидрофосфат натрия — кислая соль;
e) 0.2 моль NH3 и 0.1 моль (см. формулу массовой доли ω). Аммиак в избытке, значит, получится средняя соль — (NH4)2SO4
ж) 0.1 моль P2O5 и 0,4 моль КОН
3KOH + H3PO4 = K3PO4 + 3H2O
Гидроксид калия дан в значительном избытке, значит, получится фософат калия — средняя соль
з) 0.1 моль CaO и 0.2 моль H2SO4
CaO + 2H2SO4 = Ca(НSO4)2 + H2O
2. Определить количества растворенных веществ в растворе, полученном пропусканием через 200 г 4 %-ного раствора гидроксида натрия при н.у.:
а) 1,12 л углекислого газа;
б) 2,24 л сернистого газа;
в) 3,36 л сероводорода;
г) 4,48 л углекислого газа;
д) 20 г SO3.
n(NaOH)=m(раствора)*ω Mr = 200 г*0.04 40 гмоль = 0.2 моль
Выпишем все уравнения:
CO2 + 2NaOH = Na2CO3 + H2O
0,05 0.2 —> 0,05 моль
SO2 + 2NaOH = Na2SO3 + H2O
0.1 0.2 —> 0.1 моль
H2S + NaOH = NHS + H2O
0,15 0.2 моль —> 0,15 моль
CO2 + NaOH = NaHCO3
0.2 0.2 —> 0.2 моль
SO3 + NaOH = NaHSO4
0.25 0.2 —> 0.2 моль
Количества вещества продукта реакции находим традиционно по недостатку.
Обсуждение: «Кислые и средние соли»
(Правила комментирования)
Кислые
соли —
это соли,
которые образуются при неполном замещении
атомов водорода в
молекулах кислот атомамиметаллов.Они
содержат в своём составе два вида
катионов: катион металла (или аммония)
и катион водорода, и многозарядный
анион кислотного
остатка. Катион водорода
даёт к названию соли приставку «гидро»,
например, гидрокарбонат натрия.
Такие
соли диссоциируют в водных растворах
на катионы металлов, катионы водорода
и анионы кислотных остатков. Они
образуются при избытке кислоты и
содержат в своём составе атомы водорода.
Кислые соли образуются только
многоосновными кислотами и проявляют
свойства как солей, так и кислот. Кислые
соли сильных кислот (гидросульфаты,
дигидрофосфаты) при гидролизе дают
кислую реакцию среды (с чем и связано
их название). В то же время растворы
кислых солей слабых кислот (гидрокарбонаты,
тартраты) могут обладать нейтральной
или щелочной реакцией среды.
|
Содержание
|
Физические
свойства
Кислые
соли – твёрдые кристаллические
вещества,
обладающие различной растворимостью,
и характеризующиеся высокими температурами
плавления. Окраска солей зависит от
металла, входящего в их состав.
Химические
свойства
1.
Кислые соли реагируют с металлами,
стоящими в ряду стандартных электродных
потенциалов (ряд Бекетова) левее атома
водорода:
2KНSO4
+ Mg = H2
+ MgSO4
+ K2SO4,
2NaHCO3
+ Fe = H2
+ Na2CO3
+ Fe2(CO3)3
Так
как эти реакции протекают в водных
растворах, для опытов нельзя применять
такие металлы как литий,
натрий, калий, барий и
другие активные металлы, которые при
обычных условиях реагируют с водой.
2.
Кислые соли реагируют с кислотами, в
случае если образующаяся в результате
реакции кислота более слабая или летучая,
чем кислота, вступающая в реакцию:
NaHCO3
+ HCl = NaCl + H2O
+ CO2
Для
проведения таких реакций обычно берут
сухую соль и действуют на нее
концентрированной кислотой.
3.
Кислые соли реагируют с водными растворами
щелочей c образованием средней соли и
воды:
1)
Ba(HCO3)2
+ Ba(OH)2
= 2BaCO3
+ 2H2O
2)
2KHSO4
+ 2NaOH = 2H2O
+ K2SO4
+ Na2SO4,
3)
NaHCO3
+ NaOH = H2O
+ Na2CO3
Такие
реакции используют для получения средних
солей.
4. Кислые соли реагируют с
растворами солей, в случае, если в
результате реакции выпадает осадок,
выделяется газ или образуется вода:
1)
2KHSO4
+ MgCO3
= H2O
+ CO2
+ K2SO4
+ MgSO4,
2)
2KHSO4
+ BaCl2
= BaSO4
+ K2SO4
+ 2HCl.
3)
2NaHCO3
+ BaCl2
= BaCO3
+ Na2CO3
+ 2HCl
Указанные
реакции используются, в том числе, для
получения практически нерастворимых
солей.
5.
Некоторые кислые соли при нагревании
разлагаются:
1)
Ca(HCO3)2
= CaCO3
+ CO2
+ H2O
2)
2NaHCO3
= CO2
+ H2O
+ Na2CO3
6.
Кислые соли реагируют с основными оксидами с
образованием воды и средних солей:
1)
2KHSO4
+ MgO = H2O
+ MgSO4
+ K2SO4,
2)
2NaHCO3
+ CuO = H2O
+ CuCO3
+ Na2CO3
7.
При гидролизе кислые
соли распадаются на катионы металла и
кислые анионы: КHSO4 →
К+ +
НSO4–
Образующиеся
кислые анионы, в свою очередь, обратимо
диссоциируют: HSO4– →
H+ +
SO42–
Получение
Кислые
соли образуются при воздействии избытка
кислоты на щелочь. В зависимости от
количества молей кислоты (в данном
случае — ортофосфорной)
могут образовываться дигидроортофосфаты (1) и
гидроортофосфаты (2):
-
Ba(OH)2 +
2H3PO4 →
Ba(H2PO4)2 +
2H2O -
Ba(OH)2 +
H3PO4 →
BaHPO4 +
2H2O
При
получении кислых солей важны молярные
соотношения исходных веществ. Например,
при молярном соотношении NaOH и H2SO4 2:1
образуется средняя соль:
2NaOH
+ H2SO4 =
Na2SO4 +
2H2O
А при соотношении 1:1 — кислая: NaOH + H2SO4 =
NaHSO4 +
H2O
1.
Кислые соли образуются в результате
взаимодействия растворов кислот с
металлами, стоящими в ряду активности
металлов левее водорода:
Zn
+ 2H2SO4
= H2
+ Zn(HSO4)2,
2.
Кислые соли образуются в результате
взаимодействия кислот с основными
оксидами:
1)
CaO + H3PO4
= CaHPO4+
H2O,
2)
CuO + 2H2SO4
= Cu(HSO4)2
+ H2O
3.
Кислые соли образуются в результате
взаимодействия кислот с основаниями
(реакция нейтрализации):
1)
NaOH + H2SO4
= NaHSO4
+ H2O
2)
H2SO4
+ KOH = KHSO4
+ H2O
3)
Mg(OH)2
+ 2H2SO4
= Mg(HSO4)2
+ 2H2O
В
зависимости от соотношений концентраций
кислот и оснований, участвующих в
реакциях нейтрализации, можно получать
средние, кислые и основные соли.
4.
Кислые соли можно получить в результате
взаимодействия кислот и средних солей:
Ca3(PO4)2
+ H3PO4
= 3CaHPO4
5.
Кислые соли образуются в результате
взаимодействия оснований с избытком
кислотного оксида:
Ca(OH)2
+ 2CO2
= Ca(HCO3)2
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #