Все вещества делятся на простые и сложные.
Простые вещества состоят из атомов одного элемента.
Сложные вещества (химические соединения) состоят из атомов нескольких элементов.
Простые вещества разделяют на металлы и неметаллы. Деление основано на различиях в их свойствах.
Металлы имеют характерный «металлический» блеск, ковкость, высокую теплопроводность и электропроводность. При комнатной температуре все металлы (кроме ртути) твёрдые. Большинство металлов вытесняют из кислот водород.
Рис. (1). Серебро
Неметаллы не обладают характерным блеском, ковкостью. Многие неметаллы при обычных условиях газообразны.
Рис. (2). Сера
Сложные вещества делят на органические и неорганические.
Органические вещества — соединения углерода. В их состав могут также входить атомы водорода, кислорода, азота, фосфора, серы.
Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение.
Органических веществ миллионы. Они содержатся во всех живых организмах, входят в состав продуктов питания, топлива, лекарств, красителей, пластмасс.
Рис. (3). Изделия из пластмасс
Неорганические вещества — это все простые вещества, а также химические соединения, не являющиеся органическими. Неорганические соединения состоят из атомов любых химических элементов, кроме углерода. Но к неорганическим относят в виде исключения также и некоторые углеродсодержащие вещества: соду, мел, угарный и углекислый газы и др.
Неорганических веществ около (700) тысяч. Они образуют неживую природу: минералы, горные породы и т. д. Почти все неорганические вещества имеют немолекулярное строение. Большинство из них при обычных условиях представляют собой твёрдые вещества.
Рис. (4). Мел
Источники:
Рис. 1. Серебро https://cdn.pixabay.com/photo/2014/12/22/00/06/silver-576793_960_720.png
Рис. 2. Сера https://upload.wikimedia.org/wikipedia/commons/thumb/4/44/Sulfur-sample.jpg/1280px-Sulfur-sample.jpg Общественное достояние
Рис. 3. Изделия из пластмасс https://cdn.pixabay.com/photo/2015/05/23/18/41/sand-pit-780855_960_720.jpg
Рис. 4. Мел https://cdn.pixabay.com/photo/2020/09/20/11/24/limestones-5586848_960_720.jpg
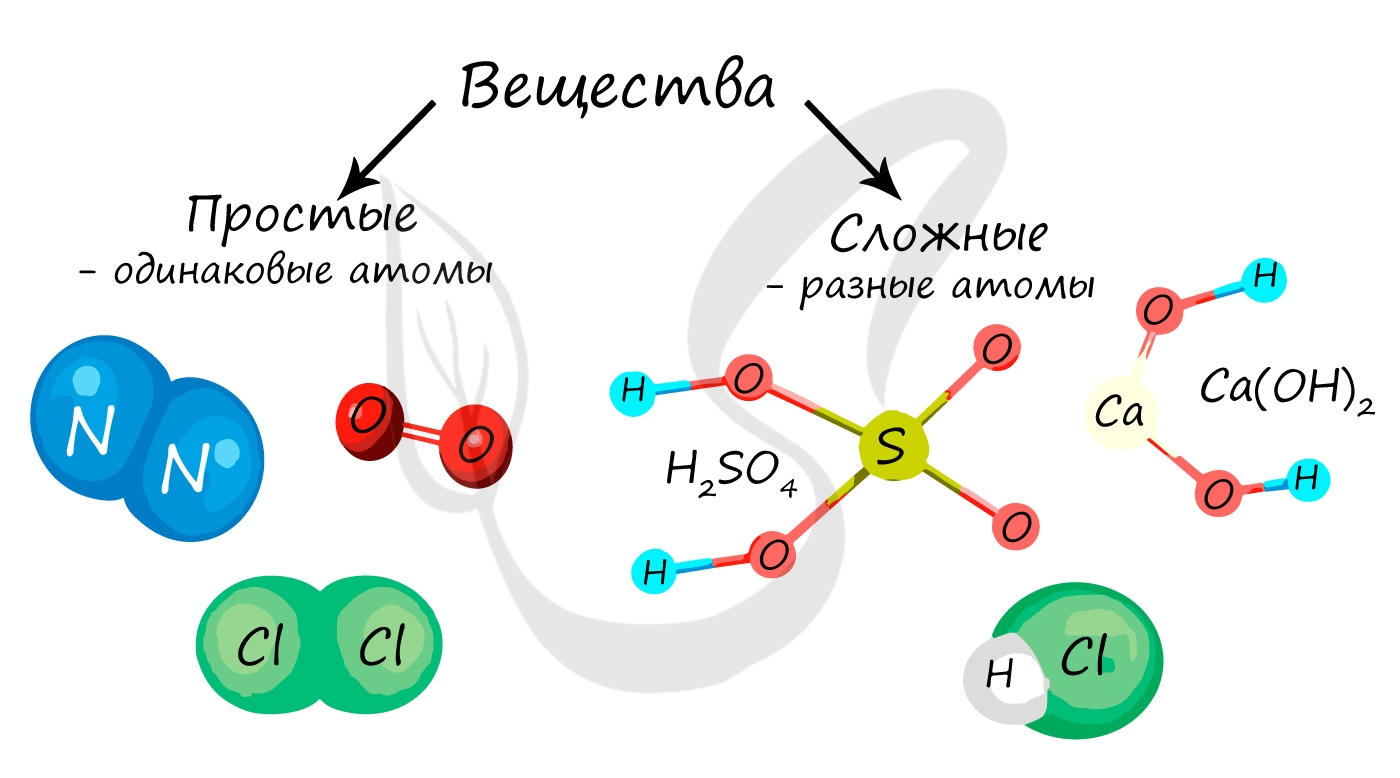
Вещество в химии — любая совокупность атомов и молекул. Вещества в химии подразделяются на простые и сложные.
Простые и сложные вещества
Простые вещества состоят из атомов одного химического элемента, то есть их образуют два и более одинаковых атома:
H2, N2, O2, O3(озон), Mn, Fe.
Сложные вещества состоят из атомов двух и более видов: KMnO4, H2SO4, HCl.
Предмет химии (греч. chymos — сок)
У любой науки есть предмет изучения и методами, с помощью которых изучается предмет. Химия — наука о веществах,
их превращениях и явлениях, которые сопровождают эти превращения.
Хочу заметить важную деталь: необходимо четко разделять химические и физические реакции. При химических реакциях
происходят изменения в составе молекул: одни атомы сменяются другими, молекулы рвутся на части и собираются снова
в обновленном виде.
При физических реакциях молекулы неизменны, связи атомов внутри них не подвергается изменениям.

К признакам химических реакций относится ряд критериев:
- Выделение газа
- Появление запаха
- Изменение окраски раствора или реагирующих веществ
- Выпадение осадка
- Образование воды
- Выделение тепла
- Поглощение тепла

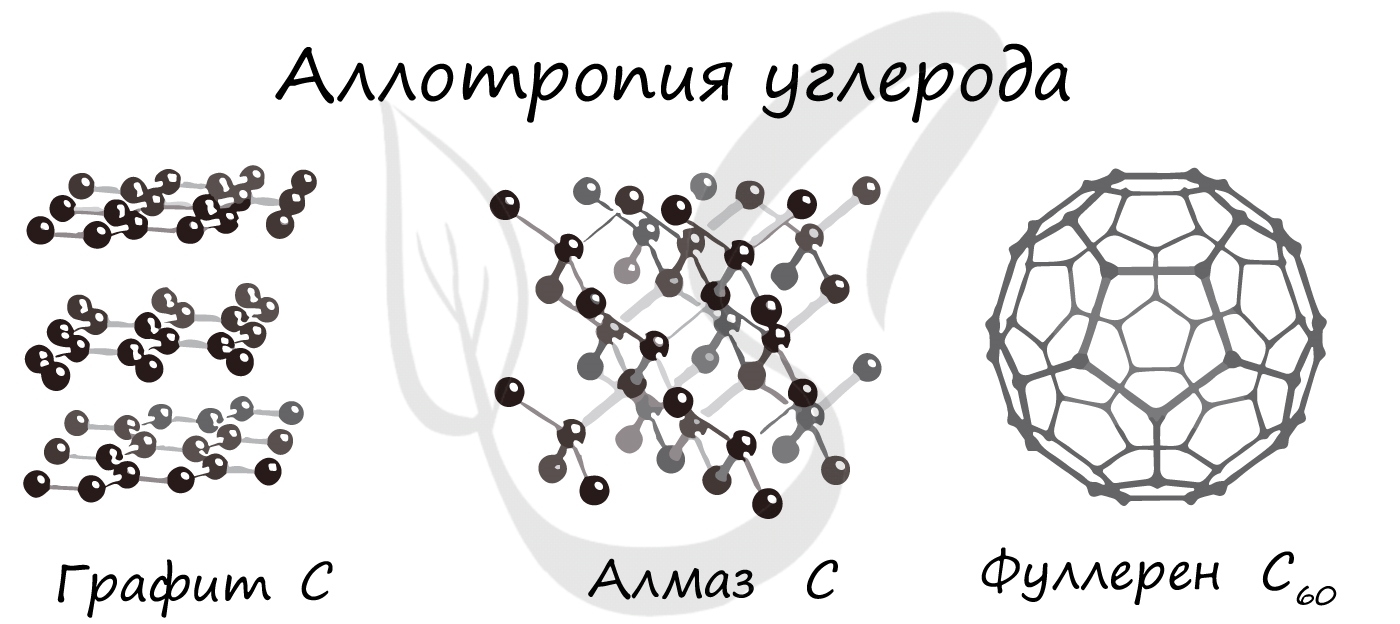
Аллотропия
Аллотропия (греч. allos — иной + tropos образ) — свойство некоторых химических элементов принимать различные физические формы,
существовать в виде двух и более простых веществ.
Такие уникальные способности имеются у углерода. Его известнейшие аллотропные модификации: алмаз, графит и фуллерен. В разделе
химических связей мы вернемся к ним, однако будет хорошо, если вы уже сейчас запомните: алмаз и графит имеют атомное строение,
фуллерен — молекулярное.
Обратите внимание: вы можете догадаться о строении веществ по их формуле. У фуллерена молекулу составляют 60 атомов углерода.
Мы изучали, что молекула — это как минимум два атома, соединенных вместе. Таким образом, уже по формуле, очевидно, что строение
фуллерена молекулярное.
Среди аллотропных модификаций фосфора выделяют: белый, красный и черный фосфор. Белый (P4) фосфор имеет молекулярное
строение, а красный и черный (P∞) — атомное.

Аллотропные модификации серы включают ромбическую, моноклинную, и пластическую серу. Ромбическая (S8) и моноклинная
сера (S8) имеют молекулярное строение. Пластическая сера (S∞) представляет собой длинные цепочки атомов,
тем не менее также характеризуется молекулярным строением.
Надо заметить, что с течением времени, пластическая и моноклинная модификации серы, неустойчивые, превращаются в ромбическую, наиболее устойчивую.

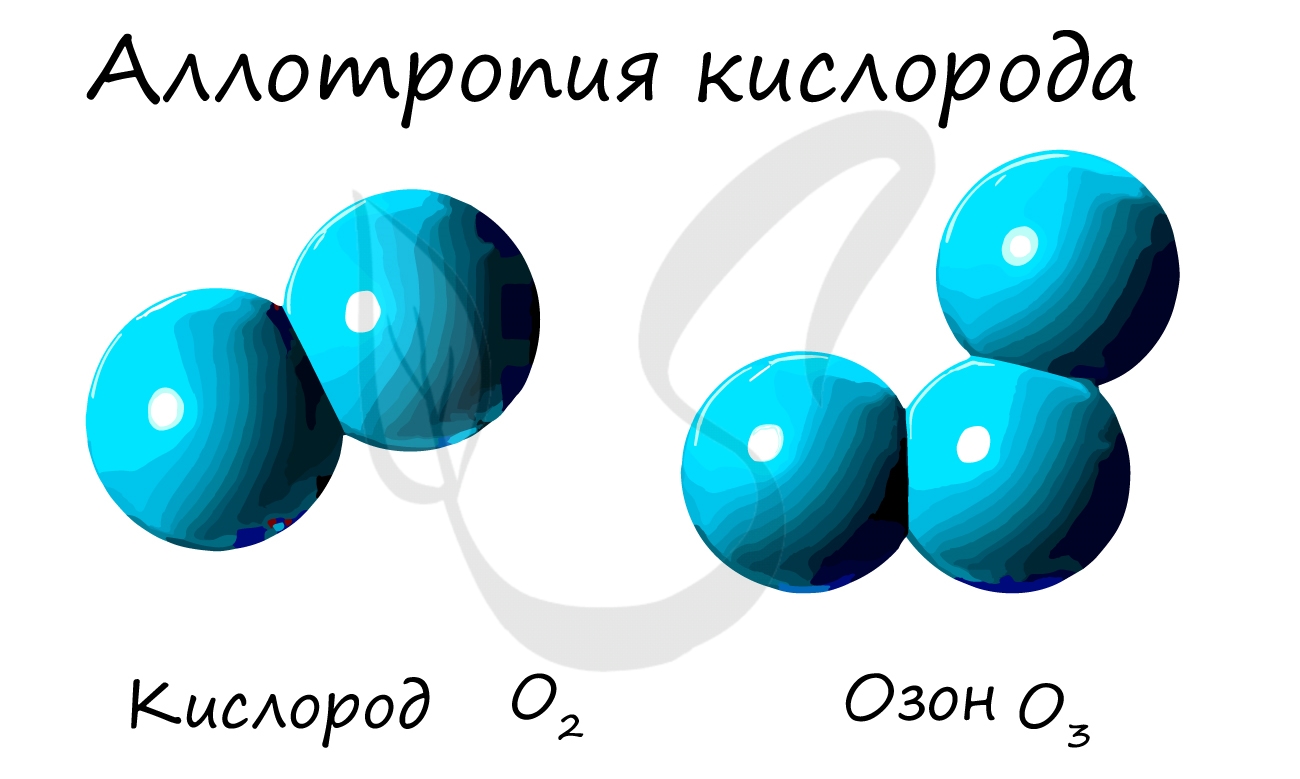
Из аллотропных модификаций кислорода наиболее известен озон (греч. ozo — иметь сильный запах). Озон — неустойчивая модификация
кислорода, образуется в озоновом слое под действием ультрафиолетового излучения. Имеет молекулярное строение и формулу — O3.
Озон — ядовитый газ. Применяется как окислитель при отбеливании, при очистке воды и кондиционировании воздуха. В медицине существует
целое направление, посвященное лечению с применение озона — озонотерапия.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная).
Классификация неорганических веществ с примерами соединений
Теперь проанализируем представленную выше классификационную схему более детально.
Как мы видим, прежде всего все неорганические вещества делятся на простые и сложные:
Простыми веществами называют такие вещества, которые образованы атомами только одного химического элемента. Например, простыми веществами являются водород H2, кислород O2, железо Fe, углерод С и т.д.
Среди простых веществ различают металлы, неметаллы и благородные газы:
Металлы образованы химическими элементами, расположенными ниже диагонали бор-астат, а также всеми элементами, находящимися в побочных группах.
Благородные газы образованы химическими элементами VIIIA группы.
Неметаллы образованы соответственно химическими элементами, расположенными выше диагонали бор-астат, за исключением всех элементов побочных подгрупп и благородных газов, расположенных в VIIIA группе:
Названия простых веществ чаще всего совпадают с названиями химических элементов, атомами которых они образованы. Однако для многих химических элементов широко распространено такое явление, как аллотропия. Аллотропией называют явление, когда один химический элемент способен образовывать несколько простых веществ. Например, в случае химического элемента кислорода возможно существование молекулярных соединений с формулами O2 и O3. Первое вещество принято называть кислородом так же, как и химический элемент, атомами которого оно образовано, а второе вещество (O3) принято называть озоном. Под простым веществом углеродом может подразумеваться любая из его аллотропных модификаций, например, алмаз, графит или фуллерены. Под простым веществом фосфором могут пониматься такие его аллотропные модификации, как белый фосфор, красный фосфор, черный фосфор.
Сложные вещества
Сложными веществами называют вещества, образованные атомами двух или более химических элементов.
Так, например, сложными веществами являются аммиак NH3, серная кислота H2SO4, гашеная известь Ca(OH)2 и бесчисленное множество других.
Среди сложных неорганических веществ выделяют 5 основных классов, а именно оксиды, основания, амфотерные гидроксиды, кислоты и соли:
Оксиды — сложные вещества, образованные двумя химическими элементами, один из которых кислород в степени окисления -2.
Общая формула оксидов может быть записана как ЭxOy, где Э — символ какого-либо химического элемента.
Номенклатура оксидов
Название оксида химического элемента строится по принципу:
Например:
Fe2O3 — оксид железа (III); CuO — оксид меди (II); N2O5 — оксид азота (V)
Нередко можно встретить информацию о том, что в скобках указывается валентность элемента, однако же это не так. Так, например, степень окисления азота N2O5 равна +5, а валентность, как это ни странно, равна четырем.
В случае, если химический элемент имеет единственную положительную степень окисления в соединениях, в таком случае степень окисления не указывается. Например:
Na2O — оксид натрия; H2O — оксид водорода; ZnO — оксид цинка.
Классификация оксидов
Оксиды по их способности образовывать соли при взаимодействии с кислотами или основаниями подразделяют соответственно на солеобразующие и несолеобразующие.
Несолеобразующих оксидов немного, все они образованы неметаллами в степени окисления +1 и +2. Список несолеобразующих оксидов следует запомнить: CO, SiO, N2O, NO.
Солеобразующие оксиды в свою очередь подразделяются на основные, кислотные и амфотерные.
Основными оксидами называют такие оксиды, которые при взаимодействии с кислотами (или кислотными оксидами) образуют соли. К основным оксидам относят оксиды металлов в степени окисления +1 и +2, за исключением оксидов BeO, ZnO, SnO, PbO.
Кислотными оксидами называют такие оксиды, которые при взаимодействии с основаниями (или основными оксидами) образуют соли. Кислотными оксидами являются практически все оксиды неметаллов за исключением несолеобразующих CO, NO, N2O, SiO, а также все оксиды металлов в высоких степенях окисления (+5, +6 и +7).
Амфотерными оксидами называют оксиды, которые могут реагировать как с кислотами, так и основаниями, и в результате этих реакций образуют соли. Такие оксиды проявляют двойственную кислотно-основную природу, то есть могут проявлять свойства как кислотных, так и основных оксидов. К амфотерным оксидам относятся оксиды металлов в степенях окисления +3, +4, а также в качестве исключений оксиды BeO, ZnO, SnO, PbO.
Некоторые металлы могут образовывать все три вида солеобразующих оксидов. Например, хром образует основный оксид CrO, амфотерный оксид Cr2O3 и кислотный оксид CrO3.
Как можно видеть, кислотно-основные свойства оксидов металлов напрямую зависят от степени окисления металла в оксиде: чем больше степень окисления, тем сильнее выражены кислотные свойства.
Основания
Основания — соединения с формулой вида Me(OH)x, где x чаще всего равен 1 или 2.
Исключения: Be(OH)2, Zn(OH)2, Sn(OH)2 и Pb(OH)2 не относятся к основаниям, несмотря на степень окисления металла +2. Данные соединения являются амфотерными гидроксидами, которые еще будут рассмотрены в этой главе более подробно.
Классификация оснований
Основания классифицируют по количеству гидроксогрупп в одной структурной единице.
Основания с одной гидроксогруппой, т.е. вида MeOH, называют однокислотными основаниями, с двумя гидроксогруппами, т.е. вида Me(OH)2, соответственно, двухкислотными и т.д.
Также основания подразделяют на растворимые (щелочи) и нерастворимые.
К щелочам относятся исключительно гидроксиды щелочных и щелочно-земельных металлов, а также гидроксид таллия TlOH.
Номенклатура оснований
Название основания строится по нижеследующему принципу:
Например:
Fe(OH)2 — гидроксид железа (II),
Cu(OH)2 — гидроксид меди (II).
В тех случаях, когда металл в сложных веществах имеет постоянную степень окисления, указывать её не требуется. Например:
NaOH — гидроксид натрия,
Ca(OH)2 — гидроксид кальция и т.д.
Кислоты
Кислоты — сложные вещества, молекулы которых содержат атомы водорода, способные замещаться на металл.
Общая формула кислот может быть записана как HxA, где H — атомы водорода, способные замещаться на металл, а A — кислотный остаток.
Например, к кислотам относятся такие соединения, как H2SO4, HCl, HNO3, HNO2 и т.д.
Классификация кислот
По количеству атомов водорода, способных замещаться на металл, кислоты делятся на:
— одноосновные кислоты: HF, HCl, HBr, HI, HNO3;
— двухосновные кислоты: H2SO4, H2SO3, H2CO3;
— трехосновные кислоты: H3PO4, H3AsO4.
Следует отметить, что количество атомов водорода в случае органических кислот чаще всего не отражает их основность. Например, уксусная кислота с формулой CH3COOH, несмотря на наличие 4-х атомов водорода в молекуле, является не четырех-, а одноосновной. Основность органических кислот определяется количеством карбоксильных групп (-COOH) в молекуле.
Также по наличию кислорода в молекулах кислоты подразделяют на бескислородные (HF, HCl, HBr и т.д.) и кислородсодержащие (H2SO4, HNO3, H3PO4 и т.д.). Кислородсодержащие кислоты называют также оксокислотами.
Более детально про классификацию кислот можно почитать здесь.
Номенклатура кислот и кислотных остатков
Нижеследующий список названий и формул кислот и кислотных остатков обязательно следует выучить.
В некоторых случаях облегчить запоминание может ряд следующих правил.
Как можно видеть из таблицы выше, построение систематических названий бескислородных кислот выглядит следующим образом:
Например:
HF — фтороводородная кислота;
HCl — хлороводородная кислота;
H2S — сероводородная кислота.
Названия кислотных остатков бескислородных кислот строятся по принципу:
Например, Cl— — хлорид, Br— — бромид.
Названия кислородсодержащих кислот получают добавлением к названию кислотообразующего элемента различных суффиксов и окончаний. Например, если кислотообразующий элемент в кислородсодержащей кислоте имеет высшую степень окисления, то название такой кислоты строится следующим образом:
Например, серная кислота H2S+6O4, хромовая кислота H2Cr+6O4.
Все кислородсодержащие кислоты могут быть также классифицированы как кислотные гидроксиды, поскольку в их молекулах обнаруживаются гидроксогруппы (OH). Например, это видно из нижеследующих графических формул некоторых кислородсодержащих кислот:
Таким образом, серная кислота иначе может быть названа как гидроксид серы (VI), азотная кислота — гидроксид азота (V), фосфорная кислота — гидроксид фосфора (V) и т.д. При этом число в скобках характеризует степень окисления кислотообразующего элемента. Такой вариант названий кислородсодержащих кислот многим может показаться крайне непривычным, однако же изредка такие названия можно встретить в реальных КИМах ЕГЭ по химии в заданиях на классификацию неорганических веществ.
Амфотерные гидроксиды
Амфотерные гидроксиды — гидроксиды металлов, проявляющие двойственную природу, т.е. способные проявлять как свойства кислот, так и свойства оснований.
Амфотерными являются гидроксиды металлов в степенях окисления +3 и +4 (как и оксиды).
Также в качестве исключений к амфотерным гидроксидам относят соединения Be(OH)2, Zn(OH)2, Sn(OH)2 и Pb(OH)2, несмотря на степень окисления металла в них +2.
Для амфотерных гидроксидов трех- и четырехвалентных металлов возможно существование орто- и мета-форм, отличающихся друг от друга на одну молекулу воды. Например, гидроксид алюминия (III) может существовать в орто-форме Al(OH)3 или мета-форме AlO(OH) (метагидроксид).
Поскольку, как уже было сказано, амфотерные гидроксиды проявляют как свойства кислот, так и свойства оснований, их формула и название также могут быть записаны по-разному: либо как у основания, либо как у кислоты. Например:
| Амфотерный гидроксид в форме основания | Амфотерный гидроксид в форме кислоты | «Кислотный» остаток |
| Zn(OH)2 гидроксид цинка | H2ZnO2 цинковая кислота | ZnO22- цинкат |
| Al(OH)3 (орто)гидроксид алюминия | H3AlO3 ортоалюминиевая кислота | AlO33- ортоалюминат |
| AlO(OH) метагидроксид алюминия | HAlO2 метаалюминиевая кислота | AlO2— метаалюминат |
Соли
Соли — это сложные вещества, в состав которых входят катионы металлов и анионы кислотных остатков.
Так, например, к солям относятся такие соединения как KCl, Ca(NO3)2, NaHCO3 и т.д.
Представленное выше определение описывает состав большинства солей, однако же существуют соли, не попадающие под него. Например, вместо катионов металлов в состав соли могут входить катионы аммония или его органические производные. Т.е. к солям относятся такие соединения, как, например, (NH4)2SO4 (сульфат аммония), [CH3NH3]+Cl— (хлорид метиламмония) и т.д.
Также противоречат определению солей выше класс так называемых комплексных солей, которые будут рассмотрены в конце данной темы.
Классификация солей
С другой стороны, соли можно рассматривать как продукты замещения катионов водорода H+ в кислоте на другие катионы или же как продукты замещения гидроксид-ионов в основаниях (или амфотерных гидроксидах) на другие анионы.
При полном замещении образуются так называемые средние или нормальные соли. Например, при полном замещении катионов водорода в серной кислоте на катионы натрия образуется средняя (нормальная) соль Na2SO4, а при полном замещении гидроксид-ионов в основании Ca(OH)2 на кислотные остатки нитрат-ионы образуется средняя (нормальная) соль Ca(NO3)2.
Соли, получаемые неполным замещением катионов водорода в двухосновной (или более) кислоте на катионы металла, называют кислыми. Так, при неполном замещении катионов водорода в серной кислоте на катионы натрия образуется кислая соль NaHSO4.
Соли, которые образуются при неполном замещении гидроксид-ионов в двухкислотных (или более) основаниях, называют основными солями. Например, при неполном замещении гидроксид-ионов в основании Ca(OH)2 на нитрат-ионы образуется основная соль Ca(OH)NO3.
Соли, состоящие из катионов двух разных металлов и анионов кислотных остатков только одной кислоты, называют двойными солями. Так, например, двойными солями являются KNaCO3, KMgCl3 и т.д.
Если соль образована одним типом катионов и двумя типами кислотных остатков, такие соли называют смешанными. Например, смешанными солями являются соединения Ca(OCl)Cl, CuBrCl и т.д.
Существуют соли, которые не попадают под определение солей как продуктов замещения катионов водорода в кислотах на катионы металлов или продуктов замещения гидроксид-ионов в основаниях на анионы кислотных остатков. Это — комплексные соли. Так, например, комплексными солями являются тетрагидроксоцинкат- и тетрагидроксоалюминат натрия с формулами Na2[Zn(OH)4] и Na[Al(OH)4] соответственно. Распознать комплексные соли среди прочих чаще всего можно по наличию квадратных скобок в формуле. Однако нужно понимать, что, чтобы вещество можно было отнести к классу солей, в его состав должны входить какие-либо катионы, кроме (или вместо) H+, а из анионов должны быть какие-либо анионы помимо (или вместо) OH—. Так, например, соединение H2[SiF6] не относится к классу комплексных солей, поскольку при его диссоциации из катионов в растворе присутствуют только катионы водорода H+. По типу диссоциации данное вещество следует скорее классифицировать как бескислородную комплексную кислоту. Аналогично, к солям не относится соединение [Ag(NH3)2]OH, т.к. данное соединение состоит из катионов [Ag(NH3)2]+ и гидроксид-ионов OH—, т.е. его следует считать комплексным основанием.
Номенклатура солей
Номенклатура средних и кислых солей
Название средних и кислых солей строится по принципу:
Если степень окисления металла в сложных веществах постоянная, то ее не указывают.
Названия кислотных остатков были даны выше при рассмотрении номенклатуры кислот.
Например,
Na2SO4 — сульфат натрия;
NaHSO4 — гидросульфат натрия;
CaCO3 — карбонат кальция;
Ca(HCO3)2 — гидрокарбонат кальция и т.д.
Номенклатура основных солей
Названия основных солей строятся по принципу:
Например:
(CuOH)2CO3 — гидроксокарбонат меди (II);
Fe(OH)2NO3 — дигидроксонитрат железа (III).
Номенклатура комплексных солей
Номенклатура комплексных соединений значительно сложнее, и для сдачи ЕГЭ многого знать из номенклатуры комплексных солей не нужно.
Следует уметь называть комплексные соли, получаемые взаимодействием растворов щелочей с амфотерными гидроксидами. Например:
*Одинаковыми цветами в формуле и названии обозначены соответствующие друг другу элементы формулы и названия.
Тривиальные названия неорганических веществ
Под тривиальными названиями понимают названия веществ не связанные, либо слабо связанные с их составом и строением. Тривиальные названия обусловлены, как правило, либо историческими причинами либо физическими или химическими свойствами данных соединений.
Список тривиальных названий неорганических веществ, которые необходимо знать:
| Na3[AlF6] | криолит |
| SiO2 | кварц, кремнезем |
| FeS2 | пирит, железный колчедан |
| CaSO4∙2H2O | гипс |
| CaC2 | карбид кальция |
| Al4C3 | карбид алюминия |
| KOH | едкое кали |
| NaOH | едкий натр, каустическая сода |
| H2O2 | перекись водорода |
| CuSO4∙5H2O | медный купорос |
| NH4Cl | нашатырь |
| CaCO3 | мел, мрамор, известняк |
| N2O | веселящий газ |
| NO2 | бурый газ |
| NaHCO3 | пищевая (питьевая) сода |
| Fe3O4 | железная окалина |
| NH3∙H2O (NH4OH) | нашатырный спирт |
| CO | угарный газ |
| CO2 | углекислый газ |
| SiC | карборунд (карбид кремния) |
| PH3 | фосфин |
| NH3 | аммиак |
| KClO3 | бертолетова соль (хлорат калия) |
| (CuOH)2CO3 | малахит |
| CaO | негашеная известь |
| Ca(OH)2 | гашеная известь |
| прозрачный водный раствор Ca(OH)2 | известковая вода |
| взвесь твердого Ca(OH)2 в его водном растворе | известковое молоко |
| K2CO3 | поташ |
| Na2CO3 | кальцинированная сода |
| Na2CO3∙10H2O | кристаллическая сода |
| MgO | жженая магнезия |
Как определить класс неорганического вещества
Существует множество неорганических веществ, которые подразделяются на классы. Для того чтобы правильно классифицировать предложенные соединения, необходимо иметь представление об особенностях строения каждой группы веществ, которых всего четыре. Это оксиды, кислоты, основания и соли. Задания на определение веществ разных классов могут быть на всех видах контроля по химии, включая единый государственный экзамен (ЕГЭ).

Инструкция
Кислоты. Сюда относятся сложные соединения, которые состоят из атомов водорода и кислотного остатка. Атомы водорода в формуле находятся на первом месте, причем их может быть различное количество. Исходя из этого, кислоты, в свою очередь, подразделяются на одноосновные:
HCl — хлороводородная кислота (соляная);
HNO3 — азотная кислота.
Двухосновные:
H2SO4 — серная кислота;
H2S — сероводородная кислота.
Трехосновные:
H3PO4 — ортофосфорная кислота;
H3ВO3 — борная кислота.
Основания. Это сложные вещества, которые состоят из атомов металлов и гидроксильных групп. Количество последних определяется по валентности металла. Основания могут быть растворимыми в воде:
КOН — гидроксид калия;
Ca(OН)2 — гидроксид кальция;
и нерастворимыми:
Zn(OН)2 — гидроксид цинка;
Al(OН)3 — гидроксид алюминия.
К классу оксидов относятся сложные вещества, которые состоят только из двух химических элементов, одним из которых будет являться кислород, стоящий в формуле на втором месте. Оксиды имеют собственную классификацию. В основные оксиды входят вещества, которые соответствуют основаниям. В составе химической формулы они имеют атомы металлов.
ВaO — оксид бария;
К2O — оксид калия;
Li2O — оксид лития.
К кислотным можно отнести оксиды, которым соответствуют кислоты. В их формулу входят атомы неметаллов.
SO3 — оксид серы (VI);
SO2 — оксид серы (IV);
СO2 — оксид углерода (IV);
Р2O5 — оксид фосфора (V).
К амфотерным относятся оксиды, в состав которых входят переходные элементы, такие как цинк, алюминий, бериллий и др.:
BeO — оксид бериллия;
ZnO — оксид цинка;
Al2O3 — оксид алюминия.
Соли – это сложные вещества, состоящие из атомов металлов и кислотных остатков. На первом месте в их формулах стоят металлы.
КCl — хлорид калия;
CaSO4 — сульфат кальция;
Al(NO3)3 — нитрат алюминия;
Ba3(PO4)2 — ортофосфат бария.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
По составу химические
соединения бывают простыми и сложными.
Простое вещество- это вещество,
образованное путем сочетания атомов
одного и того же элемента, и является
формой существования химических
элементов в свободном состоянии.
Химический элемент
– это вид атомов, обозначенный
определенными символами и имеющий
определенную совокупность химических
свойств.
В природе существует
явление аллотропии. Аллотропия – это
образование одним и тем же химическим
элементом различных веществ. Это явление
обусловлено различием числа атомов в
молекулах вещества или иным типом
решетки (например, кислород О 2;
озон О 3).
В настоящее время
известно более 110 химических элементов
и около 400 простых веществ.
Все химические
элементы делятся на металлы и неметаллы.
Данный тип классификации сложился
исторически на основе практического
опыта. Металлы – это химические элементы,
способные отдавать электроны. Неметаллы
– это электроотрицательные элементы,
способные присоединять электроны. В
таблице Менделеева граница металлы
–неметаллы условно идет по диагонали
бор-астат (металлы расположены слева,
а неметаллы –справа). Элементы вблизи
диагонали имеют промежуточные свойства
(например, полупроводники).
Сложные вещества
– это вещества, состоящие из комбинаций
простых веществ. Сложные вещества
подразделяются на неорганические
(300000 видов) и органические, которых еще
больше. В свою очередь неорганические
вещества бывают пяти классов:
— оксиды (содержат
кислород);
— гидроксиды
(содержат ОН);
— кислоты (содержат
кислотный остаток, например, SO
4);
— амфотерные
гидроксиды;
— соли (содержат
металлы).
Оксиды – это
соединения двух элементов, в которых
атомы кислорода связаны с атомами
другого элемента.
Гидроскиды (щелочи)
– это вещества, которые в водном растворе
диссоциируют с образование катионом
металла, анионов гидроксила и не образуют
других анионов.
Амфотерные
гидроксиды – это гидроксиды, которые
в водном растворе диссоциируют с
образованием катионов водорода Н+ и
анионов ОН-, т.е. проявляют свойства
кислот и оснований.
Кислоты – это
химические соединения, которые в водном
растворе диссоциируют на катионы
водорода и анионы кислотного остатка.
Соли – это химические
соединения, которые в воде диссоциируют
на катионы металла и анионы кислотного
остатка. Все классы химических соединений
неорганического типа находятся в
генетической взаимосвязи, которая может
быть представлена в виде схемы:
М
еталлы
Неметаллы
Основные оксиды
Кислотные оксиды
Гидроксиды
Кислоты
Соли
При этом условном
обозначении необходимо учитывать
наличие обратных связей между сложными
неорганическими веществами.
Органическими
называют соединения углерода, атомы
которого связаны с атомами других
элементов, преимущественно малополярными
связями. В природе эти соединения
встречаются исключительно в организмах
растений и животных и являются продуктами
жизнедеятельности или распада этих
организмов.
Для органических
соединений характерен ряд отличительных
признаков и свойств, которые составляют
предмет для отдельной области химии –
органической химии. В основном эти
отличия обусловлены особенностями
свойств углерода:
— в периодической
системе элементов углерод расположен
между типичными металлами и неметаллами,
проявляет ковалентность, равную 4, и
способен соединяться со многими
элементами;
— его атомы способны
соединяться друг с другом, образуя
прочные, иногда весьма длинные цепи:
линейные, разветвленные, колцеобразные;
связь в цепочках между атомами углерода
может быть одинарной, двойной и тройной;
— в типичных
химических превращениях углеродная
структура органической молекулы не
нарушается, а в реакции принимают участие
периферийные группы, которые носят
название функциональных, или атомы,
связанные кратными связями;
— молекулы
органических соединений при одинаковом
составе и равных молекулярных массах
могут иметь различную структуру и
различные свойства. Это явление называют
изомерией, оно объясняет существование
огромного числа органических соединений;
— огромное
разнообразие органических соединений
состоит из небольшого числа химических
элементов: углерода, водорода, кислорода,
фосфора, серы, галогенов. В отдельных
случаях в состав органических соединений
могут входить металлы;
— для углерода не
характерны соединения с ионными связями.
Подавляющее большинство органических
молекул построены на основе ковалентных
связей, поэтому органические вещества
являются неэлектролитами и не диссоциируют
в растворах. Реакции протекают в
молекулярной форме с небольшой скорость;
— Температура
плавления органических соединений
лежит в интервале 100-200 С, реже -300-400 С. В
присутствии кислорода подавляющее
большинство органических соединений
полностью сгорает с образованием
диоксида углерода и воды. При нагревании
без доступа воздуха органические
вещества преобразуются в вещества с
другими свойствами вследствие структурной
перестройки.
В биосфере
органические вещества играют важную
роль, участвуя во всех процессах
растительных и животных организмов. В
качестве отдельных групп органических
соединений выступают ферменты, гормоны,
витамины и т.п.
Теория химического
строения органических соединений была
предложена в 60-е годы XIX
века русским химиком А.М. Бутлеровым.
Дополненная современными представлениями
о природе химической связи, пространственной
структуре молекул, характере взаимного
влияния атомов и молекул, эта теория
составляет фундамент органической
химии наших дней.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #