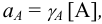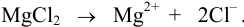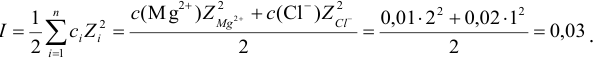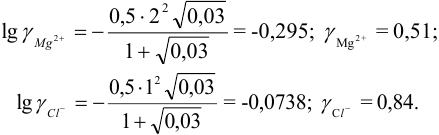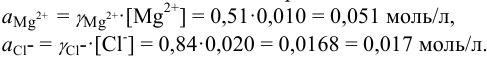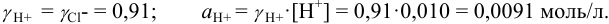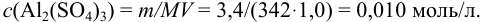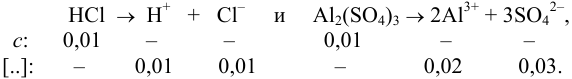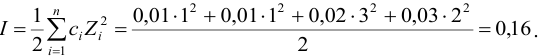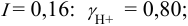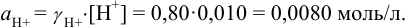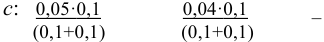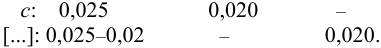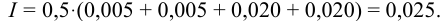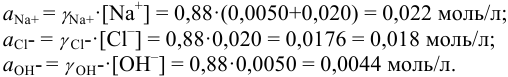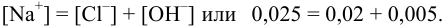Несмотря на то,
что термодинамика не учитывает процессы,
происходящие в реальных растворах,
например, притяжение и отталкивание
ионов, термодинамические закономерности,
выведенные для идеальных растворов,
можно применить и для реальных растворов,
если заменить концентрации активностями.
Активность (a) -такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
Активность может
быть как меньше, так и больше номинальной
концентрации вещества в растворе.
Активность чистого растворителя, а
также растворителя в не слишком
концентрированных растворах принимается
равной 1. За 1 принимается также активность
твёрдого вещества, находящегося в
осадке, или жидкости, не смешивающейся
с данным раствором. В бесконечно
разбавленном растворе активность
растворённого вещества совпадает с его
концентрацией.
Отношение
активности вещества в данном растворе
к его концентрации называетсякоэффициентом активности.
Коэффициент
активности — это своеобразный поправочный
коэффициент, показывающий, насколько
реальность отличается от идеала.
3.3.
Отклонения от идеальности в растворах
сильных электролитов
Особенно заметное
отклонение от идеальности имеет место
в растворах сильных электролитов. Это
отражается, например, на их температурах
кипения, плавления, давлении пара над
раствором и, что особенно важно для
аналитической химии, на величинах
констант различных равновесий, протекающих
в таких растворах.
Для характеристики
активности электролитов используют:
Для электролита
AmBn:
Величина, которая
учитывает влияние концентрации (С) и
заряда (z) всех ионов,
присутствующих в растворе, на активность
растворённого вещества, называетсяионной силой (I).
Пример
3.1.В 1,00 л водного раствора
содержится 10,3 г NaBr,
14,2 г Na2SO4
и 1,7 г NH3.
Чему равна ионная сила такого раствора?
0,100 Моль/л
0,100 Моль/л
С(Na+)
= 0,300 моль/л, С(Br—) =
0,100 моль/л, С(SO42-)
= 0,100моль/л
I=
0,5[0,300(+1)2+ 0,100(-1)2+ 0,100(-2)2]
= 0,400 моль/л
Рис.
3.1. Влияние
ионной силы на среднеионный коэффициент
активности HCl
На рис. 3.1 показан
пример влияния ионной силы на активность
электролита (HCl). Аналогичная
зависимость коэффициента активности
от ионной силы наблюдается также уHClO4,LiCl,AlCl3и многих других
соединений. У некоторых электролитов
(NH4NO3,AgNO3) зависимость
коэффициента активности от ионной силы
является монотонно убывающей.
Универсального
уравнения, с помощью которого можно
было бы рассчитать коэффициент активности
любого электролита при любой величине
ионной силы, не существует. Для описания
зависимости коэффициента активности
от ионной силы в очень разбавленных
растворах (до I< 0,01) можно
использоватьпредельный закон
Дебая-Хюккеля
где
A
— коэффициент, зависящий от температуры
и диэлектрической проницаемости среды;
для водного раствора (298К) A
0,511.
Данное уравнение
было получено голландским физиком П.
Дебаем и его учеником Э. Хюккелем исходя
из следующих предположений. Каждый ион
был представлен в виде точечного заряда
(т.е. размер иона не учитывался), окружённого
в растворе ионной атмосферой—
областью пространства сферической
формы и определённого размера, в которой
содержание ионов противоположного
знака по отношению к данному иону больше,
чем вне её. Заряд ионной атмосферы равен
по величине и противоположен по знаку
заряду создавшего её центрального иона.
Между центральным ионом и окружающей
его ионной атмосферой существует
электростатическое притяжение, которое
стремится стабилизировать данный ион.
Стабилизация приводит к понижению
свободной энергии иона и уменьшению
его коэффициента активности. В предельном
уравнении Дебая-Хюккеля природа ионов
не учитывается. Считается, что при малых
значениях ионной силы коэффициент
активности иона не зависит от его
природы.
При
увеличении ионной силы до 0,01 и больше
предельный закон начинает давать всё
большую и большую погрешность. Это
происходит потому, что реальные ионы
имеют определённый размер, вследствие
чего их нельзя упаковать так плотно,
как точечные заряды. При увеличении
концентрации ионов происходит уменьшение
размеров ионной атмосферы. Так как
ионная атмосфера стабилизирует ион и
уменьшает его активность, то уменьшение
её размера приводит к менее значительному
уменьшению коэффициента активности.
Для расчёта
коэффициентов активности при ионных
силах порядка 0,01 — 0,1 можно использовать
расширенное уравнение Дебая-Хюккеля:
где
B
0,328 (T
= 298K,
a
выражено в ),
a
— эмпирическая константа, характеризующая
размеры ионной атмосферы.
При более высоких
значениях ионной силы (до 1)
количественную оценку коэффициента
активности можно проводить поуравнению
Дэвиса.
В
данном уравнении a
принято равным 3,05, поэтому произведение
Ba
равно 1. Фактор 0,2I
учитывает образование ионных пар,
изменение диэлектрической проницаемости
и т.д.
В ещё более
концентрированных растворах начинают
сильно проявляться индивидуальные
особенности ионов, поэтому уравнения,
описывающего экспериментальные данные
для таких растворов, нет.У
одних электролитов коэффициент активности
уменьшается, что может быть обусловлено
образованием ионных пар, у других он
увеличивается — за счёт уменьшения не
принимающих участие в гидратации молекул
воды и по другим причинам.
Пример
3.2. Рассчитать коэффициенты
активности иона H+
при ионной силе 0,010 и 0,10.
При I
= 0,010 = -0,0511;
0,89.
При I
= 0,10
=-0,0836,
=
0,82
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
From Wikipedia, the free encyclopedia
In thermodynamics, an activity coefficient is a factor used to account for deviation of a mixture of chemical substances from ideal behaviour.[1] In an ideal mixture, the microscopic interactions between each pair of chemical species are the same (or macroscopically equivalent, the enthalpy change of solution and volume variation in mixing is zero) and, as a result, properties of the mixtures can be expressed directly in terms of simple concentrations or partial pressures of the substances present e.g. Raoult’s law. Deviations from ideality are accommodated by modifying the concentration by an activity coefficient. Analogously, expressions involving gases can be adjusted for non-ideality by scaling partial pressures by a fugacity coefficient.
The concept of activity coefficient is closely linked to that of activity in chemistry.
Thermodynamic definition[edit]
The chemical potential, 
,
where μo
B is the chemical potential of a pure substance 

This is generalised to include non-ideal behavior by writing
when 
,
where 





In many cases, as 
Note that in general activity coefficients are dimensionless.
In detail: Raoult’s law states that the partial pressure of component B is related to its vapor pressure (saturation pressure) and its mole fraction 
with the convention
In other words: Pure liquids represent the ideal case.
At infinite dilution, the activity coefficient approaches its limiting value, 
immediately gives
In other words: The compound shows nonideal behavior in the dilute case.
The above definition of the activity coefficient is impractical if the compound does not exist as a pure liquid. This is often the case for electrolytes or biochemical compounds. In such cases, a different definition is used that considers infinite dilution as the ideal state:
with
and
The 
Modifying mole fractions or concentrations by activity coefficients gives the effective activities of the components, and hence allows expressions such as Raoult’s law and equilibrium constants to be applied to both ideal and non-ideal mixtures.
Knowledge of activity coefficients is particularly important in the context of electrochemistry since the behaviour of electrolyte solutions is often far from ideal, due to the effects of the ionic atmosphere. Additionally, they are particularly important in the context of soil chemistry due to the low volumes of solvent and, consequently, the high concentration of electrolytes.[3]
Ionic solutions[edit]
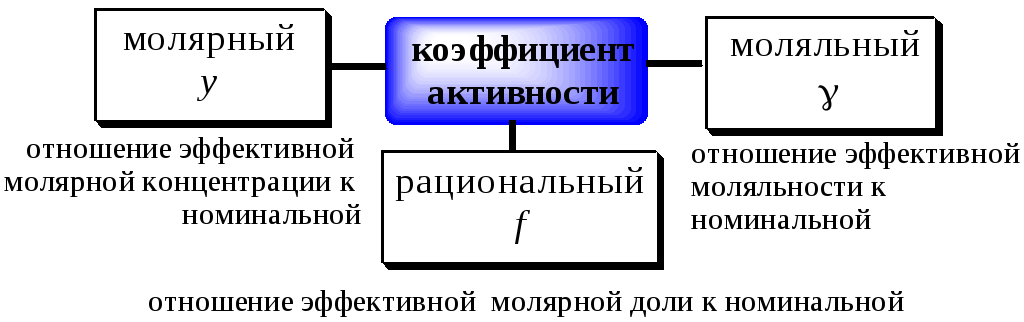
For solution of substances which ionize in solution the activity coefficients of the cation and anion cannot be experimentally determined independently of each other because solution properties depend on both ions. Single ion activity coefficients must be linked to the activity coefficient of the dissolved electrolyte as if undissociated. In this case a mean stoichiometric activity coefficient of the dissolved electrolyte, γ±, is used. It is called stoichiometric because it expresses both the deviation from the ideality of the solution and the incomplete ionic dissociation of the ionic compound which occurs especially with the increase of its concentration.
For a 1:1 electrolyte, such as NaCl it is given by the following:
where 

More generally, the mean activity coefficient of a compound of formula 
Single-ion activity coefficients can be calculated theoretically, for example by using the Debye–Hückel equation. The theoretical equation can be tested by combining the calculated single-ion activity coefficients to give mean values which can be compared to experimental values.
The prevailing view that single ion activity coefficients are unmeasurable independently, or perhaps even physically meaningless, has its roots in the work of Guggenheim in the late 1920s.[5] However, chemists have never been able to give up the idea of single ion activities, and by implication single ion activity coefficients. For example, pH is defined as the negative logarithm of the hydrogen ion activity. If the prevailing view on the physical meaning and measurability of single ion activities is correct then defining pH as the negative logarithm of the hydrogen ion activity places the quantity squarely in the unmeasurable category. Recognizing this logical difficulty, International Union of Pure and Applied Chemistry (IUPAC) states that the activity-based definition of pH is a notional definition only.[6] Despite the prevailing negative view on the measurability of single ion coefficients, the concept of single ion activities continues to be discussed in the literature, and at least one author presents a definition of single ion activity in terms of purely thermodynamic quantities and proposes a method of measuring single ion activity coefficients based on purely thermodynamic processes.[7]
Concentrated ionic solutions[edit]
For concentrated ionic solutions the hydration of ions must be taken into consideration, as done by Stokes and Robinson in their hydration model from 1948.[8] The activity coefficient of the electrolyte is split into electric and statistical components by E. Glueckauf who modifies the Robinson–Stokes model.
The statistical part includes hydration index number h, the number of ions from the dissociation and the ratio r between the apparent molar volume of the electrolyte and the molar volume of water and molality b.
Concentrated solution statistical part of the activity coefficient is:
[9][10][11]
The Stokes–Robinson model has been analyzed and improved by other investigators as well.[12][13]
Experimental determination of activity coefficients[edit]
Activity coefficients may be determined experimentally by making measurements on non-ideal mixtures. Use may be made of Raoult’s law or Henry’s law to provide a value for an ideal mixture against which the experimental value may be compared to obtain the activity coefficient. Other colligative properties, such as osmotic pressure may also be used.
Radiochemical methods[edit]
Activity coefficients can be determined by radiochemical methods.[14]
At infinite dilution[edit]
Activity coefficients for binary mixtures are often reported at the infinite dilution of each component. Because activity coefficient models simplify at infinite dilution, such empirical values can be used to estimate interaction energies. Examples are given for water:
| X | γx∞ (K) | γW∞ (K) |
|---|---|---|
| Ethanol | 4.3800 (283.15) | 3.2800 (298.15) |
| Acetone | 6.0200 (307.85) |
Theoretical calculation of activity coefficients[edit]
Activity coefficients of electrolyte solutions may be calculated theoretically, using the Debye–Hückel equation or extensions such as the Davies equation,[16] Pitzer equations[17] or TCPC model.[18][19][20][21] Specific ion interaction theory (SIT)[22] may also be used.
For non-electrolyte solutions correlative methods such as UNIQUAC, NRTL, MOSCED or UNIFAC may be employed, provided fitted component-specific or model parameters are available. COSMO-RS is a theoretical method which is less dependent on model parameters as required information is obtained from quantum mechanics calculations specific to each molecule (sigma profiles) combined with a statistical thermodynamics treatment of surface segments.[23]
For uncharged species, the activity coefficient γ0 mostly follows a salting-out model:[24]
This simple model predicts activities of many species (dissolved undissociated gases such as CO2, H2S, NH3, undissociated acids and bases) to high ionic strengths (up to 5 mol/kg). The value of the constant b for CO2 is 0.11 at 10 °C and 0.20 at 330 °C.[25]
For water as solvent, the activity aw can be calculated using:[24]
where ν is the number of ions produced from the dissociation of one molecule of the dissolved salt, b is the molality of the salt dissolved in water, φ is the osmotic coefficient of water, and the constant 55.51 represents the molality of water. In the above equation, the activity of a solvent (here water) is represented as inversely proportional to the number of particles of salt versus that of the solvent.
Link to ionic diameter[edit]
The ionic activity coefficient is connected to the ionic diameter by the formula obtained from Debye–Hückel theory of electrolytes:
where A and B are constants, zi is the valence number of the ion, and I is ionic strength.
Dependence on state parameters[edit]
The derivative of an activity coefficient with respect to temperature is related to excess molar enthalpy by
Similarly, the derivative of an activity coefficient with respect to pressure can be related to excess molar volume.
Application to chemical equilibrium[edit]
At equilibrium, the sum of the chemical potentials of the reactants is equal to the sum of the chemical potentials of the products. The Gibbs free energy change for the reactions, ΔrG, is equal to the difference between these sums and therefore, at equilibrium, is equal to zero. Thus, for an equilibrium such as
Substitute in the expressions for the chemical potential of each reactant:
Upon rearrangement this expression becomes
The sum
σμo
S + τμo
T − αμo
A − βμo
B is the standard free energy change for the reaction, 
Therefore,
where K is the equilibrium constant. Note that activities and equilibrium constants are dimensionless numbers.
This derivation serves two purposes. It shows the relationship between standard free energy change and equilibrium constant. It also shows that an equilibrium constant is defined as a quotient of activities. In practical terms this is inconvenient. When each activity is replaced by the product of a concentration and an activity coefficient, the equilibrium constant is defined as
where [S] denotes the concentration of S, etc. In practice equilibrium constants are determined in a medium such that the quotient of activity coefficient is constant and can be ignored, leading to the usual expression
which applies under the conditions that the activity quotient has a particular (constant) value.
References[edit]
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «Activity coefficient». doi:10.1351/goldbook.A00116
- ^ DeHoff, Robert (2018). «Thermodynamics in materials science». Entropy (2nd ed.). 20 (7): 230–231. Bibcode:2018Entrp..20..532G. doi:10.3390/e20070532. ISBN 9780849340659. PMC 7513056. PMID 33265621.
- ^ Ibáñez, Jorge G.; Hernández Esparza, Margarita; Doría Serrano, Carmen; Singh, Mono Mohan (2007). Environmental Chemistry: Fundamentals. Springer. ISBN 978-0-387-26061-7.
- ^ Atkins, Peter; dePaula, Julio (2006). «Section 5.9, The activities of ions in solution». Physical Chemisrry (8th ed.). OUP. ISBN 9780198700722.
- ^ Guggenheim, E. A. (1928). «The Conceptions of Electrical Potential Difference between Two Phases and the Individual Activities of Ions». The Journal of Physical Chemistry. 33 (6): 842–849. doi:10.1021/j150300a003. ISSN 0092-7325.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «pH». doi:10.1351/goldbook.P04524
- ^ Rockwood, Alan L. (2015). «Meaning and Measurability of Single-Ion Activities, the Thermodynamic Foundations of pH, and the Gibbs Free Energy for the Transfer of Ions between Dissimilar Materials». ChemPhysChem. 16 (9): 1978–1991. doi:10.1002/cphc.201500044. ISSN 1439-4235. PMC 4501315. PMID 25919971.
- ^ Stokes, R. H; Robinson, R. A (1948). «Ionic Hydration and Activity in Electrolyte Solutions». Journal of the American Chemical Society. 70 (5): 1870–1878. doi:10.1021/ja01185a065. PMID 18861802.
- ^ Glueckauf, E. (1955). «The influence of ionic hydration on activity coefficients in concentrated electrolyte solutions». Transactions of the Faraday Society. 51: 1235. doi:10.1039/TF9555101235.
- ^ Glueckauf, E. (1957). «The influence of ionic hydration on activity coefficients in concentrated electrolyte solutions». Transactions of the Faraday Society. 53: 305. doi:10.1039/TF9575300305.
- ^ Kortüm, G. (1959). «The Structure of Electrolytic Solutions». Angewandte Chemie. London: Herausgeg. von W. J. Hamer; John Wiley & Sons, Inc., New York; Chapman & Hall, Ltd. 72 (24): 97. doi:10.1002/ange.19600722427. ISSN 0044-8249.
- ^ Miller, Donald G. (1956). «On the Stokes-Robinson Hydration Model for Solutions». The Journal of Physical Chemistry. 60 (9): 1296–1299. doi:10.1021/j150543a034.
- ^ Nesbitt, H. Wayne (1982). «The stokes and robinson hydration theory: A modification with application to concentrated electrolyte solutions». Journal of Solution Chemistry. 11 (6): 415–422. doi:10.1007/BF00649040. S2CID 94189765.
- ^ Betts, R. H.; MacKenzie, Agnes N. (1952). «Radiochemical Measurements of Activity Coefficients in Mixed Electrolytes». Canadian Journal of Chemistry. 30 (2): 146–162. doi:10.1139/v52-020.
- ^ «Activity Coefficients at Infinite Dilution of 30 Important Components from Dortmund Data Bank». Dortmund Data Bank. DDBST GmbH. Retrieved 13 December 2018.
- ^ King, E. L. (1964). «Book Review: Ion Association, C. W. Davies, Butterworth, Washington, D.C., 1962». Science. 143 (3601): 37. Bibcode:1964Sci…143…37D. doi:10.1126/science.143.3601.37. ISSN 0036-8075.
- ^ Grenthe, I.; Wanner, H. «Guidelines for the extrapolation to zero ionic strength» (PDF). Archived from the original (PDF) on 2008-12-17. Retrieved 2007-07-23.
- ^ Ge, Xinlei; Wang, Xidong; Zhang, Mei; Seetharaman, Seshadri (2007). «Correlation and Prediction of Activity and Osmotic Coefficients of Aqueous Electrolytes at 298.15 K by the Modified TCPC Model». Journal of Chemical & Engineering Data. 52 (2): 538–547. doi:10.1021/je060451k. ISSN 0021-9568.
- ^ Ge, Xinlei; Zhang, Mei; Guo, Min; Wang, Xidong (2008). «Correlation and Prediction of Thermodynamic Properties of Nonaqueous Electrolytes by the Modified TCPC Model». Journal of Chemical & Engineering Data. 53 (1): 149–159. doi:10.1021/je700446q. ISSN 0021-9568.
- ^ Ge, Xinlei; Zhang, Mei; Guo, Min; Wang, Xidong (2008). «Correlation and Prediction of Thermodynamic Properties of Some Complex Aqueous Electrolytes by the Modified Three-Characteristic-Parameter Correlation Model». Journal of Chemical & Engineering Data. 53 (4): 950–958. doi:10.1021/je7006499. ISSN 0021-9568.
- ^ Ge, Xinlei; Wang, Xidong (2009). «A Simple Two-Parameter Correlation Model for Aqueous Electrolyte Solutions across a Wide Range of Temperatures». Journal of Chemical & Engineering Data. 54 (2): 179–186. doi:10.1021/je800483q. ISSN 0021-9568.
- ^ «Project: Ionic Strength Corrections for Stability Constants». IUPAC. Archived from the original on 29 October 2008. Retrieved 2008-11-15.
- ^ Klamt, Andreas (2005). COSMO-RS from quantum chemistry to fluid phase thermodynamics and drug design (1st ed.). Amsterdam: Elsevier. ISBN 978-0-444-51994-8.
- ^ a b N. Butler, James (1998). Ionic equilibrium: solubility and pH calculations. New York, NY [u.a.]: Wiley. ISBN 9780471585268.
- ^ Ellis, A. J.; Golding, R. M. (1963). «The solubility of carbon dioxide above 100 degrees C in water and in sodium chloride solutions». American Journal of Science. 261 (1): 47–60. Bibcode:1963AmJS..261…47E. doi:10.2475/ajs.261.1.47. ISSN 0002-9599.
External links[edit]
- AIOMFAC online-model An interactive group-contribution model for the calculation of activity coefficients in organic–inorganic mixtures.
- Electrochimica Acta Single-ion activity coefficients
Влияние электростатических взаимодействий на поведение ионов в растворе. Ионная сила раствора. Коэффициент активности
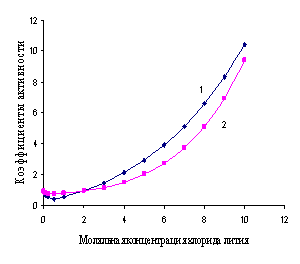
Характеристикой электростатического поля в растворе и мерой электростатических взаимодействий ионов является ионная сила раствора I, связанная с концентрацией ионов 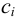
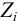
Ионной силой раствора определяется коэффициент активности иона 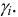
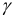
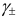
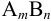
Например, для 0,01 М раствора 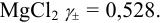
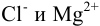
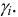
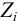
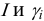
В практических расчетах для оценки коэффициентов активности используют ряд постулатов, упрощающих расчеты:
- Коэффициенты активности ионов равного заряда, независимо от знака и размера, приблизительно равны.
- Растворы, содержащие только нейтральные молекулы, можно считать идеальными
.
- Разбавленные растворы электролитов (особенно — слабых!) приближаются к идеальным
.
Поэтому при расчете величины 
Коэффициент активности является мерой отклонения реальной системы от идеальной. Он связывает концентрацию иона и его активность 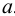
где [А] — равновесная концентрация иона А. Активность имеет размерность концентрации (моль/л).
Следует помнить, что при расчетах любого из четырех видов химических равновесий с применением табличных (термодинамических) констант равновесия получают значения активностей частиц, а не их равновесные концентрации. Расчет равновесных концентраций при I > 0 проводится с учетом у с использованием уравнения (2.11), связывающего различные константы.
Пример 2.1.
Вычислить ионную силу, коэффициенты активности и активность ионов в 0,010 М растворе 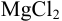
Решение:
Уравнение диссоциации сильного электролита
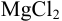
Начальная концентрация (моль/л) с: 0,010
Равновесные концентрации (моль/л) […]: — 0,010 0,020.
По формуле (2.1) вычисляют ионную силу раствора:
Коэффициенты активности можно найти в табл. 1 приложения: при / = 0,03 для двухзарядного иона 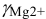
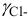
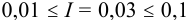
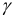
Активности ионов соответственно равны:
Пример 2.2.
Во сколько раз изменится активность ионов водорода в 0,010М растворе 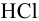
Решение:
Для 0,010 М раствора 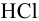
Молярная концентрация раствора 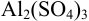
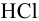
В полученном растворе сильных электролитов устанавливаются равновесия:
В величину I (формула 2.1) вносят вклад все ионы, находящиеся в растворе:
При
Отношение полученных активностей (0,0091/0,0080) показывает, что при введении в раствор 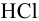
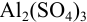
Пример 2.3.
Вычислить ионную силу и активности ионов в растворе, полученном при сливании по 100 мл 0,050 М раствора 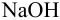
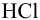
Решение:
При сливании растворов протекает реакция нейтрализации с образованием достаточно слабого электролита — воды, диссоциацией которой пренебрегаем. Данные указывают на избыток взятой щелочи.
С учетом разбавления
и после расчета
В растворе присутствуют ионы 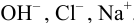
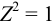
Соответственно 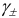
Проверкой решения может быть выполнение принципа электронейтральности раствора в целом:
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
1.3.4. Коэффициенты активности
Электростатические взаимодействия приводят к значительным отклонениям в поведении системы от идеального. Учесть отклонения от идеального, т.е. предусмотреть влияние электростатических факторов можно с помощью метода активностей: вместо концентраций реагирующих частиц [A] используют величины, называемые активностями aA. Численные значения активностей выбирают таким образом, чтобы форма функциональной зависимости для свободной энергии
GA = GA0 + nRT·ln[A]
сохранялась и для реальных растворов:
GA = GA0 + nRT·ln aA.
Следовательно, активность — это та концентрация, которую имел бы компонент воображаемого идеального раствора, обладающего теми же термодинамическими свойствами, что и данный реальный раствор и имеет размерность (моль/л).
Тогда для общей реакции
aA + bB = cC + dD
с учетом активностей получаем константу равновесия — выражение закона действующих масс:
K0 = aCc·aDd/aAa·aBb,
применимое к любым химическим системам — как идеальным, так и реальным.
Отношение активности частицы к ее равновесной концентрации
gA = aA/[A]
называется коэффициентом активности. Коэффициенты активности ионов в растворах электролитов могут служить мерой электростатических взаимодействий в системе. Для идеальных растворов электростатические взаимодействия пренебрежимо малы, активности приравниваются равновесным концентрациям, тогда g = 1.
Известно несколько методов определения и расчета коэффициентов активности. Поскольку электростатические взаимодействия весьма заметны в растворах электролитов, то остановимся на расчетах коэффициентов активности ионов. Они зависят от ионной силы, вычисляемой по известному уравнению:
I = (1/2)·S[Ai]·zi2,
где zi — заряд иона Аi; S — cумма всех ионов, присутствующих в растворе. Ионная сила учитывает электростатическое влияние всех ионов в растворе. Она имеет размерность концентрации и для растворов сильных I-I электролитов численно равна ей.
Одним из наиболее применяемых методов определения коэффициентов активности индивидуальных ионов является оценка по приближению Дебая-Хюккеля [8]
lggi = —Azi2(I)1/2
в случае, когда I £ 0.01 M, и
lggi = -Azi2(I)1/2/[1+aB(I)1/2],
если I = 0.01-0.1 M, где A и B — константы, зависящие от температуры и диэлектрической проницаемости растворителя (для воды при 298 К А » 0.5 и В » 0.33); а — эмпирическая константа, учитывающая размеры ионов и характеризующая среднее расстояние сближения сольватированных ионов в предположении, что они являются жесткими сферами. Значение а можно приближенно было принято считать постоянным, не зависящим от природы иона и равным ~ (3…5)×10—8 см (хотя с этим трудно согласиться).
В разбавленных растворах (I < 0.1 M) коэффициенты активности ионов меньше единицы, но при I ® 0 величина gi ® 1. Растворы с очень низкой ионной силой (I < 0.0001 M) можно считать идеальными. При высоких ионных силах коэффициенты активности начинают зависеть от природы ионов, а затем и от общего состава раствора. В этих случаях для нахождения коэффициентов активности следует пользоваться конкретными справочными данными. В очень концентрированных растворах (ионная сила больше единицы) коэффициенты активности ионов могут быть намного больше единицы. Причиной этого считается связывание значительного количества растворителя в результате сольватации ионов и, таким образом, в увеличении кажущейся концентрации ионов. При ионных силах от 0.1 до 0.5 М во многих случаях хорошие результаты дают расчеты по уравнению Дэвиса [9]:
lggi = -Azi2(I)1/2/[1+aB(I)1/2]+ CI,
где а и С — константы (подбирают эмпирически для каждого конкретного электролита).
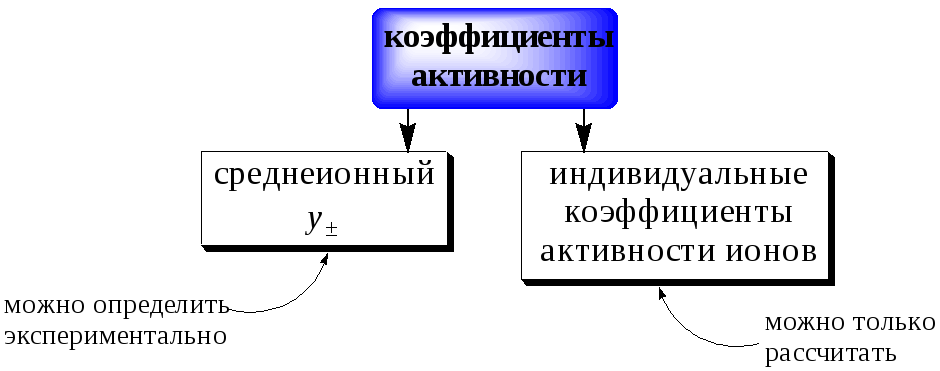
Экспериментально определить коэффициенты активности отдельных ионов невозможно, так как нельзя получить раствор, содержащий ионы только одного сорта. Опытным путем можно было измерить лишь средний коэффициент активности g± ионов электролита AmBn, который связан с коэффициентами активности составляющих его ионов An+ и Bm- следующим образом:
g± = (gAm· gBn)(m+n).
Уравнения Дебая-Хюккеля и Дэвиса пригодны в первом приближении и для расчетов коэффициентов активности незаряженных молекул (неэлектролитов). В этих случаях zi = 0 и в уравнениях Дебая-Хюккеля коэффициент активности неэлектролита равен единице при ионной силе I £ 0.1 М, при больших значениях ионной силы необходимо использовать уравнение Дэвиса, которое для неэлектролитов превращается в lgg = CI. Константа С в этом случае называется солевым коэффициентом, зависящим от диэлектрической проницаемости неэлектролита e. Для веществ с низкойe (газы, сахара, белки) C>0, g > 1. Для таких веществ наблюдается эффект “высаливания”, т.е. уменьшение их растворимости в воде в присутствии электролитов. Для веществ же с высокой e(например, для HCN e = 111) C< 0, g < 1.
Все, что было сказано выше, свидетельствует о непростой ситуации с коэффициентами активности как гидратированных или сольватированных ионов, так и нейтральных молекул (неэлектролитов), для которых до сего времени не было разработано единой, всеохватывающей теории, позволяющей однозначно рассчитывать g. Допускается неоправданно большое число подгоночных параметров при изменениях концентраций одного и того же растворенного вещества и природы растворителя.
Теория гидродинамических флуктуаций в растворах симметричных и несимметричных, сильных и слабых электролитов, предлагаемая нами, дает возможность оценивать коэффициенты активности и отдельных ионов, и недиссоциированных молекул, а также транспортные свойства во всем диапазоне изучаемых концентраций (от 0 до 4-5 моль/л) в любом растворителе.
1.3.4.1. Соотношения между коэффициентами активности и концентрацией растворов электролитов
Коэффициент активности есть мера отклонения реальных (практических, экспериментальных) параметров от идеальных, разработанных в первом приближении для разбавленных растворов неэлектролитов. Величины их в растворах высоких концентраций становятся виртуальными. В самом деле, значения коэффициентов в несколько десятков, то есть отклонений от идеальных параметров в десятки раз, сложно приспособить к законам для практического применения в растворах, где доминируют процессы ассоциации или других межмолекулярных взаимодействий.
Тем не менее, имеется ряд фактических данных о зависимости коэффициентов активности электролитов от моляльности, причем при некоторых концентрациях (от децимоляльных для одних электролитов до нескольких моляльностей для других) наблюдается точка минимума.
До сих пор в литературе нет внятных объяснений и, тем более, обоснований появления этого минимального значения коэффициента активности.
По нашему мнению [10, 11], коэффициенты активности представляют собой вероятность распределения ионных составляющих растворов по Больцману, которая применительно к растворам может быть аппроксимирована следующим образом:
g = exp(-ћw/kБT) (1.22)
g = exp[-(4pzKtzAne2ћ2CiNA/m·1000· kБ2T2)1/2] (1.23)
где w — частота плазмоподобных колебаний «диссоциация-рекомбинация в нейтральные молекулы или ионные ассоциаты» (а) в растворах электролитов [12]
, (а)
w = (4pzKtzAne2CiNA/m·1000)1/2;
ћ — постоянная Планка;
zie — заряд иона;
Ci — ионная составляющая электролита (Сi = С·a, С — исходная концентрация электролита, a — степень диссоциации электролита);
NA — число Авогадро;
m — приведенная масса несольватированных ионов электролита, определяемая по формуле: m = 1/mKt + 1/mAn;
kБ — константа Больцмана;
Т — температура по Кельвину.
В данной работе предложено модельное уравнение расчета оптимальных концентраций электролитов, соответствующих минимуму коэффициента активности и рассуждения [13-18].
Показано, что в точке минимума функции
g = f(C) (1.22)
при концентрации С0, характеризующей gmin имеет место равенство ћw = kБT, w = w0 и это характеризует особую точку, в которой происходит изменение знака диэлектрического отклика. При w =w0 и далее при всех w >w0 в растворе электролита образуется новая структура, элементами которой являются ионные ассоциаты. В этой особой точке коэффициент активности g имеет минимально возможное значение. Чтобы сшить решения до и после равенства ћw = kБT , сокращая показатель экспоненты и учитывая универсальные постоянные, приходим к виду:
g = 0.368·exp[-(245.467/T)·(C0/μ)1/2] , (1.23)
а затем − к выражению (4):
g = 0.368·exp{[(C0)1/2-(C)1/2]/(C0)1/2} (1.24)
где С0 — концентрация электролита в точке gmin.
Из уравнений (1.22), (1.23) и (1.24) подстановкой универсальных постоянных и размерности в СГС: kБ = 1.38·10-16, е = 4.8·10-10, ћ = 1.05·10-27, NA = 6.023·1023, масса в ед. СГС равна 1.67·10-24, получаем:
С0 = 1.02·10-6·m·Т 2/ (1.25)
Уравнения (1.23) и (1.24) выражают коэффициент активности для неассоциированных ионов электролита, тогда как литературные (экспериментальные) величины g± учитывают в этой точке фактические (реальные) взаимодействия сольватированных ионов с образованием молекулярной формы электролита или ионных ассоциатов по равновесию (а). Поэтому не следует ожидать полного тождества коэффициентов активности, теоретически оцененных по уравнению (1.24), с литературными, но, безусловно, важен характер зависимости коэффициентов активности от концентраций.
В табл.1.3 приведены полученные концентрации для 42 электролитов при gmin.
Таблица 1.3
Значения концентрации электролита C0, моль/л при gmin по уравнению (1.25)
|
Ион |
Li+ |
Na+ |
K+ |
Rb+ |
Cs+ |
NH4+ |
|
F— |
0.46 |
0.94 |
1.16 |
1.41 |
1.51 |
0.84 |
|
Cl— |
0.53 |
1.26 |
1.68 |
2.27 |
2.54 |
1.08 |
|
Br— |
0.58 |
1.62 |
2.37 |
3.74 |
4.52 |
1.33 |
|
I— |
0.60 |
1.76 |
2.70 |
4.63 |
5.88 |
1.43 |
|
NO3— |
0.56 |
1.52 |
2.17 |
3.26 |
3.83 |
1.26 |
|
ClO4— |
0.59 |
1.69 |
2.54 |
4.17 |
5.15 |
1.38 |
|
CNS — |
0.56 |
1.49 |
2.11 |
3.13 |
3.66 |
1.24 |
Что касается увеличения коэффициента активности g при больших концентрациях электролита, то не было предложено рациональной количественной теории, определяющей концентрации растворов с минимумом g и значительным увеличением его с повышением моляльности. В данной работе дается объяснение этому факту и рассчитаны оптимальные концентрации электролитов, соответствующие минимуму коэффициента активности. Так, за пределами концентрации С0, соответствующей минимуму коэффициента активности, в связи с сокращением длин свободного пробега сольватированных ионов или молекул, превалирующими становятся межионные взаимодействия, приводящие преимущественно к ионным ассоциатам в полярных с низкими значениями диэлектрических проницаемостей растворителях или к молекулярным сольватам в неполярных с низкими значениями диэлектрических проницаемостей растворителях.
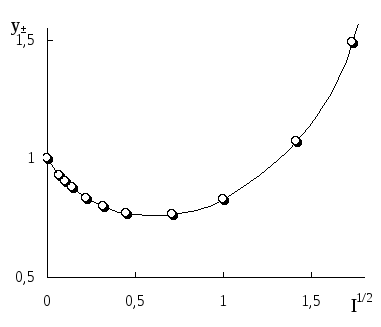
Уравнение (1.24) позволяет рассчитывать теоретические значения коэффициентов активности различных электролитов в зависимости от их концентраций. Функция проходит через минимум при С0, повторяя контур зависимости фактических (реальных) g± от моляльности растворов (рис. 1.1 и 1.2).
Рис. 1.1. Зависимости рассчитанных (1) и экспериментальных (2) коэффициентов активности от моляльной концентрации водного раствора хлороводородной кислоты
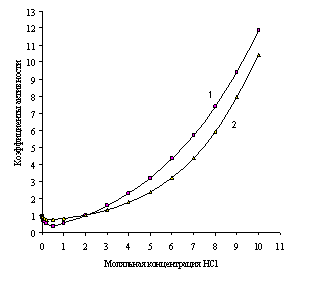
Рис. 1.2. Зависимости рассчитанных (1) и экспериментальных (2) коэффициентов активности от моляльной концентрации водного раствора хлорида лития
На рис. 1.1 и 1.2 показана приемлемость предлагаемой модельной оценки коэффициента активности в связи с достаточно заметным соответствием хода зависимости функций g = f (m) и g± = f (m) для водных растворов хлороводородной кислоты (рис. 1.1) и хлорида лития (рис. 1.2).
В табл. 1.4 в качестве примера представлены экспериментальные (литературные) и рассчитанные по уравнению (1.24) величины коэффициентов активности хлороводородной кислоты и хлорида лития.
Таким образом, в данной работе теоретически обосновываются области концентраций растворов электролитов, в которых наблюдается минимум коэффициентов активности, объясняется феномен доминирования ассоциативных явлений, приводящих к образованию ионных ассоциатов или в зависимости от свойств и природы растворителя − к преимущественному состоянию растворов в виде молекулярных сольватов.
Таблица 1.4
Коэффициенты активности HCl и LiCl, оцененные по уравнению (1.24), в сравнении с экспериментальными в зависимости от концентрации С (моль/1000 г)
|
МоляльностьСm , моль/1000 г воды |
HCl |
LiCl |
||
|
g (теор.) |
g±(лит.) |
g (теор.) |
g± (лит.) |
|
|
0.001 |
0.9565 |
0.965 |
0.9579 |
0.963 |
|
0.002 |
0.9390 |
0.952 |
0.9407 |
0.948 |
|
0.005 |
0.9051 |
0.928 |
0.9077 |
0.921 |
|
0.01 |
0.8684 |
0.904 |
0.8719 |
0.895 |
|
0.02 |
0.8190 |
0.875 |
0.8237 |
0.865 |
|
0.05 |
0.7291 |
0.830 |
0.7358 |
0.819 |
|
0.1 |
0.6396 |
0.796 |
0.6478 |
0.790 |
|
0.2 |
0.5314 |
0.767 |
0.5412 |
0.757 |
|
0.5 |
0.3679 |
0.757 |
0.3787 |
0.739 |
|
1.0 |
0.5570 |
0.809 |
0.5347 |
0.774 |
|
2.0 |
1.0006 |
1.009 |
0.9445 |
0.921 |
|
3.0 |
1.5686 |
1.316 |
1.4615 |
1.156 |
|
4.0 |
2.2914 |
1.762 |
2.1118 |
1.510 |
|
5.0 |
3.1998 |
2.380 |
2.9207 |
2.020 |
|
6.0 |
4.3273 |
3.220 |
3.9156 |
2.720 |
|
7.0 |
5.7119 |
4.370 |
5.1272 |
3.710 |
|
8.0 |
7.3959 |
5.900 |
6.5895 |
5.100 |
|
9.0 |
9.4273 |
7.940 |
8.3408 |
6.960 |
|
10.0 |
11.8596 |
10.440 |
10.4235 |
9.400 |












![{displaystyle gamma _{pm }={sqrt[{p+q}]{gamma _{mathrm {A} }^{p}gamma _{mathrm {B} }^{q}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c66f131bcf882828c4edbb068ee7800812be4e47)












![{displaystyle K={frac {[mathrm {S} ]^{sigma }[mathrm {T} ]^{tau }}{[mathrm {A} ]^{alpha }[mathrm {B} ]^{beta }}}times {frac {gamma _{mathrm {S} }^{sigma }gamma _{mathrm {T} }^{tau }}{gamma _{mathrm {A} }^{alpha }gamma _{mathrm {B} }^{beta }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/95d7e43431f4648654306641285e434365d7af57)
![{displaystyle K={frac {[mathrm {S} ]^{sigma }[mathrm {T} ]^{tau }}{[mathrm {A} ]^{alpha }[mathrm {B} ]^{beta }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59e684b2a458ef9a608ef9a8d8f9e55473da1e86)

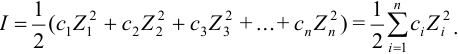
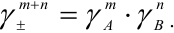
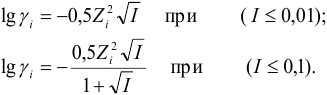
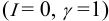 .
.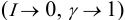 .
.