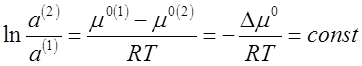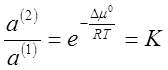Процесс
экстракции почти всегда можно описывать
как обычную, хотя и двухфазную, химическую
реакцию. Большинство реакций экстракции
обратимо, поэтому к экстракционным
процессам можно приложить закон действия
масс. Константу равновесия реакции
экстракции в данном случае называют
константой экстракции
К:
К=
. 8.11
где
о—
коэффициент активности Ме в органической
фазе;
— средний моляльный коэффициент активности
соли; s
– коэффициент активности экстрагента.
Количественно
экстракция характеризуется константой
распределения — Кр.
Исходя, из
равенства химических потенциалов
растворенного вещества в органической
и водной фазах при равновесии, константа
распределения равна:
=
, 8.12
где
ао
и ав
– термодинамические активности
растворенного вещества в органической
и водной фазах; со
и св –
его молярные( моляльные) концентрации;
и
–
соответствующие коэффициенты
термодинамической активности. Константа
распределения, как и всякая другая
константа равновесия, зависит лишь от
природы вещества и условий равновесия
(давления, температуры).
Коэффициент
распределения D характеризует
распределение вещества между двумя
фазами и является отношением концентрации
распределяющегося вещества в водной и
органической фазах:
D
=
(8.13)
Из (8.12 ) и (8.13)
получим:
Кр
=
D
(8.14)
Для
идеального раствора (трехкомпонентной
системы), в которой нет диссоциации и
ассоциации, нет взаимного растворения
фаз, а также отсутствует взаимодействие
растворенного вещества с растворителем,
=
=1
и при постоянном давлении и температуре
уравнение (8.14) превращается в следующее:
Кр
=
=D (8.15)
Избирательность
процесса экстракции при разделении
данной пары элементов определяется
величиной коэффициента
разделения
R,
равной отношению коэффициентов
распределения.
Часто используют
для количественного описания экстракции
фактор извлечения.
R =
,
при
Vв = Vорг
эти величины характеризуют эффективность
извлечения элемента.
Концентрации
радиоактивного элемента в органической
и водной фазах пропорциональны объемным
удельным активностям элемента в водной
и органической фазах:
I
уд орг =
;
Iуд
в =
, (8.16)
где
Io – общая
радиоактивность активность раствора,
тогда
Кр =
(8.17)
Величина
Кр в общем случае зависит
не только от свойств
экстрагента,
но и от многих других факторов:
концентрации распределяемого вещества
в исходном водном растворе, наличия
кислот и солей, природы разбавителя,
состава экстрагируемого комплекса и
т. д.
Так,
при больших
концентрациях
извлекаемого элемента в водном растворе
коэффициент распределения может
уменьшаться
благодаря насыщению органической фазы.
Состав
раствора
также существенно влияет на коэффициент
распределения. Так, коэффициент
распределения возрастает с увеличением
концентрации аниона (катиона), вводимого
в раствор в форме неэкстрагируемой соли
или кислоты. Коэффициент распределения
пропорционален коэффициентам активности
катиона и аниона в водной фазе,
которыеувеличиваются с ростом концентрации
посторонней соли. Добавление в водный
раствор таких солей и кислот, называемых
высаливателями,
является
удобным практическим приемом увеличения
коэффициента распределения. При этом
уменьшается активность воды и растет
..
Значительное
влияние на коэффициенты распределения
оказывает концентрация водородных
ионов в
водных растворах. При экстракции
кислородсодержащими органическими
растворителями это влияние обусловлено
участием ионов водорода в образовании
экстрагируемого соединения, а также
связыванием части экстрагента в
соединение с кислотой. Влияние рН
раствора на коэффициенты распределения
особенно существенно при экстракции
внутрикомплексных соединений.
Помимо
перечисленных факторов, практическое
значение имеет и присутствие в водном
растворе посторонних
ионов, не
входящих в состав экстрагируемого
соединения, но способных, например,
участвовать в образовании комплексных
соединений с катионом экстрагируемого
металла. Эффективность влияния этих
посторонних ионов определяется
константами устойчивости соответствующих
комплексных соединений. Это обстоятельство
часто используют в экстракционных
процессах для разделения элементов
путем связывания элемента, от которого
необходимо освободиться, в неэкстрагируемое
комплексное соединение.
Одной
из наиболее важных
характеристик процесса распределения
элемента между двумя несмешивающимися
фазами является его зависимость
от состава и природы органической фазы.
В качестве
экстрагентов применяют различные
кислородсодержащие органические
растворители, такие как эфиры, кетоны,
спирты. Однако в настоящее время большое
значение приобрели фосфороорганические
соединения и амины с высокой молекулярной
массой.
Выбор
экстрагента для промышленного применения,
кроме того, определяется его химической
и радиационной устойчивостью, вязкостью,
воспламеняемостью, растворимостью в
воде, токсичностью и стоимостью. В
последнее время в экстракционной
практике начинают использовать системы
на основе водорастворимых полимеров и
неорганических солей в качестве
высаливателей. Эти системы нетоксичны
и сравнительно дешевы. В настоящее время
они только изучаются.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В современном химико-токсикологическом анализе метод экстракции широко используется для изолирования токсических веществ из объектов биологического происхождения, для очистки вытяжек из биологического материала от примесей, для выделения токсических веществ из предварительно очищенных вытяжек. Этот метод применяется для обнаружения токсических веществ при помощи некоторых качественных реакций, для количественного определения этих веществ экстракционно-фото-метрическими методами, для концентрирования исследуемых веществ, находящихся в сильно разбавленных растворах, и для ряда других целей.
Экстракция
— процесс извлечения растворителями соответствующих веществ из различных объектов. Объекты, из которых извлекают соответствующие соединения, могут быть твердыми веществами и жидкостями. Поэтому процессы извлечения подразделяют на экстракцию в системе твердое тело — жидкость и на экстракцию в системе жидкость — жидкость (жидкостную экстракцию).
Для экстракции веществ в системе твердое тело — жидкость в качестве экстрагентов применяют органические растворители. Извлечение соответствующих веществ из твердых тел водой называется
выщелачиванием.
В химико-токсикологическом анализе метод экстракции в системе твердое тело — жидкость и метод выщелачивания применяются для изолирования исследуемых веществ (целевых компонентов) из органов трупов, растений, почвы и других объектов.
Процесс экстракции (выщелачивания) целевых компонентов из биологического материала является многостадийным. Основными стадиями этого процесса являются: проникновение экстра-гента в клетки и ткани трупного материала и в другие объекты, в которых находится исследуемое вещество, растворение целевого компонента в экстрагенте или взаимодействие целевого компонента с экстрагентом в клетках и тканях биологического материала, перенос растворенного целевого компонента через оболочки клеток в межклеточное пространство и смешивание извлеченных из клеток веществ с основной массой экстрагента.
Степень изолирования исследуемых веществ из биологического материала зависит от растворимости извлекаемых веществ в экстрагенте, структуры (пористости) биологического материала, проникающей способности экстрагентов в клетки и ткани биологического материала, степени его измельчения, интенсивности перемешивания смеси измельченного биологического материала и экстрагента, кратности настаивания биологического материала с экстрагеитом, температуры, рН среды и ряда других факторов. Влияние отдельных перечисленных выше факторов на изолирование токсических веществ из биологического материала приводится ниже (см. гл. V, § 2—4).
Жидкостная экстракция
— процесс распределения растворенного вещества между двумя несмешивающимися жидкими фазами, одной из которых в большинстве случаев является вода, а второй — несмешивающийся с водой органический растворитель.
Извлечение вещества из фазы органического растворителя в водную фазу называется
реэкстρакцией.
Некоторыми преимуществами метода экстракции объясняется широкое применение его не только в токсикологической химии, но и в химической технологии, фармации, биохимии и т. д. При использовании методов экстракции отсутствует химическое превращение разделяемых веществ и не образуются побочные продукты. Вещества, выделенные с помощью метода экстракции, как правило, не содержат примесей, связанных с процессами адсорбции и окклюзии. Этот метод оправдывает себя при разделении термолабильных веществ. Использование метода экстракции для концентрирования позволяет переводить вещества из сильно разбавленных растворов в небольшой объем органического растворителя.
Переход экстрагируемого вещества из одного растворителя в другой происходит в результате разности концентраций и неодинаковой растворимости этого вещества в обоих растворителях. Этот процесс происходит до тех пор, пока не наступит равновесие концентраций извлекаемого вещества в одном и другом растворителях.
Исследования показали, что экстрагируемость химических соединений зависит от растворимости их в воде и в несмешивающихся с водой органических растворителях, применяемых для экстракции. Подтверждением этого является то, что коэффициент распределения некоторых веществ приблизительно равен отношению их растворимостей в органическом растворителе и в воде.
Органические растворители, которые применяются для экстракции органических соединений, оказались непригодными для экстракции большого числа неорганических соединений. Поэтому сделаны попытки найти подходящие экстрагенты для извлечения неорганических соединений из водных растворов. Проведенные исследования показали, что для экстракции неорганических соединений в качестве экстрагентов с успехом могут быть использованы некоторые карбоновые и сульфоновые кислоты,
отдельные фосфорорганические соединения, высокомолекулярные амины, соли четвертичных аммониевых оснований и др. Эти вещества при экстракции взаимодействуют с неорганическими соединениями и их ионами. Кроме перечисленных соединений в качестве экстрагентов для ионов металлов предложены так называемые хелатирующие агенты (вещества, растворы которых с ионами металлов образуют хелаты). К числу хелатирующих агентов относятся; купферон, 8-оксихинолин, дитизон, дитиокар-баматы и др.
В связи с применением перечисленных выше веществ для экстракции неорганических соединений и их ионов изменилось представление об экстрагентах. В настоящее время под экстрагентом понимают органический растворитель (содержащий или не содержащий другие компоненты), который извлекает вещество из водной фазы. Составная часть экстрагента, химически взаимодействующая с извлекаемым веществом, называется
реа
гентом.
В зависимости от состава и свойств экстрагентов экстракционные системы подразделяются на две группы. К первой группе относятся экстракционные системы с так называемым «физическим» распределением компонентов. В этих системах отсутствует химическое взаимодействие между экстрагентом (органическим растворителем) и экстрагируемыми веществами. Различная растворимость некоторых веществ, а следовательно, и неодинаковая экстрагируемость их объясняются физическими свойствами этих веществ и экстрагеитов (дипольный момент, диэлектрическая проницаемость и др.).
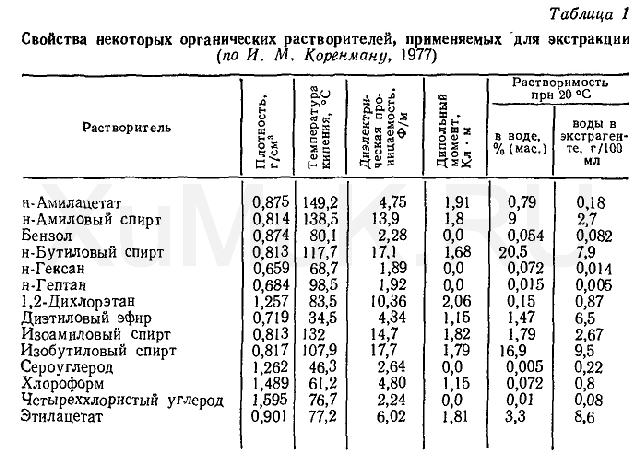
Свойства некоторых органических растворителей, применяемых в качестве экстрагентов, приведены в табл. 1.
Ко второй группе относятся экстракционные системы, в которых экстракция осуществляется за счет химического взаимодействия извлекаемых веществ с экстрагентами. Эффективность разделения веществ в таких системах зависит от прочности образующихся соединений или комплексов. Эти экстракционные системы используются для извлечения неорганических веществ.
Экстракция с помощью экстрагентов, взаимодействующих с экстрагируемыми веществами, является более сложным процессом, чем экстракция, основанная на физическом распределении. При использовании экстрагентов, взаимодействующих с экстрагируемыми веществами, процессы экстракции могут осложняться побочными реакциями. В ряде случаев одновременно может происходить экстракция нескольких различных соединений.
Основные количественные характеристики процессов экстракции
Несмотря на то что экстракция как метод разделения длительное время применяется в аналитической химии и химической технологии, теоретические основы этого метода долгое время оставались неизученными. В частности, долгое время оставались неизученными основные количественные характеристики экстракционных процессов, что было определенным препятствием для широкого внедрения экстракции в практику. Для расчета количества вещества, которое экстрагируется органическими растворителями, необходимо знать константу и коэффициент распределения, степень экстракции и т. д.
М. Бертло и Ю. Юнгфлейш были первыми исследователями, которые в 1872 г. на основании экспериментальных данных показали, что отношение равновесных концентраций вещества, распределяющегося между двумя жидкими фазами, является постоянным. Это отношение термодинамическим путем было выведено В. Нернстом, который в 1891 г. сформулировал
закон распределения.
Согласно закону распределения, вещество, растворенное в двух несмешивающихся или ограниченно смешивающихся жидкостях, распределяется между ними в постоянном отношении. Это отношение для идеальных систем зависит только от температуры, природы вещества и не зависит от концентрации.
Из этого закона следует, что при одновременном растворении нескольких веществ каждое из них распределяется между обеими жидкими фазами таким образом, как будто в системе нет никаких других веществ, подлежащих распределению. Закон распределения справедлив лишь в том случае, если распределяемое вещество в обеих фазах находится в одной и той же форме.
Константа распределения вещества. Постоянная величина, выражающая отношение концентраций распределяемого вещества, находящегося в обеих фазах (после наступления равновесия) в одной и той же форме, называется константой распределения:
где
Р
о
— константа распределения:
[А]
о
—концентрация вещества в фазе органического растворителя, моль/л;
[А]
В
— концентрация вещества в водной фазе, моль/л.
Величина константы распределения зависит от природы распределяемого вещества, состава и свойств применяемого экстрагента, температуры, при которой производится экстракция. Эта константа не зависит от равновесных концентраций экстрагируемого вещества и объемов водной и неводной фаз. Числовое значение константы распределения можно вычислить и по другой формуле (9), исходя из величины степени экстракции соответствующего вещества и объемов жидких фаз.
Коэффициент распределения. При расчетах константы распределения вещества по формуле (1) необходимо быть уверенным в том, что распределяемое вещество в обеих фазах находится в одинаковой форме (в одинаковом молекулярном состоянии). Однако во многих экстракционных системах не соблюдается указанное выше условие. В одной из жидких фаз могут происходить диссоциация, ассоциация, сольватация, гидролиз распределяемого вещества, образование комплексов и т. д. Для расчетов экстракционных равновесий в таких системах не принимают во внимание форму существования вещества в каждой фазе, а учитывают только отношение суммарных (аналитических) концентраций распределяемого вещества в обеих фазах.
На основании определения суммарных концентраций можно рассчитать не константу, а коэффициент распределения данною вещества в применяемой системе растворителей (вода — органический растворитель).
Коэффициент распределения
— это отношение суммарной аналитической концентрации вещества в фазе органического растворителя к суммарной аналитической концентрации этого вещества в водной фазе (без учета того, в какой форме находится вещество в каждой фазе):
где D — коэффициент распределения;
С
о
— суммарная аналитическая концентрация вещества в фазе органического растворителя, моль/л;
С
В
— суммарная аналитическая концентрация вещества в водной фазе, моль/л.
Степень экстракции. Степень экстракции (процент экстракции) — это отношение количества экстрагированного вещества к общему (начальному) количеству этого вещества в водном растворе:
где
R
— степень экстракции вещества, %; А — количество вещества, которое экстрагировалось органическим растворителем; N — общее (начальное) количество вещества в водном растворе.
Количество вещества А, которое экстрагируется органическим растворителем, можно определить экспериментальным путем, применив соответствующий метод количественного определения. Зная начальное количество вещества и количество этого вещества, перешедшего в органический растворитель, рассчитывают степень экстракции.
Степень экстракции вещества можно определить не только экспериментальным путем, но и путем соответствующих расчетов, зная константу или коэффициент распределения вещества, а также отношение объемов водной фазы и фазы органического растворителя. Степень экстракции с указанными величинами связана следующим соотношением:
где
R
—степень экстракции;
Р
о
— константа распределения;
V
B
— объем водной фазы, мл;
V
o
— объем фазы органического растворителя, мл.
В формуле (4) отношение объема водной фазы к объему фазы органического растворителя заменяют величиной г:
Объем органического растворителя, необходимого для экстракции, рассчитывают по формуле
После соответствующего преобразования формулы (4) степень экстракции рассчитывают по уравнению
Из формулы (7) можно рассчитать величину r:
Если известна степень экстракции
R
и отношение объемов фаз r
,
то константу распределения
Р
0
можно рассчитать при помощи следующего уравнения:
На основании числовых значений константы распределения и степени экстракции можно рассчитать ряд других количественных характеристик процессов экстракции.
Ниже мы приведем несколько примеров расчетов ряда количественных характеристик экстракционных процессов неэлектролитов, к числу которых относятся многие органические соединения, имеющие значение в фармации и токсикологии.
Расчет объема органического растворителя, необходимого для однократной экстракции.
Примеры этих расчетов приведены ниже.
Пример 1. Вычислить объем органического растворителя, который необходимо взять для однократной экстракции 99 % вещества из 100 мл раствора, если константа распределения Р
0
этого вещества между органическим растворителем и водной фазой равна 20.
Для решения этой задачи пользуются формулой (7):
Значение r рассчитывают по формуле (8), а значение
V
o
— по формуле (6):
Таким образом, для однократной экстракции 99 % вещества
(Р
о
=20) из 100 мл водного раствора требуется 500 мл органического растворителя.
Пример 2. Какой объем органического растворителя необходимо взять для однократной экстракции 99 % вещества из 100 мл водного раствора, если
Ρ
= 10?
Эту задачу решают аналогично предыдущей:
Расчеты показывают, что для однократной экстракции 99 % вещества
(Р
о
= 10) из 100 мл водного раствора требуется 1000 мл органического растворителя.
На основании произведенных выше расчетов
(см. примеры 1 и 2)
можно сделать такие выводы: чем больше константа распределения
Р
о
вещества, тем меньший объем органического растворителя требуется для однократной экстракции его из водных растворов; степень экстракции
R
вещества тем больше, чем меньше величина r, т. е. чем больший объем органического растворителя применяется для однократной экстракции.
Расчет объема органического растворителя для многократной
экстракции.
Из приведенных выше расчетов
(см. примеры 1 и 2)
следует, что для однократной экстракции вещества из водных растворов необходимо брать органические растворители, объемы которых значительно больше объемов водных растворов.
Учитывая это, для извлечения веществ из водных растворов производят многократную экстракцию их малыми объемами органических растворителей вместо однократной экстракции большим объемом того же растворителя. Преимущество многократной экстракции веществ малыми объемами растворителей перед однократной экстракцией большими объемами этих растворителей показано на приведенных ниже примерах.
Пример 3. Какой общий объем органического растворителя необходимо использовать для многократной экстракции, чтобы из 100 мл водного раствора извлечь 99 % вещества, если
Р
о
= 20, а на каждую экстракцию берут по 25 мл органического растворителя?
Для решения этой задачи пользуются формулой (7).
Вначале определяют степень экстракции вещества, %:
Расчеты показывают, что степень экстракции вещества при указанных выше условиях составляет 83 %. Следовательно, и при каждой последующей экстракции тоже будет экстрагироваться 83 % от оставшегося в водном растворе вещества.
При второй экстракции из водного раствора будет извлекаться
Χ
2
вещества:
При третьей экстракции из водного раствора будет извлекаться Х
3
вещества:
Эти расчеты показывают, что при трех последовательных экстракциях из водного раствора извлекается около 99,5 % вещества и при этом расходуется только 75 мл органического растворителя, в то время как для однократной экстракции 99 % того же вещества
(см. пример 1)
необходимо затратить 500 мл органического растворителя.
Приведенные выше расчеты показывают, что для извлечения вещества из водных растворов необходимо производить многократную экстракцию небольшими объемами органических растворителей вместо однократной экстракции большим объемом этих растворителей.
Количество экстракций, необходимых для извлечения заданного количества вещества из раствора. Для расчета полноты экстракции вещества определяют, сколько раз необходимо экстрагировать его из водного раствора, чтобы добиться извлечения заданного количества этого вещества.
С этой целью пользуются следующей формулой:
где
т
— количество экстракций, необходимых для извлечения заданного количества вещества;
С
В
— начальная концентрация вещества в водном растворе, моль/л; [Ат]
В
— концентрация оставшегося в водной фазе вещества после
т
экстракций, моль/л.
Пример 4. Рассчитать число экстракций, необходимых для извлечения 99 % вещества органическим растворителем (порциями по 10 мл) из 100 мл 1 Μ водного раствора, если Р
о
=20.
Для решения этой задачи вначале необходимо определить [Am]
в
и r:
Подставим значения соответствующих величин в формулу (10).
экстракции (округленно 4 экстракции).
Приведенный пример показывает зависимость числа экстракций от объемов органического растворителя и водной фазы, степени экстракции и константы распределения вещества.
Механизм процесса экстракции. Согласно теории растворов, растворение вещества в воде или в органических растворителях сопровождается образованием малопрочных соединений молекул этого вещества с молекулами растворителя. Если растворителем является вода, то в растворе образуются гидраты, а если растворителем является органический растворитель, то в растворах образуются сольваты молекул растворенного вещества. Гидраты и сольваты молекул являются малопрочными.
При взбалтывании водного раствора вещества с органическим растворителем, который не смешивается с водой, гидратная оболочка молекул растворенного вещества разрушается. Молекулы воды в гидратной оболочке замещаются молекулами органического растворителя, в результате чего образуются сольваты молекул растворенного вещества, которые легко переходят в органический растворитель.
Хорошо экстрагируются молекулы тех веществ, сольваты которых в фазе органического растворителя являются более прочными, чем гидраты этих молекул в воде.
Более сложными являются процессы экстракции электролитов, которые в водных растворах частично или полностью распадаются на ионы. Ионы, несущие определенный заряд, хорошо гидратируются диполями воды. Связь ионов с диполями воды относительно прочная. Поэтому ионы, имеющие прочные гидрат-ные оболочки, остаются в водной фазе и не экстрагируются органическими растворителями. Ими могут экстрагироваться только недиссоциированные молекулы соответствующего вещества. Это необходимо учитывать при экстракции органических веществ, являющихся слабыми электролитами. Степень экстракции этих веществ зависит от рН среды. С изменением рН раствора изменяется степень диссоциации молекул, а следовательно, изменяется и относительное количество недиссоциированных молекул вещества. С увеличением количества недиссоциированных молекул увеличивается степень экстракции слабых электролитов и наоборот.
Экстракция органических кислот.
Недиссоциированные молекулы органических кислот в водных растворах являются электронейтральными и слабо гидратируются молекулами воды. При контакте водных растворов с органическими растворителями электронейтральные молекулы кислоты легко сольватируются, и поэтому переходят в слой органического растворителя.
Ионы, образующиеся в водных растворах при диссоциации слабых кислот, имеют соответствующие заряды, и поэтому легко гидратируются диполями воды. Связь молекул воды с ионами кислоты относительно прочная. Поэтому такие ионы слабо сольватируются молекулами органических растворителей и не экстрагируются органическими растворителями из водных растворов.
Изменение концентрации водородных ионов в водной фазе приводит к относительному увеличению или уменьшению количества недиссоциированных молекул, а следовательно, и к изменению экстрагируемости кислоты.
С повышением рН (т. е. с уменьшением концентрации водородных ионов в водном растворе) увеличивается диссоциация кислоты в растворе, что приводит к уменьшению ее недиссоциированных молекул. В результате этого понижается экстрагируе-мость слабой кислоты органическими растворителями из таких растворов.
При повышении концентрации водородных ионов (т. е. с понижением рН) в водном растворе увеличивается число молекул недиссоциированной кислоты, а следовательно, возрастает ее экстрагируемость органическими растворителями. При значительном повышении концентрации водородных ионов в водном растворе слабую кислоту практически полностью можно перевести в недиссоциированное состояние и этим повысить ее экстрагируемость.
Экстракция оснований.
Многие органические основания, к числу которых относятся алкалоиды и их многочисленные синтетические аналоги, являются фармацевтическими препаратами. Эти основания в нейтральной среде находятся в недиссоциированном состоянии. При действии кислот на органические основания образуются их соли, которые в водных растворах диссоциируют на ионы.
Недиссоциированные молекулы органических оснований слабо гидратируются молекулами воды, но хорошо сольватируются молекулами органических растворителей. Поэтому недиссоциированные молекулы органических оснований хорошо экстрагируются из водных растворов органическими растворителями.
Ионы, образующиеся при диссоциации солей органических оснований, хорошо гидратируются молекулами воды и слабо сольватируются молекулами органических растворителей. Поэтому соли органических оснований (за небольшим исключением) не экстрагируются органическими растворителями.
Органические основания являются слабыми электролитами. Степень диссоциации их зависит от рН среды. От прибавления кислот к органическим основаниям они переходят в соли. При этом увеличивается количество ионов и уменьшается количество недиссоциированных молекул, а следовательно, уменьшается степень экстракции этих веществ органическими растворителями. От прибавления щелочей к солям органических оснований уменьшается количество ионов и увеличивается количество недиссоциированных молекул этих оснований. В результате этого в щелочной среде увеличивается степень экстракции органических оснований.
Экстракция амфотерных соединений. К числу амфотерных соединений, имеющих токсикологическое значение, относятся вещества, в молекулах которых содержится аминный азот и фенольные группы (морфин, сальсолин и др.), а также соединения, содержащие аминный азот и карбоксильную группу (аминокислоты и др.). Эти соединения в зависимости от рН среды диссоциируют как основания (в кислой среде) и как кислоты (в щелочной среде). Экстракция амфотерных соединений зависит от рН среды, так как при изменении рН изменяется количество ионов и недиссоциированных молекул амфотерных соединений. Амфотерные соединения, находящиеся в молекулярном состоянии, экстрагируются органическими растворителями. Ионы амфотерных соединений хорошо гидратируются молекулами воды и почти не экстрагируются органическими растворителями.
Наибольшие количества амфотерных соединений экстрагируются при рН, соответствующем изоэлектрической точке этих веществ. Это объясняется тем, что в изоэлектрической точке молекулы амфотерных соединений не имеют электрического заряда.
Влияние различных факторов на экстракцию
На экстракцию веществ органическими растворителями оказывают влияние различные факторы (природа экстрагируемого вещества, природа экстрагента, температура, рН среды, присутствие электролитов в водных растворах, скорость взбалтывания и др.).
Влияние температуры на экстракцию. Изменение температуры влияет на константу распределения экстрагируемого вещества. Это объясняется тем, что при изменении температуры изменяется растворимость экстрагируемых веществ в каждой фазе, а также изменяется взаимная растворимость органической и водной фаз. Причем с изменением температуры растворимость вещества в каждой фазе изменяется неодинаково. Это является одной из причин изменения константы распределения вещества при изменении температуры.
При изменении температуры может изменяться диссоциация и ассоциация вещества в соответствующей фазе. Поэтому при изменении температуры изменяется гидратация (сольватация) и экстрагируемость химических соединений.
Влияние рН среды на экстракцию. Экстрагируемость органических веществ зависит от ряда факторов, в том числе и от рН среды. Количество экстрагированного вещества зависит от диссоциации его в водной фазе. Это связано с тем, что недиссоциированные молекулы вещества и его ионы неодинаково экстрагируются органическими растворителями из водных растворов. При экстракции недиссоциированные молекулы переходят в органическую фазу, а ионы, которые хорошо гидратированы молекулами воды, остаются в водной фазе. Поэтому сильные электролиты, хорошо диссоциирующие в воде на ионы, не экстрагируются органическими растворителями.
Влияние электролитов на экстракцию. Прибавление хорошо растворимых солей к водному раствору другого вещества может понижать или повышать его растворимость в воде. Понижение растворимости веществ в водных растворах под влиянием электролитов называется
высаливанием,
а повышение растворимости —
всаливанием.
Высаливание является фактором, понижающим растворимость веществ в воде и повышающим их экстрагируемость органическими растворителями из водных растворов.
Высаливающее действие электролитов зависит от природы и свойств высаливаемого вещества, от природы и свойств высаливателя, концентрации и радиуса ионов высаливателя и т. д. Ионы высаливателя с малым радиусом имеют большую плотность заряда, чем ионы с большим радиусом. Поэтому ионы с малым радиусом гидратируются лучше, чем ионы с большим радиусом. В связи с этим высаливающее действие ионов с малым радиусом большее, чем высаливающее действие крупных ионов. Однако это правило имеет и ряд исключений.
Установлено, что высаливающим действием обладают и некоторые хорошо растворимые в воде неэлектролиты. Так, например, этиловый спирт хорошо высаливает уксусную кислоту из ее водных растворов при экстракции этой кислоты этилацетатом и т. д.
Вещества, проявляющие свойства всаливателей, применяются для повышения растворимости слаборастворимых веществ в воде. Известно несколько теорий, объясняющих процесс всаливания. Согласно одной из них, всаливание объясняется химическим взаимодействием всаливателей и всаливающихся веществ в экстракционных системах. В результате этого могут образовываться соединения или комплексы, хорошо растворимые в воде, которые не экстрагируются органическими растворителями.
Требования, предъявляемые к органическим растворителям
для экстракции.
К органическим растворителям, применяемым для экстракции, предъявляется ряд требований.
1. Органический растворитель должен хорошо извлекать исследуемое вещество из водной фазы.
2. Желательно, чтобы применяемый растворитель был избирательным или селективным. Он должен извлекать из растворов только одно вещество или группу родственных соединений.
3. Растворитель должен иметь незначительную растворимость в воде, а вода не должна заметно растворяться в этом растворителе.
При использовании для экстракции органических растворителей, растворяющихся в воде или растворяющих воду, конечные объемы фаз после взбалтывания не будут равны начальным объемам этих фаз. Это может быть источником ошибок при расчетах константы и коэффициента распределения, а также при вычислении степени экстракции. Чтобы исключить возможные ошибки при расчетах, органический растворитель насыщают водой, а воду — органическим растворителем. Только после этого производят экстракцию.
4. Органический растворитель по возможности не должен быть низкокипящим. Температура кипения растворителя должна быть выше 50 °С. Низкокипящие органические растворители даже при комнатной температуре быстро улетучиваются. Поэтому при экстракции их объемы уменьшаются, а концентрация экстрагированных веществ в этих растворителях увеличивается. Это может быть одним из источников ошибок при расчетах константы или коэффициента распределения экстрагируемого вещества. Однако низкая температура кипения органических растворителей является положительным фактором с точки зрения регенерации их после экстракции.
5. Плотность органических растворителей по возможности должна отличаться от плотности воды и водных растворов. При большой разности плотностей указанных жидкостей разделение фаз происходит быстро.
6. Растворители не должны быть огнеопасными или ядовитыми. Есть и некоторые другие требования, предъявляемые к растворителям.
СОДЕРЖАНИЕ
ПРЕДЫДУЩАЯ | СЛЕДУЮЩАЯ
Не путать с константой распределения.
В физических наук, А коэффициент распределения ( Р) или коэффициент распределения ( D) представляет собой отношение концентраций одного соединения в виде смеси двух несмешивающихся растворителей при равновесии. Таким образом, это соотношение представляет собой сравнение растворимости растворенного вещества в этих двух жидкостях. Коэффициент распределения обычно относится к соотношению концентраций неионизированных разновидностей соединения, тогда как коэффициент распределения относится к соотношению концентраций всех разновидностей соединения (ионизированных и неионизированных).
В химических и фармацевтических науках обе фазы обычно являются растворителями. Чаще всего одним из растворителей является вода, а вторым — гидрофобным, например 1-октанол. Следовательно, коэффициент распределения измеряет, насколько гидрофильным («водолюбивым») или гидрофобным (« водобоязненным ») является химическое вещество. Коэффициенты распределения полезны при оценке распределения лекарств в организме. Гидрофобные препараты с высокими коэффициентами распределения октанол-вода в основном распределяются в гидрофобных областях, таких как липидные бислои клеток. И наоборот, гидрофильные препараты (низкие коэффициенты распределения октанол / вода) обнаруживаются в основном в водных областях, таких как сыворотка крови.
Если один из растворителей представляет собой газ, а другой — жидкость, можно определить коэффициент распределения газ / жидкость. Так, например, кровь / газ коэффициент распределения в течение общих анестезиологических мер, как легко анестетик проходит от газа в кровь. Коэффициенты распределения также могут быть определены, когда одна из фаз является твердой, например, когда одна фаза представляет собой расплавленный металл, а вторая — твердый металл, или когда обе фазы являются твердыми веществами. Разделение вещества на твердое вещество приводит к твердому раствору.
Коэффициенты разделения могут быть измерены экспериментально различными способами (встряхиваемой колбой, ВЭЖХ и т. Д.) Или оценены расчетом на основе множества методов (на основе фрагментов, на основе атомов и т. Д.).
Если вещество присутствует в виде нескольких химических частиц в системе разделения из-за ассоциации или диссоциации, каждому виду присваивается свое собственное значение K ow. Связанное значение D не различает разные виды, а указывает только на соотношение концентраций вещества между двумя фазами.
СОДЕРЖАНИЕ
- 1 Номенклатура
- 2 Коэффициент распределения и log P
- 3 Коэффициент распределения и log D
- 4 Пример данных коэффициента разделения
- 5 приложений
- 5.1 Фармакология
- 5.1.1 Фармакокинетика
- 5.1.2 Фармакодинамика
- 5.2 Наука об окружающей среде
- 5.3 Агрохимические исследования
- 5.4 Металлургия
- 5.5 Разработка потребительских товаров
- 5.1 Фармакология
- 6 Измерение
- 6.1 Метод делительной воронки
- 6.2 Встряхивать колбу
- 6.3 На основе ВЭЖХ
- 6.4 pH-метр
- 6.5 Электрохимический
- 7 Прогноз
- 7.1 На основе атома
- 7.2 На основе фрагментов
- 7.3 На основе знаний
- 7.4 Log D из журнала P и p K a
- 7.5 Log P из журнала S
- 8 Коэффициент распределения октанол-вода
- 8.1 Примеры значений
- 9 См. Также
- 10 Ссылки
- 11 Дальнейшее чтение
- 12 Внешние ссылки
Номенклатура
Несмотря на официальную рекомендацию об обратном, термин « коэффициент распределения» остается преимущественно используемым термином в научной литературе.
Напротив, IUPAC рекомендует больше не использовать термин заголовка, а заменить его более конкретными терминами. Например, константа раздела, определенная как
-
( K D) A = [A] org/[A] вод., ( 1)
где K D — константа равновесия процесса, [A] представляет концентрацию исследуемого растворенного вещества A, а «org» и «aq» относятся к органической и водной фазам соответственно. IUPAC также рекомендует «коэффициент распределения» для случаев, когда можно определить коэффициенты активности переноса, и «коэффициент распределения» для отношения общих аналитических концентраций растворенного вещества между фазами, независимо от химической формы.
Коэффициент разделения и log P

Коэффициент распределения, сокращенно Р, определяются как конкретное соотношение концентраций одного растворенного вещества между двумя растворителями (двухфазным жидких фазами), специально для непредставленных ионизированных растворенных веществ, а также логарифм отношения, таким образом, войти P. Когда одним из растворителей является вода, а другим — неполярный растворитель, значение log P является мерой липофильности или гидрофобности. Определенный прецедент состоит в том, что типы липофильной и гидрофильной фаз всегда должны быть в числителе и знаменателе соответственно; например, в двухфазной системе из п — октанол (далее просто «октанол») и воды:
- бревно п окт / Вт знак равно бревно ( [ растворенное вещество ] октанол неионизированный [ растворенное вещество ] воды неионизированный ) . { displaystyle log P _ { text {oct / wat}} = log left ({ frac {{ big [} { text {solute}} { big]} _ { text {octanol}} ^ { text {неионизированный}}} {{ big [} { text {solute}} { big]} _ { text {вода}} ^ { text {неионизированный}}}} Правильно).}
В первом приближении в неполярной фазе в таких экспериментах обычно преобладает неионизированная форма растворенного вещества, которая электрически нейтральна, хотя это может быть неверно для водной фазы. Чтобы измерить коэффициент распределения ионизируемых растворенных веществ, pH водной фазы регулируется таким образом, чтобы преобладающая форма соединения в растворе была неионизированной, или его измерение при другом интересующем pH требует рассмотрения всех разновидностей, неионизированных. и ионизированный (см. ниже).
Соответствующий коэффициент распределения для ионизируемых соединений, сокращенно log P I, выводится для случаев, когда существуют доминирующие ионизированные формы молекулы, так что необходимо учитывать разделение всех форм, ионизированных и неионизированных, между двумя фазами (а также как взаимодействие двух равновесий, разделения и ионизации). M используется для обозначения количества ионизированных форм; для I -й формы ( I = 1, 2,…, M) логарифм соответствующего коэффициента распределения,, определяется таким же образом, как и для неионизированной формы. Например, для перегородки октанол – вода она равна бревно п окт / Вт я { displaystyle log P _ { text {oct / wat}} ^ {I}}
- бревно п окт / Вт я знак равно бревно ( [ растворенное вещество ] октанол я [ растворенное вещество ] воды я ) . { displaystyle log P _ { text {oct / wat}} ^ { mathrm {I}} = log left ({ frac {{ big [}} { text {solute}} { big] } _ { text {октанол}} ^ {I}} {{ big [} { text {solute}} { big]} _ { text {вода}} ^ {I}}} right). }
Чтобы отличить этот коэффициент от стандартного неионизированного коэффициента разделения, неионизированному часто присваивается символ log P 0, так что индексированное выражение для ионизированных растворенных веществ становится просто расширением этого коэффициента в диапазоне значений I gt; 0. бревно п окт / Вт я { displaystyle log P _ { text {oct / wat}} ^ {I}}
Коэффициент распределения и log D
Коэффициент распределения, log D, представляет собой отношение суммы концентраций всех форм соединения (ионизированных и неионизированных) в каждой из двух фаз, одна, по существу, всегда водная; как таковой, он зависит от pH водной фазы, и log D = log P для неионизируемых соединений при любом pH. Для измерения коэффициентов распределения pH водной фазы забуферен до определенного значения, так что pH существенно не нарушается введением соединения. Затем значение каждого log D определяется как логарифм отношения — суммы экспериментально измеренных концентраций различных форм растворенного вещества в одном растворителе к сумме таких концентраций его форм в другом растворителе; это может быть выражено как
- бревно D окт / Вт знак равно бревно ( [ растворенное вещество ] октанол ионизированный + [ растворенное вещество ] октанол неионизированный [ растворенное вещество ] воды ионизированный + [ растворенное вещество ] воды неионизированный ) . { displaystyle log D _ { text {oct / wat}} = log left ({ frac {{ big [} { text {solute}} { big]} _ { text {octanol}} ^ { text {ionized}} + { big [} { text {solute}} { big]} _ { text {octanol}} ^ { text {неионизированный}}} {{ big [ } { text {solute}} { big]} _ { text {water}} ^ { text {ionized}} + { big [} { text {solute}} { big]} _ { текст {вода}} ^ { text {неионизированный}}}} right).}
В приведенной выше формуле каждый надстрочный индекс «ионизированный» указывает сумму концентраций всех ионизированных частиц в их соответствующих фазах. Кроме того, поскольку log D зависит от pH, необходимо указать pH, при котором был измерен log D. В таких областях, как открытие лекарств — областях, связанных с явлениями разделения в биологических системах, таких как человеческое тело, — log D при физиологическом pH = 7,4 представляет особый интерес.
Часто удобно выражать log D через P I, определенный выше (который включает P 0 как состояние I = 0), таким образом охватывая как неионизированные, так и ионизированные частицы. Например, в октанол – вода:
- бревно D окт / Вт знак равно бревно ( ∑ я знак равно 0 M ж я п окт / Вт я ) , { displaystyle log D _ { text {oct / wat}} = log left ( sum _ {I = 0} ^ {M} f ^ {I} P _ { text {oct / wat}} ^ { Я прав),}
который суммирует индивидуальные коэффициенты распределения (не их логарифмы), и где указывает на рН-зависимую мольную долю из I -го вида (растворенного вещества) в водной фазе, а также другие переменные определены как и ранее. ж я { displaystyle f ^ {I}}
Пример данных коэффициента разделения
Значения для системы октанол-вода в следующей таблице взяты из Дортмундского банка данных. Они отсортированы по коэффициенту распределения, от наименьшего к наибольшему (ацетамид является гидрофильным и 2,2 ‘, 4,4’, 5-пентахлорбифенил липофильным), и представлены с температурой, при которой они были измерены (что влияет на значения).
| Составная часть | журнал P OW | Т (° С) |
|---|---|---|
| Ацетамид | -1,16 | 25 |
| Метанол | -0,81 | 19 |
| Муравьиная кислота | -0,41 | 25 |
| Диэтиловый эфир | 0,83 | 20 |
| п-дихлорбензол | 3,37 | 25 |
| Гексаметилбензол | 4,61 | 25 |
| 2,2 ‘, 4,4’, 5-пентахлорбифенил | 6,41 | Окружающий |
Значения для других соединений можно найти во множестве доступных обзоров и монографий. Критические обсуждения проблем измерения log P и соответствующего вычисления его оценочных значений (см. Ниже) появляются в нескольких обзорах.
Приложения
Фармакология
Коэффициент распределения лекарственного средства сильно влияет на то, насколько легко лекарство может достичь своей намеченной цели в организме, насколько сильным будет эффект, когда он достигнет своей цели, и как долго он будет оставаться в организме в активной форме. Следовательно, log P молекулы является одним из критериев, используемых медицинскими химиками при принятии решений при доклиническом открытии лекарств, например, при оценке лекарственного сходства кандидатов в лекарства. Кроме того, он используется для расчета липофильной эффективности при оценке качества исследований соединений, где эффективность для соединения определяются как его потенция, с помощью измеренных значений Pic 50 или рЕСа 50, минус его значение лога — P.

Фармакокинетика.
В контексте фармакокинетики (того, как организм абсорбирует, метаболизирует и выводит лекарство), коэффициент распределения оказывает сильное влияние на свойства ADME лекарства. Следовательно, гидрофобность соединения (измеряемая по коэффициенту распределения) является основным фактором, определяющим, насколько оно похоже на лекарство. Более конкретно, для перорального всасывания лекарственного средства оно обычно должно сначала пройти через липидные бислои в кишечном эпителии (процесс, известный как трансцеллюлярный транспорт). Для эффективного транспорта лекарство должно быть достаточно гидрофобным, чтобы разделяться на липидный бислой, но не настолько гидрофобным, чтобы, оказавшись в бислое, оно не делилось снова. Точно так же гидрофобность играет важную роль в определении того, где лекарства распределяются в организме после абсорбции, и, как следствие, в том, как быстро они метаболизируются и выводятся из организма.
Фармакодинамика
В контексте фармакодинамики (как лекарство влияет на организм) гидрофобный эффект является основной движущей силой связывания лекарств с их рецепторами- мишенями. С другой стороны, гидрофобные лекарственные средства имеют тенденцию быть более токсичными, потому что они, как правило, сохраняются дольше, имеют более широкое распределение в организме (например, внутриклеточное ), несколько менее избирательны в их связывании с белками и, наконец, часто широко распространены. метаболизируется. В некоторых случаях метаболиты могут быть химически активными. Следовательно, рекомендуется сделать препарат как можно более гидрофильным, в то же время сохраняя адекватную аффинность связывания с терапевтическим белком-мишенью. В случаях, когда лекарство достигает целевого местоположения посредством пассивных механизмов (например, диффузии через мембраны), идеальный коэффициент распределения для лекарственного средства обычно имеет промежуточное значение (ни слишком липофильный, ни слишком гидрофильный); в случаях, когда молекулы достигают своих целей иным образом, такое обобщение не применимо.
Наука об окружающей среде
Гидрофобность соединения может дать ученым представление о том, насколько легко соединение может поглощаться грунтовыми водами, загрязняя водные пути, и его токсичность для животных и водных организмов. Коэффициент распределения также можно использовать для прогнозирования подвижности радионуклидов в подземных водах. В области гидрогеологии коэффициент распределения октанол – вода K ow используется для прогнозирования и моделирования миграции растворенных гидрофобных органических соединений в почве и грунтовых водах.
Агрохимические исследования
Гидрофобные инсектициды и гербициды обычно более активны. Гидрофобные агрохимикаты обычно имеют более длительный период полураспада и, следовательно, демонстрируют повышенный риск неблагоприятного воздействия на окружающую среду.
Металлургия
В металлургии коэффициент распределения является важным фактором при определении того, как различные примеси распределяются между расплавленным и затвердевшим металлом. Это критический параметр для очистки с использованием зонной плавки и определяет, насколько эффективно можно удалить примеси с помощью направленной кристаллизации, описываемой уравнением Шейля.
Разработка потребительских товаров
Многие другие отрасли принимают во внимание коэффициенты распределения, например, при составлении макияжа, мазей для местного применения, красок, красок для волос и многих других потребительских товаров.
Измерение
Был разработан ряд методов измерения коэффициентов распределения, включая метод встряхивания, метод делительной воронки, обращенно-фазовую ВЭЖХ и pH-метрические методы.
Метод делительной воронки
В этом методе твердые частицы, присутствующие в двух несмешивающихся жидкостях, могут быть легко разделены путем суспендирования этих твердых частиц непосредственно в этих несмешивающихся или некоторых смешивающихся жидкостях.
Встряхнуть колбу
Классическим и наиболее надежным методом определения log P является метод встряхивания, который заключается в растворении части рассматриваемого растворенного вещества в объеме октанола и воды с последующим измерением концентрации растворенного вещества в каждом растворителе. Наиболее распространенный метод измерения распределения растворенного вещества — УФ / видимая спектроскопия.
На основе ВЭЖХ
Более быстрый метод определения log P использует высокоэффективную жидкостную хроматографию. Log P растворенного вещества можно определить путем корреляции времени его удерживания с аналогичными соединениями с известными значениями log P.
Преимущество этого метода в том, что он быстрый (5–20 минут на образец). Однако, поскольку значение log P определяется линейной регрессией, несколько соединений с аналогичными структурами должны иметь известные значения log P, и экстраполяция от одного химического класса к другому — применение уравнения регрессии, полученного от одного химического класса ко второму — может не может быть надежным, поскольку каждый химический класс будет иметь свои характерные параметры регрессии.
pH-метрический
Набор pH-метрических методов определяет профили pH липофильности непосредственно на основе однократного кислотно-основного титрования в двухфазной системе вода – органический растворитель. Следовательно, один эксперимент может быть использован для измерения логарифмов коэффициента распределения (log P), дающего распределение молекул, которые в основном нейтральны по заряду, а также коэффициента распределения (log D) всех форм молекулы по Диапазон pH, например, от 2 до 12. Однако этот метод требует отдельного определения значения (значений) pK a вещества.
Электрохимический
Границы раздела поляризованной жидкости использовались для изучения термодинамики и кинетики переноса заряженных частиц из одной фазы в другую. Существуют два основных метода. Первый — это ITIES, «интерфейс между двумя растворами несмешивающихся электролитов». Второй — капельные эксперименты. Здесь реакция на тройной границе раздела между проводящим твердым телом, каплями окислительно-восстановительной жидкой фазы и раствором электролита использовалась для определения энергии, необходимой для переноса заряженных частиц через границу раздела.
Прогноз
Есть много ситуаций, когда полезно предсказание коэффициентов разделения до экспериментального измерения. Например, широко используются десятки тысяч промышленных химикатов, но только небольшая их часть прошла строгую токсикологическую оценку. Следовательно, необходимо расставить приоритеты для оставшейся части тестирования. Уравнения QSAR, которые, в свою очередь, основаны на рассчитанных коэффициентах разделения, можно использовать для получения оценок токсичности. Вычисленные коэффициенты разделения также широко используются при открытии лекарств для оптимизации библиотек скрининга и прогнозирования лекарственного сходства разработанных лекарственных препаратов-кандидатов до их синтеза. Как более подробно обсуждается ниже, оценки коэффициентов разделения могут быть выполнены с использованием множества методов, включая основанные на фрагментах, атомах и знаниях, которые полагаются исключительно на знание структуры химического вещества. Другие методы прогнозирования полагаются на другие экспериментальные измерения, такие как растворимость. Методы также различаются по точности и применимости ко всем молекулам или только к тем, которые похожи на уже изученные молекулы.
На основе атома
Стандартные подходы этого типа, использующие атомарные вклады, были названы теми, кто формулирует их, с буквой префикса: AlogP, XlogP, MlogP и т. Д. Обычный метод прогнозирования log P с помощью этого типа метода — параметризация вкладов коэффициента распределения различных атомов к общему молекулярному коэффициенту разделения, что дает параметрическую модель. Эта параметрическая модель может быть оценена с использованием ограниченного наименьших квадратов оценки, используя обучающий набор соединений с экспериментально измеренным коэффициентов распределения. Чтобы получить разумные корреляции, наиболее распространенные элементы, содержащиеся в лекарствах (водород, углерод, кислород, сера, азот и галогены), разделены на несколько различных типов атомов в зависимости от окружения атома в молекуле. Хотя этот метод, как правило, наименее точен, его преимущество состоит в том, что он является наиболее общим и позволяет получить, по крайней мере, приблизительную оценку для большого количества молекул.
На основе фрагментов
Наиболее распространенный из них использует метод группового вклада и называется cLogP. Было показано, что log P соединения может быть определен суммой его неперекрывающихся молекулярных фрагментов (определяемых как один или несколько атомов, ковалентно связанных друг с другом внутри молекулы). Фрагментарные значения log P были определены статистическим методом, аналогичным атомарным методам (подгонка методом наименьших квадратов к обучающей выборке). Кроме того, включены поправки типа Хаммета для учета электронных и стерических эффектов. Этот метод в целом дает лучшие результаты, чем методы, основанные на атомах, но не может использоваться для прогнозирования коэффициентов разделения для молекул, содержащих необычные функциональные группы, для которых метод еще не параметризован (скорее всего, из-за отсутствия экспериментальных данных для молекул, содержащих такие группы). функциональные группы).
Основанный на знаниях
Типичное прогнозирование на основе интеллектуального анализа данных использует машины опорных векторов, деревья решений или нейронные сети. Этот метод обычно очень успешен для расчета значений log P при использовании с соединениями, имеющими схожую химическую структуру и известные значения log P. Подходы молекулярного анализа применяют прогнозирование на основе матрицы сходства или автоматическую схему фрагментации на молекулярные субструктуры. Кроме того, существуют также подходы, использующие максимально распространенные поиски подграфов или ядер молекул.
Журнал D из журнала P и p K a
Для случаев, когда молекула неионизирована:
- бревно D ≅ бревно п . { displaystyle log D cong log P.}
Для других случаев оценка log D при заданном pH, исходя из log P и известной мольной доли неионизированной формы, в случае, когда разделением ионизированных форм на неполярную фазу можно пренебречь, может быть сформулирована как ж 0 { displaystyle f ^ {0}}
- бревно D ≅ бревно п + бревно ( ж 0 ) . { displaystyle log D cong log P + log left (f ^ {0} right).}
Следующие приблизительные выражения действительны только для монопротоновых кислот и оснований :
- бревно D кислоты ≅ бревно п + бревно [ 1 1 + 10 п ЧАС — п K а ] , бревно D базы ≅ бревно п + бревно [ 1 1 + 10 п K а — п ЧАС ] . { displaystyle { begin {align} log D _ { text {acid}} amp; cong log P + log left [{ frac {1} {1 + 10 ^ { mathrm {p} H- mathrm {p} K_ {a}}}} right], \ log D _ { text {base}} amp; cong log P + log left [{ frac {1} {1 + 10 ^ { mathrm {p} K_ {a} — mathrm {pH}}}} right]. end {align}}}
Дальнейшие приближения для случая, когда соединение в значительной степени ионизировано:
Для предсказания p K a, которое, в свою очередь, можно использовать для оценки log D, часто применялись уравнения типа Хэммета.
Журнал P из журнала S
Если растворимость органического соединения известна или предсказана как в воде, так и в 1-октаноле, то log P можно оценить как
- бревно п знак равно бревно S о — бревно S ш . { displaystyle log P = log S _ { text {o}} — log S _ { text {w}}.}
Существует различные подходы к предсказать растворимость, и так войти S.
Коэффициент распределения октанол-вода
Основная статья: Коэффициент разделения октанол-вода
Коэффициент распределения между н- октанолом и водой известен как коэффициент распределения н- октанол-вода, или K ow. Его также часто называют символом P, особенно в английской литературе. Он также известен как соотношение распределения н- октанол-вода.
К OW, будучи тип коэффициента распределения, служит мерой взаимосвязи между липофильности (Жирорастворимость) и гидрофильности (растворимости в воде) вещества. Значение больше единицы, если вещество более растворимо в жироподобных растворителях, таких как н-октанол, и меньше единицы, если оно более растворимо в воде.
Примеры значений
Значения log K ow обычно находятся в диапазоне от -3 (очень гидрофильный) до +10 (чрезвычайно липофильный / гидрофобный).
Перечисленные здесь значения отсортированы по коэффициенту разделения. Ацетамид является гидрофильным, а 2,2 ‘, 4,4’, 5-пентахлорбифенил является липофильным.
| Вещество | log K OW | Т | Ссылка |
|---|---|---|---|
| Ацетамид | -1,155 | 25 ° C | |
| Метанол | -0,824 | 19 ° С | |
| Муравьиная кислота | -0,413 | 25 ° C | |
| Диэтиловый эфир | 0,833 | 20 ° C | |
| п- дихлорбензол | 3,370 | 25 ° C | |
| Гексаметилбензол | 4,610 | 25 ° C | |
| 2,2 ‘, 4,4’, 5- пентахлорбифенил | 6,410 | Окружающий |
Смотрите также
- Коэффициент распределения кровь – газ
- Хеминформатика
- Правило Липинского 5
- Липофильная эффективность
- Закон о распределении
- ИТИ
- Диаграмма ионного разделения
использованная литература
дальнейшее чтение
- Бертод А., Карда-Брох С. (май 2004 г.). «Определение коэффициентов разделения жидкость-жидкость методами разделения». (вторичный). Журнал хроматографии A. 1037 (1–2): 3–14. DOI : 10.1016 / j.chroma.2004.01.001. PMID 15214657.
- Комер Дж., Там К. (2001). «Профили липофильности: теория и измерение». В Testa B, van de Waterbed HM, Folkers G, Guy R (ред.). Фармакокинетическая оптимизация в исследованиях лекарственных средств: биологические, физико-химические и вычислительные стратегии. (вторичный). Вайнхайм: Wiley-VCH. стр. 275 -304. DOI : 10.1002 / 9783906390437.ch17. ISBN 978-3-906390-22-2.
- Ханс К., Лео А. (1979). Константы заместителей для корреляционного анализа в химии и биологии. (вторичный). Нью-Йорк: ISBN John Wiley amp; Sons Ltd. 978-0-471-05062-9.
- Хилл А.П., Молодой Р.Дж. (август 2010 г.). «Физические свойства в открытии лекарств: современный взгляд на растворимость и гидрофобность». (вторичный). Открытие наркотиков сегодня. 15 (15–16): 648–55. DOI : 10.1016 / j.drudis.2010.05.016. PMID 20570751.
- Kah M, Brown CD (август 2008 г.). «LogD: липофильность для ионизируемых соединений». (вторичный). Chemosphere. 72 (10): 1401–8. Bibcode : 2008Chmsp..72.1401K. DOI : 10.1016 / j.chemosphere.2008.04.074. PMID 18565570.
- Клопман Г, Чжу Х (февраль 2005 г.). «Последние методологии оценки коэффициентов разделения н-октанол / вода и их использование для прогнозирования свойств транспорта через мембрану лекарств». (вторичный). Миниобзоры по медицинской химии. 5 (2): 127–33. DOI : 10.2174 / 1389557053402765. PMID 15720283.
- Лео А., Хэнш С. и Элкинс Д. (1971). «Коэффициенты разделения и их использование». (вторичный). Chem Ред. 71 (6): 525–616. DOI : 10.1021 / cr60274a001.
- Лео А, Хукман Д.Х., Хэнш С. (1995). Изучение QSAR, гидрофобных, электронных и стерических констант. (вторичный). Вашингтон, округ Колумбия: Американское химическое общество. ISBN 978-0-8412-3060-6.
- Маннхольд Р., Пода Г. И., Остерманн С., Тетко И. В. (март 2009 г.). «Расчет молекулярной липофильности: современное состояние и сравнение методов log P для более чем 96 000 соединений». (вторичный). Журнал фармацевтических наук. 98 (3): 861–93. DOI : 10.1002 / jps.21494. PMID 18683876.
- Мартин YC (2010). «Глава 4: Гидрофобные свойства молекул». Количественный дизайн лекарств: критическое введение. (среднее) (2-е изд.). Бока-Ратон: CRC Press / Тейлор и Фрэнсис. стр. 66 -73. ISBN 978-1-4200-7099-6.
- Пандит Н.К. (2007). «Глава 3: Растворимость и липофильность». Введение в фармацевтические науки. (среднее) (1-е изд.). Балтимор, Мэриленд: Липпинкотт Уильямс и Уилкинс. С. 34–37. ISBN 978-0-7817-4478-2.
- Перлман RS, Данн WJ, Блок JH (1986). Коэффициент разделения: определение и оценка. (среднее) (1-е изд.). Нью-Йорк: Pergamon Press. ISBN 978-0-08-033649-7.
- Сангстер Дж (1997). Коэффициенты разделения октанол-вода: основы и физическая химия. (вторичный). Серия Wiley по химии растворов. 2. Чичестер: ISBN John Wiley amp; Sons Ltd. 978-0-471-97397-3.
внешние ссылки
- vcclab.org. Обзор множества калькуляторов logP и других калькуляторов физических свойств, доступных на рынке и в Интернете.
Как найти коэффициент распределения
Главным показателем эффективности экстракции является коэффициент распределения. Он считается по формуле: Со/Св, где Со – концентрация извлекаемого вещества в органическом растворителе (экстракторе), а Св – концентрация этого же вещества в воде, после наступления равновесия. Как можно опытным путем найти коэффициент распределения?
Перед вами поставлена такая задача. Дан раствор уксусной кислоты известной концентрации, диэтиловый эфир, проверочный (титровальный) раствор щелочи – гидроксида натрия, а также раствор индикатора — фенолфталеина. Следует рассчитать коэффициент распределения вещества – уксусной кислоты – между диэтиловым эфиром и водой. Как это сделать?
В лабораторную емкость (например, плоскодонную колбу со шлифом) налейте некоторый объем раствора уксусной кислоты –50 мл. Потом в эту же колбу добавьте такой же объем диэтилового эфира, плотно закройте «пришлифованной» пробкой и несколько минут встряхивайте смесь (вручную или с помощью качалки).
После встряхивания сделайте перерыв на 15 – 20 минут (отчетливо увидите, как смесь расслоится). Повторите встряхивание. Эту процедуру следует проделать минимум дважды, для более полной экстракции уксусной кислоты и, соответственно, более точного результата.
Во время первого «отстаивания», проведите контрольное титрование некоторого количества раствора кислоты раствором гидроксида натрия в присутствии индикатора фенолфталеина. Запишите, сколько миллилитров щелочи ушло на нейтрализацию, обозначив эту величину С1.
После последнего «отстаивания» смеси, когда проявится четкая граница раздела фаз, осторожно перелейте в делительную воронку. Отвергнув нижний краник, отберите более тяжелый водный слой. В нем по-прежнему содержится уксусная кислота, но, разумеется, в меньшей концентрации – ведь часть ее была экстрагирована эфиром.
Отберите точно такое же количество раствора кислоты, как и при контрольном титровании, и снова оттитруйте его едким натром в присутствии фенолфталеина. Количество миллилитров щелочи, затраченное на нейтрализацию, обозначьте С2.Коэффициент распределения рассчитайте по формуле: С1/С2. Задача решена.
Определение коэффициента распределения вещества между двумя несмешивающимися или ограниченно смешивающимися растворителями
Страницы работы
Содержание работы
Цель работы: определение коэффициента
распределения вещества между двумя несмешивающимися или ограниченно
смешивающимися растворителями.
1. ЗАКОН РАСПРЕДЕЛЕНИЯ
Если в систему, состоящую из двух несмешивающихся
или ограниченно смешивающихся жидкостей, добавить третье вещество, способное
растворяться в каждой из этих жидкостей, то это вещество будет распределяться
между обеими жидкостями в соответствии с условием фазового равновесия.
При этом каждая из обеих фаз системы
будет состоять из трех компонентов.
В состоянии равновесия химический
потенциал растворенного вещества (компонента) одинаков в обоих растворах
(фазах), то есть
μ(1)=μ(2),
(1),
где μ(1) и μ(2) химические потенциалы растворенного
компонента соответственно в первой и второй фазах. Так как
μ=μ°+ RTlna, (2),
где а — активность растворенного компонента, то
μ°(1)+ RTlna(1) = μ°(2)+ RTlna(1)
(3),
Отсюда следует, что
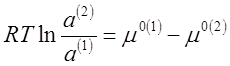
(4),
но
так как разность μ°(1)— μ°(2) при постоянной температуре величина постоянная, то
(5),
где Δ μ° —
разность стандартных химических потенциалов растворенного вещества в первой и
второй фазах.
Из соотношения (5) получают:
(6),
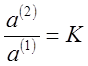
где К — коэффициент
распределения; величина, постоянная при данной температуре.
Выражение (7) является количественным
выражением закона распределения, который формулируется следующим образом:
Отношение активностей растворенного
вещества при равновесном распределении его между двумя несмешивающимися или
ограниченно смешивающимися растворителями при данной температуреесть величина постоянная при различных количествах
растворенного вещества.
Из уравнения (6) следует, что
коэффициент распределения не зависит от активностей растворенного вещества в
обоих растворителях, но зависит от температуры, природы растворенного вещества
и природы растворителя.
Зависимость коэффициента распределения
от температуры определяется уравнением, аналогичным уравнению изобары
химической реакции:
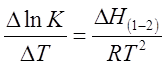
где
Δ Н(1-2) (кДж/моль) — изменение энтальпии при переходе
распределяемого вещества из одной фазы в другую (в данном случае — из первой во
вторую).
Закон распределения справедлив только
в том случае, когда добавление третьего вещества в систему из двух
несмешивающихся или (ограниченно смешивающихся жидкостей не вызывает изменения
растворимости этих жидкостей друг в друге.
Для разбавленных растворов, вместо
отношения активностей, можно использовать отношение мольных долей:
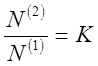
где N(1) и N(2)
— мольные доли растворенного
компонента в обеих фазах. Или отношение концентраций:
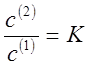
где с(1) и с(2) — молярные
концентрации растворенного вещества (моль/л).
Если в растворе присутствует несколько
невзаимодействующих веществ, то распределение каждого из растворенных веществ
между двумя фазами определяется индивидуальным коэффициентом распределения,
величина которого не зависит от присутствия других веществ.
Для малорастворимых веществ даже
насыщенные растворы остаются разбавленными и подчиняются законам предельно
разбавленных растворов.
Поэтому
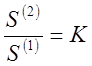
где S(1) и S(2) — концентрации насыщенных растворов
(растворимости) малорастворимого компонента в обеих фазах.
Справедливость этого соотношения будет
понятна, если учесть, что химические потенциалы растворенного компонента в
обоих насыщенных растворах равны химическому потенциалу чистого компонента, то
есть равны между собой.
Уравнение (10) довольно хорошо
оправдывается в тех случаях, когда количество частиц распределяющегося
компонента одинакова в обеих фазах, то есть нет ни диссоциации, ни ассоциации
частиц.
Рассмотрим два
простейших предельных случая.
1. Если
распределяемое вещество диссоциирует во втором растворителе практически
полностью на две частицы, то закон распределения справедлив в форме
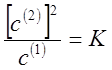
2. Если распределяемое вещество во втором растворителе
ассоциировано в двойные частицы и степень ассоциации близка к единице, то закон
распределения принимает вид
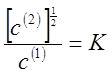
В общем случае применимо соотношение
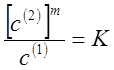
где m — величина, постоянная для
определенной системы при постоянной температуре.
Все
отклонения от законов идеальных растворов учитываются коэффициентами
активности. Поэтому, если известны активности распределяемого компонента в двух
растворителях, то уравнением (7) можно пользоваться и при диссоциации, и при
ассоциации молекул в растворе.
Часто на практике вычисление коэффициента
распределения производят по одной из формул (10), (12) или (13) (если известно,
что в одной из фаз растворенное вещество не диссоциирует и не ассоциирует),
выбирая ту из них, которая дает более постоянные значения К при различных
концентрациях.
Экспериментальное определение коэффициентов
распределения может служить для определения степени ассоциации или диссоциации растворенного вещества в том или ином
растворителе ___________ изучения химических равновесии в растворе. Последнее
применимо в тех случаях, когда только один из участников реакции, происходящей
в первой фазе, способен растворяться во торой фазе. Для этого система
доводится до состояния равновесия и по концентрации вещества во второй фазе
рассчитывается его равновесная концентрация в первой фазе, а следовательно, и
константа равновесия реакции.
Из закона распределения вытекает, что вещество, растворённое в одном
растворителе, можно извлечь из раствора, добавляя к нему второй растворитель, несмешивающийся с
первым. Такое
извлечение растворенного
вещества из раствора называется экстракцией.
2. ЭКСТРАКЦИЯ
Похожие материалы
- Изучение взаимной растворимости жидкостей
- Изучение взаимной растворимости жидкостей в системах с одной парой ограниченно растворимых жидкостей и построение диаграммы трехкомпонентной системы
- Равновесия в гетерогенных системах
Информация о работе
Тип:
Отчеты по лабораторным работам
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание — внизу страницы.










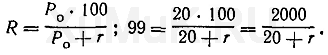
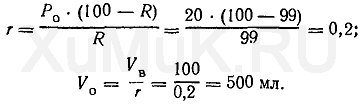
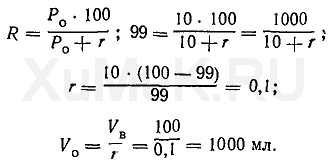
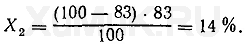
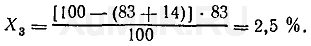
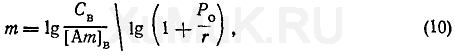
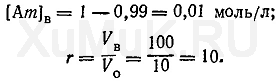
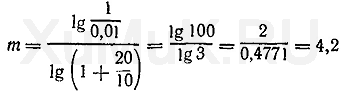
![{ displaystyle log P _ { text {oct / wat}} = log left ({ frac {{ big [} { text {solute}} { big]} _ { text {octanol}} ^ { text {неионизированный}}} {{ big [} { text {solute}} { big]} _ { text {вода}} ^ { text {неионизированный}}}} Правильно).}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d826d547125b661d94f40ef87db5312e59d95e35)

![{ displaystyle log P _ { text {oct / wat}} ^ { mathrm {I}} = log left ({ frac {{ big [}} { text {solute}} { big] } _ { text {октанол}} ^ {I}} {{ big [} { text {solute}} { big]} _ { text {вода}} ^ {I}}} right). }](https://wikimedia.org/api/rest_v1/media/math/render/svg/16ec04cb84d936176cb002a82c47c64a436112db)
![{ displaystyle log D _ { text {oct / wat}} = log left ({ frac {{ big [} { text {solute}} { big]} _ { text {octanol}} ^ { text {ionized}} + { big [} { text {solute}} { big]} _ { text {octanol}} ^ { text {неионизированный}}} {{ big [ } { text {solute}} { big]} _ { text {water}} ^ { text {ionized}} + { big [} { text {solute}} { big]} _ { текст {вода}} ^ { text {неионизированный}}}} right).}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fdcedc538ee644a7ad0ee0132589728aba5b3523)



![{ displaystyle { begin {align} log D _ { text {acid}} amp; cong log P + log left [{ frac {1} {1 + 10 ^ { mathrm {p} H- mathrm {p} K_ {a}}}} right], \ log D _ { text {base}} amp; cong log P + log left [{ frac {1} {1 + 10 ^ { mathrm {p} K_ {a} - mathrm {pH}}}} right]. end {align}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b272380120b601a24df41e31ce388e26f7fcb795)