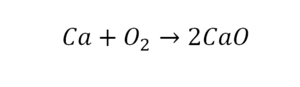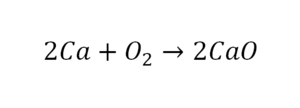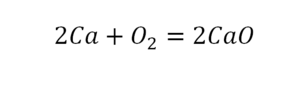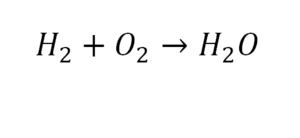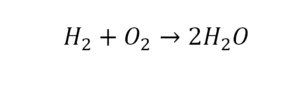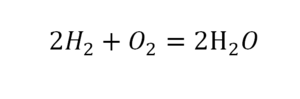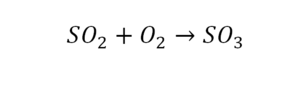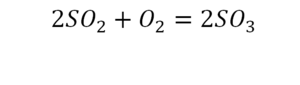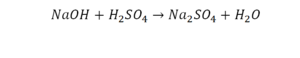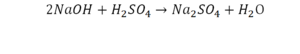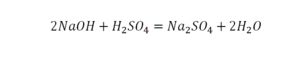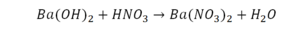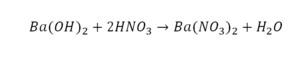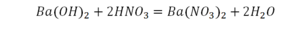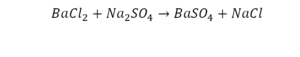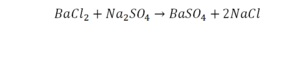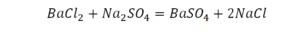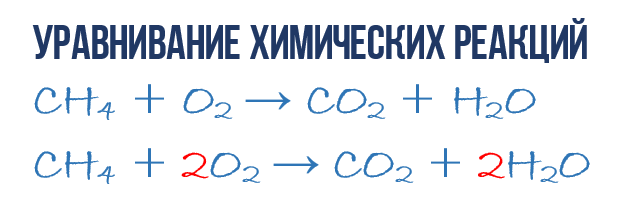Как расставлять коэффициенты в химических уравнениях
Уравнением реакции в химии называется запись химического процесса с помощью химических формул и математических знаков.
Такая запись является схемой химической реакции. Когда возникает знак «=», то это называется «уравнение». Попробуем его решить.
Пример разбора простых реакций
В кальции один атом, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. С правой стороны уравнения Са тоже один. По кальцию нам не надо работать.
Видео: Коэффициенты в уравнениях химических реакций.
Смотрим следующий элемент — кислород. Индекс 2 говорит о том, что здесь 2 иона кислорода. С правой стороны нет индексов, то есть одна частица кислорода, а с левой — 2 частицы. Что мы делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты — это то, что написано перед наименьшей частью. Они имеют право меняться. Для удобства саму формулу не переписываем. С правой части один умножаем на 2, чтобы получить и там 2 иона кислорода.
После того как мы поставили коэффициент, получилось 2 атома кальция. С левой стороны только один. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество атомов элементов равно с обеих сторон, то можем поставить знак «равно».
Другой наглядный пример: два водорода слева, и после стрелочки у нас тоже два водорода.
Смотрим дальше:
- Два кислорода до стрелочки, а после стрелочки индексов нет, значит, один.
- Слева больше, а справа меньше.
- Ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось два атома водорода. И чтобы получить 4, мы должны водород умножить на два.
Видео: Расстановка коэффициентов в химическом уравнении
Вот тот случай, когда элемент в одной и в другой формуле с одной стороны, до стрелочки.
Один ион серы слева, и один ион — справа. Две частицы кислорода, плюс еще две частицы кислорода. Значит, что с левой стороны 4 кислорода. Справа же находится 3 кислорода. То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. Для этого умножаем на два всю формулу после стрелочки. После умножения получаем шесть ионов кислорода, да еще и 2 атома серы. Слева же имеем одну микрочастицу серы. Теперь уравняем ее. Ставим слева уравнения перед серой 2.
Уравняли.
Сложные реакции
Этот пример более сложный, так как здесь больше элементов вещества.
Это называется реакцией нейтрализации. Что здесь нужно уравнивать в первую очередь:
- С левой стороны один атом натрия.
- С правой стороны индекс говорит о том, что здесь 2 натрия.
Напрашивается вывод, что надо умножить всю формулу на два.
Видео: Составление уравнений химических реакций
Теперь смотрим, сколько серы. С левой и правой стороны по одной. Обращаем внимание на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем 2.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны также 6 атомов. Проверяем водород. Два атома водорода и еще 2 атома водорода. То есть будет четыре атома водорода с левой стороны. И с другой стороны также четыре атома водорода. Все элементы уравнены. Ставим знак «равно».
Видео: Химические уравнения. Как составлять химические уравнения.
Здесь пример интересен тем, что появились скобки. Они говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на него. Начать необходимо с азота, так как его меньше, чем кислорода и водорода. Слева азот один, а справа, с учетом скобок, его два.
Справа два атома водорода, а нужно четыре. Мы выходим из положения, просто умножая воду на два, в результате чего получили четыре водорода. Отлично, водород уравняли. Остался кислород. До реакции присутствует 8 атомов, после — тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Последний пример.
На очереди у нас барий. Он уравнен, его трогать не нужно. До реакции присутствует два хлора, после нее — всего один. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Видео: Балансирование химических уравнений.
Теперь за счет коэффициента, который только что поставлен, после реакции получилось два натрия, и до реакции тоже два. Отлично, все остальное уравнено.
Также уравнивать реакции можно методом электронного баланса. Этот метод имеет ряд правил, по которым его можно осуществлять. Следующим действием мы должны расставить степени окисления всех элементов в каждом веществе для того, чтобы понять где произошло окисление, а где восстановление.
Как определять, находить коэффициент в химических уравнениях
Уравнение реакции в химии — символическая запись протекания химического взаимодействия с помощью математических знаков, химических обозначений и коэффициентов. Расставить в химических уравнениях коэффициенты можно несколькими способами, каждый из которых имеет свои преимущества и уровень сложности.
Распространненые способы уравнивания
Существует не один способ правильной расстановки коэффициентов в химических уравнениях. Чтобы найти нужную схему реакций, можно ознакомиться с самыми распространёнными методами:
- Подбор коэффициентов. В этом способе расставляются акценты на нахождение наименьшего общего кратного и приравнивания к нему обеих частей уравнения.
- Запись онлайн. Безусловно, наипростейший из всех представленных, для которого нужно лишь уметь находить подходящий сайт.
- Вычисления столбиком. Способ представляет собой математическую запись с подбором.
- Метод полуреакций. Иногда встречается под названием «Электронно-ионный баланс», используется при окислительно-восстановительных реакциях.
Чтобы научиться уравнивать химические записи, необходимо разобраться в перечисленных способах. Безусловно, необязательно запоминать каждый, но ознакомившись с методами, легче подобрать тот, с которым расставить коэффициенты в уравнениях химических реакций станет упрощённой задачей.
Подбор коэффициентов
Чтобы решить, как расставить индексы и коэффициенты в записи, можно использовать метод подбора, который считается самым лёгким и понятным, среди прочих:
- Изначально в левой части реакции записываются исходные вещества, ставится стрелка к правой, ещё не заполненной части.
- В правой части записываются полученные продукты.
- В этом пункте происходит выравнивание коэффициентов за счет закона сохранения массы, который гласит о том, что с обеих сторон уравнения должно быть одинаковое количество атомов.
- Число атомов проверяется на соответствие в правой и левой частях уравнения и под стрелкой рисуется диагональная черта.
Метод подбора активно применяется при записи реакций, у которых продуктом является одно вещество. Он наиболее лёгок для понимания и запоминания, с него начинается путь уравнивания записей для школьников 8 класса.
Вычисления с помощью столбика
Такой способ заключается в том, чтобы определять нужные числа с помощью валентностей, составляя небольшие уравнения. Всё, что нужно, — уметь правильно определить, показывать и посчитать исходные реагенты и продукты реакции.
Шаг первый — записать реакцию и в двух столбиках перечислить реагенты и продукты.
Ag + O2 -> AgO. Вещества из этого примера распределяем в 2 колонки, соответственно Ag, O2 — в одной, AgO — в другой.
Следующее действие — расставление валентностей и поиск наименьшего общего кратного.
Валентность серебра — постоянная, в соединении с кислородом также III. Поэтому нужно показать в столбцах эти валентности (II и III). Наименьшим общим кратным является число 6, значит, количество молекул серебра нужно домножить на 2.
Предпоследний шаг — сравнение коэффициентов и индексов.
Сравнивая обе части записи, можно заметить, что они неравны, поэтому необходимо найти сумму и в продуктах поставить индекс 2, а перед серебром в части реагентов — 4. Так получается уравнение: 4Ag + O2 = 2 Ag2O.
Этот вариант похож на метод уравнивания, но отличается тем, что в нём нужно учитывать не закон сохранения массы, а больше внимания уделять валентности элемента. Он используется при вычислении как простых и коротких записей, так и громоздких, достаточно сложных.
Решение методом полуреакций
Способ полуреакций создан для упрощения составления ионных реакций. В нём учитывается число зарядов и их направленность. Для уравнивания по числу зарядов нужно от той части схемы, в которой прописаны реагенты отнять количество электронов, равное коэффициенту перед продуктом из правой части схемы. После этого стрелку можно заменить на знак равенства.
Несколько советов для уравнивания реакций
Прежде всего, стоит изучить все способы выравнивания коэффициентов и понять, с помощью какого метода записывать будет проще, быстрее и удобнее. Для этого нужно рассмотреть плюсы и минусы способов и согласовать их со слабыми и сильными сторонами в понимании химии.
Если же подробное изучение темы не понадобится в дальнейшем, а уравнять реакцию нужно только единожды, можно воспользоваться множеством сайтов, которые предлагают решить проблему онлайн. Нужно просто ввести уравнение в нужное поле.
Как расставлять коэффициенты в химических уравнениях
Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
http://na5.club/himiya/kak-opredelyat-nahodit-koefficzient-v-himicheskih-uravneniyah.html
http://www.poznavayka.org/himiya/kak-rasstavlyat-koefficzienty-v-himicheskih-uravneniyah/
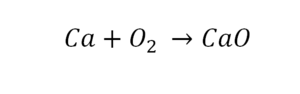
Такая запись является схемой химической реакции. Когда возникает знак «=», то это называется «уравнение». Попробуем его решить.
…
Оглавление:
- Пример разбора простых реакций
- Видео: Коэффициенты в уравнениях химических реакций.
- Видео: Расстановка коэффициентов в химическом уравнении
- Сложные реакции
- Видео: Составление уравнений химических реакций
- Видео: Химические уравнения. Как составлять химические уравнения.
- Видео: Балансирование химических уравнений.
- Видео: Как поставить коэффициенты в химических уравнениях
Пример разбора простых реакций
В кальции один атом, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. С правой стороны уравнения Са тоже один. По кальцию нам не надо работать.
Это интересно: алканы — химические свойства предельных углеводородов.
Видео: Коэффициенты в уравнениях химических реакций.
Смотрим следующий элемент — кислород. Индекс 2 говорит о том, что здесь 2 иона кислорода. С правой стороны нет индексов, то есть одна частица кислорода, а с левой — 2 частицы. Что мы делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты — это то, что написано перед наименьшей частью. Они имеют право меняться. Для удобства саму формулу не переписываем. С правой части один умножаем на 2, чтобы получить и там 2 иона кислорода.
После того как мы поставили коэффициент, получилось 2 атома кальция. С левой стороны только один. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество атомов элементов равно с обеих сторон, то можем поставить знак «равно».
Другой наглядный пример: два водорода слева, и после стрелочки у нас тоже два водорода.
Смотрим дальше:
- Два кислорода до стрелочки, а после стрелочки индексов нет, значит, один.
- Слева больше, а справа меньше.
- Ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось два атома водорода. И чтобы получить 4, мы должны водород умножить на два.
Видео: Расстановка коэффициентов в химическом уравнении
Вот тот случай, когда элемент в одной и в другой формуле с одной стороны, до стрелочки.
Один ион серы слева, и один ион — справа. Две частицы кислорода, плюс еще две частицы кислорода. Значит, что с левой стороны 4 кислорода. Справа же находится 3 кислорода. То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. Для этого умножаем на два всю формулу после стрелочки. После умножения получаем шесть ионов кислорода, да еще и 2 атома серы. Слева же имеем одну микрочастицу серы. Теперь уравняем ее. Ставим слева уравнения перед серой 2.
Уравняли.
Сложные реакции
Этот пример более сложный, так как здесь больше элементов вещества.
Это называется реакцией нейтрализации. Что здесь нужно уравнивать в первую очередь:
- С левой стороны один атом натрия.
- С правой стороны индекс говорит о том, что здесь 2 натрия.
Напрашивается вывод, что надо умножить всю формулу на два.
Видео: Составление уравнений химических реакций
Теперь смотрим, сколько серы. С левой и правой стороны по одной. Обращаем внимание на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем 2.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны также 6 атомов. Проверяем водород. Два атома водорода и еще 2 атома водорода. То есть будет четыре атома водорода с левой стороны. И с другой стороны также четыре атома водорода. Все элементы уравнены. Ставим знак «равно».
Видео: Химические уравнения. Как составлять химические уравнения.
Следующий пример.
Здесь пример интересен тем, что появились скобки. Они говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на него. Начать необходимо с азота, так как его меньше, чем кислорода и водорода. Слева азот один, а справа, с учетом скобок, его два.
Справа два атома водорода, а нужно четыре. Мы выходим из положения, просто умножая воду на два, в результате чего получили четыре водорода. Отлично, водород уравняли. Остался кислород. До реакции присутствует 8 атомов, после — тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Последний пример.
На очереди у нас барий. Он уравнен, его трогать не нужно. До реакции присутствует два хлора, после нее — всего один. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Видео: Балансирование химических уравнений.
Теперь за счет коэффициента, который только что поставлен, после реакции получилось два натрия, и до реакции тоже два. Отлично, все остальное уравнено.
Также уравнивать реакции можно методом электронного баланса. Этот метод имеет ряд правил, по которым его можно осуществлять. Следующим действием мы должны расставить степени окисления всех элементов в каждом веществе для того, чтобы понять где произошло окисление, а где восстановление.
Видео: Как поставить коэффициенты в химических уравнениях
Как расставить коэффициенты в химических уравнениях?
Добавлено: 12 мая 2022 в 9:59

В химии уравнение – это запись реакции с помощью формул веществ и математических знаков.
Знак «=» подразумевает, что реакция уравнена, поэтому принято сперва ставить «→» и только в самом конце заменять его на «=».
Вам встретятся следующие понятия:
- Коэффициент – множитель, означающий количество частиц прореагировавшего или образовавшегося вещества. Если перед формулой не стоит коэффициент, он равен 1.
- Индекс – это количественное значение атомов элемента в формуле. Если индекс не стоит, он равен 1.
Например, формуле 8H2O 8 – коэффициент (взято 8 молекул воды), а 2 – индекс (в молекуле воды содержится 2 атома водорода).
Правила расстановки коэффициентов
Коэффициенты в уравнениях химических реакций
Есть несколько принципов, по которым расставляются коэффициенты:
1) Количество элемента в левой части должно совпадать с его количеством в правой;
2) Коэффициент умножается на индекс каждого химического элемента в формуле;
3) Если в одной части уравнения есть несколько веществ, содержащих один и тот же химический элемент, то числовые значения этого элемента из всех формул складываются.
Несмотря на кажущуюся легкость этой темы, иногда именно с нее начинаются пробелы в знаниях по химии. Чтобы не допустить этого мы рекомендуем не затягивать с отставанием по предмету, а сразу записаться на курсы по химии для школьников. Особенно, если химия понадобится для выпускного экзамена.
Уравнивание простых реакций
Коэффициенты в уравнениях химических реакций
Разберемся, как правила работают на практике примере простой реакции соединения:
P + О2 →P2O5
Считаем сколько атомов фосфора в левой части и сколько в правой. Слева фосфор содержит простое вещество P. Индекс не стоит, значит он равен 1. Значит слева 1 атом P. Справа фосфор содержит P2O5, причем стоит индекс 2, значит справа 2 фосфора.
Считаем кислород. Слева 2 атома кислорода, а справа их 5.
Уравниваем кислород. Нужно домножить с каждой стороны его количество на такое число, чтобы в правой стороне кислорода стало столько же, сколько и в левой. Найдем наименьшее общее кратное 2 и 5. Это 10. Слева у кислорода ставим коэффициент 5, чтобы его количество стало равно 10, а справа перед P2O5 пишем 2.
Получаем такую запись:
P + 5O2 → 2P2O5
Уравниваем фосфор. В левой стороне 1 атом фосфора, в правой стороне его стало 4, так как мы поставили 2 перед P2O5, и теперь эту двойку нужно умножать на индекс в формуле. Чтобы количество фосфора в обеих частях сравнялось, ставим 4 в левой части у P.
Реакция уравнена. Пишем знак «=».
4P + 5O2 = 2P2O5
Коэффициенты в уравнениях химических реакций
Уравнивание сложных реакций
Единственное, на что стоит обратить внимание: кислород и водород удобнее уравнивать последними. В остальном процесс идентичен.
Рассмотрим реакцию гидроксида кальция с соляной кислотой.
Ca(OH)2 + HCl → CaCl2 + H2O
Число кальция в каждой части равно 1, кальций уравнен. Сравним количество хлора. Слева 1, справа 2. Ставим перед HCl 2.
Ca(OH)2 + 2HCl → CaCl2 + H2O
Считаем кислород. Слева 2, справа 1. Пишем 2 у воды. Проверяем водород. В левой части его содержат оба вещества. Суммируем количество атомов H, получаем 4. Справа водорода тоже 4. Ставим «=».
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Коэффициенты в уравнениях химических реакций
Расстановка коэффициентов с помощью электронного баланса
Метод электронного баланса применим для окислительно-восстановительных реакций. Изучение этого метода начинается с определения степеней окисления.
Степень окисления – это заряд атома элемента в соединениях.
Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
Определяем, степень окисления каких элементов поменялась. Это медь и азот. Степень окисления меди была 0, стала +2. Степень окисления азота была +5, стала +4.
Чтобы медь из нуля перешла в +2, она должна отдать 2 электрона. Чтобы азот из +5 перешел в +4, он должен принять 1 электрон.
Пишем:
Cu0 – 2e → Cu+2
N+5 + 1e → N+4
Коэффициенты в уравнениях химических реакций
Далее нужно найти наименьшее общее кратное 2 и 1. Это 2. Делим его на количество отданных медью электронов, затем снова делим его на количество принятых электронов азотом. Найденные значения как раз и являются искомыми коэффициентами.
Cu0 – 2e → Cu+2 2 2 1
N+5 + 1e → N+4 1 2 2
Пишем 2 перед NO2. В правой стороне азота стало 4. Ставим 4 перед HNO3. Перед Cu коэффициенты не нужны, так как по балансу получилась единица. В левой части 4 водорода, пишем 2 перед водой. Проверяем кислород. И там, и там его по 12. Ставим «=».
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Сперва процесс занимает много времени, но после многочисленных уравниваний он доводится до автоматизма.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Содержание
- Химическое уравнение
- Уравнивание химических реакций
- Коэффициенты в уравнениях химических реакций
Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
- CH4 + O2 → CO2 + H2O (1)
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H2O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
- 1CH4 + O2 → 1CO2 + H2O (2)
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
- 1CH4 + O2 → 1CO2 + 2H2O (3)
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
- 1CH4 + 2O2 → 1CO2 + 2H2O или СH4 + 2O2 → CO2 + 2H2O (4)
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
- C7H5N3O6 + O2 → CO2 + H2O + N2 (5)
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
- 2C7H5N3O6 + O2 → 14CO2 + 5H2O + 3N2 (7)
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
- 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2 (8)
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
- 4C7H5N3O6 + 21O2 → 28CO2 + 10H2O + 6N2 (9)
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
- C7H5N3O6 + 5,25O2 → 7CO2 + 2,5H2O + 1,5N2 (10)
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·1023, мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C7H5N3O6 = 227,13 г/моль
- O2 = 31,999 г/моль
- CO2 = 44,010 г/моль
- H2O = 18,015 г/моль
- N2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO2 | |
| 671,98 г CO2 | 180,15 г H2O | |
| 168,08 г N2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2:
- CaCO3 + 2HCl → CaCl2 + CO2 + H2O (11)
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H+ и Cl—. Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
- CaCO3(тв.) + 2H+(водн.) → Ca2+(водн.) + CO2(г.) + H2O(ж.) (12)
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H+, образуя при этом положительный ион Ca2+, CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.