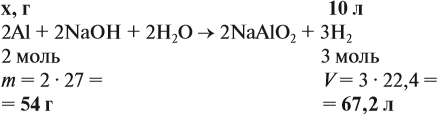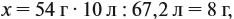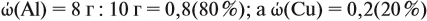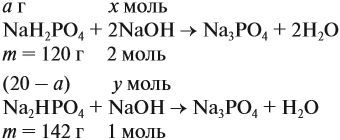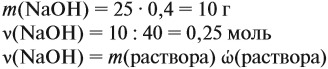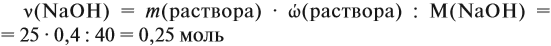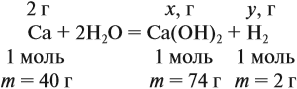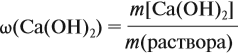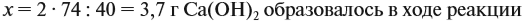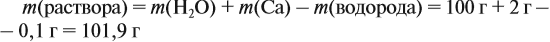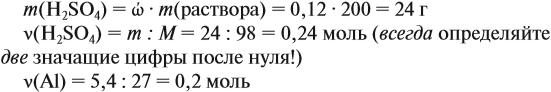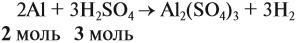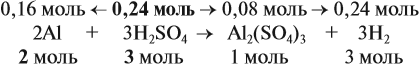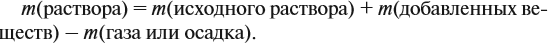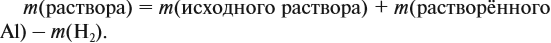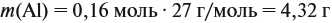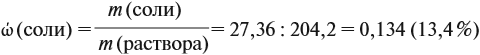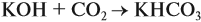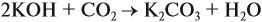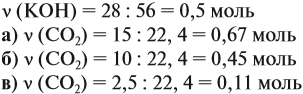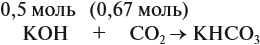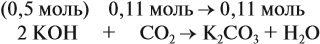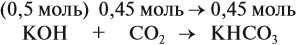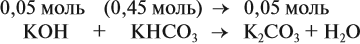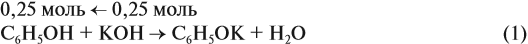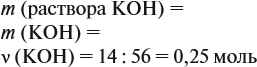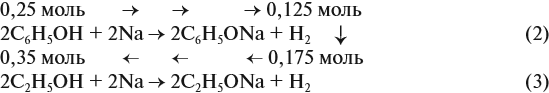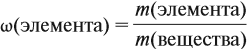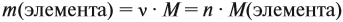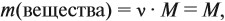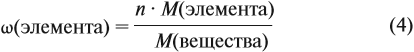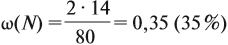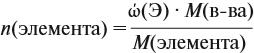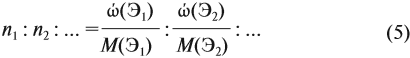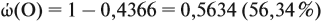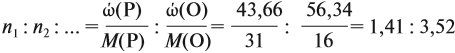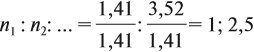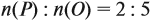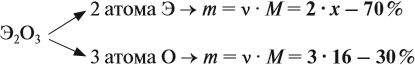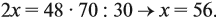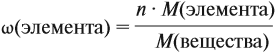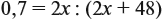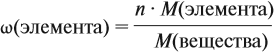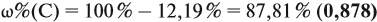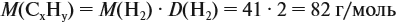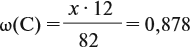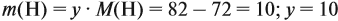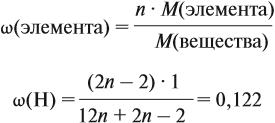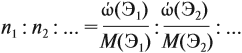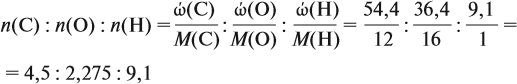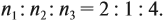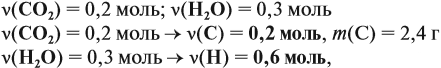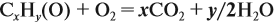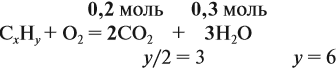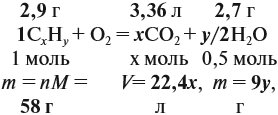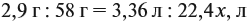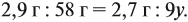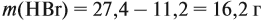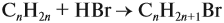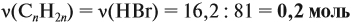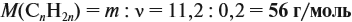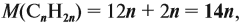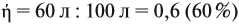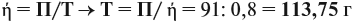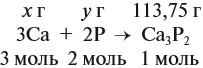Задачи на определение количественного состава смеси – частые гости на экзаменах или контрольных любых уровней и классов. Многие из этих задач имеют схожую идею решения, поэтому, поняв основные принципы и методы, можно с легкостью решить задачу любой сложности на эту тематику.
Воздействие на смесь химическими реактивами
Первой идеей, или типом задач, являются те, где на смесь действуют определенными химическими реактивами. Эти вещества взаимодействуют только с одним компонентов смеси, что позволяет рассчитать его массу. Необходимым для решения являются знания характерных химических реакций, ведь без этого, попросту нереально написать соответствующие уравнения реакций. Рассмотрим это на таком примере.
Пример 1
Смесь, масса которой 41,8 г, которая содержит натрий карбонат, натрий нитрат и натрий сульфат, поместили в раствор H2SO4, масса которого равна 98 г, а массовая часть кислоты – 10%, и нагрели. Выделилось 2,24 л газа. К полученному раствору добавили избыток барий хлорида и получили 46,6 г осадка. Определите массовую часть натрий нитрата в исходной смеси.
Решение
Итак, первое, что нужно определить: какой газ выделяется при растворении в сульфатной кислоте? Это только карбонат натрия, другие компоненты не взаимодействуют с сульфатной кислотой. Тогда:
Na2CO3 + H2SO4 →rightarrow Na2SO4 + CO2 ↑uparrow + H2O
Тогда найдем количество моль газа и карбоната натрия:
nCO2=V/V0=2,24/22,4=0,1 моль
Далее в раствор добавляют хлорид бария. Как известно, ионы бария взаимодействую с сульфат-ионами и выпадает осадок сульфата бария.
Ba2+ + SO42- →rightarrow BaSO4
Стоит быть внимательным, т.к. в растворе есть два источника сульфат-ионов – сульфат натрия и сульфатная кислота. Можем найти, сколько было сульфата натрия:
nBaSO4=m/Mr=46,6/(233)=0,2 моль
nH2SO4=m/Mr=mр-ра ⋅cdot W/Mr=98 ⋅cdot 0,1/98=0,1 моль
Таким образом, nNa2SO4=nBaSO4 – nH2SO4 = 0,2 – 0,1=0,1 моль
Теперь, зная сколько было натрий сульфата и карбоната, можем найти массу натрий нитрата:
mNa2SO4=n ⋅cdot Mr=0,1 ⋅cdot 142=14,2 г
mNa2CO3=n ⋅cdot Mr=0,1 ⋅cdot 106=10,6 г
mNaNO3=m- mNa2CO3 — mNa2SO4=41,8-14,2-10,6=17 г
WNaNO3=mNaNO3/m=17/41,8 ⋅cdot 100%=40,67%
Нахождение состава смеси по плотности
Другим типом задач является нахождение состава смеси по известной плотности. Для решения таких задач требуется умение составления и решения несложных уравнений. Рассмотрим этот тип задач на таком примере
Пример 2
Смесь водорода и аммиака имеет плотность в 12,57 раза меньше плотности углекислого газа. Определите объемную часть водорода в смеси.
Решение
Сначала найдем, какую плотность имеет смесь. Как известно, плотность прямо пропорциональна молярной массе, поэтому молярная масса смеси
Mrсмеси=MrCO2/12,57=44/12,57=3,5 г/моль
Далее, пусть x – объемная доля водорода в смеси, тогда (1-х) – объемная доля аммиака. Тогда, составим такое уравнение:
MrH2 ⋅cdot x+MrNH3 ⋅cdot (1-x)=Mrсмеси
2 ⋅cdot x + 17 ⋅cdot (1-x)=3,5
15x=13,5
x=0,9
Или 90% водорода в смеси.
Взаимодействие реагента с обоими компонентами смеси
Далее рассмотрим тип задач, в которых реагент взаимодействует с обоими компонентами смеси. Для решения таких задач нужно составить уравнение. Рассмотрим такой пример.
Пример 3
На 25 г смеси алюминия и меди подействовали концентрированной азотной кислотой и нагрели. Получили 33,6 л газа. Определите массовую часть алюминия в смеси.
Решение
Первое, что нужно сделать – написать уравнения реакций:
Cu + 4HNO3 →rightarrow Cu(NO3)2 + 2NO2 + 2H2O
Al + 6HNO3 →rightarrow Al(NO3)3 + 3NO2 + 3H2O
Стоит отметить, что здесь азотная кислота реагирует с алюминием, поскольку взята горячая кислота.
Заметим, что на один моль меди приходится 2 моль газа, а на 1 моль алюминия – 3 моль газа.
Найдем количество газа:
n=V/V0=33,6/22,4=1,5 моль
Далее составим такой уравнение:
Пусть x г – масса алюминия в смеси, тогда (25-х) г – масса меди.
Тогда:
(nAl) ⋅cdot 3+(nCu) ⋅cdot 2=0,5
Или x/MrAl ⋅cdot 3+(25-x)/MrCu ⋅cdot 2=1,5
(x/27) ⋅cdot 3+(25-x) ⋅cdot 2/64=1,5
Решая, получаем х=9 г
Или W=m/mсмеси=9/25 ⋅cdot 100%=36%
В итоге, имеем, что для успешной борьбы с задачами на определение количественного состава смеси, важно иметь знания как в химии, так и обладать определенными математическими навыками.
Для того чтобы решить любую задачу из этого раздела, необходимо знать
- теоретические основы задачи;
- общие принципы оформления расчёта по уравнению химической реакции.
Поскольку теоретические основы изложены в различных разделах Самоучителя и других учебниках, нужно перед решением задачи повторить нужный раздел.
Рассмотрим общие принципы оформления расчётов по уравнениям реакций.
Содержание
- Оформление расчётов по уравнениям реакций
- Задачи для самостоятельного решения
- Задачи по теме «Количественный состав смесей»
- Задачи для самостоятельного решения
- Задачи на «избыток–недостаток»
- Задачи для самостоятельного решения
- Задачи на установление формулы вещества
- Задачи для самостоятельного решения
- Задачи, в которых учитывается «выход» полученного вещества
- Задачи для самостоятельного решения
Оформление расчётов по уравнениям реакций
Для того чтобы выполнить расчёт по уравнению реакции, нужно:
- составить уравнение химической реакции, расставить коэффициенты;
- по коэффициентам уравнения химической реакции определить число молей реагирующих веществ;
- НАД формулами соединений указать данные задачи, отметив их размерность (г, л, моль);
- ПОД формулами этих соединений сделать расчёт таким образом, чтобы размерность величин «над» и «под» химическими формулами совпали;
- составить пропорцию из «верхних» данных и «нижних» результатов и выполнить расчёт.
Разберём этот алгоритм на примере.
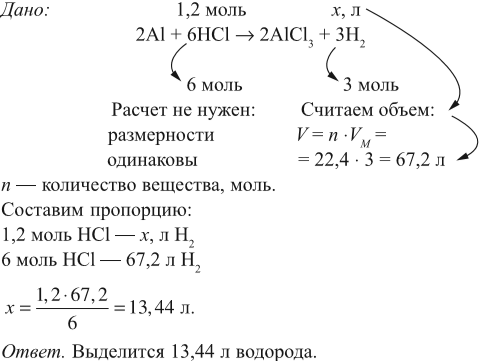
Задача 17. В раствор, содержащий 1,2 моль НCl опустили избыток алюминия. Какой объём водорода выделится при этом?
Решение. Составим уравнение реакции и запишем, что дано в ней, над формулами соединений. При этом обязательно указывайте размерность.
Задача 18. Сколько граммов алюминия нужно растворить в соляной кислоте, чтобы получить 5,6 л водорода?
Решение. Составим уравнение реакции и запишем, что дано в ней, над химическими формулами соединений. При этом обязательно указывайте размерность.
В случае, когда нужно определить объёмы реагирующих газов, можно воспользоваться следствием из закона Авогадро.
Объёмы реагирующих газов относятся как их коэффициенты в уравнении химической реакции.
Задача 19. Какой объём углекислого газа выделится при полном сгорании 6 л ацетилена С2Н2?
Решение.
Задачи для самостоятельного решения
25. Какой объём кислорода потребуется для полного сгорания 6,2 г фосфора? Сколько молей оксида фосфора при этом получится?
26. Сколько молей фосфора нужно сжечь, чтобы получить 28,4 г оксида фосфора V?
27. Какой объём водорода потребуется на восстановление 10,6 г Fe3О4 до железа? (Реакция идет по схеме: МеxОy + Н2 → Ме + H2O.)
28. Какой объём кислорода потребуется для сгорания 8,8 г пропана? (Пропан: С3Н8.)
29. Какой объём кислорода требуется для полного сгорания 5 л этилена С2Н4?
30. Хватит ли 10 л кислорода для полного сгорания 17 л водорода?
32. Какой объём водорода может присоединиться к пропену массой 21 г?
34. Сколько миллилитров бензола (пл.= 0,78 г/мл) можно получить из 56 л ацетилена?
35. Какой объём водорода выделится, если в избыток спирта бросить 0,23 г натрия?
36. Сколько граммов диэтилового эфира можно получать из 23 г этанола?
37. Какой объем этилена должен вступить в реакцию, для того чтобы образовалось 500 мл спирта (пл. = 0,8 г/мл)?
38. Какой объём водорода может присоединиться к 22 г этаналя?
39. Какой объём спирта нужно окислить для получения 11 г этаналя? (плотность спирта равна 0,8 г/мл).
40. Какой объём хлора вступит в реакцию с уксусной кислотой массой 15 г, если в реакции должна получиться хлоруксусная кислота?
41. Какой объём водорода потребуется для гидрирования 0,2 моль триолеина? Где применяется полученный продукт?
42. Какой объём кислорода потребуется для полного сгорания 100 г уксусной кислоты?
Задачи по теме «Количественный состав смесей»
Состав смесей очень часто определяют в различных задачах, например в которых упоминаются растворы. Дело в том, что растворы — это однородные смеси. Задачи такого типа решаются по разному, но в любом случае следует помнить, что массу (объём) смеси нельзя подставлять в уравнение реакции и нельзя находить по уравнению реакции. По уравнению реакции можно найти только массу или объём компонента смеси.
Внимание! Если в условии упоминается смесь веществ или раствор, то составлять уравнения реакций нужно для всех компонентов смеси, указывая, идёт реакция или нет, а затем выполнять расчёт, оформляя решение задачи по каждому уравнению так, как показано выше.
Задачи такого типа можно условно разделить на две группы:
- задачи, в которых имеется хотя бы одна величина, которую можно сразу подставить в уравнение реакции и сделать необходимый расчёт;
- задачи, в которых таких данных нет.
Рассмотрим задачу первого типа.
Задача 20. Смесь меди и алюминия массой 10 г обработали раствором щёлочи. При этом выделилось 10 л газа (н. у.). Определить состав смеси в масс.% (массовые доли алюминия и меди в смеси).
Решение. Составим уравнения реакций:
Составим пропорцию и определим массу алюминия в смеси:
отсюда:
Ответ. ώ(Al) = 80 %, ώ(Сu) = 20 %.
В задачах второго типа в химическом превращении участвуют все компоненты смеси, в результате чего образуется смесь газов или других продуктов реакции. В этих случаях нужно прибегнуть к приёму, когда неизвестная величина (о ней спрашивается в задачи), принимается за известную, и обозначается А.
Задача 21. На нейтрализацию 20 г смеси гидрофосфата и дигидрофосфата натрия потребовалось 25 г 40 %-ного раствора NaOH. Определить состав смеси.
Составим уравнения реакций:
Определим количество вещества NaOH, которое содержится в растворе (можно считать, используя значение массы этого вещества, но более простые числа получаются, если используется величина «моль»):
Внимание: количество вещества щёлочи можно рассчитать сразу:
Теперь используем приём, который был отработан в задаче 16: пусть в смеси содержится а г дигидрофосфата, тогда гидрофосфата содержится (20 — а) г. Подставим эти величины в уравнения реакций и найдём значения х и у:
Поскольку х + у = 0,25 моль, получаем уравнение
Ответ. Смесь состояла из 11,34 г дигидрофосфата и 8,66 г гидрофосфата.
При получении растворов происходят не только физические процессы (дробление вещества, диффузия), но и взаимодействие вещества и растворителя. (Подробнее см. урок 6) Иногда в результате такого взаимодействия образуются совершенно новые вещества. В этом случае необходимо составить уравнение или схему происходящего процесса, а в расчётной формуле указывать, о каком веществе идёт речь.
Задача 22. В 100 мл воды растворили 2 г кальция. Определить массовую долю вещества в полученном растворе.
Решение. Поскольку кальций реагирует с водой, составим уравнение соответствующей реакции:
Таким образом, в растворе содержится не кальций, а гидроксид кальция. Отразим это в расчётной формуле:
Значит, нам нужно вычислить m[Са(ОН)2] по уравнению реакции:
а затем массу раствора:
Обратите внимание: массу полученного раствора вычисляют, исходя из массы исходных веществ или смесей, добавляя к ним массы тех веществ, которые были добавлены, и, вычитая массы веществ, которые вышли из сферы реакции в виде газа или осадка.
Ответ. Массовая доля щёлочи составит 3,6 %.
Задачи для самостоятельного решения
43. Через известковую воду пропустили 3 л воздуха. Выпало 0,1 г осадка. Определить объёмную долю (φ) углекислоты (CO2) в воздухе.
44. 20 г мела опустили в соляную кислоту. При этом выделилось 4 л газа. Определить массовую долю (ώ) карбоната кальция в образце этого мела.
45. В 200 г воды растворили 15 г оксида лития. Найти массовую долю веществ в полученном растворе.
46. 20 г смеси хлорида натрия и карбоната натрия обработали соляной кислотой. При этом выделилось 2,24 л газа. Установить состав смеси в масс.%.
47. Для превращения 2,92 г смеси гидроксида и карбоната натрия потребовалось 1,344 л хлороводорода. Вычислить состав смеси.
48. При растворении 3 г сплава меди и серебра в разбавленной азотной кислоте получено 7,34 г смеси нитратов. Определить процентный состав смеси и объём газов, полученных при прокаливании образовавшихся солей.
49. Сколько граммов 30 %-ной азотной кислоты нужно взять для нитрования 5,6 л пропана?
50. Какой, объём кислорода потребуется для сжигания смеси, состоящей из 8 г метана и 11,2 л этана?
51. Какой объём метана можно получить при нагревании 20 г смеси, содержащей 25 % ацетата натрия, остальное — щёлочь?
52. Через бромную воду пропустили смесь, которая состоит из 8 г метана и 5,6 л этена. Сколько граммов брома вступит в реакцию?
53. Какой объём природного газа, который содержит 98 % метана, потребуется для получения 52 кг ацетилена?
54. Из 10 г загрязнённого карбида кальция получили 2,24 л ацетилена. Чему равна массовая доля карбида кальция в исходном образце?
55. Какой объём кислорода нужен для сжигания смеси, которая состоит из 4 г метана, 10 л этена и 1 моль этина?
56. Сколько граммов 40 %-ной азотной кислоты нужно взять для получения 24,2 г нитробензола?
57. Сколько граммов азотной кислоты потребуется для нитрования 4,7 г фенола, если ώ(кислоты) в исходном растворе равна 30 %.
58. Сколько граммов 30 %-ной муравьиной кислоты нужно для растворения 2,7 г алюминия?
59. Сколько граммов 40 %-ного раствора КОН требуется для омыления (гидролиза) 3 моль тристеарина?
60. Рассчитать объём газа, который должен выделиться при брожении 160 г 20 %-ного раствора глюкозы (брожение прошло полностью).
61. На реакцию с 50 мл раствора анилина пошло 4,2 г брома. Рассчитать массовую долю анилина в исходном растворе (плотность раствора равна единице).
Задачи на «избыток–недостаток»
Такие задачи имеют в условии легко узнаваемый признак: указаны данные для обоих (или всех) реагирующих веществ. В этом случае нужно вначале определить количество (в моль) реагирующих веществ.
Затем по уравнению реакции определить молярные соотношения этих веществ и сделать вывод — какое из них находится в недостатке. Именно по этой величине (в моль!) ведутся последующие расчёты.
Задача 23. Какой объём водорода выделится при взаимодействии 5,4 г алюминия с 200 г 12 %-ного раствора серной кислоты? Чему равны массовые доли веществ в полученном растворе?
Решение. Определим массы и количество вещества для алюминия и серной кислоты:
Составим уравнение реакции:
Из уравнения реакции видно, что молярные соотношения исходных веществ 2 : 3, это означает, что 0,2 моль алюминия реагируют полностью с 0,3 моль серной кислоты, но этой кислоты имеется только 0,24 моль, т. е. недостаток. Укажем количество вещества серной кислоты (0,24 моль) в уравнении реакции и выполним расчёт по коэффициентам:
Теперь можно ответить на все вопросы задачи. Объём водорода рассчитать несложно, поскольку мы уже определили количество (моль) этого вещества.
Задание. Рассчитайте объём водорода.
Для того чтобы определить массовые доли растворённых веществ, нужно установить, какие вещества растворимы. В данном случае — это серная кислота и соль. Но серная кислота вступила в реакцию полностью. Массу соли рассчитайте по количеству вещества её.
Массу раствора всегда следует рассчитывать по формуле:
В данном случае:
Обратите внимание: следует добавить не ту массу алюминия, которую, добавили в раствор, а только ту, которая вступила в реакцию:
Задание. Рассчитайте массу раствора, предварительно рассчитав массу водорода.
Теперь рассчитаем массовую долю соли в полученном растворе:
Ответ. Массовая доля сульфата алюминия равна 13,4 %, а объём водорода 5,4 литра.
Анализ на «избыток — недостаток» позволяет установить и качественный и количественный состав реакционной смеси. Особенно важен этот анализ в случае, когда могут получаться кислые или основные соли.
Задача 24. Установить состав и массу солей, если в раствор, содержащий 28 г КОН пропустить: а) 15 л СО2; б) 10 л СО2; в) 2,5 л СО2.
При решении подобных задач следует учитывать, что при взаимодействии щелочей с многоосновными кислотами или их ангидридами могут получаться как средние, так и кислые соли. В данном случае, если молярное соотношение компонентов 1 : 1, то образуется кислая соль:
А если щёлочь в избытке (2 : 1 и более), то получается средняя соль:
Поэтому в начале нужно рассчитать количество вещества обоих компонентов:
В первом случае (а) ν (СО2) > ν (КОН), поэтому образуется только кислая соль:
В этом случае углекислый газ находится в избытке, а его избыток не может реагировать дальше. Значит, образуется только кислая соль в количестве 0,5 моль (считаем по «недостатку»).
В третьем случае (в) ν (СО2) < ν (КОН), т. е. когда КОН в избытке, происходят обе реакции. Легко видеть, что 0,11 моль СО2 полностью прореагирует с 0,11 · 2 = 0,22 моль КОН. Поэтому, фактически, идёт только вторая реакция:
и образуется только средняя соль в количестве 0,11 моль.
Во втором случае (б) идут обе реакции:
Здесь остаётся в избытке 0,5 – 0,45 = 0,05 моль КОН, который вступает в следующую стадию процесса:
В этой реакции остаётся 0,45 – 0,05 = 0,4 моль КНСО3 и образуется 0,05 моль К2СО3.
Внимание!
Теперь можно подвести итог, определив, когда нужно определять количества заданных веществ в моль, а когда — нет.
Определять количества заданных веществ в моль НЕ НУЖНО, когда:
- расчёт ведут по одному уравнению, по которому нужно определить массу или объём реагирующих веществ (см. задачу 18);
- расчёт ведут для газов, для которых известен объём (см. задачу 19).
Определять количества заданных веществ в моль НУЖНО, когда:
- определяют избыток (недостаток) реагирующих веществ (см. задачу 23);
- расчёт ведут по нескольким уравнениям. Для примера рассмотрим задачу 25.
Задача 25. Для нейтрализации раствора фенола в этаноле потребовалось 25 мл 40 %-ного раствора КОН (ρ = 1,4 г/мл). При взаимодействии исходного раствора с натрием может выделиться 6,72 л газа. Определить состав исходной смеси.
Известно, что со щелочами реагируют только фенолы:
Рассчитаем:
подставим полученную величину в уравнение реакции (1). Составим уравнения реакций с натрием и перенесём в уравнение (2) количество вещества фенола:
Но в реакциях (2) и (3) было получено 0,3 моль водорода (6,72 л : 22,4 л/моль = 0,3 моль), значит, в реакции (3) было получено 0,175 моль Н2. Теперь легко найти количественный состав смеси.
И, наконец, понятие моль необходимо при установлении формулы вещества (см. урок 31.4).
Задачи для самостоятельного решения
62. Через 200 мл 13 %-ного раствора гидроксида бария (пл. = 1,1 г/мл) пропустили 2 л хлороводорода. Определить цвет индикатора в полученном растворе и массу полученной соли.
63. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59 %-ной ортофосфорной кислоты. Определить состав и массовую долю соли в полученном растворе.
64. 8,4 г карбоната магния растворили в 250 мл 15 %-ного раствора серной кислоты (пл. = 1,08 г/мл). Определить массовую долю соли в полученном растворе.
65. 8,4 г цинка растворили в 70 г 120 %-ной соляной кислоты. Определить массовую долю соли в полученном растворе.
66. 25 л СО2 пропустили через 500 г 7,5 %-ного раствора едкого натра. Рассчитать массовые доли солей в полученном растворе.
67. Рассчитать массовую долю кислоты в растворе, полученном смешением 200 мл 15 %-ного раствора серной кислоты (пл. = 1,2 г/мл) с 150 мл 10 %-ного раствора нитрата бария (пл. = 1,04 г/мл).
68. Какой объём газа выделится, если 3,2 г меди растворить в 50 г 30 %-ной азотной кислоты? Чему равны массовые доли растворённых веществ в полученном растворе?
69. Твёрдое вещество, полученное при прокаливании карбоната кальция, растворили в воде. Через полученный раствор пропустили сернистый газ, в результате чего образовалась кислая соль массой 101 г. Определить массу карбоната и объёмы газов.
70. Смешали 200 г 12 %-ного раствора дигидрофосфата натрия и 150 г 5 %-ного раствора гидроксида натрия. Какие вещества содержатся в полученном растворе? Определить их массовые доли и реакцию среды раствора.
71. Через 100 мл 1,48 %-ного раствора сульфата меди (пл. = 1,08 г/мл) пропустили 300 мл сероводорода. Рассчитать массу осадка и массовую долю кислоты в полученном растворе.
72. Смешали 12 л бутена и 12 л кислорода. Смесь подожгли. Какой из этих газов и в каком объёме останется в смеси после реакции? Какой объём газа и жидкой воды образуется при этом?
73. Вычислить массу фенолята натрия, который образуется при взаимодействии 9,4 г фенола с 50 г 12 %-ного раствора гидроксида натрия.
74. Сколько граммов карбида кальция, который содержит 16 % примесей, нужно для получения 30 г уксусной кислоты?
Задачи на установление формулы вещества
Молекулярная формула вещества отражает его количественный состав. Количественный состав вещества, как и количественный состав раствора, выражают при помощи массовых долей элементов в нём:
Поскольку масса вещества в условии задачи, как правило, не указывается, применяем уже опробованный способ:
Пусть количество вещества равно 1 моль, тогда:
где n — число атомов этого элемента в веществе;
так как количество вещества равно 1 моль.
Получаем:
Задача 26. Определить массовую долю азота в нитрате аммония.
Решение. Поскольку в молекуле NH4NO3 два атома азота, а Мr(NH4NO3) = 80,
Ответ. ω(N) = 35 %.
Зная массовые доли химических элементов в веществе (элементный состав), можно определять молекулярную формулу неизвестного вещества.
Задача 27. Массовая доля фосфора в оксиде равна 43,66 %. Установить формулу этого оксида.
Решение. Из формулы (4) следует, что:
Поэтому отношение числа атомов n элементов данном в веществе равно:
Согласно этой формуле, нам нужно найти ώ(О) в этом оксиде:
Подставим все данные в формулу (5):
Полученные величины (они должны содержать 2 значащие цифры после запятой) разделим на наименьшее число:
Поскольку число атомов не может быть дробным, обе величины умножим на 2:
Ответ. Искомая формула — Р2О5.
Если в задаче не указано, какой элемент входит в состав оксида, но указана его валентность, задача упрощается.
Задача 28. Массовая доля трёхвалентного элемента в оксиде равна 70 %. Установить формулу этого оксида.
Решение. Формула оксида Э2О3:
Из выделенной жирным шрифтом пропорции получаем:
Это железо.
Ответ. Формула оксида Fe2O3.
Эту задачу можно решить и по формуле:
Подставив данные задачи, получаем:
если М(элемента) = х, то М(вещества) равна 2х + 48.
Решите теперь полученное уравнение:
Ответ. х = 56, значит, формула оксида Fe2O3.
Задача 29. Установить формулу углеводорода, если он содержит 12,19 % водорода. Плотность по водороду равна 41.
Решение. Сначала составим общую формулу углеводорода СхHу и рассчитаем массовую долю Н в нём:
где n — число атомов.
По данным задачи рассчитаем массовую долю углерода:
и молярную массу вещества:
Подставив эти данные в формулу, получаем:
Решив полученное уравнение, получаем n = 6 (атомов углерода).
Найдём массу атомов водорода:
Поэтому формула углеводорода С6H10. Если известен гомологический ряд вещества (общая формула этого ряда), то задача упрощается.
Задача 30. Установить формулу алкина, если он содержит 12,19 % водорода.
Решение. Сначала составим общую формулу алкина СnH2n–2 и рассчитаем массовую долю Н в нём:
Решив полученное уравнение, получаем n = 6 (атомов углерода). Поэтому формула алкина С6H10.
Аналогично задаче 27 решаются все задачи, в которых дан элементный состав вещества, независимо от числа элементов.
Задача 31. Установить молекулярную формулу вещества, если оно содержит 54,4 % С, 36,4 % О и 9,1 % Н; D(H2) = 44.
Соотношение числа атомов n элементов в любом веществе равно:
Подставим данные задачи в эту формулу:
Полученные величины (они должны содержать 2 значащие цифры после запятой) разделим на наименьшее число (2,275):
Получаем состав: С2Н4О. М(С2Н4О) = 44 г/моль, а реальная — 88 г/моль, значит, все индексы следует удвоить. Молекулярная формула вещества С4Н8О2. Это может быть или одноосновная предельная кислота, или её эфир.
Задача 32. При полном сгорании 4,6 г органического вещества получили 8,8 г углекислого газа и 5,4 г воды. Найти молекулярную формулу вещества.
Решение. Определим количества и массы веществ, полученных при сгорании:
поскольку 1 молекула воды (1 моль) содержит два атома (2 моль) этого элемента, поэтому m(Н) = 0,6 г. Суммарная масса этих элементов — 3,0 г. Но сгорело 4,6 г вещества, значит, оно содержит кислород (1,6 г). ν(О) = 0,1 моль.
Составим уравнение реакции горения и подставим полученные данные в уравнение реакции:
получаем молярные соотношения продуктов реакции:
Теперь определим соотношение атомов элементов в исходном веществе, которое равно молярному соотношению элементов в этом веществе:
Молекулярная формула вещества С2Н6О.
Этот способ определения молекулярной формулы оптимален, когда неизвестна молекулярная масса вещества, поскольку, если молярная масса дана и задана в задаче через плотность или иначе, то задача решается «в лоб» — по уравнению химической реакции.
Задача 33. При полном сгорании 2,9 г органического вещества получили 3,36 л углекислого газа и 2,7 г воды. Плотность по водороду равна 29.
Решение. Сначала рассчитаем молярную массу газа:
Теперь составим схему реакции, обозначив формулу исходного вещества СхНу
Из выделенных параметров составим пропорции, сначала для СО2:
а затем для воды:
Решив обе, получаем: х = 3, у = 6, т. е. искомая формула С3Н6.
Теперь нужно проверить соответствие полученной формулы заданной молярной массе: М(С3Н6) = 42 г/моль, что явно меньше 58 г/моль. Значит, в состав исходного вещества входит кислород. Его молярная масса: М(О) = 58 – 42 = 16, т. е. в состав вещества входит 1 атом кислорода.
Искомая формула С3Н6О.
Задача 34. Установить формулу алкена, если 11,2 г его при взаимодействии с бромоводородом образует 27,4 г бромида с положением брома у третичного атома углерода.
Решение. Вначале рассчитаем массу бромоводорода, согласно закону сохранения массы:
и составим уравнение реакции, используя общую формулу алкенов:
откуда найдём количество вещества алкена:
Теперь легко определить молярную массу неизвестного вещества:
Определим молярную массу неизвестного вещества через n:
отсюда: 14n = 56; n = 4.
Ответ. Состав искомого алкена С4Н8; это 2-метилпропен.
Задачи для самостоятельного решения
75. Оксид неметалла (V), содержащего 56,3 % кислорода, растворили в воде. Определить массовую долю вещества в этом растворе, если исходный оксид был получен из 3,1 г неметалла.
76. Какой щелочной металл образует сульфат с массовой долей кислорода 23,9 %?
77. Плотность паров алкана равна 3,214 г/л. Определите его молекулярную массу. Какую формулу имеет этот углеводород?
78. Один литр алкена имеет массу 1,25 г. Определите молярную массу этого вещества. Составьте его графическую формулу.
79. Углеводород с плотностью по гелию 28,5 содержит 15,8 % водорода. Установить его формулу.
80. При сгорании 2,24 л углеводорода получили 8,96 л СО2 и 7,2 мл воды. Определить формулу углеводорода.
81. Органическое вещество содержит 37,7 % С, 6,3 % Н и 56 % Сl; 6,35 г его паров занимает объём 11,2 л. При гидролизе этого соединения образуется вещество, которое при восстановлении даёт вторичный спирт. Определить состав и строение исходного вещества.
82. При сгорании 1 л газообразного углеводорода, обесцвечивающего раствор перманганата калия, расходуется 4,5 л кислорода и образуется 3 л СО2. Определить формулу углеводорода.
83. Установить формулу вещества, при сгорании 4,6 г которого образуется 4,48 л СО2 и 5,4 мл воды. Плотность паров этого вещества по водороду равна 23.
84. При взаимодействии 16 г одноатомного спирта с натрием выделилось 5,6 л водорода. Какой спирт был взят для реакции?
85. Одноосновная кислота имеет состав: ώ(С) = 40 %; ώ(Н) = 6,67 %; ώ (О) = 53,33 %. Плотность паров её по аргону 1,5. Какая это кислота?
86. Определить строение сложного эфира предельной α-аминоуксусной кислоты, если известно, что он содержит 15,73 % азота.
87. Имеется смесь четырёх изомеров, каждый из которых реагирует с НСl и содержит в молекуле 23,7 % азота. Определить строение этих соединений и массу исходной смеси, если известно, что вещества предельные, а при сгорании смеси образуется 4,48 л азота.
Задачи, в которых учитывается «выход» полученного вещества
Реальные химические процессы никогда не происходят со 100 %-ным выходом, который рассчитывается по уравнению реакции. Например, вы рассчитали, что должно выделиться 100 л газа, а реально его получено 60 л. Значит, выход (ή) в этой реакции равен:
Выход продукта выражается в долях единицы или в процентах. В нашем примере:
Задача 35. Рассчитать массы исходных веществ, необходимых для получения 91 г нитрида кальция, что составляет 80 % от теоретически возможного.
Следует помнить, что в уравнение химической реакции можно подставлять данные только теоретического выхода. Поэтому рассчитаем его (Т):
Подставим полученную величину в уравнение реакции и найдём искомые величины:
Задание. Остальной расчёт сделайте самостоятельно.
Задачи для самостоятельного решения
88. Какой объем этилена можно получить из 92 граммов спирта? Выход составляет 80 % от теоретически возможного количества.
89. Сколько граммов хлорвинила можно получить из 56 л ацетилена, если выход составляет 80 %?
90. 46 г глицерина обработали азотной кислотой. Рассчитайте массу полученного вещества, если выход составляет 40 %. Где применяется это вещество?
91. Из 56 л ацетилена получили 88 г этаналя. Рассчитайте выход в % от теоретически возможного.
92. Сколько граммов спирта нужно взять, чтобы получить 7,4 г этилформиата, что составляет 80 % от теоретического выхода?
93. При нагревании 2,84 г иодметана с 0,69 г натрия получено 179,2 мл углеводорода. Определить выход в % от теоретически возможного.
94. 184 г толуола прореагировали с 1,5 моль хлора в присутствии хлорида алюминия. Реакция протекала с выходом 90 % от теоретически возможного. Вычислить объём полученного газа, водный раствор которого не окрашивает раствор фенолфталеина.
95. При нагревании 28,75 мл алканола (ρ = 0,8 г/мл) с концентрированной серной кислотой, получили газ, который может присоединить 8,96 л водорода. Определить строение спирта, если выход газа составляет 80 %.
96. Какой объём 40 %-ного формалина с плотностью 1,1 г/мл можно получить из 48 мл метанола? Плотность спирта 0,8 г/мл. Выход 80 %.
97. Сколько граммов эфира можно получить при взаимодействии 30 г уксусной кислоты и 30 г этанола с выходом 30 %?
Задачи на смеси и сплавы на ЕГЭ по химии
-
Типичные заблуждения и ошибки при решении задач на смеси.
-
Необходимые теоретические сведения.
-
Электрохимический ряд напряжений металлов.
-
Реакции металлов с кислотами.
-
Продукты восстановления азотной кислоты.
-
Продукты восстановления серной кислоты.
-
Реакции металлов с водой и со щелочами.
-
Примеры решения задач.
-
Решение примера 1.
-
Решение примера 2.
-
Решение примера 4.
-
Решение примера 5.
-
Задачи для самостоятельного решения.
-
1. Несложные задачи с двумя компонентами смеси.
-
2. Задачи более сложные.
-
3. Три металла и сложные задачи.
-
Ответы и комментарии к задачам для самостоятельного решения.

Задачи на смеси и сплавы — очень частый вид задач на ЕГЭ по химии. Они требуют чёткого представления о том, какие из веществ вступают в предлагаемую в задаче реакцию, а какие нет.
О смеси мы говорим тогда, когда у нас есть не одно, а несколько веществ (компонентов), «ссыпанных» в одну емкость. Вещества эти не должны взаимодействовать друг с другом.
к оглавлению ▴
Типичные заблуждения и ошибки при решении задач на смеси.
- Попытка записать оба вещества в одну реакцию. Вот одна из распространенных ошибок:
«Смесь оксидов кальция и бария растворили в соляной кислоте…»Многие выпускники пишут уравнение реакции так:Это ошибка. Ведь в этой смеси могут быть любые количества каждого оксида!
А в приведенном уравнении предполагается, что их равное количество. - Предположение, что их мольное соотношение соответствует коэффициентам в уравнениях реакций. Например:
Количество цинка принимается за
, а количество алюминия — за
(в соответствии с коэффициентом в уравнении реакции). Это тоже неверно. Эти количества могут быть любыми и они никак между собой не связаны.
- Попытки найти «количество вещества смеси», поделив её массу на сумму молярных масс компонентов.Это действие вообще никакого смысла не имеет. Каждая молярная масса может относиться только к отдельному веществу.
Часто в таких задачах используется реакция металлов с кислотами. Для решения таких задач надо точно знать, какие металлы с какими кислотами взаимодействуют, а какие — нет.
к оглавлению ▴
Необходимые теоретические сведения.
Способы выражения состава смесей.
- Массовая доля компонента в смеси— отношение массы компонента к массе всей смеси. Обычно массовую долю выражают в %, но не обязательно.
где
– «омега», массовая доля компонента в смеси,
– масса компонента,
– масса смеси
- Мольная доля компонента в смеси — отношение числа моль (количества вещества) компонента к суммарному числу моль всех веществ в смеси. Например, если в смесь входят вещества
,
и
, то:
где
– «хи», мольная доля компонента в смеси,
– число моль (количество вещества) компонента А
- Мольное соотношение компонентов.Иногда в задачах для смеси указывается мольное соотношение её составляющих. Например:
- Объёмная доля компонента в смеси (только для газов)— отношение объёма вещества А к общему объёму всей газовой смеси.
где
– «фи», объёмная доля компонента в смеси,
– объём вещества А,
– общий объём всей газовой смеси
к оглавлению ▴
Электрохимический ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au
Реакции металлов с кислотами.
- С минеральными кислотами, к которым относятся все растворимые кислоты (кроме азотной и концентрированной серной, взаимодействие которых с металлами происходит по-особому), реагируют только металлы, в электрохимическом ряду напряжений находящиеся до (левее) водорода.
- При этом металлы, имеющие несколько степеней окисления (железо, хром, марганец, кобальт), проявляют минимальную из возможных степень окисления — обычно это
.
- Взаимодействие металлов с азотной кислотой приводит к образованию, вместо водорода, продуктов восстановления азота, а с серной концентрированной кислотой — к выделению продуктов восстановления серы. Так как реально образуется смесь продуктов восстановления, часто в задаче есть прямое указание на конкретное вещество.
к оглавлению ▴
Продукты восстановления азотной кислоты.
| Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот | ||||
| Неактивные металлы (правее алюминия включительно) + конц. Кислота; Неметаллы + конц. Кислота |
Активные металлы (левее Mg включительно) + конц. Кислота | Активные металлы (левее Mg включительно) + разб Кислота | Металлы от алюминия до железа включительно + разб. кислота | Неактивные металлы (правее кобальта включительно) + разб. Кислота |
| Пассивация: с холодной концентрированной азотной кислотой не реагируют:
|
||||
| Не реагируют с азотной кислотой ни при какой концентрации:
|
к оглавлению ▴
Продукты восстановления серной кислоты.
| Неактивные металлы (правее железа) + конц. кислота Неметаллы + конц. Кислота |
Щелочные металлы до магния включительно + концентрированная кислота. |
| Пассивация: с холодной концентрированной серной кислотой не реагируют:
|
|
| Не реагируют с серной кислотой ни при какой концентрации:
|
к оглавлению ▴
Реакции металлов с водой и со щелочами.
- В воде при комнатной температуре растворяются только металлы, которым соответствуют растворимые основания (щелочи). Это щелочные металлы (
), а также металлы IIA группы:
. При этом образуется щелочь и водород. При кипячении в воде также можно растворить магний.
- В щелочи могут раствориться только амфотерные металлы: алюминий, цинк и олово. При этом образуются гидроксокомплексы и выделяется водород.
Внимание! Многие ошибки в решении задач ЕГЭ по химии связаны с тем, что школьники плохо владеют математикой. Специально для вас — материал о том, как решать задачи на проценты, сплавы и смеси.
к оглавлению ▴
Примеры решения задач.
Рассмотрим три примера задач, в которых смеси металлов реагируют с соляной кислотой:
Пример 1. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси.
В первом примере медь не реагирует с соляной кислотой, то есть водород выделяется при реакции кислоты с железом. Таким образом, зная объём водорода, мы сразу сможем найти количество и массу железа. И, соответственно, массовые доли веществ в смеси.
к оглавлению ▴
Решение примера 1.
- Находим количество водорода:
моль.
- По уравнению реакции:
Количество железа тоже 0,25 моль. Можно найти его массу:
г.
- Теперь можно рассчитать массовые доли металлов в смеси:
Пример 2. При действии на смесь алюминия и железа массой 11 г избытком соляной кислоты выделилось 8,96 л газа (н.у.). Определить массовые доли металлов в смеси.
Во втором примере в реакцию вступают оба металла. Здесь уже водород из кислоты выделяется в обеих реакциях. Поэтому прямым расчётом здесь нельзя воспользоваться. В таких случаях удобно решать с помощью очень простой системы уравнений, приняв за — число моль одного из металлов, а за
— количество вещества второго.
к оглавлению ▴
Решение примера 2.
- Находим количество водорода:
моль.
- Пусть количество алюминия —
моль, а железа
моль. Тогда можно выразить через
и
количество выделившегося водорода:
- Нам известно общее количество водорода:
моль. Значит,
(это первое уравнение в системе).
- Для смеси металлов нужно выразить массычерез количества веществ.
Значит, масса алюминия
масса железа
а масса всей смеси
(это второе уравнение в системе).
- Итак, мы имеем систему из двух уравнений:
Решать такие системы гораздо удобнее методом вычитания, домножив первое уравнение на 18:и вычитая первое уравнение из второго:
- Дальше находим массы металлов и их массовые доли в смеси:
соответственно,
Пример 3. 16 г смеси цинка, алюминия и меди обработали избытком раствора соляной кислоты. При этом выделилось 5,6 л газа (н.у.) и не растворилось 5 г вещества. Определить массовые доли металлов в смеси.
В третьем примере два металла реагируют, а третий металл (медь) не вступает в реакцию. Поэтому остаток 5 г — это масса меди. Количества остальных двух металлов — цинка и алюминия (учтите, что их общая масса 16 − 5 = 11 г) можно найти с помощью системы уравнений, как в примере №2.
Ответ к Примеру 3: 56,25% цинка, 12,5% алюминия, 31,25% меди.
Следующие три примера задач (№4, 5, 6) содержат реакции металлов с азотной и серной кислотами. Главное в таких задачах — правильно определить, какой металл будет растворяться в ней, а какой не будет.
Пример 4. На смесь железа, алюминия и меди подействовали избытком холодной концентрированной серной кислоты. При этом часть смеси растворилась, и выделилось 5,6 л газа (н.у.). Оставшуюся смесь обработали избытком раствора едкого натра. Выделилось 3,36 л газа и осталось 3 г не растворившегося остатка. Определить массу и состав исходной смеси металлов.
В этом примере надо помнить, что холодная концентрированная серная кислота не реагирует с железом и алюминием (пассивация), но реагирует с медью. При этом выделяется оксид серы (IV).
Со щелочью реагирует только алюминий — амфотерный металл (кроме алюминия, в щелочах растворяются ещё цинк и олово, в горячей концентрированной щелочи — ещё можно растворить бериллий).
к оглавлению ▴
Решение примера 4.
- С концентрированной серной кислотой реагирует только медь, число моль газа:
моль
(конц.)
(не забудьте, что такие реакции надо обязательно уравнивать с помощью электронного баланса)Так как мольное соотношение меди и сернистого газа
, то меди тоже
моль.
Можно найти массу меди:г.
- В реакцию с раствором щелочи вступает алюминий, при этом образуется гидроксокомплекс алюминия и водород:
- Число моль водорода:
моль,мольное соотношение алюминия и водорода
и, следовательно,
моль.
Масса алюминия:
г
- Остаток — это железо, массой 3 г. Можно найти массу смеси:
г.
- Массовые доли металлов:
Пример 5. 21,1 г смеси цинка и алюминия растворили в 565 мл раствора азотной кислоты, содержащего 20 мас. % НNО3 и имеющего плотность 1,115 г/мл. Объем выделившегося газа, являющегося простым веществом и единственным продуктом восстановления азотной кислоты, составил 2,912 л (н.у.). Определите состав полученного раствора в массовых процентах. (РХТУ)
В тексте этой задачи чётко указан продукт восстановления азота — «простое вещество». Так как азотная кислота с металлами не даёт водорода, то это — азот. Оба металла растворились в кислоте.
В задаче спрашивается не состав исходной смеси металлов, а состав получившегося после реакций раствора. Это делает задачу более сложной.
к оглавлению ▴
Решение примера 5.
- Определяем количество вещества газа:
моль.
- Определяем массу раствора азотной кислоты, массу и количество вещества растворенной
:
Обратите внимание, что так как металлы полностью растворились, значит — кислоты точно хватило (с водой эти металлы не реагируют). Соответственно, надо будет проверить, не оказалась ли кислота в избытке, и сколько ее осталось после реакции в полученном растворе.
- Составляем уравнения реакций (не забудьте про электронный баланс) и, для удобства расчетов, принимаем за
— количество цинка, а за
— количество алюминия. Тогда, в соответствии с коэффициентами в уравнениях, азота в первой реакции получится
моль, а во второй —
моль:
- Тогда, учитывая, что масса смеси металлов
г, их молярные массы —
г/моль у цинка и
г/моль у алюминия, получим следующую систему уравнений:
– количество азота
– масса смеси двух металлов
Решать эту систему удобно, домножив первое уравнение на 90 и вычитая первое уравнение их второго.
значит,
моль
значит,
моль
Проверим массу смеси:
г.
- Теперь переходим к составу раствора. Удобно будет переписать реакции ещё раз и записать над реакциями количества всех прореагировавших и образовавшихся веществ (кроме воды):
- Следующий вопрос: осталась ли в растворе азотная кислота и сколько её осталось?По уравнениям реакций, количество кислоты, вступившей в реакцию:
моль,т.е. кислота была в избытке и можно вычислить её остаток в растворе:
моль.
- Итак, в итоговом растворесодержатся:
нитрат цинка в количестве
моль:
г
нитрат алюминия в количестве
моль:
г
избыток азотной кислоты в количестве
моль:
г
- Какова масса итогового раствора?Вспомним, что масса итогового раствора складывается из тех компонентов, которые мы смешивали (растворы и вещества) минус те продукты реакции, которые ушли из раствора (осадки и газы):
Масса
нового
раствора= Сумма масс
смешиваемых
растворов и/или веществ— Масса осадков — Масса газов Тогда для нашей задачи:
= масса раствора кислоты + масса сплава металлов — масса азота
г
г
- Теперь можно рассчитать массовые доли веществ в получившемся растворе:
Пример 6. При обработке г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось
л газа (н.у.), а при действии на эту смесь такой же массы избытка хлороводородной кислоты —
л газа (н.у.). Определите состав исходной смеси. (РХТУ)
При решении этой задачи надо вспомнить, во-первых, что концентрированная азотная кислота с неактивным металлом (медь) даёт , а железо и алюминий с ней не реагируют. Соляная кислота, напротив, не реагирует с медью.
к оглавлению ▴
Задачи для самостоятельного решения.
1. Несложные задачи с двумя компонентами смеси.
1-1. Смесь меди и алюминия массой г обработали
-ным раствором азотной кислоты, при этом выделилось
л газа (н. у.). Определить массовую долю алюминия в смеси.
1-2. Смесь меди и цинка массой г обработали концентрированным раствором щелочи. При этом выделилось
л газа (н.y.). Вычислите массовую долю цинка в исходной смеси.
1-3. Смесь магния и оксида магния массой г обработали достаточным количеством разбавленной серной кислоты. При этом выделилось
л газа (н.у.). Найти массовую долю магния в смеси.
1-4. Смесь цинка и оксида цинка массой г растворили в разбавленной серной кислоте. Получили сульфат цинка массой
г. Вычислите массовую долю цинка в исходной смеси.
1-5. При действии смеси порошков железа и цинка массой г на избыток раствора хлорида меди (II) образовалось
г меди. Определите состав исходной смеси.
1-6. Какая масса -ного раствора соляной кислоты потребуется для полного растворения
г смеси цинка с оксидом цинка, если при этом выделился водород объемом
л (н.у.)?
1-7. При растворении в разбавленной азотной кислоте г смеси железа и меди выделяется оксид азота (II) объемом
л (н.у.). Определите состав исходной смеси.
1-8. При растворении г смеси железных и алюминиевых опилок в
-ном растворе соляной кислоты (
г/мл) выделилось
л водорода (н.у.). Найдите массовые доли металлов в смеси и определите объем израсходованной соляной кислоты.
к оглавлению ▴
2. Задачи более сложные.
2-1. Смесь кальция и алюминия массой г прокалили без доступа воздуха с избытком порошка графита. Продукт реакции обработали разбавленной соляной кислотой, при этом выделилось
л газа (н.у.). Определите массовые доли металлов в смеси.
2-2. Для растворения г сплава магния с алюминием использовано
мл
-ного раствора серной кислоты (
г/мл). Избыток кислоты вступил в реакцию с
мл раствора гидрокарбоната калия с концентрацией
моль/л. Определите массовые доли металлов в сплаве и объем газа (н.у.), выделившегося при растворения сплава.
2-3. При растворении г смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора досуха образовалось
г железного купороса — гептагидрата сульфата железа (II). Определите количественный состав исходной смеси.
2-4. При взаимодействии железа массой г с хлором образовалась смесь хлоридов железа (II) и (III) массой
г. Вычислите массу хлорида железа (III) в полученной смеси.
2-5. Чему была равна массовая доля калия в его смеси с литием, если в результате обработки этой смеси избытком хлора образовалась смесь, в которой массовая доля хлорида калия составила ?
2-6. После обработки избытком брома смеси калия и магния общей массой г масса полученной смеси твердых веществ оказалась равной
г. Эту смесь обработали избытком раствора гидроксида натрия, после чего осадок отделили и прокалили до постоянной массы. Вычислите массу полученного при этом остатка.
2-7. Смесь лития и натрия общей массой г окислили избытком кислорода, всего было израсходовано
л (н.у.). Полученную смесь растворили в
г
-го раствора серной кислоты. Вычислите массовые доли веществ в образовавшемся растворе.
2-8. Сплав алюминия с серебром обработали избытком концентрированного раствора азотной кислоты, остаток растворили в уксусной кислоте. Объемы газов, выделившихся в обеих реакциях измеренные при одинаковых условиях, оказались равными между собой. Вычислите массовые доли металлов в сплаве.
к оглавлению ▴
3. Три металла и сложные задачи.
3-1. При обработке г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось
л газа. Такой же объем газа выделяется и при обработке этой же смеси такой же массы избытком разбавленной серной кислоты (н.у.). Определите состав исходной смеси в массовых процентах.
3-2. г смеси железа, меди и алюминия, взаимодействуя с избытком разбавленной серной кислоты, выделяет
л водорода (н.у.). Определите состав смеси в массовых процентах, если для хлорирования такой же навески смеси требуется
л хлора (н.у.).
3-3. Железные, цинковые и алюминиевые опилки смешаны в мольном отношении (в порядке перечисления).
г такой смеси обработали избытком хлора. Полученную смесь хлоридов растворили в
мл воды. Определить концентрации веществ в полученном растворе.
3-4. Сплав меди, железа и цинка массой г (массы всех компонентов равны) поместили в
раствор соляной кислоты массой
г. Рассчитайте массовые доли веществ в получившемся растворе.
3-5. г смеси, состоящей из кремния, алюминия и железа, обработали при нагревании избытком гидроксида натрия, при этом выделилось
л газа (н.у.). При действии на такую массу смеси избытка соляной кислоты выделяется
л газа (н.у.). Определите массы веществ в исходной смеси.
3-6. При обработке смеси цинка, меди и железа избытком концентрированного раствора щелочи выделился газ, а масса нерастворившегося остатка оказалась в раза меньше массы исходной смеси. Этот остаток обработали избытком соляной кислоты, объем выделившегося газа при этом оказался равным объему газа, выделившегося в первом случае (объемы измерялись при одинаковых условиях). Вычислите массовые доли металлов в исходной смеси.
3-7. Имеется смесь кальция, оксида кальция и карбида кальция с молярным соотношением компонентов (в порядке перечисления). Какой минимальный объем воды может вступить в химическое взаимодействие с такой смесью массой
г?
3-8. Смесь хрома, цинка и серебра общей массой г обработали разбавленной соляной кислотой, масса нерастворившегося остатка оказалась равной
г. Раствор после отделения осадка обработали бромом в щелочной среде, а по окончании реакции обработали избытком нитрата бария. Масса образовавшегося осадка оказалась равной
г. Вычислите массовые доли металлов в исходной смеси.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1-1. (алюминий не реагирует с концентрированной азотной кислотой);
1-2. (в щелочи растворяется только амфотерный металл — цинк);
1-3. ;
1-4. ;
1-5. (железо, вытесняя медь, переходит в степень окисления
);
1-6. г;
1-7. (железо в азотной кислоте переходит в
);
1-8. (железо в реакции с соляной кислотой переходит в
);
мл раствора
.
2-1. (кальций и алюминий с графитом (углеродом) образуют карбиды
и
; при их гидролизе водой или
выделяются, соответственно, ацетилен
и метан
);
2-2. ;
2-3. (гептагидрат сульфата железа —
);
2-4. г;
2-5. ;
2-6. г;
2-7. (при окислении кислородом лития образуется его оксид, а при окислении натрия — пероксид
, который в воде гидролизуется до пероксида водорода и щелочи);
2-8. ;
3-1. ;
3-2. ;
3-3. (железо в реакции с хлором переходит в степень окисления
);
3-4. (не забудьте, что медь не реагирует с соляной кислотой, поэтому её масса не входит в массу нового раствора);
3-5. г
г
г
(кремний — неметалл, он реагирует с раствором щелочи, образуя силикат натрия и водород; с соляной кислотой он не реагирует);
3-6. ;
3-7. мл;
3-8. (хром при растворении в соляной кислоте переходит в хлорид хрома (II), который при действии брома в щелочной среде переходит в хромат; при добавлении соли бария образуется нерастворимый хромат бария)
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Задачи на смеси и сплавы на ЕГЭ по химии» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.05.2023
Цель работы:
Определить
содержание отдельных компонентов
контрольной смеси методом внутренней
нормализации без учета калибровочных
коэффициентов (методом простой
нормировки).
Сущность работы:
Для определения
количественного состава анализируемой
смеси используют зависимость между
содержанием данного компонента в смеси
и размерами соответствующего ему пика
на хроматограмме. Чаще всего количественную
оценку хроматограмм производят по
площади пиков S.
Упрощенный метод измерения площади
пика состоит в умножении высоты пика
на его ширину, измеренную на расстоянии,
равном половине высоты.
Метод простой
нормировки основан на предположении,
что вещества, независимо от их строения,
взятые в одинаковом количестве, дают
одну и ту же площадь пика. Это приближено
выполняется, если вещества химически
сходны, а в качестве газа – носителя
применяется газ, теплопроводность
которого приблизительно на порядок
отличается от теплопроводности
анализируемых веществ (детектор –
катарометр). Такими обычно являются
водород и гелий.
Площадь каждого
пика рассчитывают путем умножения
высоты пика на его ширину, измеренную
на полувысоте пика:
2.12)
Расчет содержания
данного компонента в анализируемой
смеси проводят по формуле:

где ωi
– массовая доля
-го
компонента, %;– площадь пика
-го
компонента, мм2;
– сумма площадей пиков всех компонентов,
мм2.
Метод простой
нормировки не дает точных результатов
в случае различной чувствительности
детектора по отношению к разделяемым
компонентам смеси.
Выполнение
работы: На
газовом хроматографе снимают 2–3
воспроизводимых хроматограммы контрольной
смеси. Рассчитывают площади пиков
отдельных компонентов и определяют
содержание компонентов в смеси. Результаты
оформляют в виде таблицы.
Таблица
2.2
Расчет
состава смеси
|
№ |
Компонент |
Высота |
Ширина мм |
Площадь мм2 |
Содержание |
|
1 |
|||||
|
2 |
|||||
|
3 |
Работа 3. Определение критериев разделения
Цель работы:
1. Определить
степень разделения 2-х компонентов и
селективность жидкой фазы на 2-х колонках.
2. Определить
эффективность хроматографических
колонок (число теоретических тарелок
и ВЭТТ) с различными жидкими фазами.
3. Определить
критерии разделения и сравнить две
хроматографические колонки по
эффективности и селективности.
Сущность работы.
Для оценки
хроматографического разделения
компонентов пользуются тремя группами
критериев.
1.
Первая группа критериев зависит от
природы сорбента и сорбата (разделяемых
компонентов), от температуры и характеризует
качество разделения в зависимости от
различия абсорбируемости или растворимости
разделяемых веществ. К критериям этой
группы относятся степень разделения
и критерий
селективности жидкой фазы КС,
которые определяется соотношениями:


где
,
,
–объем, время, расстояние удерживания
разделяемых компонентов смеси,
соответственно;,
,
– объем, время, расстояние удерживания
несорбирующегося компонента смеси.
Если
= 1, то вещества не разделяются.
Для неразделяемых
веществ КС
= 0, при полном
разделении значение КС
→ 1.
Селективность жидкой фазы не зависит
от размеров колонки, природы газа-носителя,
от количества введенной в колонку пробы.
2.
Вторая группа критериев обусловлена
кинетическими и диффузионными факторами,
которые вызывают размывание
хроматографических полос. К этим факторам
относятся: размеры колонки, природа
газа-носителя, скорость потока, температура
колонки, количество вводимой в колонку
пробы и др. Совокупность параметров
хроматографического опыта, входящих
во вторую группу, от которых так же, как
от селективности, зависит качество
разделения, можно назвать общим термином
– эффективность.
Эффективность
хроматографической колонки выражается
числом теоретических тарелок N
или высотой, эквивалентной теоретической
тарелке, (ВЭТТ), H.
Процесс разделения
смеси веществ в хроматографической
колонке подобен разделению на тарельчатых
ректификационных колонках. По аналогии
с теорией дистилляционных колонн
хроматографическая колонка мысленно
разбивается на ряд последовательных
теоретических ступеней – тарелок, через
которые периодически проходят порции
газа. Предполагается, что за время
нахождения порции газа на тарелке
успевает установиться равновесие между
подвижной и неподвижной фазами для всех
компонентов. Таким образом, хроматографический
процесс многоступенчатый и состоит из
большого числа актов сорбции и десорбции
или растворения и испарения, а сама
колонка рассматривается как система,
состоящая из совокупности многих
ступеней – тарелок.
Длина элементарного
участка колонки, на котором достигается
состояние равновесия между концентрацией
вещества в подвижной и неподвижной
фазах, называется условно высотой,
эквивалентной теоретической тарелке
(ВЭТТ).
Существует простая
зависимость:
(2.16),
где L
–длина хроматографической колонки,
см;
N
–число теоретических тарелок
Число теоретических
тарелок связано с параметрами
хроматографического пика соотношениями:

где
,
,
– приведенные (исправленнные) расстояние,
мм, время, мин, объем удерживания, мл,
соответственно;– ширина хроматографического полупика
(ширина пика, измеренная на ½ его высоты),
мм.
Число теоретических
тарелок зависит от длины колонки и
свойств сорбента. ВЭТТ зависит только
от типа сорбента и характера его упаковки
в колонке. Чем больше N
и меньше ВЭТТ для колонки, тем эффективнее
происходит разделение на колонке.
Выполнение
работы: На
газовом хроматографе в идентичных
условиях, но с разными хроматографическими
колонками поочередно снимают хроматограммы
полученной контрольной смеси. Условия
хроматографирования определяются
природой анализируемой смеси. На
полученных хроматограммах измеряют
расстояния удерживания пиков отдельных
компонентов смеси и индивидуальных
веществ. Рассчитывают их объемы
удерживания (времена удерживания). Затем
рассчитывают число теоретических
тарелок N,
высоту,
эквивалентную теоретической тарелке
Н, критерии
разделения
иКС
и оценивают
эффективность колонок. Результаты
оформляют в виде таблицы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Количественный состав — смесь
Cтраница 1
Количественный состав смеси выражают в объемных процентах.
[1]
Количественный состав смеси ( в объемн. Площадь каждого пика рассчитывают по произведению высоты пика ( расстояние от максимума пика до его основания) на ширину пика на половине его высоты. Рассчитанную площадь пика каждого компонента умножают на коэффициент чувствительности для данного компонента. Сумму всех площадей принимают за 100 объемн.
[3]
Количественный состав смеси ( в %) вычисляют по площадям пиков.
[5]
Количественный состав смеси ( в %) рассчитывают по методу внутреннего стандарта — по площадям пиков ( см. стр.
[7]
Количественный состав смеси выражают в объемных процентах.
[8]
Определить количественный состав смеси бензол — гексан — циклогексан методами: а) абсолютной калибровки, б) внутренней нормировки, в) метки.
[9]
Определить количественный состав смеси бензол — гексан — циклогексан методами: а) абсолютной калибровки; б) метки; в) внутренней нормировки.
[10]
Определяют количественный состав смеси. Результаты анализа сводят в таблицу.
[11]
Определение количественного состава смеси основано на допущении, что интенсивность сигнала компонента пропорциональна содержанию его в смеси. В качестве меры интенсивности обычно принимается площадь пиков.
[12]
Измерение количественного состава смесей из двух и трех каучуков в резинах можно использовать [41] для оценки равномерности их распределения в образце. Для этого в разных точках резинового массива необходимо отобрать не менее 10 проб; несовпадение состава проб, отобранных от одного образца, свидетельствует о неравномерном распределении каучуков. Аналогичная методика применяется для контроля процессов смешения при приготовлении резиновой смеси.
[13]
Определение количественного состава смеси основано на допущении, что интенсивность сигнала компонента пропорциональна содержанию его в смеси. В качестве меры интенсивности обычно принимается площадь пиков.
[14]
Страницы:
1
2
3
4