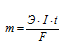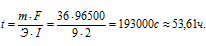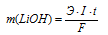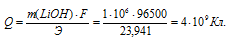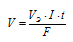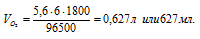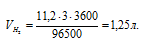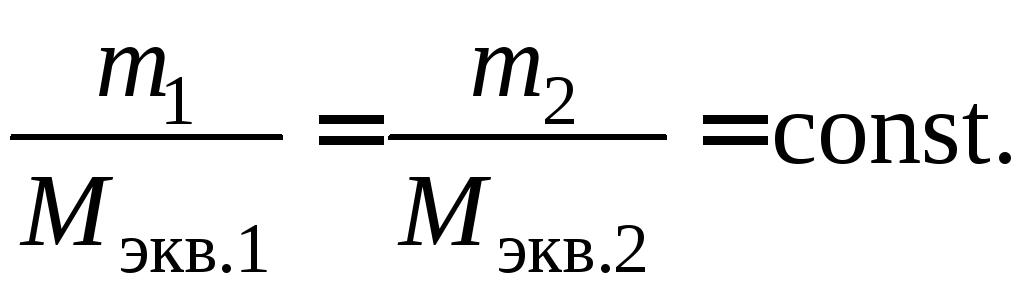Расчет количества электричества, необходимое для электрохимического превращения одного эквивалента вещества
Задача 700.
Сколько времени потребуется для полного разложения 2 молей воды током силой 2 А?
Решение:
Для расчета времени используем уравнение закона Фарадея:
Здесь m — масса образовавшегося или подвергшегося превращению вещества; Э — его эквивалентная масса; I — сила тока; t — время; F — постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Решим уравнение закона Фарадея относительно времени и подставим данные задачи (m = M . n = 18 . 2 = 36,
I = 2A, Э = М/2 = 18/2= 9 г/моль):
Ответ: 53,61ч.
Задача 701.
Как электролитически получить LiОН из соли лития? Какое количество электричества необходимо для получения 1 т LiОН? Составить схемы электродных процессов.
Решение:
Электролитически гидроксид лития можно получить из соли литя при электролизе её водного раствора. Например, при электролизе раствора соли LiCl. Стандартный электродный потенциал системы Li+ + 1
2H2O + 2
На аноде будет происходить электрохимическое окисление хлора, стандартный потеннциал которого (+1,36 В) выше, чем воды (+1,23 В). Хлор будет окисляться, потому что наблюдается значительное перенапряжение процесса окисления воды, материал анода оказывает тормозящее воздействие на его протекание:
2Cl— + 2
Сложив уравнения катодного и анодного процессов, получим суммарное уравнение:
2H2O + 2Cl— = H2↑ + 2OH— + Cl2↑.
у катода у анода
Таким образом, одновременно с выделением газообразного водорода (катод) и газообразного хлора (анод), образуется гидроксид лития (катодное пространство).
Количество электричества (Q = It) находим по формуле:
Здесь Э – эквивалентная масса серебра; F – постоянная Фарадея (96500 Кл/моль), т. е. количество электричества, необходимое для осуществления превращения одного эквивалента вещества; t – время, с; I – сила тока; m – масса выделившегося вещества.
Тогда
Ответ: 4 . 109 Кл.
Задача 702.
Найти объем кислорода (условия нормальные), который выделится при пропускании тока силой 6 А в течение ЗО мин через водный раствор КОН.
Решение:
При вычислении объемов выделившихся газов представим уравнение закона Фарадея в следующей форме:
Здесь V — объем выделившегося газа, л; VЭ — его эквивалентный объем, л/моль;
F — число Фарадея (96500 Кл/моль); t – время (для данного процесса равно 30 . 60 = 1800 с). Поскольку при нормальных условиях эквивалентный объем кислорода равен 5,6 л/моль, то получаем:
Ответ: 627мл.
Задача 703.
Найти объем водорода (условия нормальные), который выделится при пропускании тока силой в 3 А в течение 1 ч через водный раствор Н2SO4.
Решение:
При вычислении объемов выделившихся газов представим уравнение закона Фарадея в следующей форме:
Здесь V — объем выделившегося газа, л; VЭ — его эквивалентный объем, л/моль; F — число Фарадея
(96500 Кл/моль); t – время (для данного процесса равно 60 . 60 = 3600 с). Поскольку при нормальных условиях эквивалентный объем водорода равен 11,2 л/моль, то получаем:
Ответ: 1,25л.
Количественные соотношения при электролизе
Количественные расчеты процессов
электролиза осуществляются на основании
законов М. Фарадея.
Первый закон Фарадея.
Масса вещества, выделяющегося на
электроде при электролизе, пропорциональна
количеству прошедшего через раствор
электричества.
m
= k
· Q,
где m– масса восстановленного или
окисленного вещества (г);k–
коэффициент пропорциональности
(электрохимический эквивалент) (г/Кл);
Q– количество электричества, прошедшего
через электролит (Кл).
Напомним, что кулон (Кл) – количество
электричества, проходящее по проводнику
при силе тока 1 ампер (А) за время 1 с.
Количество электричества Qрассчитывается как произведение силы
тока I в амперах на времяtв секундах.
Q
= I
· t.
Электрохимический эквивалент (k)
представляет собой массу вещества,
которая восстанавливается на катоде
или окисляется на аноде при прохождении
через раствор 1 Кл электричества. Величину
электрохимического эквивалента можно
рассчитать по формуле:
k
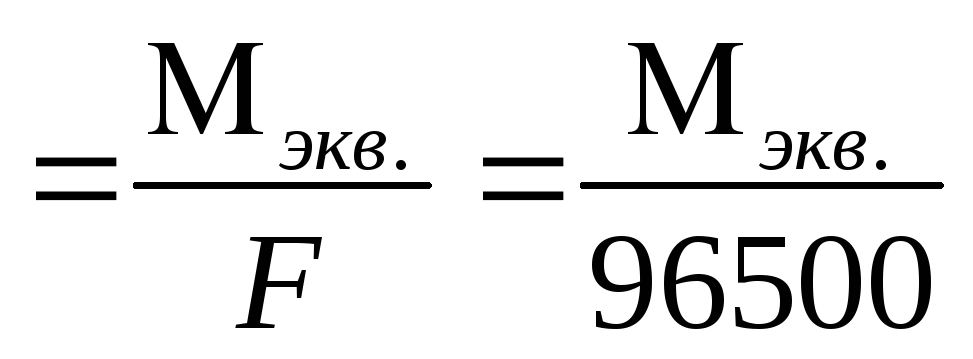
где Mэкв. – молярная масса
эквивалента этого вещества (г/моль);F– постоянная Фарадея.
Постоянная Фарадея представляет собой
количество электричества, необходимое
для выделения из раствора 1 моль
эквивалентов вещества (F = 96500 Кл/моль).
Это количество электричества равно
заряду 1 моль (6,02 ∙ 1023)
электронов.
Молярная масса эквивалента для элемента,
в свою очередь, может быть найдена как
частное от деления молярной массы
элемента на его валентность:
Mэкв =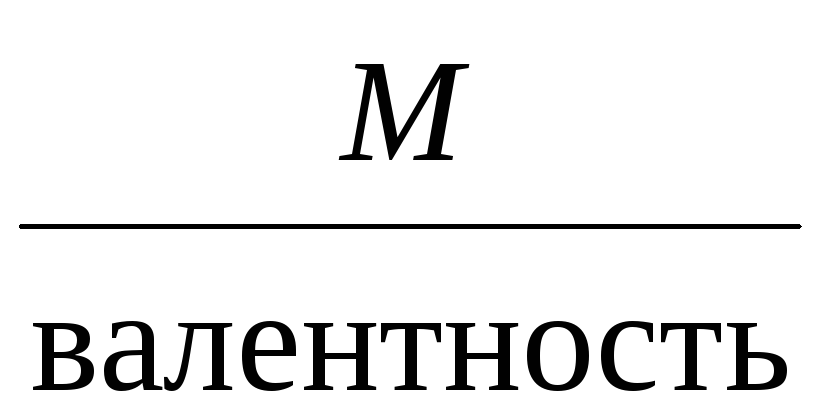
Например, молярные массы эквивалентов
для серебра, меди и алюминия будут,
соответственно, равны:
Mэкв(Ag) =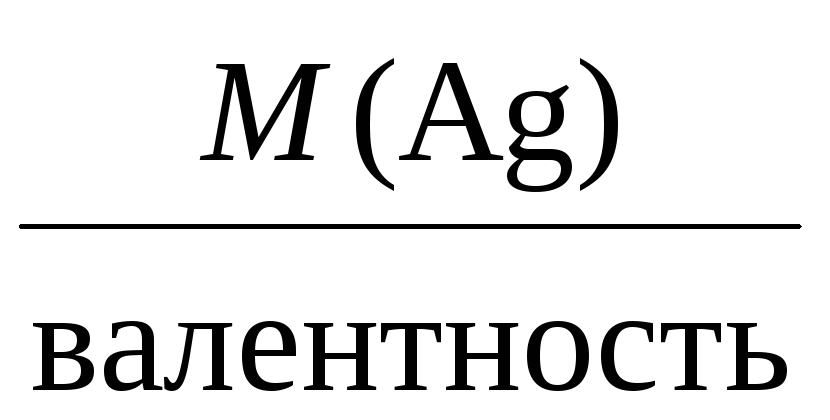
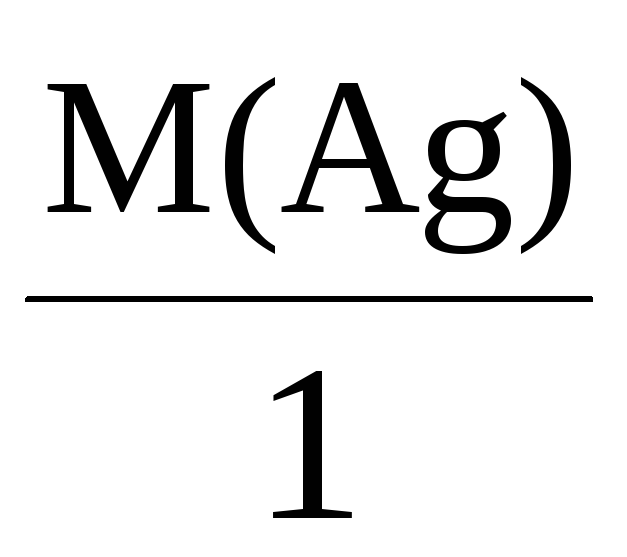
= 108 г/моль,
Mэкв(Ag) =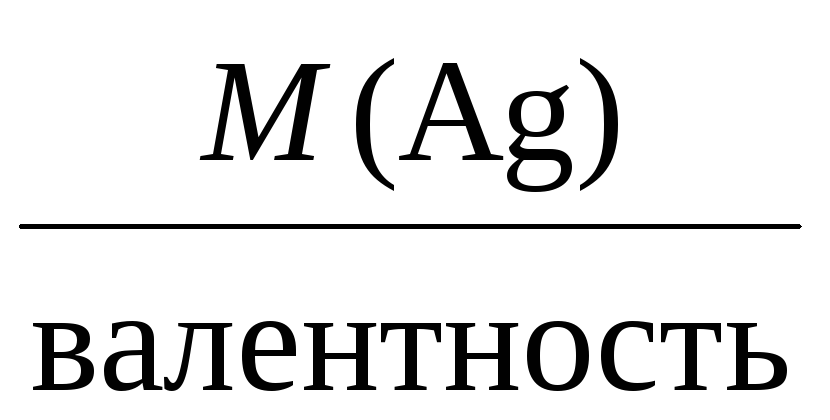
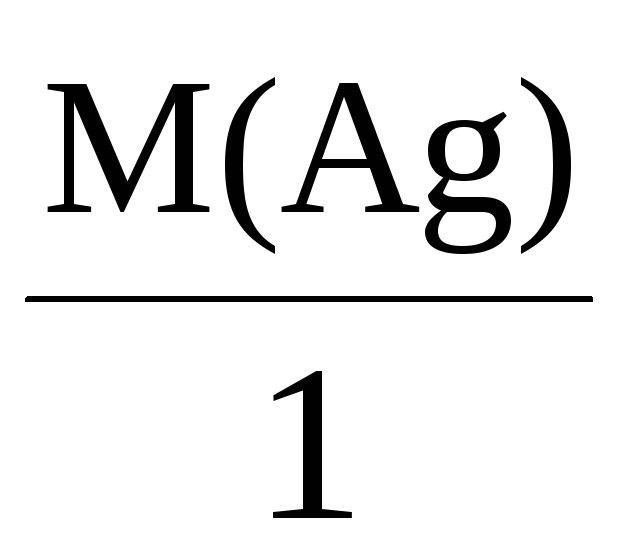
= 108 г/моль,
Mэкв(Cu) =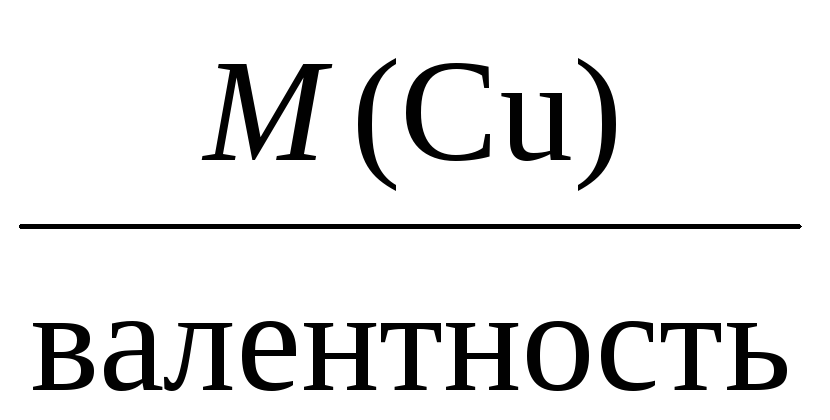
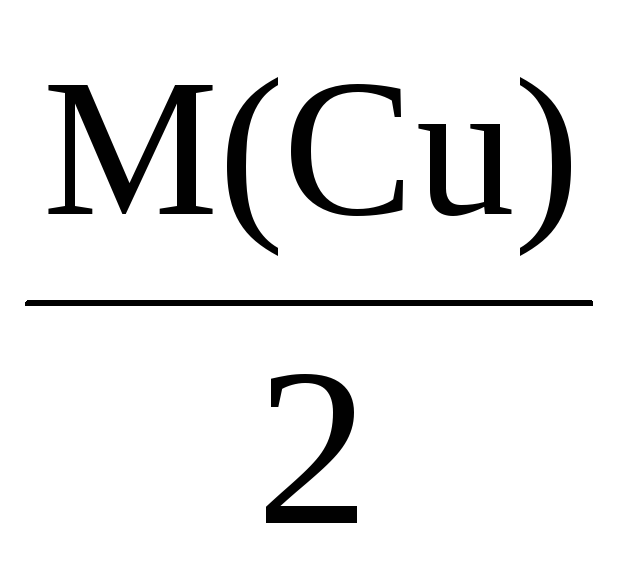
= 32 г/моль,
Mэкв(Al) =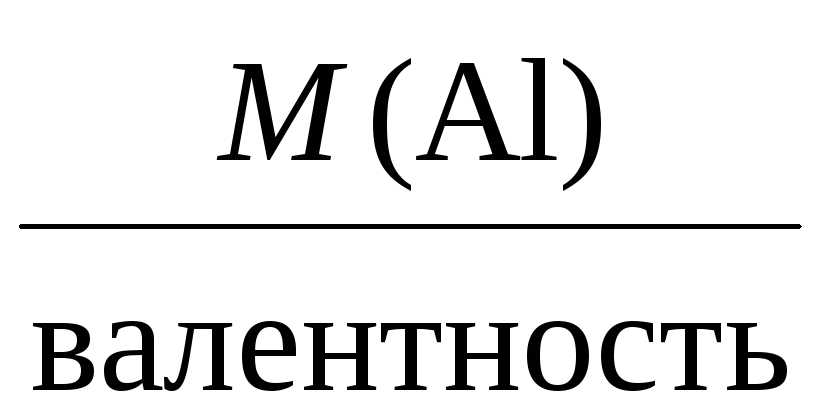
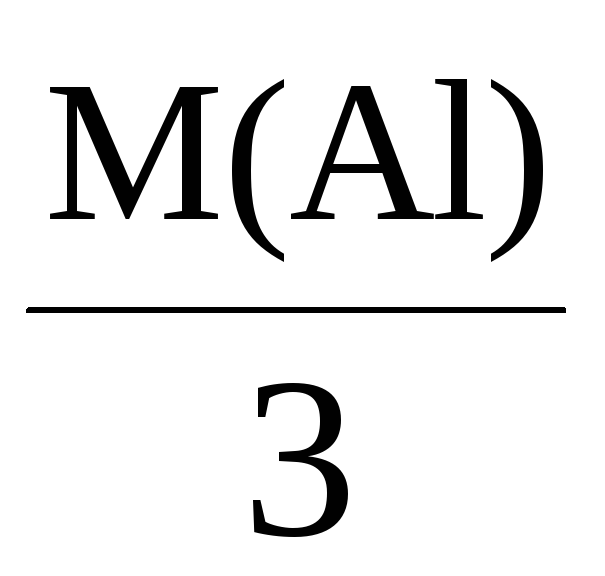
= 9 г/моль.
При пропускании через раствор 96500 Кл
электричества на катоде выделится,
соответственно, 108 г серебра, 32 г меди
или 9 г алюминия.
Таким образом, при количественных
расчетах процесса электролиза можно
пользоваться следующими формулами:
m=k
· Q=k
∙ I ·
τ,
m=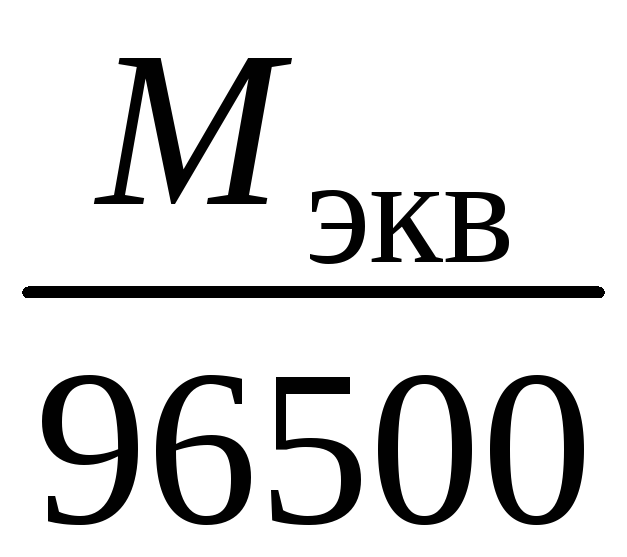
τ.
Второй закон Фарадея.
Массы окисляющихся и восстанавливающихся
на электродах веществ, при пропускании
через раствор одного и того же количества
электричества, пропорциональны молярным
массам их эквивалентов.
Полезно иметь в виду, что если для разряда
одного однозарядного иона (например,
Na+, Cl–) требуется 1 электрон,
то для выделения из раствора электролита
1 моль таких же ионов, требуется число
электронов, равное числу Авогадро –
6,02·1023(1 моль электронов). Это
количество электронов как раз и имеет
общий заряд, равный 96500 Кл. Соответственно,
для разряда 1 моль двухзарядных ионов,
потребуется 2 моль электронов, или
количество электричества, равное 2
· 96500 Кл и т.д.
Используя вышеприведенные формулы,
можно производить ряд расчетов, связанных
с процессом электролиза, например:
вычислять количества веществ,
выделяемых или разлагаемых определенным
количеством электричества;
находить силу тока по количеству
выделившегося вещества и времени,
затраченному на его выделение;
устанавливать, сколько времени
потребуется для выделения определенного
количества вещества при заданной силе
тока.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Закон Фарадея для электролиза

4.3
Средняя оценка: 4.3
Всего получено оценок: 269.
4.3
Средняя оценка: 4.3
Всего получено оценок: 269.
В 1836 году Майкл Фарадей опубликовал выведенные математически количественные характеристики электролиза. Обнаруженные взаимосвязи между количеством прошедшего через электролит электричества и количеством выделившегося при этом вещества впоследствии были названы законами Фарадея для электролиза.
Первый закон
Если пропускать через раствор медного купороса электрический ток в течение определённого количества времени, то на катоде выделяется небольшое количество меди. Однако если пустить ток большей силы, за такое же количество времени на катоде образуется большее количество меди. При увеличении времени и одинаковой силе тока также увеличивается количество меди.
Фарадей установил взаимосвязь массы вещества, силы тока и времени. Математически эта взаимосвязь выражается следующим образом:
m = kIt,
где:
- m – масса вещества;
- k – электрохимический эквивалент;
- I – сила тока;
- t – время.
Электрохимический эквивалент – это масса вещества, образованная при прохождении через электролит тока в 1 А за одну секунду. Выражается как соотношение массы вещества к количеству электричества или г/Кл.
Произведение силы тока и времени выражает количество электричества: q = It. Это электрический заряд, измеряемый в кулонах (один ампер к одной секунде). Электрический заряд отражает способность тела быть источником электромагнитного поля и принимать участие в электромагнитном взаимодействии.
Соответственно, уравнение Фарадея приобретает вид:
m = kq.
Первый закон электролиза Фарадея: масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.
Второй закон
Фарадей, пропуская электрический ток одинаковой силы через различные электролиты, заметил, что массы веществ на электродах неодинаковы. Взвесив выделившиеся вещества, Фарадей сделал вывод, что вес зависит от химической природы вещества. Например, на каждый грамм выделенного водорода приходилось 107,9 г серебра, 31,8 г меди, 29,35 г никеля.
На основе полученных данных Фарадей вывел второй закон электролиза: для определённого количества электричества масса химического элемента, образовавшегося на электроде, прямо пропорциональна эквивалентной массе элемента. Она равна массе одного эквивалента – количеству вещества, реагирующему или замещающему 1 моль атомов водорода в химических реакциях:
μeq = μ/z,
где:
- μ – молярная масса вещества;
- z – число электронов на один ион (валентное число ионов).
Для выделения одного моля эквивалента затрачивается одинаковое количество электричества – 96485 Кл/моль. Это число называется числом Фарадея и обозначается буквой F.
Согласно второму закону, электрохимический эквивалент прямо пропорционален эквивалентной массе вещества:
k = (1/F) μeq или k = (1/zF)μ.
Два закона Фарадея можно привести к общей формуле: m = (q / F) ∙ (μ/z).
Что мы узнали?
Фарадей, проводя реакцию электролиза разных веществ, вывел два закона. Согласно первому закону, масса вещества, осевшего на электрод, прямо пропорциональная количеству электричества, пропущенного через электролит: m = kq. Второй закон отражает взаимосвязь электрохимического эквивалента и эквивалентной массы вещества: k = (1/F) μeq. Электрохимический эквивалент – количество выделившегося вещества при прохождении единицы электричества. Эквивалентная масса – количество вещества, реагирующее с 1 молем водорода.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Лиза Шифр
4/5
-
Евгений Пшеничный
5/5
-
Татьяна Батарон
4/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 269.
А какая ваша оценка?
Рекомендуемые сообщения
Решение задач по фото за 30 минут! Мы онлайн – кликай!
-
- Поделиться
полное условие звучит так:
Какие процессы протекают при электролизе раствора нитрата меди (II)? Какое количество электричества потребуется для выделения 3,2 г меди? Какой объем газа выделится на аноде (н.у.)?
С процессами разобралась — на катоде выделяется медь, на аноде — кислород. А вот дальше… Мне кажется, что условие недостаточное — не указано время электролиза. Поэтому ничего не могу рассчитать.Я права? Ведь время — значительный показатель, пренебречь им нельзя… Или я чего-то не вижу? Для расчета думала использовать формулу
m=M*I*T/n*F, отсюда I= m*n*F/M*T
пожалуйста, подскажите, что можно сделать?
Ссылка на комментарий
—>
-
- Поделиться
Вы не правы. Количество выделившегося вещества (хоть объем газа, хоть масса металла) зависит от количества электричества, прошедшего через электроды. Так что вопрос поставлен абсолютно корректно. С законом Фарадея разберитесь как следует.
Ссылка на комментарий
- Автор
-
- Поделиться
Вы не правы. Количество выделившегося вещества (хоть объем газа, хоть масса металла) зависит от количества электричества, прошедшего через электроды. Так что вопрос поставлен абсолютно корректно. С законом Фарадея разберитесь как следует.
я, собственно, по нему и пыталась решать… Из закона понимаю, что чем больший ток мы пропускаем, тем больше вещества выделится на электроде. Второй закон тут, по-моему, совсем ни при чем. Может быть, вы смогли бы мне объяснить, как все-таки это решить, пожалуйста?
Ссылка на комментарий
-
- Поделиться
Закон Фарадея (первый) традиционно пишут в двух вариантах. Вот из Википедии:
Первое равенство — это как раз запись через количества электричества, никакого времени не нужно. Как и силы тока.
Изменено 27 Декабря, 2011 в 18:31 пользователем mypucm
Ссылка на комментарий
- Автор
-
- Поделиться
Большое вам спасибо! вы меня направили в правильном направлении! :ar:
Ссылка на комментарий
-
- Поделиться
Электролиз Cu(NO3)2:
(-)Катод Cu + 2e = Cu
(+) Анод 2H2O — 4e = O2 + 4Н+
Масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит
По первому закону Фарадея имеем:
m=k*q, k=1/F * A/z или m=A*q/F*z, q=m*F*z/A
m=3,2 г; A=63,5 г/моль; z=2
q=3,2*9,65*10^4*2/63,5=9726 Кл
Ссылка на комментарий
- Автор
-
- Поделиться
Электролиз Cu(NO3)2:
(-)Катод Cu + 2e = Cu
(+) Анод 2H2O — 4e = O2 + 4Н+
Масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит
По первому закону Фарадея имеем:
m=k*q, k=1/F * A/z или m=A*q/F*z, q=m*F*z/A
m=3,2 г; A=63,5 г/моль; z=2
q=3,2*9,65*10^4*2/63,5=9726 Кл
большое спасибо!
Ссылка на комментарий
- 4 года спустя…
-
- Поделиться
Электролиз Cu(NO3)2:
(-)Катод Cu + 2e = Cu
(+) Анод 2H2O — 4e = O2 + 4Н+
Масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит
По первому закону Фарадея имеем:
m=k*q, k=1/F * A/z или m=A*q/F*z, q=m*F*z/A
m=3,2 г; A=63,5 г/моль; z=2
q=3,2*9,65*10^4*2/63,5=9726 Кл
А если
K | 2H2O + 2e = 2OH- + H2
OH- + Na+ = NaOH
Q= (F*m*n)/M
Q=(26,8*0,14*2)/40
М=40 г/моль гидроксида натрия
n=2 число электронов
m(NaOH)= 0,14 г
F=26,8 A*ч так считать ?
Ссылка на комментарий
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти
По этой ссылке вы найдёте полный курс лекций по математике:
Электролизом называется окислительно-восстанови-тельный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролита. Химические реакции протекают на электродах за счет электрической энергии. При электролизе катод является восстановителем, так как он отдает электроны, а анод — окислителем, так как он принимает электроны от анионов.
Например, если в раствор хлорида меди опустить электроды и пропустить постоянный электрический ток, то ионы меди будут двигаться к катоду, а ионы хлора — к аноду. На катоде происходит процесс восстановления: Cu2f + 2ё « Си, а на аноде — окисления: 2СГ — 2ё- С12. В итоге на катоде будет выделяться медь, а на аноде — хлор. Восстановительное и окислительное действие электрического тока во много раз сильнее химических восстановителей и окислителей.
Ни один химический окислитель не может отнять у иона фтора его электрон. Окислить ион фтора удалось лишь при электролизе расплава смеси безводного жидкого фтороводорода с фторидом калия. На угольном аноде выделяется фтор: 2F» — 2ё = F2, а на никелевом катоде — водород: 2Н+ + 2ё = Н2. Различают электролиз расплавов и растворов электролитов. Процессы в расплавленных электролитах — наи- более простой случай электролиза.
Так, в расплаве хлорида натрия содержатся ионы Na+ и С Г. При пропускании через него электрического тока ионы Na+ у катода присоединяют электроны и восстанавливаются до атомов натрия, ионы хлора СГу анода отдают электроны и окисляются до атомов хлора, которые затем образуют молекулы. Пример 1 Схема электролиза расплава NaCl расплав 2 процесс восстановления 1 процесс окисления электролиз 2NaCl -Г 2Na + CLf. Пример 2 Схема электролиза расплава СаВг2 1 процесс восстановления 1 процесс окисления электролиз СаВг2 Са + Вг2. Пример 3
Схема электролиза расплава КОН КОН К+ + ОН». расплав 4 процесс восстановления 1 процесс окисления электролиз — ионное уравнение электролиз — молекулярное урав- нение Если электролизу подвергается расплав, который содержит несколько различных катионов, то в этом случае последовательность восстановления определяется электродным потенциалом металла в данных условиях. В первую очередь восстанавливаются катионы металлов, обладающие большим значением электродного потенциала.
Более сложные процессы протекают при электролизе водных растворов электролитов, поскольку в этих процессах принимает участие вода. Рассмотрим электролиз концентрированного раствора хлорида натрия. В этом случае в растворе, кроме гидратированных ионов натрия и хлора, присутствуют молекулы воды и продукты ее диссоциации, которые участвуют в электродных реакциях. При прохождении тока через раствор к катоду будут двигаться катионы натрия и водород, а к аноду — хлорид и гидроксид-ионы. По этой причине реакции, протекающие на электродах, будут существенно отличаться от реакций, идущих в расплаве соли.
Возможно вам будут полезны данные страницы:
На катоде, вместо ионов натрия, будут восстанавливаться молекулы воды и ионы водорода, поскольку они обладают большей окислительной способностью с ионами натрия. На аноде происходит окисление хлорид-ионов (обладающих большей восстановительной способностью по сравнению с гидроксид-ионами). Пример 4 Схема электролиза раствора NaCl , расплав 1 процесс восстановления 1 процесс окисления электролиз электролиз 2NaCl + 2Н20 — Н2| + С12| + 2NaOH — молекулярное уравнение.
Последовательность, в которой происходит разряд ионов на катоде из растворов солей, определяется рядом стандартных электродных потенциалов, в котором металлы располагаются в ряд по нарастанию алгебраической величины их нормальных электродных потенциалов. Поясним, как образуется ряд стандартных электродных потенциалов. Погружение металла в раствор одноименной соли приводит к процессам перехода ионов металла с поверхности металла в раствор — растворение металла, или из раствора в металл — осаждение металла.
Вследствие этих процессов поверхность металла (электрода) приобретает положительный или отрицательный заряд, причем его величина и знак будут определяться природой металла, концентрацией соли в растворе и температурой. Гидратированные катионы и анионы, находящиеся в растворе, притягиваются заряженными поверхностями металлов, в результате чего на поверхности раздела металл-раствор образуется два слоя с противоположными зарядами — так называемый двойной электрический слой.
Разность потенциалов этого слоя носит название электродного потенциала. Непосредственно измерить величину потенциала отдельного электрода не представляется возможным. Поэтому электродные потенциалы измеряют путем сопоставления с потенциалом принятого для сравнения электрода. В качестве последнего обычно применяют стандартный водородный электрод, величину потенциала которого условно принимают за ноль. Этот электрод состоит из платиновой пластинки, покрытой платиновой чернью (электролитически осажденной платиной), которая погружена в 1 М раствор серной кислоты и омывается струей газообразного водорода под давлением 1 атм.
Если теперь пластинку любого металла, погруженную в раствор его соли, содержащий 1 моль ионов металла в 1000 г воды, соединить с водородным электродом с помощью так называемого «электролитического ключа», то получится гальванический элемент, электродвижущую силу которого (ЭДС) легко измерить. Эта ЭДС, измеренная при 25 °С, называется стандартным электродным Ряд стандартных электродных потенциалов металлов потенциалом данного металла.
Располагая металлы в порядке возрастания алгебраической величины их стандартных электродных потенциалов, получают ряд стандартных электродных потенциалов металлов.- Чем левее металл в ряду стандартных потенциалов, тем труднее его ион разряжается при электролизе. При этом возможны три случая: (TJ Катионы металлов, имеющих стандартный потенциал больший, чем у водорода (от Си2+ до Аи3+), прн электролизе практически полностью восстанавливаются на катоде.
(Т) Катионы металлов, имеющих малую величину стандартного электродного потенциала (от Li+ до А13+ включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды. [з] Катионы металлов, имеющих стандартный электродный потенциал меньший, чем у водорода, но больший, чем у алюминия (от А13+ до Н2), при электролизе на катоде восстанавливаются одновременно с молекулами воды. Если же водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения алгебраической величины стандартного электродного потенциала соответствующего металла.
Так, из смеси катионов Ag+, Cu2+, Zn2+ сначала будут восстанавливаться катионы серебра, затем катионы меди и последними — катионы цинка. Характер реакций, протекающих на аноде, зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод. Аноды бывают нерастворимые и растворимые. Первые изготавливаются из угля, графита, платины (в процессе электролиза они не переходят в раствор в виде ионов); вторые — из меди, серебра, цинка, кадмия, никеля и др. металлов (в процессе электролиза переходят в раствор в виде ионов, т. е. разрушаются).
На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды. При этом анионы бескислородных кислот и их солей (СГ, Br», I», S2″) окисляются у анода. При электролизе водных растворов щелочей кислоро-досодержащих кислот и их солей (S042~, N03″, С032~, Р043~), а также фторидов на аноде происходит электрохимическое окисление воды с выделением кислорода. Рассмотрим возможные случаи электролиза раствора солей на угольных электродах (электроды не участвуют в окислительно-восстановительных реакциях). Электролиз раствора соли, образованной активным металлом, стоящим в ряду напряжений до алюминия и кислотным остатком кислородосодержащей кислоты сводится к электролизу воды.
Пример 5 Схема электролиза водного раствора MgS04 MgS04 т± Mg2+ + SO2″, раствор электролиз Учитывая, что 4Н+ + 40Н» — 4Н20, электролиз 2Н20 — 2H2t+02|. Электролиз раствора соли, образованной малоактивным металлом, стоящим в ряду напряжений после водорода, и кислотным остатком кислородосодержащей кислоты. В данном случае при электролизе получается металл, кислород, а в катодно-анодном пространстве образуется соответствующая кислота. Пример 6 Схема электролиза водного раствора CuS04 CuS04 Cu2+ + SO2″, процесс восстановления 1 процесс окисления K(-): Cu2+ + 2ё Си0 электролиз электролиз 2CuS04 + 2Н20 — 2Cu + 021 + 2H2S04.
Электролиз раствора соли, образованной активным металлом (до А1) и кислотным остатком галогено-водородной кислоты. При электролизе получается водород, галоген, в катодно-анодном пространстве — щелочь. Пример 7 Схема электролиза водного раствора СаС12 СаС12 Са2+ + 2СГ, раствор НОН Н+ + ОН~. 1 процесс восстановления 1 процесс окисления электролиз , электролиз Электролиз раствора соли, образованный малоактивным металлом и кислотным остатком галоге-новодородной кислоты.
При электролизе получается металл и галоген. Пример 8 Схема электролиза водного раствора , раствор 1 процесс восстановления А(+): 2С1 — 2ё С12 1 процесс окисления лектролиз электролиз Если соль образована металлом, стоящим в ряду напряжения от алюминия до водорода и в процессе восстановления принимает участие вода, то процесс электролиза идет в зависимости от концентрации раствора соли. Чем менее концентрированный раствор, тем менее интенсивно восстанавливается металл. P^J Пример 9 Схема электролиза водного раствора Ni(N03)2 раствор 1 процесс окисления электролиз ‘2 2 1 1 ‘ электролиз P^l Пример 10 I
Схема элек электролиза водного раствора NaOH NaOH Na+ 4- ОН», раствор НОН Н+ 4- ОН». } 1 процесс восстановления / электролиз электролиз 2Н20 -V 2H?t + 0„t • 2 процесс восстановления 1 процесс окисления Пример 11 Схема электролиза водного раствора HgSC^ H2S04 2Н* + so;-, раствор НОН Н+ + ОН». nsr 2 процесс восстановления 1 процесс окисления электролиз электролиз 2На0 — 2H2t+02t-Растворимый анод при электролизе сам подвергается окислению (растворению), т. е. посылает электроны во внешнюю цепь.
Так, при электролизе раствора сульфата никеля с никелевым анодом процесс сводится к выделению никеля на катоде и постепенному растворению анода. Количество сульфата никеля в растворе остается неизменным. Пример 12 Схема электролиза водного раствора NiS04 с растворимым анодом раствор Количественно процесс электролиза описывается законами Фарадея: |Т) Количество вещества, восстановленного на катоде или окисленного на аноде, пропорционально количеству прошедшего через раствор или расплав электричества: m-kM^Q, где т — масса окисленного или восстановленного вещества; его молярная масса эквивалента;.
Q — количество электричества, прошедшего через электролит; к — коэффициент пропорциональности. [2] Количество окисляющихся или восстанавливающихся на электродах веществ при пропускании одного и того же количества электричества пропорциональны их молярным массам эквивалентов. Оба закона Фарадея можно выразить общей формулой: где F — число Фарадея. Учитывая, что количество электричества Q равно произведению силы тока J в амперах на время т в секундах, формулу можно написать так:
Величина Е называется электрохимическим эквивалентом вещества и характеризует собой массу вещества, которое восстанавливается на катоде или окисляется на аноде при прохождении через электролит одного кулона электричества. Молярная масса эквивалента связана с электрохимическим эквивалентом отношением: — EF.
Пример 13 Вычислите объем кислорода, выделившегося на угольном аноде при пропускании через разбавленный раствор серной кислоты тока силой 5 А в течение часа.
Дано: Найти: У(02) Решение: 1) Уравнение электролиза: электролиз 2) Находим количество электричества: ? = /• г; Q = 5 • 3600 = 18 ООО Кл. 3) Определим массу кислорода, выделившегося на аноде: 4) Найдем, какой объем при н. у. займет 1,492 г кислорода. Для этого сначала найдем количество вещества: 1,492 Y(Oz) — 32 — 0,047 моль. Откуда V(02) = 0,047 • 22,4 = 1,044 л. Ответ: V(02) = 1,044 л. Пример 14 Рассчитайте время, необходимое для полного выделения хлора, содержащегося в 2 л 0,5 Н раствора хлорида калия при электролизе этого раствора током силой 5 А. Дано: V(C2) — 2 л СН(КС1) = 0,5 1=5 А
Найти: Решение: Определяем, что в 2 л 0,5 Н раствора хлорида калия содержится: 2 • 0,5 e 1 моль • экв. соли, для разложения которой требуется 96 500 Кл. Исходя из этого: Q 96 500 т = —, т = ——— = 321,8 мин = 5,3 ч. • I 5 • 1 Ответ: т= 5,3 час. Пример 15 Между какими из следующих попарно взятых веществ, формулы которых даны ниже (электролит берется в виде водного раствора), будет протекать реакция замещения: а) А1 + Cu(N03)2; б) Zn + MgS04.
Напишите уравнения реакции в ионной форме. Решение: В рассматриваемых реакциях замещения свободный металл будет вытеснять металл из соли в раствор в том случае, если он обладает большей восстановительной способностью по сравнению с металлом, образующим соль. Сравнивая пары металлов— А1 и Си; Zn и Mg, мы видим из их положения в электрохимическом ряду напряжений, что реакция замещения возможна только в первом случае и она отразится следующим уравнением: 2А1° + 3Cu2f — 3Cu° + 2AI8*. Применение электролиза расплавов и растворов огромно.
Такие ценные металлы, как алюминий, натрий, цинк, олово, свинец, кадмий, серебро, золото, получают исключительно путем электролиза. В производстве никеля, магния, меди, белой жести электрохимическая продукция составляет 80-90 %. Хлор и его кислородные соединения в промышленности получают также электрохимически. Все шире развиваются электрохимические методы получения органических соединений. Электролиз начинают применять для обессоливания воды, для укрепления грунтов за счет удаления воды (электроосмос).
Его развитие тесно связано с проблемой получения чистых и особо чистых материалов. Ни одна отрасль машиностроения не может обойтись без электрохимических методов обработки поверхности металлических изделий. Электрохимическим методом наносят металлические покрытия, которые предохраняют металл от ржавчины. Электролиз используют для получения точных копий с различных предметов — гальванопластика. Предмет, с которого хотят получить копию, покрывают воском и получают матрицу.
Поверхность восковой матрицы покрывают
тонким слоем графита, делая ее проводящей электрический ток. Графитовый катод опускают в ванну с раствором сульфата меди, анодом служит медь. При электролизе медный анод растворяется, а на катоде осаждается медь. С помощью гальванопластики изготавливаются клише для печати матрицы грампластинок, металлизируют различные предметы. Электролиз используют для очистки металлов от примесей. Рафинирование (очистка) меди основано на анодном растворении металла.
В больших ваннах подвешивают ряд пластин из черновой меди, а между ними — тонкие пластинки чистой меди, заливают электролит и пропускают ток. Анод — черновая медь — растворяется, а на пластинках из чистой меди, которые служат катодом, нарастает слой очищенной меди. Электролитическая медь содержит 99,97 % чистой меди. Вопросы и задачи для самостоятельного решения 1. Укажите отличие проводников первого рода от проводников второго рода.
2. Укажите, от каких факторов зависит последователь- ность расположения металлов по величинам их электродных потенциалов. 3. Объясните, почему электродные потенциалы металлов имеют положительный или отрицательный знак. 4 Объясните, почему последовательность изменения активности металлов в ряду стандартных электродных потенциалов не совпадает с последовательностью изменения активности металлов в группах и периодах периодической системы.
5. Цинковые пластинки опущены в растворы нитратов калия, кальция, никеля и свинца. В каких случаях будут протекать химические реакции? Напишите соответствующие уравнения процессов в молекулярной и ионно-молекулярной формах. 6. Какая масса технического цинка, содержащего 2 % примесей, требуется для вытеснения из раствора нитрата меди (II) 6,35 г меди? Ответ: 6,67 г. 7. Какие процессы, протекающие на электродах, объединяются общим названием * электролиз*?
8. Чем вызвана необходимость пространственного разделения процессов, протекающих на электродах? 9. Объясните, чем определяется последовательность восстановления катионов на катоде при электролизе растворов электролитов? 10. Какие факторы предопределяют выбор материала для электродов при проведении процесса электролиза? 11. Какими показателями оценивается эффективность процессов электролиза?
12. При получении каких веществ в народном хозяйстве используется электролиз? 13. Составьте схемы электролиза водного раствора нитрата цинка, если: а) анод угольный; б) анод цинковый. 14. Какие химические процессы происходят у катода и у анода при электролизе раствора иодида натрия. 15. Чем отличается электролиз расплава едкого натра «От электролиза его раствора? Какие вещества и в каком количестве выделяются при электролизе раствора едкого натра, если через раствор пропускают ток силой 10 А в течение 10 ч 44 мин? Ответ: 44,8 л Н2 и 22,4 л 02 (н. у.).
16. Какое количество продуктов будет получено при электролизе расплава едкого натра током силой 0,6 А в течение Зч? Ответ: 1,54 г Na; 0,38 л 02 (н. у.). 17. Будет ли меняться в ходе электролиза водного раствора гидроксида калия: масса гидроксида калия в растворе; концентрация раствора? Почему? 18. Какое количество электричества необходимо пропустить через раствор поваренной соли для получения 1 г едкого натра? Ответ: 2412,5 Кл. 19. С каким полюсом батареи — положительным или отрицательным — должна быть соединена металлическая деталь при ее хромировании?
20. Определите объем водорода, выделившегося на катоде (н. у.) при электролизе водного раствора серной кислоты, если известно, что при этом вступило в реакцию 1,505′ 1024 электронов. Ответ: 28 л. 21. При прохождении через раствор соли трехвалентного металла тока силой ЗА в течение 15 мин на катоде выделилось 1,071 г металла. Определите атомную массу металла. Ответ: 114,9. 22.
При электролизе раствора нитрата хрома (III) током силой 1 А масса хромового катода возросла на 10 г. Какое количество электричества было пропущено через раствор и в течение какого времени? Ответ: 55700 Кл; 15 ч 28 мин. 23. Через раствор нитрата никеля (II) в течение 2 ч 27 мин пропускали ток силой 3,5 А. Определите, на сколько граммов за это время уменьшилась масса никелевого анода. Ответ: 9,4 г. 24. При электролизе током силой 2 А в течение 40 мин на катоде выделилось 4,542 г некоторого металла. Определите молярную массу эквивалента этого металла. Ответ: 91,3 г.