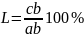Для анализа диаграммы состояния железо-углерод мы пользуемся правилом фаз или законом Гиббса:
C = k + n – f,
где С – количество степеней свободы системы;
k – количество компонентов;
n – количество внешних факторов (температура, давление);
f – количество фаз.
Как «справиться» с расчетом количества степеней свободы?
Компонентов, как известно, 2 (железо и углерод). Внешних факторов – 1 (температура), потому что давление мы не меняем.
Самое трудное – определить количество фаз. С этим справляются хуже всего. Обычно очень «смущают» пунктиры, проведенные из точек S, E, C вниз до пересечения с осью концентраций. Эти пунктиры, в общем, не имеют значения для определения количества фаз. Они нанесены на диаграмму для удобства.
Для облегчения подсчета количества фаз можно представить диаграмму состояния «в цвете».
Фазовые области на рисунке раскрашены каждая своим цветом.
У нас диаграмма начерчена на плоскости, состав изменяется по 1 линии (ось концентраций, т.е. по горизонтали). Температура изменяется по вертикали. Значит, больше 2 фаз в каждой области просто быть не может.
Главное правило: каждая двухфазная область на диаграмме граничит справа и слева с однофазными областями. Поэтому в двухфазной области будут те обе фазы, которые «ограничивают» двухфазную область справа и слева.
Однофазных областей на диаграмме как известно 4: аустенит, феррит, жидкость, дельта-феррит, а также 1 линия для цементита (только при 6,67% углерода).
Поэтому:
в области DCF (желтая) будут 2 фазы – жидкость и цементит.
в области JBCE (синяя) будут 2 фазы – жидкость и аустенит.
в области SEFK (розовая) – аустенит и цементит.
в области QPK (голубая) – феррит и цементит.
в области PGS (серая) – феррит и аустенит.
в области AHB (фиолетовая) – жидкость и дельта-феррит.
в области NHJ (оранжевая) – аустенит и дельта-феррит.
Остальные области диаграммы состояния железо-углерод имеют 1 фазу.
-
Правило фаз (закон Гиббса) и правило определения состава и количества фаз (правило отрезков).
Процесс
кристаллизации сплавов и связанные с
ним многие закономерности строения
описываются с помощью диаграммы
состояния
(ДГ)
– графическое изображение состояния
сплавов (фазовый состав и структура, в
зависимости от элементов и температуры).
ДГ
определяют устойчивые равновесные
состояния сплавов, обладающие при
данных условиях миниальной свободной
энергией. Строят их экспериментальными
методами, одним из которых является
термический
анализ,
с помощью которого получают кривые
охлаждения (кристаллизации) и точки
перегиба кривых называют критическими
точками. Они
соответветвтсвуют температурам, при
которых в сплавах начивают/заканчиваются
какие-либо фазовые превращения.
Для
построения диаграмм состояния и снятия
кривых охлаждения берут большое
количество сплавов с разной концентрацией
компонентов.
Зависимость
существования устойчивых фаз, отвечающая
условиям равновесия, описывается
условием
Гиббса:
,
где с – число степеней свободы,
к
– число компонент, ф – число фаз.
2
– число внешних факторов (Т, Р)
П
од
числом «с» (вариантностью системы),
понимается возможность изменения
температуры, давления и концентрации
без изменения числа фаз, находящихся в
равновесии.
Применяя
правило фаз Гиббса к металлам, можно во
множестве случаев принять изменяющимся
только один внешний фактор – температуру,
так как давление мало влияет на фазовые
превращения.
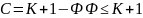
Если
максимальное число фаз: с = 0 (при Т =
константа).
Диаграмма
состояния сплавов, имеющих неограниченную
растворимость в жидком, твёрдом состоянии.
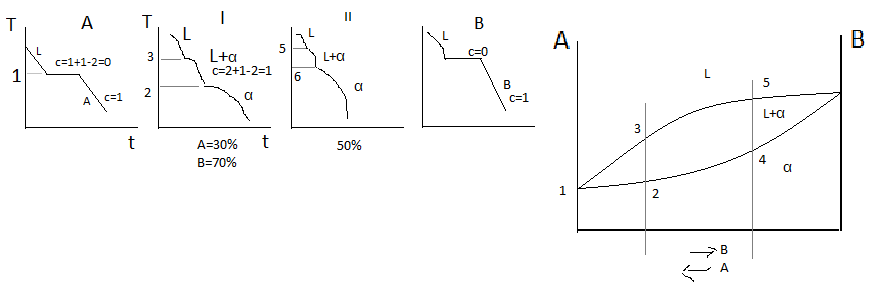
Правило отрезков.
Верхняя
линяя на диаграмме 1-3-5-6 – линия начала
кристаллизации – Ликвидус. Линия 1-2-4-6
– линия окончания кристаллизации –
линия Солидус. Выше линии Ликвидус
существует только жидкая фаза L.
Между линиями ликвидус и солиус идёт
процесс кристаллизации и в равновесии
находятся 2 фазы, т.е.число степеней
свободы с=2+1-2=1. Ниже линии солидус – все
сплавы однофазны и состоят из α-твёрдого
раствора. Такую диаграмму состояния
имеют следующие сплавы: Cu-Ni,
Cu-Pt,
Au-Ag,
Fe-Va,
Fe-Ni,
Mo-W.
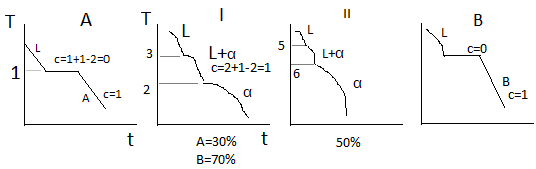
Р
ассмотрим
более подробно процесс кристаллизации
сплава 50% А 50% В. Кристаллизация начинается
при температуре T1,
когда из жидкого раствора выделяются
первые кристаллы α-твёрдого раствора.
Ниже температуры T1
сплав 2х фазный (L+α).
В процессе кристаллизации твёрдых
растворов состав твёрдой и жидкой фазы
меняется. Каждой температуре соответствует
определённое количество и концентрация
фаз. В реальных условиях или при быстром
охлаждении не успевает произойти
выравнивание концентрации в твёрдом
растворе. Даже в пределах 1-го кристалла
будет наблюдаться неоднородный химический
состав. Первые кристаллы α-твёрдого
раствора обогащены компонентом В, а
далее всё время меняется соотношение
А и В. И последние кристаллы будут
содержать больше компонента А.
И
так,
для определения количественного
соотношения фаз, находящихся в равновесии
при данной температуре, пользуются
правилом
отрезков
(рычага).
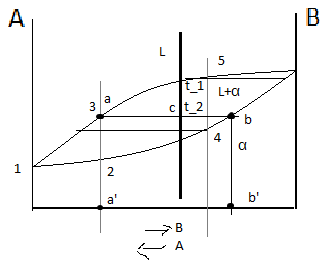
Правило
отрезков
позволяет определить:
Состав
фаз или концентрацию компонентов в
соответствующих фазах. Для этого точки
пересечения коноды с линиями диаграммы
переносятся на ось концентрации, т.е.
конода параллельна линии концентрации.
Конода – линия, соединяющая состав фаз,
находящихся в равновесии. a’
– состав жидкой фазы, b’
– состав α-твёрдого раствора. Количество
фаз:
.
Если точка, показывающая состав при
данной температуре, т.е. линия ниже линии
ликвидуса и выше линии солидуса, а её
состав соответствует исходному составу.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Содержание:
- Правило фаз Гиббса
- Независимые компоненты и степени свободы системы
- Однокомпонентные системы
- Двухкомпонентные системы
- Общая характеристика растворов
Правило фаз (или правило фаз Гиббса) — соотношение, связывающее число компонентов, фаз и термодинамических степеней свободы в равновесной термодинамической системе. Роль правила фаз особенно велика при рассмотрении гетерогенных равновесий в многофазных многокомпонентных системах.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Правило фаз Гиббса
Правило фаз Гиббса утверждает, что число степеней свободы С равновесной термодинамической системы равно разности между числом компонентов К и числом фаз Ф, плюс число факторов п, влияющих на равновесие.
Независимые компоненты и степени свободы системы
Представления о гомогенных и гетерогенных системах и фазах, изложенных в предыдущей главе, следует дополнить понятиями о компонентах и степенях свободы. Компонентами называют индивидуальные вещества системы, концентрации которых определяют состав всех ее фаз, т. е. веществ в системе может быть больше, чем требуется для описания состава всех ее фаз. Например, при установлении равновесия
система состоит из трех веществ, но для описания состава всех трех фаз достаточно знать любые два, их называют независимыми компонентами; состав третьей фазы легко определить, используя уравнение вещественного баланса. Из приведенного примера следует: число независимых компонентов равновесной системы равно общему числу индивидуальных веществ минус число связывающих их уравнений. При наличии химических реакций число независимых компонентов системы меньше числа индивидуальных веществ. Если же между веществами нет химического взаимодействия, то числа независимых компонентов и индивидуальных веществ совпадают (например, воздух состоит из такого же числа независимых компонентов, сколько сортов молекул входит в его состав).
Степенями свободы (С) равновесной системы называют те параметры, которые можно произвольно изменять, не меняя числа и природы фаз системы. Степенями свободы могут являться концентрации реагирующих веществ в фазах переменного состава (растворах), давление, температура.
Число степеней свободы определяют разностью между общим числом независимых переменных системы и числом уравнений, их связывающих. В приведенном выше примере общее число переменных равно двум (температура и давление С02 или его концентрация), уравнение одно, следовательно, число степеней свободы С данной системы равно: 2—1 = 1.
Количественное соотношение между числами степени свободы (С), фаз (Ф) и независимых компонентов (К), получившее название правила фаз, выведено В. Гиббсом (1876), оно имеет вид
С+Ф = K +2, (7.1)
Здесь 2 — число переменных параметров системы (давление и температура). Использование этого правила помогает при изучении химических реакций и равновесных систем.
Рассмотрим некоторые конкретные примеры.
Пример 1. Система представлена равновесием
Число независимых компонентов К равно разности числа индивидуальных веществ и числа уравнений, их связывающих, следовательно,

Связь 

Пример 2. Пусть система представлена равновесием
Число независимых компонентов в ней равно

Это легко понять, если записать выражение температурной зависимости константы равновесия:
Следовательно, чтобы определить значение любой из переменных, нужно задать значения остальных трех.
Пример 3. Пусть система представлена ненасыщенным водным раствором хлористого натрия NaCl. В растворе, помимо молекул воды

Эта однофазная система представлена тремя индивидуальными фермами соединений и одним уравнением, отсюда число независимых компонентов в этой однофазной системе равно
Поскольку газовая фаза (пар над раствором) не входит в рассматриваемую систему (по условию), то в выражении правила фаз Гиббса число параметров должно стать на единицу меньше, т. е. 
Однокомпонентные системы
Наиболее просты системы, состоящие из одного компонента. Каждая однокомпонентная система представлена единственным веществом, находящимся в различных агрегатных состояниях. Так, например, вода может существовать в парообразном, жидком и кристаллическом состояниях, каждое из которых устойчиво в определенных интервалах температуры и давления.
Переменными параметрами . однокомпонентных систем могут служить только давление и температура, поскольку состав фаз по условию постоянен. Поэтому состояние однокомпонентных систем может быть представлено в виде зависимости давления от температуры:
Графическое изображение такой зависимости получило название диаграммы состояния или фазовой диаграммы
состояния, поскольку состав фаз в однокомпонентной системе одинаков и при изменении условий не меняется.
Давление пара в процессах па рообра зова ни я уста на вл ивается и над твердыми, и над жидкими веществами:
Характер этой функциональной зависимости приведен на графике рис. 7.1. Точка плавления кристаллической фазы находится .совместным решением приведенных выше уравнений; исходя из условия равенства жидкой и кристаллической фаз должно выполняться условие 
При переходе из кристаллического состояния в пар (сублимация) степень разупорядоченности движения частиц больше, чем при испарении (в жидкости беспорядочность движения частиц больше, чем в кристаллах), поэтому величина 
Поскольку температура может принимать только значения Т > 0, величина 
Точно так же обстоит дело с полиморфными превращениями, если они есть.
Зависимость температуры плавления чистых веществ от давления p = fT можно определить уравнением Клаузиуса— Клайперона (приближенная форма):
В этом уравнении


На рис. 7.2, а, б показано, что каждому из условий соответствует определенный наклон линии р = f(Т). Крутой ход кривых в равновесии между двумя конденсированными фазами объясняют незначительной разностью
Рассмотрим в качестве примера однокомпонентную систему вода—лед—пар. С точки зрения правила фаз Гиббса для такой системы 
Равновесие двух фаз (испарение, сублимация) характеризуется одной степенью свободы (произвольны давление или температура). Двухфазные превращения описываются следующими уравнениями:

При использовании этих данных на рис. 7.3 построен график зависимости р =f(Т), получивший название диаграммы’; состояния воды. Линии (а), (b) и (с) отвечают равновесиям двух фаз: твердое вещество— пар; твердое вещество— жидкость; жидкость— пар соответственно. Точка пересечения трех кривых носит название тройной точки, она отвечает равновесию всех трех фаз, а участки диаграммы I, II и III отвечают однофазному равновесию с тремя степенями свободы. Линия (b) имеет отрицательный наклон, соответствующий отрицательному значению 
Двухкомпонентные системы
Перейдем к характеристике более сложных, двухкомпонентных систем. С точки зрения правила фаз число степеней свободы в системах с К = 2 может максимально быть равным 3, если Ф= 1. Это означает, что кроме таких переменных параметров системы, как давление и температура, появляется третий— концентрация раствора. Примером однофазных систем переменного состава, образованных двумя и более независимыми компонентами, служат растворы. Растворы образуются во всех агрегатных состояниях. Они могут быть газообразными, жидкими и твердыми.
Все газы в любых соотношениях между собой неограниченно растворимы. Только при низких температурах и очень высоких давлениях в некоторых газовых смесях наблюдается расслоение. В жидком состоянии ограничение растворимости наблюдают довольно часто. Однако с повышением температуры растворимость обычно возрастает, так что многие жидкие смеси, расслоенные на две фазы, с повышением температуры становятся однофазными. Наиболее важные группы жидких растворов следующие:
1) водные, неводные и органические растворы;
2) солевые расплавы галогенидных, кислородных и сульфидных соединений (при высоких температурах);
3) расплавы металлов (при высоких температурах).
В твердом состоянии ограничение в растворимости также имеет место. Известны три типа твердых растворов: замещения, внедрения и вычитания. Твердые растворы замещения обычно образуются двумя или несколькими различными элементами, так что в кристаллической структуре места атомов одного элемента неупорядоченно замещаются атомами второго элемента. В результате распределение каждого из элементов оказывается хаотическим, а соотношение между количествами атомов того и другого сорта — произвольным. Примерами твердых растворов замещения служат сплавы меди и никеля или смешанные кристаллы хлористого и бромистого натрия. Твердые растворы внедрения получают чаще всего при растворении небольших по размеру атомов неметаллов в металлической решетке, например раствор углерода в железе. В этом случае атомы неметаллов (Н, В, С, О и др.) хаотически и в произвольных соотношениях располагаются в промежутках между атомами металла.
Твердые растворы вычитания, или дефектные структуры, характеризуются наличием пустот, которые размещаются хаотически и создают беспорядок в расположении мест, занятых атомами элементов. Примером таких структур служит сульфидный минерал пирротин, монотонно изменяющий свой состав в пределах
Общая характеристика растворов
Процесс растворения— сложный физико-химический акт, а не простое распределение частиц одного вещества между частицами другого, которое в какой-то степени применимо для описания разреженных газовых смесей. В жидких и твердых растворах частицы растворителя и растворенного вещества непосредственно взаимодействуют между собой и находятся на таких коротких расстояниях, как и в химических соединениях. Взаимодействие молекул растворителя с растворяемым веществом зависит от сил разнообразной природы, за счет которых в растворе образуются устойчивые комплексные и полимерные соединения, способные существовать вне раствора,— сольваты, а в случае водных растворов—гидраты.
Одна из важнейших количественных характеристик растворов, связанная через закон действующих масс с энергетикой процессов растворения,— концентрация раствора. Поэтому целесообразно вспомнить некоторые наиболее используемые способы выражения концентраций, кроме уже упомянутых молярности и молярной доли следует знать массовую и объемную доли, моляльную концентрацию (моляль-ность), титр.
Поскольку процессы растворения имеют сложную химическую природу, законы, определяющие растворение и отражающие природу растворов, сложны. Для упрощения введено понятие идеального раствора, простейшими примерами которого могут служить разреженные газы. В реальных газах соотношение между объемом, давлением и температурой описывается уравнением Ван-дер-Ваальса
В этом уравнении слагаемые

Составляя смеси таких газов, можно убедиться в том, что для их взаимодействия справедливо условие 
Газовые растворы, которые образуются из составляющих их частей с нулевым тепловым эффектом, а объем их смеси в точности равен сумме объемов частей, получили название идеальных.
Для жидких и твердых растворов также существует понятие идеальности, в общем виде оно может быть сформулировано следующим образом: идеальными называют растворы, которые образуются из составных частей при выполнении условий
Примерами идеальных растворов могут служить газовые смеси изотопов, а также все разбавленные растворы. И действительно, добавление к растворителю небольшого количества растворяемого вещества мало изменяет свойства растворителя и раствора, и условие идеальности (7.2) справедливо. Но свойства растворяемого вещества в таком растворе далеки от идеальных.
Концентрированные растворы но свойствам не близки к идеальным, однако для получения грубой качественной картины их можно описывать с помощью модели идеальных растворов. Для строгого решения производственных и научных задач требуется обязательное введение поправок на реальность.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
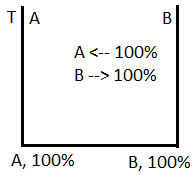
В процессе кристаллизации изменяются и концентрация фаз (поэтому состав жидкости изменяется), и количество каждой фазы (при кристаллизации количество твердой фазы увеличивается, а жидкой уменьшается). В любой точке диаграммы, когда в сплаве одновременно существуют две фазы, можно определить количество обеих фаз и их концентрацию. По диаграмме состояния можно также установить, является ли образующаяся кристаллическая фаза твердым раствором, химическим соединением или чистым компонентом. Для этого служит так называемое правило рычага, или правило отрезков.
Первое положение правила отрезков формулируется следующим образом. Чтобы определить концентрации компонентов в фазах, через данную точку, характеризующую состояние сплава, проводят горизонтальную линию до пересечения с линиями, ограничивающими данную область; проекции точек пересечения на ось концентраций показывают составы фаз.
Рассмотрим диаграмму (рис. 4.3), аналогичную диаграмме Pb – Sb. В точке а, показывающей состояние сплава К при температуре t1, сплав состоит из кристаллов В и жидкости. Выше точки l сплав находится в однофазном состоянии, и концентрация компонентов в этой фазе (т.е. в жидкости) определяется проекцией точки l. При охлаждении из сплава выделяются кристаллы В, и состав жидкости изменяется в сторону увеличения в ней компонента А.
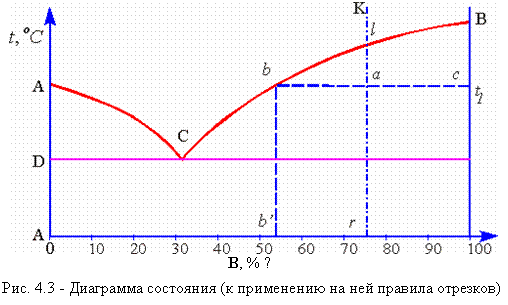 4.3 — Диаграмма состояния (к применению на ней правила отрезков) «> |
При температуре t1 концентрация компонента В в жидкости определяется проекцией точки b; это максимальное количество компонента В, которое может содержать жидкость при t1. По достижении температуры солидус жидкость принимает концентрацию точки С. Следовательно, при охлаждении сплава К. концентрация жидкости меняется по кривой lС. Выделяющиеся кристаллы В имеют постоянный состав – это чистый компонент В, концентрация которого лежит на вертикальной оси ВВ.
Следовательно, для сплава К при температуре t1 составы обеих фаз определяются проекциями точек b и с, так как эти точки находятся на пересечении горизонтальной линии проходящей через точку а, с линиями диаграммы.
Количество этих фаз также можно определить c помощью второго положения правила отрезков. Для того чтобы определить количественное соотношение фаз, через заданную точку проводят горизонтальную линию. Отрезки этой линии между заданной точкой и точками, определяющими составы фаз, обратно пропорциональны количествам этих фаз.
Например: при t1
количество жидкой фазы ас/bc .100 %
количество твердой фазы ba/bc .100 %