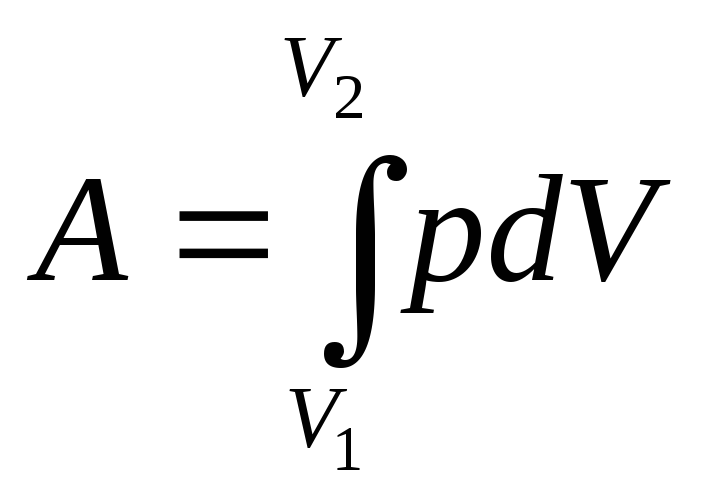Поглощенное тепло определяется как передача энергии между двумя телами при различных температурах. Тот, у кого более низкая температура, поглощает тепло того, у кого более высокая температура. Когда это происходит, тепловая энергия вещества, поглощающего тепло, увеличивается, а частицы, составляющие его, вибрируют быстрее, повышая свою кинетическую энергию.
Это может привести к повышению температуры или изменению состояния. Например, переходите от твердого вещества к жидкому, как лед, когда он тает при контакте с водой или содой при комнатной температуре.
Металлическая ложка поглощает тепло горячего кофе. Источник: Pixabay.
Благодаря теплу объекты также могут изменять свои размеры. Тепловое расширение — хороший пример этого явления. Когда большинство веществ нагревается, они имеют тенденцию увеличиваться в размерах.
Исключением является вода. Такое же количество жидкой воды увеличивает свой объем, когда она охлаждается ниже 4ºC. Кроме того, при изменении температуры может наблюдаться изменение ее плотности, что также очень заметно в случае воды.
Из чего состоит и формулы
В случае передачи энергии единицами поглощенного тепла являются джоули. Однако долгое время у тепла были свои единицы: калорийность.
Даже сегодня эта единица измерения используется для количественной оценки энергетической ценности пищи, хотя на самом деле одна диетическая калория соответствует одной килокалории тепла.
Калории
Калорийность, сокращенно известная как лайм, — это количество тепла, необходимое для повышения температуры 1 грамма воды на 1ºC.
В 19 веке сэр Джеймс Прескотт Джоуль (1818 — 1889) провел знаменитый эксперимент, в котором ему удалось преобразовать механическую работу в тепло, получив следующую эквивалентность:
В британских единицах тепловая единица называется Btu (британская тепловая единица), которая определяется как количество тепла, необходимое для повышения температуры одного фунта воды на 1 ° F.
Эквивалентность единиц следующая:
Проблема этих старых агрегатов в том, что количество тепла зависит от температуры. То есть, температура, необходимая для перехода с 70ºC до 75ºC, отличается от температуры, необходимой, например, для нагрева воды с 9ºC до 10ºC.
Вот почему определение предполагает четко определенные диапазоны: от 14,5 до 15,5 ° C и от 63 до 64 ° F для калорий и британских тепловых единиц соответственно.
От чего зависит количество поглощенного тепла?
Количество поглощенного тепла, которое улавливает материал, зависит от нескольких факторов:
— Масса. Чем больше масса, тем больше тепла она способна поглотить.
— Характеристики вещества. Есть вещества, которые, в зависимости от их молекулярной или атомной структуры, способны поглощать больше тепла, чем другие.
— Температура. Для получения более высокой температуры требуется дополнительное количество тепла.
Количество тепла, обозначенное Q, пропорционально описанным факторам. Следовательно, это можно записать как:
Где m — масса объекта, c — постоянная, называемая удельной теплоемкостью, внутренним свойством вещества, а Δ T — это изменение температуры, достигаемое за счет поглощения тепла.
Эта разница имеет положительный знак, так как при поглощении тепла ожидается, что T f > T o. Это происходит, если вещество не претерпевает фазового перехода, такого как переход воды из жидкости в пар. Когда вода закипает, ее температура остается постоянной примерно на 100ºC, независимо от того, как быстро она закипает.
Как это рассчитать?
Посредством соприкосновения двух объектов с разной температурой через некоторое время они оба достигают теплового равновесия. Затем температуры выравниваются и теплообмен прекращается. То же самое происходит, если соприкасается более двух объектов. Через определенное время все они будут иметь одинаковую температуру.
Если предположить, что соприкасающиеся объекты образуют замкнутую систему, из которой не может уйти тепло, применяется принцип сохранения энергии, поэтому можно утверждать, что:
Q поглощено = — Q отдано
Это представляет собой энергетический баланс, похожий на баланс доходов и расходов человека. По этой причине передаваемое тепло имеет отрицательный знак, так как для объекта, который уступает, конечная температура ниже начальной. Таким образом:
Уравнение Q поглощено = — Q уступлено, когда два объекта находятся в контакте.
Энергетический баланс
Для проведения энергетического баланса необходимо различать объекты, поглощающие тепло, от объектов, которые отдаются, тогда:
Σ Q k = 0
То есть сумма прироста и потерь энергии в замкнутой системе должна равняться 0.
Удельная теплоемкость вещества
Чтобы рассчитать количество поглощенного тепла, необходимо знать удельную теплоемкость каждого участвующего вещества. Это количество тепла, необходимое для повышения температуры 1 г материала на 1 ° C. Его единицы в Международной системе: Джоуль / кг. K.
Существуют таблицы с удельной теплоемкостью многих веществ, обычно рассчитываемой с помощью калориметра или аналогичных инструментов.
Пример того, как рассчитать удельную теплоемкость материала
Для повышения температуры металлического кольца с 20 до 30 ºC требуется 250 калорий. Если кольцо имеет массу 90 г. Какова удельная теплоемкость металла в единицах СИ?
Решение
Сначала конвертируются единицы:
Q = 250 калорий = 1046,5 Дж
m = 90 г = 90 x 10-3 кг
Упражнение решено
Алюминиевая чашка содержит 225 г воды и медную мешалку на 40 г при температуре 27 ° C. Образец серебра массой 400 г при начальной температуре 87 ° C помещается в воду.
Мешалка используется для перемешивания смеси до достижения конечной равновесной температуры 32 ° C. Рассчитайте массу алюминиевого стакана, учитывая, что нет потерь тепла в окружающую среду.
Схема калориметра. Источник: Solidswiki.
Подходить
Как было сказано выше, важно различать предметы, которые отдают тепло, от предметов, которые поглощают:
— Алюминиевая чашка, медная мешалка и вода поглощают тепло.
— Образец серебра выделяет тепло.
Данные
Указана удельная теплоемкость каждого вещества:
Тепло, поглощаемое или передаваемое каждым веществом, рассчитывается по формуле:
Решение
Серебряный
Q дает = 400 x 10 -3 . 234 x (32 — 87) Дж = -5148 Дж
Медная мешалка
Q поглощено = 40 x 10 -3 . 387 x (32 — 27) Дж = 77,4 Дж
вода
Поглощенный Q = 225 x 10 -3 . 4186 x (32 — 27) Дж = 4709,25 Дж
Алюминиевая кружка
Q поглощено = m алюминия . 900 x (32 — 27) J = 4500 мкм алюминия
Использование:
Σ Q k = 0
77,4 + 4709,25 + 4500 мкм алюминия = — (-5148)
Наконец, масса алюминия очищается:
м алюминия = 0,0803 кг = 80,3 г
Ссылки
- Джанколи, Д. 2006. Физика: принципы с приложениями. 6 чт . Эд Прентис Холл. 400 — 410.
- Киркпатрик, Л. 2007. Физика: взгляд на мир. 6 ta Редактирование сокращено. Cengage Learning. 156-164.
- Рекс, А. 2011. Основы физики. Пирсон. 309-332.
- Сирс, Земанский. 2016. Университетская физика с современной физикой. 14 чт . Volume1. 556-553.
- Serway, R., Vulle, C. 2011. Основы физики. 9 на Cengage Learning. 362–374
Enter the specific heat, change in temperature, and mass into the calculator to determine the total amount of heat absorbed.
- Heat Loss Calculator
- Heat Dissipation Calculator
- Cooling Capacity Calculator
- Specific Heat Calculator
- Heat Rejection Calculator
Heat Absorbtion Formula
The following formula is used to calculate the total amount of heat energy absorbed by a mass.
- Where Q is the total amount of heat energy absorbed by a mass
- m is the mass
- C is the specific heat of the material
- ΔT is the change in temperature
To calculate a heat absorption, multiply the mass by the the change in temperature, then finally multiply again by the specific heat.
This formula is also used for heat loss calculations, but the difference, in this case, is that the final temperature will be higher than the initial temperature.
Therefore, the formula for the change in temperature would be T2-T1 instead of T1-T2 in the case of cooling.
What is head absorption?
Heat absorption is the process of a material increasing in temperature due to it taking energy for a higher temperature material or solution.
The methods of heat transfer include conduction, convection, and radiation.
Example Problem
How to calculate heat absorption?
First, determine the total mass of the object or solution that is absorbing the heat.
For this example problem, the total mass of the solution is found to be 50kg.
Next, determine the specific heat of the material.
In this case, the specific heat is found to be 400 J/kg-C.
Next, determine the total change in temperature. The initial temperature is 20 C and the final temperature is 60C. Therefore the change in temperature is calculated to be 60C-20C = 40C.
Finally, calculate the total amount of heat absorbed using the formula above:
Q = m*C*ΔT
Q = 50*400*40
Q = 800,000 J.

Содержание
- TL; DR (слишком долго; не читал)
- Первый закон термодинамики и тепла
- Удельная теплоемкость объяснена
- Расчет поглощения тепла
- Советы по альтернативным единицам
На повседневном языке люди используют термины тепло и температура взаимозаменяемо. Однако в области термодинамики и физики оба термина имеют очень разные значения. Если вы пытаетесь рассчитать, сколько тепла поглощается чем-то, когда вы поднимаете температуру, вам нужно понять разницу между этими двумя показателями и как рассчитать одно из другого. Вы можете сделать это легко: просто умножьте теплоемкость вещества, которое вы нагреваете, на массу вещества и изменение температуры, чтобы найти поглощенное тепло.
TL; DR (слишком долго; не читал)
Рассчитайте теплопоглощение по формуле:
Q = тс∆T
Q означает поглощенное тепло, м масса вещества, поглощающего тепло, с удельная теплоемкость и ΔT это изменение температуры.
Первый закон термодинамики и тепла
Первый закон термодинамики гласит, что изменение внутренней энергии вещества является суммой тепла, переданного ему, и работы, проделанной над ним (или тепла, переданного ему минус проделанная работа по Это). «Работа» — это просто слово, которое физики используют для передачи физической энергии. Например, перемешивание чашки кофе работает в жидкости внутри него, и вы работаете над объектом, когда берете его или бросаете.
Тепло является еще одной формой передачи энергии, но она происходит, когда два объекта имеют разные температуры друг к другу. Если вы положите холодную воду в кастрюлю и включите плиту, пламя нагревает кастрюлю, а горячая кастрюля нагревает воду. Это повышает температуру воды и дает ей энергию. Второй закон термодинамики гласит, что тепло течет только от более горячих предметов к более холодным, а не наоборот.
Удельная теплоемкость объяснена
Ключом к решению проблемы расчета теплопоглощения является понятие удельной теплоемкости. Разные вещества нуждаются в разном количестве энергии, которая должна быть передана им, чтобы поднять температуру, и удельная теплоемкость вещества говорит вам, сколько это. Это количество с учетом символа с и измеряется в градусах Дж / кг Цельсия. Короче говоря, теплоемкость говорит вам, сколько тепловой энергии (в джоулях) необходимо для повышения температуры 1 кг материала на 1 градус C. Удельная теплоемкость воды составляет 4181 Дж / кг градуса C, а удельная теплоемкость Теплоемкость свинца составляет 128 Дж / кг градуса С. Сразу видно, что для повышения температуры свинца требуется меньше энергии, чем для воды.
Расчет поглощения тепла
Вы можете использовать информацию в двух последних разделах вместе с одной простой формулой для расчета поглощения тепла в конкретной ситуации. Все, что вам нужно знать, это разогреваемое вещество, изменение температуры и массы вещества. Уравнение:
Q = тс∆T
Вот, Q означает тепло (что вы хотите знать), м означает массу, с означает удельную теплоемкость и ΔT это изменение температуры. Вы можете найти изменение температуры, вычитая начальную температуру из конечной температуры.
В качестве примера представьте, что температура воды повышается на 2 кг с 10 до 50 градусов Цельсия. Изменение температуры составляет ∆T = (50 — 10) градусов C = 40 градусов C. Из последней секции удельная теплоемкость воды составляет 4181 Дж / кг градуса C, поэтому уравнение дает:
Q = 2 кг × 4181 Дж / кг градус C × 40 градус C
= 334 480 Дж = 334,5 кДж
Таким образом, требуется около 334,5 тысяч джоулей (кДж) тепла, чтобы поднять температуру 2 кг воды на 40 градусов Цельсия.
Советы по альтернативным единицам
Иногда удельная теплоемкость указана в разных единицах. Например, оно может быть указано в джоулях / граммах C, калориях / граммах C или джолях / моль C. Калория — это альтернативная единица энергии (1 калория = 4,184 Дж), граммы составляют 1/1000 килограмма. и моль (сокращенный до моль) является единицей, используемой в химии. Пока вы используете последовательные единицы, формула выше будет держаться.
Например, если удельная теплоемкость приведена в градусах С в джоулях на грамм, укажите также массу вещества в граммах или, в качестве альтернативы, преобразуйте удельную теплоемкость в килограммы, умножив ее на 1000. Если теплоемкость дана в градусах Дж / моль, проще всего указать массу вещества в молях. Если теплоемкость указана в калориях / кг градусах С, ваш результат будет выражен в калориях тепла, а не в джоулях, которые вы можете затем преобразовать, если вам нужен ответ в джоулях.
Если вы встретите Кельвин как единицу измерения температуры (символ K), то при изменении температуры это точно так же, как и по Цельсию, поэтому вам не нужно ничего делать.
Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции.
Любая химическая реакция сопровождается выделением или поглощением энергии в виде теплоты.
По признаку выделения или поглощения теплоты различают экзотермические и эндотермические реакции.
Экзотермические реакции – такие реакции, в ходе которых тепло выделяется (+Q).
Эндотермические реакции – реакции, при протекании которых тепло поглощается (-Q).
Тепловым эффектом реакции (Q) называют количество теплоты, которое выделяется или поглощается при взаимодействии определенного количества исходных реагентов.
Термохимическим уравнением называют уравнение, в котором указан тепловой эффект химической реакции. Так, например, термохимическими являются уравнения:
Также следует отметить, что термохимические уравнения в обязательном порядке должны включать информацию об агрегатных состояниях реагентов и продуктов, поскольку от этого зависит значение теплового эффекта.
Расчеты теплового эффекта реакции
Пример типовой задачи на нахождение теплового эффекта реакции:
При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с уравнением
C6H12O6(тв.) + 6O2(г) = 6CO2(г) + 6H2O(г) + Q
выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
Решение:
Рассчитаем количество вещества глюкозы:
n(C6H12O6) = m(C6H12O6) / M(C6H12O6) = 45 г / 180 г/моль = 0,25 моль
Т.е. при взаимодействии 0,25 моль глюкозы с кислородом выделяется 700 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль глюкозы с кислородом образуется количество теплоты, равное Q (тепловой эффект реакции). Тогда верна следующая пропорция:
0,25 моль глюкозы — 700 кДж
1 моль глюкозы — Q
Из этой пропорции следует соответствующее ей уравнение:
0,25 / 1 = 700 / Q
Решая которое, находим, что:
Q = 2800 кДж
Таким образом, тепловой эффект реакции составляет 2800 кДж.
Расчёты по термохимическим уравнениям
Намного чаще в заданиях ЕГЭ по термохимии значение теплового эффекта уже известно, т.к. в условии дается полное термохимическое уравнение.
Рассчитать в таком случае требуется либо количество теплоты, выделяющееся/поглощающееся при известном количестве реагента или продукта, либо же, наоборот, по известному значению теплоты требуется определить массу, объем или количество вещества какого-либо фигуранта реакции.
Пример 1
В соответствии с термохимическим уравнением реакции
3Fe3O4(тв.) + 8Al(тв.) = 9Fe(тв.) + 4Al2O3(тв.) + 3330 кДж
образовалось 68 г оксида алюминия. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Решение
Рассчитаем количество вещества оксида алюминия:
n(Al2O3) = m(Al2O3) / M(Al2O3) = 68 г / 102 г/моль = 0,667 моль
В соответствии с термохимическим уравнением реакции при образовании 4 моль оксида алюминия выделяется 3330 кДж. В нашем же случае образуется 0,6667 моль оксида алюминия. Обозначив количество теплоты, выделившейся при этом, через x кДж составим пропорцию:
4 моль Al2O3 — 3330 кДж
0,667 моль Al2O3 — x кДж
Данной пропорции соответствует уравнение:
4 / 0,667 = 3330 / x
Решая которое, находим, что x = 555 кДж
Т.е. при образовании 68 г оксида алюминия в соответствии с термохимическим уравнением в условии выделяется 555 кДж теплоты.
Пример 2
В результате реакции, термохимическое уравнение которой
4FeS2(тв.) + 11O2(г) = 8SO2(г) + 2Fe2O3(тв.) + 3310 кДж
выделилось 1655 кДж теплоты. Определите объем (л) выделившегося диоксида серы (н.у.). (Запишите число с точностью до целых.)
Решение
В соответствии с термохимическим уравнением реакции при образовании 8 моль SO2 выделяется 3310 кДж теплоты. В нашем же случае выделилось 1655 кДж теплоты. Пусть количество вещества SO2, образовавшегося при этом, равняется x моль. Тогда справедливой является следующая пропорция:
8 моль SO2 — 3310 кДж
x моль SO2 — 1655 кДж
Из которой следует уравнение:
8 / х = 3310 / 1655
Решая которое, находим, что:
x = 4 моль
Таким образом, количество вещества SO2, образовавшееся при этом, составляет 4 моль. Следовательно, его объем равен:
V(SO2) = Vm ∙ n(SO2) = 22,4 л/моль ∙ 4 моль = 89,6 л ≈ 90 л (округляем до целых, т.к. это требуется в условии.)
Больше разобранных задач на тепловой эффект химической реакции можно найти здесь.
Теплота Количество теплоты. Тепловое расширение тел
Количество
теплоты Q, необходимое для нагревания
т килограммов вещества от t1
до t2
градусов, определяется по формуле
Q=cm(t2-t1)
где с — удельная
теплоемкость вещества.
Количество
теплоты, выделяемое (поглощаемое)
при переходе вещества из одного
агрегатного состояния
в другое, определяется формулами:
Q
= λm
и Q
= rm,
где
m
— масса вещества; λ — удельная теплота
плавления; r — удельная теплота
парообразования.
При
повышении температуры длина твердых
тел возрастает в первом приближении
линейно с температурой по закону
L=L0(1+αt)
где
L
и Lа
— соответственно длина тела при
температуре
t°
С и 0° С; α — коэффициент линейного
расширения тела.
При
увеличении линейных размеров тела при
нагревании по приведенному выше закону
объем
его меняется по закону
V=V0
(1+βt)
где
β — коэффициент объемного расширения.
При
небольших температурах β≈3α.
При
тепловом расширении тел их плотность
ρ изменяется по закону
ρ=ρ0/(1+βt)
где
ρ0
— плотность тела при температуре 0°С
Теплоотдача и терморегуляция
Количество
теплоты Q,
переносимое вследствие теплопроводности
за время Δt,
определяется формулой
Q=k1ΔTΔSΔt/Δx
где
k1—
коэффициент теплопроводности; ΔT/Δx
— градиент тем-
пературы
в направлении, перпендикулярном площадке
ΔS.
Количество
теплоты Q,
переносимое вследствие конвекции за
время Δt,
определяется формулой;
Q=k2(T-T0)ΔSΔt
где
k2
— коэффициент теплопередачи при
конвекции; Т и Т0
— соответственно
температуры поверхности ΔS
и омываемой среды.
Количество
теплоты Q,
излучаемое за время Δt
абсолютно черным телом, определяется
формулой (закон Стефана — Больцмана)
Q0=σ0T4ΔSΔt
где
σ0—
постоянная Стефана — Больцмана; Т
— абсолютная температура
тела; ΔS
— площадь излучающей поверхности тела.
Для
реальных физических тел закон Стефана
— Больцмана имеет
вид
Q=k3σ0T4ΔSΔt
где
k3
— коэффициент, учитывающий, что свойства
поверхности реальных
физических тел отличны от свойств
поверхности абсолютно
черного тела (k3
<. 1).Для
теплового излучения кожи человека можно
считать, что
поглощающие и излучающие свойства кожи
и абсолютно черного
тела практически одинаковы, т е. k3=
1.
При
наличии двух встречных потоков радиации
от излучающей
поверхности к среде и от среды к
поверхности закон Стефана
— Больцмана имеет вид
Q=k3σ0(T4–T04)ΔSΔt
где
Т и Т0
— абсолютные температуры тела и
среды; ΔS
— площадь
излучающей поверхности тела.
Длина
волны λт,
которой соответствует максимум
излуча-тельной способности черного
тела, обратно пропорциональна абсолютной
температуре Т (закон смещения Вина):
λm=b/T
где
b
— постоянная закона смещения Вина.
Основные законы идеальных газов
При
изотермическом процессе (Т = const)
произведение объема
V
данной массы газа на его
давление р есть величина постоянная
(закон Бойля —
Мариотта):
pV
= const.
Из
закона следует, что для двух произвольных
состояний газа при указанных условиях
справедливо равенство
p1
V1=
p2
V2
При
изобарическом процессе (р = const)
отношение
объема данной массы газа к его абсолютной
температуре Т есть величина постоянная
(закон Гей-Люссака):
V/T
= const.
Для
двух произвольных состояний при указанных
условиях
V1
/T1=
V2
/T2
Коэффициент
объемного расширения
β=(V-V0)/(V0t0)=1/273
При
изохорическом процессе (V
= const)
отнoшение
давления данной массы газа к его
абсолютной
температуре есть величина постоянная
(закон Шарля):
p/T=
const
Для
двух произвольных состояний при указанных
условиях
p1/T1=p2/T2
Термический
коэффициент давления
Α=(p-p0)/(
p0t0)=1/273
Произведение
давления на объем, деленное на абсолютную
температуру, для данной массы газа есть
величина постоянная (объединенный
газовый закон):
pV/T=const
Для случая перехода
газа из одного состояния в другое
P1V1
/T1
= p2
V2
/T2
Для
любой произвольно взятой массы газа
применимо уравнение
Менделеева — Клапейрона
pV=mRT/μ
где
R
— универсальная газовая постоянная; m
— масса газа , кг;
μ
— масса одного киломоля газа.
Давление
р смеси различных газов равно сумме
парциальных
давлений pt—
газов, составляющих смесь (закон
Дальтона):
p=p1+p2+…+pn=∑pi
Масса одного
киломоля смеси газов
Масса
одной молекулы любого вещества равна
массе кило-моля
этого вещества, деленной на число
Авогадро:
m=μ/N
Давление
р, производимое газом, численно равно
двум третям
средней кинетической энергии
поступательного движения молекулы,
умноженным на число молекул в единице
объема (основное
уравнение молекулярно-кинетической
теории газов):
p=2nώ/3=nmù2/3
где
п — число молекул в единице объема; ώ
— средняя кинетическая
энергия поступательного движения одной
молекулы; ù—
средняя квадратичная скорость молекул.
Средняя кинетическая
энергия поступательного движения
одной молекулы
ώ=3kT/2
где
k
— постоянная Больцмана ( k
=R/T) ;
Т — абсолютная
температура.
Средняя квадратичная
скорость молекул
ū=(3kT/m)1/2=(3RT/μ)1/2
где
m—
масса одной молекулы.
Барометрическая
формула выражает зависимость давления
идеального
газа от высоты h
в поле силы тяжести:
где
р0
— давление газа на высоте h
= 0; g
— ускорение свободного
падения.Барометрическая
формула носит приближенный характер,
так
как температура Т различна на разных
высотах.
Киломольная
теплоемкость С связана с удельной
теплоемкостью формулой
С
= μc
Теплоемкость
одного киломоля и удельная теплоемкость
газа
при постоянном объеме выражаются
формулами:
CV=iR/2и
cV=iR/(2μ)
где i — число
степеней свободы.
Теплоемкость
одного киломоля и удельная теплоемкость
газа
при постоянном давлении выражаются
формулами:
Cp=(i+2)R/2
и
cp=(i+2)R/(2μ)
Разность киломольных
теплоемкостей
Cp-CV=R
Количество
теплоты ΔQ,
подводимое к системе (газу), идет на
изменение ее внутренней энергии и на
совершение системой (газом)
работы ΔA
против внешних сил (первое начало
термодинамики):
ΔQ=ΔU+ΔA
Применение
первого начала термодинамики к различным
процессам приводит
к следующим соотношениям:
1
. Изохорический процесс (V
= const).
Работа , совершаемая газом,
ΔА = 0, поэтому количество теплоты Δ,
подводимое к
газу, полностью идет на изменение
внутренней энергии газа,
т. е.
ΔQ=ΔU
а
так как
ΔU=ΔTCVm/μ
то
ΔQ=ΔTCVm/μ
где
m
— масса газа, кг; μ — масса одного
киломоля газа; CV
— теплоемкость одного киломоля газа
при постоянном объеме; ΔT
— изменение температуры газа.
2.Изобарический
процесс (р = const).
Работа, совершаемая
газом
,
ΔA=pΔV=mRΔT/μ
Изменение внутренней
энергии
ΔU=mCVΔT/μ
Количество теплоты,
подведенной к газу,
ΔQ=ΔU+ΔA=mCp
ΔT/μ
3.Изотермический
процесс (Т =const). Работа,
совершаемая
газом,
ΔA=(mRTln(V2/V1))/μ=p1V1ln(p1/p2)
где
V1tp1иV2,p2-объем и давление
соответственно в первом и втором
состояниях.
Изменение внутренней
энергии ΔU= 0, следовательно,
теплота, подведенная
к газу, полностью идет на совершение
работы, т. е.
ΔQ=ΔA
4.
Адиабатический процесс происходит
без теплообмена с
окружающей средой, т. е. ΔQ
= 0. Изменение внутренней энергии
ΔU=mCVΔT/μ
Работа газа
совершается за счет убыли внутренней
энергии:
ΔA=-ΔA=-ΔTmCV/μ
или
где
t1
— начальная
температура; γ — отношение теплоемкостей
(γ=Cp/CV);
V1
и V2-—начальный
и конечный объемы газа.
Работа,
совершаемая газом при изменении объема
от V1
до V2,
где
р — давление.
Для
адиабатного процесса (Q
= 0)
ΔU=A=nCv(T2-T1)
Здесь
n
— число молей идеального газа, СV
— молярная теплоемкость
газа при постоянном объеме, Т1
и T2
— начальная и конечная температуры.
Обмен веществ в
живых организмах также подчиняется
первому закону
термодинамики. Определение энергетического
обмена между живыми организмами и
окружающей средой осуществляется
с помощью калориметрии, которая
подразделяется
на прямую и непрямую. Более распространенной
является
непрямая калориметрия. В этом случае о
суммарном тепловом
эффекте реакций, протекших в организме,
судят по калорическому
коэффициенту кислорода. Он показывает,
какое количество
теплоты выделяется при полном окислении
данного вещества
до углекислого газа и воды на каждый
литр поглощенного
организмом кислорода. Установлено, что
этот коэффициент
для углеводов равен 20,9, для жиров — 19,7
и для белков — 20,3 кДж. Однако в живом
организме идет также синтез веществ,
которые затем могут окисляться. Чтобыучесть общее
количество теплоты, освобождаемое живым
организмом за
определенный промежуток времени, надо
учитывать
дыхательный коэффициент, равный отношению
объема углекислого
газа к потребленному за то же время
кислороду.
Дыхательный коэффициент для углеводов
равен 1, для белков — 0,8 и для жиров он
составляет 0,7. Существует связь
между дыхательным и калорическим
коэффициентами Это
позволяет устанавливать расход энергии
организма, зная количество поглощенного
кислорода и выделенного углекислого
газа.
Связь калорического
коэффициента 1 л кислорода с дыхательным
коэффициентом
|
Дыхатель-
ный
фициент |
к.к.
кДж |
Дыха-
тельный
коэффи-
циент |
К
кДж |
Дыхатель-
ный
фициент |
К.К.
кДж |
Дыха-
тельный
коэффи-
циент |
кДж |
|
0,70 |
19,619 |
0,78 |
19,996 |
0,86 |
20,41 |
0,94 |
20,821 |
|
0,71 |
19,636 |
0,79 |
20,051 |
0,87 |
20,461 |
0,95 |
20,871 |
|
0,72 |
19,686 |
0,80 |
20,101 |
0,88 |
20,515 |
0,96 |
20,921 |
|
0,73 |
19,737 |
0,81 |
20,151 |
0,89 |
20,566 |
0,97 |
20,976 |
|
0,74 |
19,791 |
0,82 |
20,201 |
0,90 |
20,616 |
0,98 |
21,026 |
|
0,75 |
19,841 |
0,83 |
20,256 |
0,91 |
20,666 |
0,99 |
21,076 |
|
0,76 |
19,896 |
0,84 |
20,306 |
0,92 |
20,716 |
1,00 |
21,131 |
|
0,77 |
19,946 |
0,85 |
20,360 |
0,93 |
20,767 |
— |
‑‑‑ |
Объем
потребляемого О2
и выделении СО2
при окислении 1 г питательного вещества
|
Вещество |
Потребляется |
Выделяется СО 2, Л |
Дыхательный |
|
Белок Жир Углевод |
0,97 2,0 0,83 |
0,77 1,4 0,83 |
0,8 0,7 1,0 |
Количество теплоты
для обратимого процесса
Q=∫TdS
Изменение
энтропии при нагревании или охлаждении
вещества от температуры Т1до
температурыT2
ΔS=nCpln(T2/T1)
где
Ср
— молярная теплоемкость при постоянном
давлении.
Скорость
изменения энтропии для стационарного
состояния в
живом организме
dS/dt=dSi/dt+dSe/dt=0
Здесь
dSi/dt
скорость изменения энтропии, связанной
с необра
тимыми
процессами в биологической системе;
dSe/dt
— скорость изменения
энтропии вследствие взаимодействия
системы с окружающей
средой.