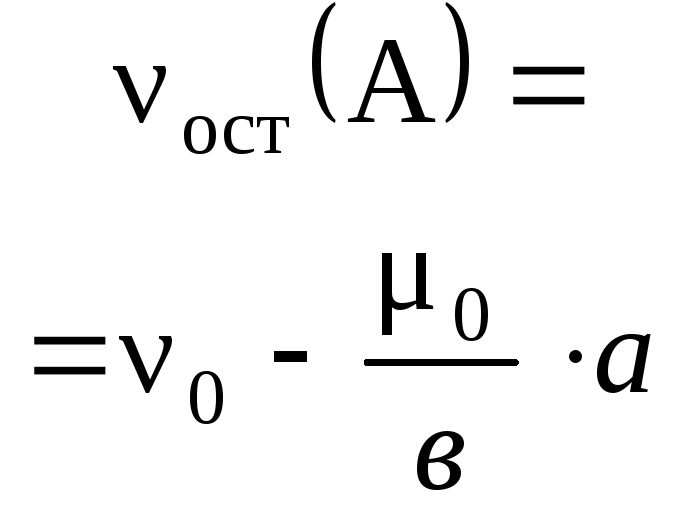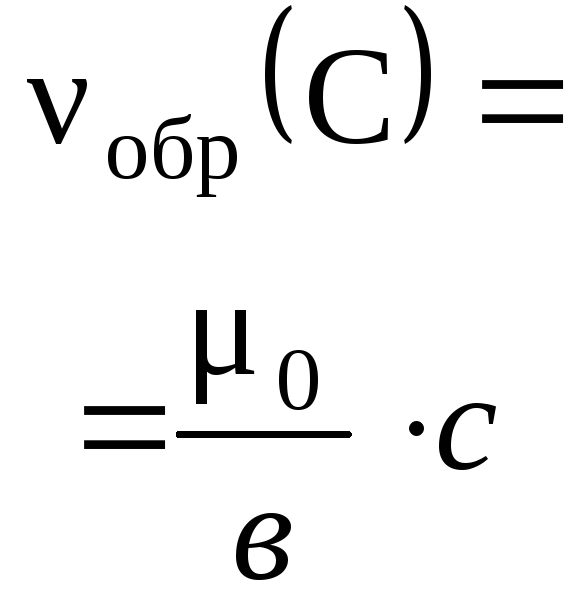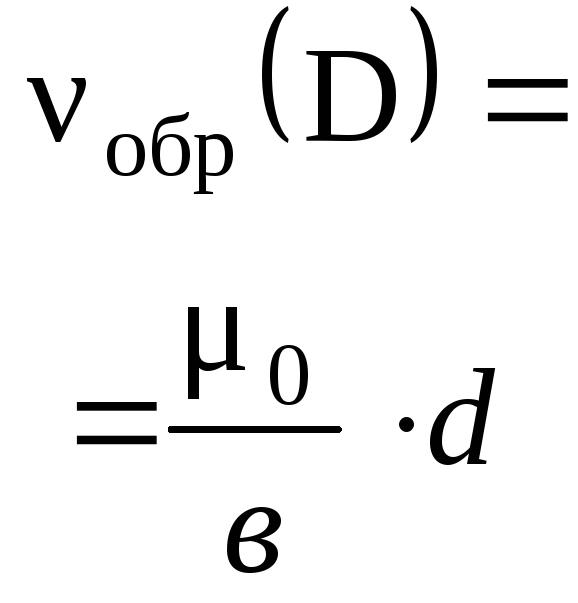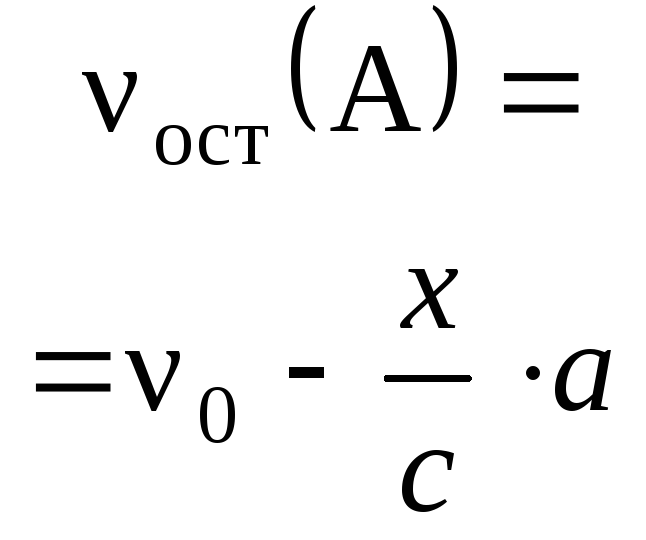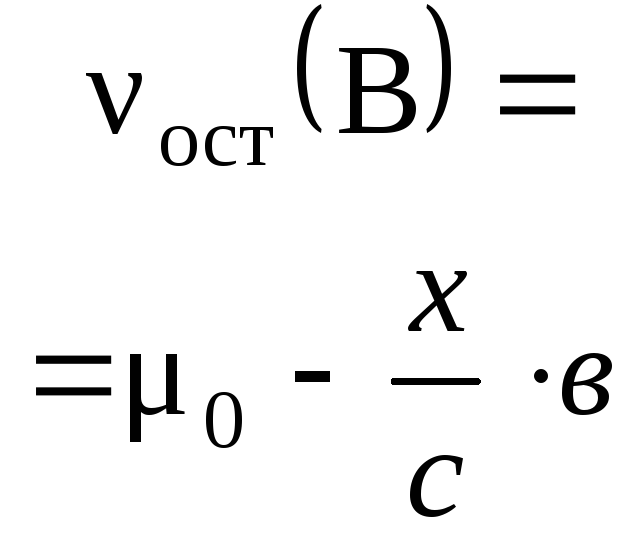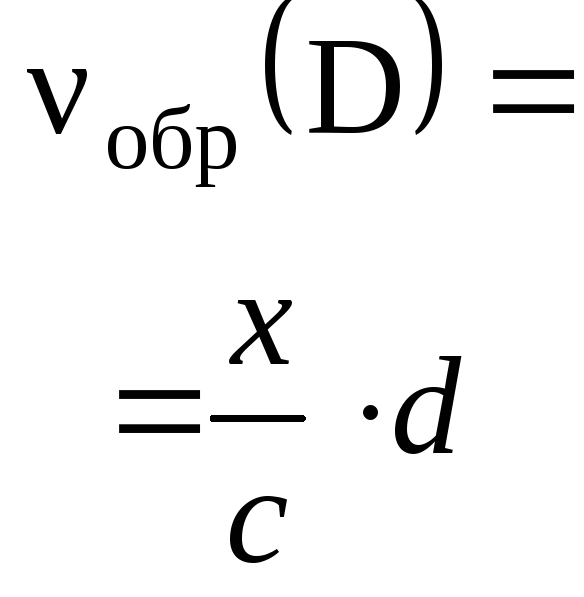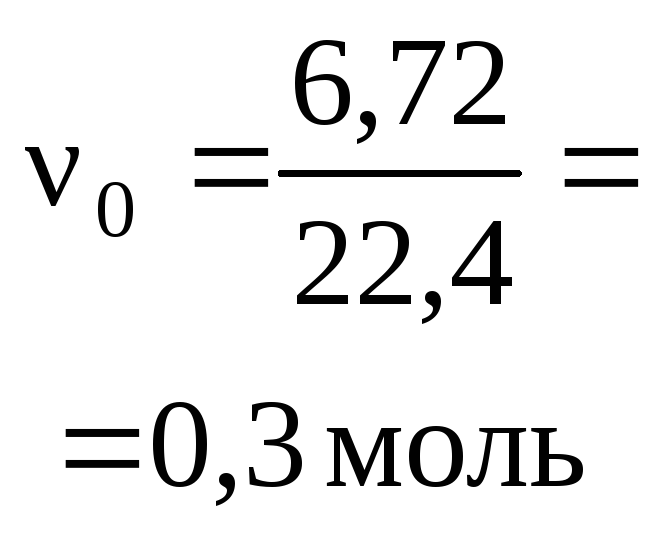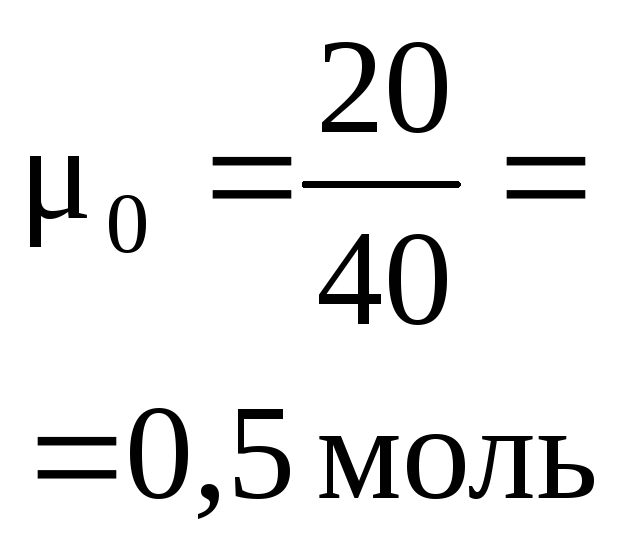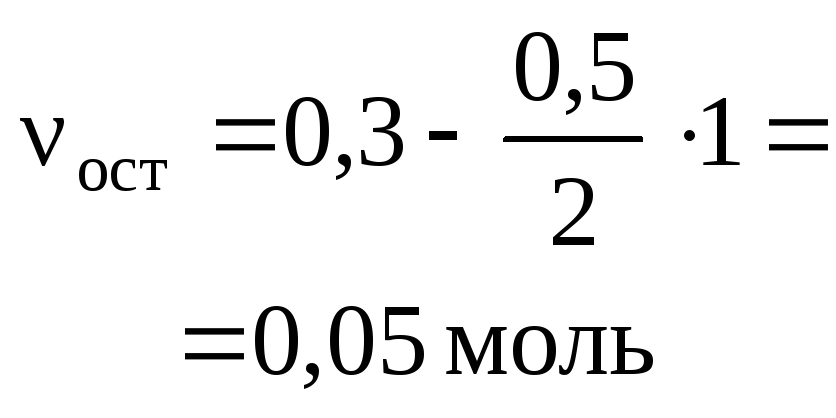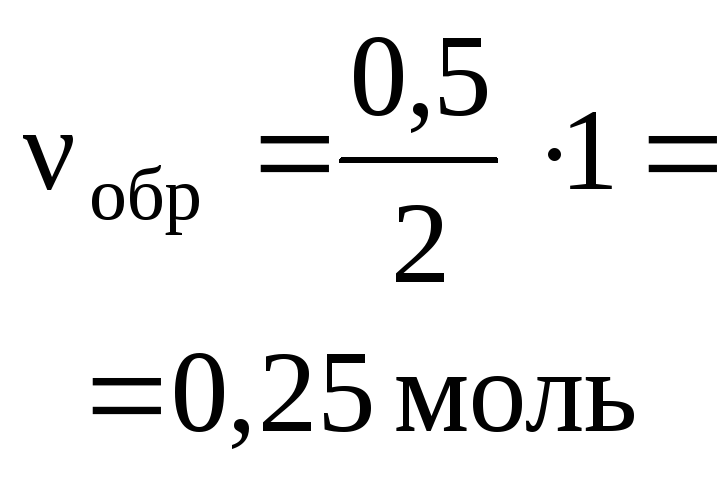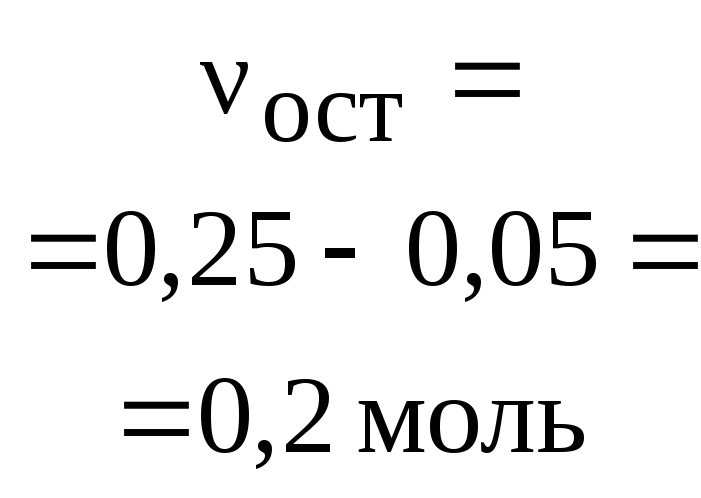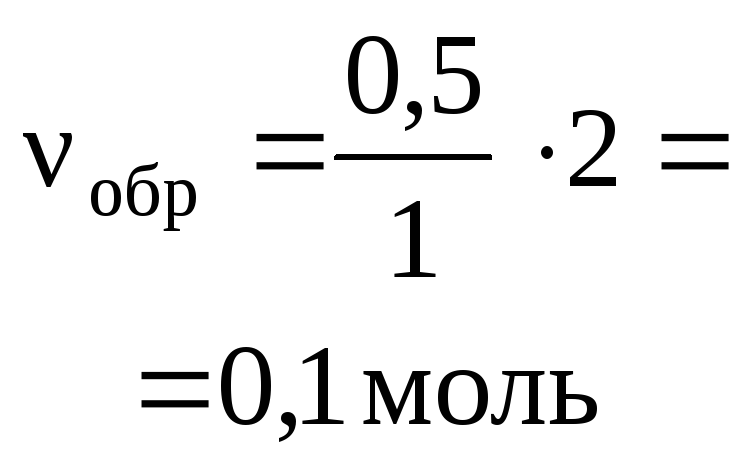ЭКЗАМЕНЫ НЕ ЗА ГОРАМИ
Подготовка к ЕГЭ по химии
Выполнение заданий высокого уровня сложности
Задачи с расчетами по уравнениям
реакций,
происходящих в растворах
При обучении школьников способам решения задач
очень большое значение придаю применению
алгоритмов. Я считаю, что вначале нужно уверенно
овладеть небольшим числом стандартных приемов,
получить представление о возможных типах задач.
Это позволит ученику выйти на творческий уровень
в своем дальнейшем химическом образовании и
самообразовании.
Одно из заданий высокого уровня сложности (оно
входит в третью часть экзаменационной
работы – задание С4) проверяет умение
производить расчеты по уравнениям реакций,
происходящих в растворах.
В учебной литературе недостаточно подробно
объясняются особенности решения таких задач.
Поэтому мы с учениками вначале разбираем все
моменты, на которые нужно обратить внимание,
записываем алгоритмы в общем виде, рассматриваем
решение задач каждого типа, затем отрабатываем
умения на самостоятельном решении целого ряда
подобных задач.
Прежде всего ученик должен усвоить понятие о
массовой доле растворенного вещества, или, иначе,
процентной концентрации раствора. Эта величина
показывает отношение массы растворенного
вещества к массе раствора:
р.в-во
= mр.в-во / mр-р.
Производные формулы:
mр.в-во = mр-р•р.в-во,
mр-р = mр.в-во / р.в-во.
Если в условии задачи указан объем раствора с
определенной плотностью, то прежде всего находят
массу раствора:
mр-р = Vр-р•р-р,
затем – массу растворенного вещества:
mр.в-во = mр-р•р.в-во.
Количество вещества находят по массе
растворенного вещества:
= mр.в-во
/ М.
Рассмотрим некоторые типы задач с расчетами по
уравнениям реакций, происходящих в растворах.
• Нахождение массовых долей веществ в
растворе после реакции.
При решении таких задач прежде всего нужно
найти количества вещества реагентов. Если задача
на избыток и недостаток, то количества вещества
продуктов реакции находят по веществу, которое
дано в недостатке.
Один из важных моментов – это нахождение
массы раствора после реакции (массы
полученного раствора, mр-р получ). Если
какое-либо вещество взаимодействует с веществом,
находящимся в растворе, то складывают массу
вещества и массу раствора; в случае, когда оба
реагирующих вещества даны в виде растворов,
складывают массы двух растворов. Если в
результате реакции образуется осадок или газ, то
из полученной суммы вычитают массу вещества,
ушедшего из раствора в виде осадка или газа:
mр-р получ = mв-во + mр-р –
mосадок (газ),
mр-р получ = mр-р1 + m
р-р2 – mосадок (газ).
При решении задач на избыток и недостаток нужно
помнить о том, что в растворе после реакции будет
находиться в растворенном виде не только продукт
реакции, но и вещество, которое было дано в
избытке.
Чтобы найти количество вещества, которое не
прореагировало – избытка, нужно от исходного
количества вещества отнять количество
прореагировавшего вещества:
изб
= исх –
прор.
Затем найти его массу и массовую долю в
растворе, полученном после реакции.
Задача 1. 4,8 г магния растворили в 200 мл
12%-го раствора серной кислоты ( = 1,05 г/мл). Найти массовую долю
соли в полученном растворе.
| Дано:
m(Mg) = 4,8 г, Vр-р(H2SO4) = 200 мл,
|
Найти: |
Р е ш е н и е
(Мg) = m / M
= 4,8 (г) / 24 (г/моль) = 0,2 моль.
mр-р(H2SO4) = Vр-р• = 200 (мл)•1,05 (г/мл) = 210
г.
mр.в-во(H2SO4) = mр-р•р.в-во = 210•0,12 =
25,2 г.
р.в-во(H2SO4)
= m/M = 25,2 (г) / 98 (г/моль) = 0,26 моль.
В недостатке – Mg. Следовательно:
(MgSO4) = 0,2
моль,
(H2) = 0,2
моль.
mр.в-во(MgSO4) = M• = 120 (г/моль)•0,2 (моль) = 24 г.
m(H2) = M• = 2 (г/моль)•0,2 (моль) = 0,4 г.
mр-р получ = mр-р(H2SO4)
+ m(Mg) – m(H2) = 210 (г) + 4,8 (г) – 0,4 (г) =
214,4 г.
р.в-во(MgSO4)
= mр.в-во(MgSO4) / mр-р получ =
24 (г) / 214,4 (г) = 0,112, или 11,2 %.
О т в е т. р.в-во(MgSO4) = 11,2 %.
Задача 2. Смешали 250 г раствора сульфата
железа(III) с концентрацией 8 % и 50 г раствора
гидроксида натрия с концентрацией 30 %. Найти
концентрацию веществ в получившемся растворе.
| Дано:
mр-р(Fe2(SO4)3)
mр-р(NaOH) = 50 г,
|
Найти: |
Р е ш е н и е
mр.в-во(Fe2(SO4)3) = mр-р•р.в-во = 250
(г)•0,08 = 20 г.
(Fe2(SO4)3)
= m/M = 20 (г) / 400 (г/моль) = 0,05 моль.
mр.в-во(NaOH) = mр-р•р.в-во = 50 (г)•0,3 = 15 г.
(NaOH) = m/M =
15 (г) / 40 (г/моль) = 0,375 моль.
В недостатке – Fe2(SO4)3.
Следовательно:
(Na2SO4)
= 0,05 (моль)•3 = 0,15 моль.
(Fe(OH)3) = 0,05
(моль)•2 = 0,1 моль.
прор(NaOH) =
0,05 (моль)•6 = 0,3 моль.
изб(NaOH) =
исх –
прор = 0,375
(моль) – 0,3 (моль) = 0,075 моль.
m(NaOH) = M• =
40 (г/моль)•0,075 (моль) = 3 г.
m(Na2SO4) = M• = 142 (г/моль)•0,15 (моль) = 21,3 г.
m(Fe(OH)3) = M• = 107 (г/моль)•0,1 (моль) = 10,7 г.
m р-р получ = mр-р(Fe2(SO4)3
+ mр-р(NaOH) – m(Fe(OH)3) = 250 (г) + 50
(г) –10,7 (г) = 289,3 г.
р.в-ва(Na2SO4)
= m / mр-р = 21,3 (г) / 289,3 (г) = 0,074, или 7,4 %.
р.в-ва(NaOH)
= m / mр-р = 3 (г) / 289,3 (г) = 0,01, или 1 %.
О т в е т. р.в-во(Na2SO4) = 7,4 %,
р.в-во(NaOH) = 1 %.
Задача 3. Карбонат кальция массой 10 г
растворили при нагревании в 150 мл
хлороводородной кислоты ( = 1,04 г/мл) с массовой долей 9 %.
Какова массовая доля хлороводорода в
получившемся растворе?
О т в е т. р.в-во(HCl) = 4,2 %.
Задача 4. 5,6 г железа растворили в 100 мл 10%-го
раствора соляной кислоты ( = 1,05 г/мл). Вычислить массовую долю
хлороводорода в полученном растворе.
О т в е т. р.в-во(HCl) = 2,9 %.
Задача 5. 5,6 г железа растворили в 200 мл
раствора соляной кислоты ( = 1,05 г/мл) с массовой долей 10 %. Найти
массовую долю соли в полученном растворе.
О т в е т. р.в-во(FeCl2) = 5,9 %.
Задача 6. Смешали 110,4 г раствора карбоната
калия с концентрацией 25 % и 111 г раствора
хлорида кальция с концентрацией 20 %. Найти
концентрацию вещества в полученном растворе.
О т в е т. р.в-во(KCl) = 14,8 %.
Задача 7. Смешали 320 г раствора сульфата
меди(II) с концентрацией 5 % и 120 г раствора
гидроксида натрия с концентрацией 10 %. Найти
концентрации веществ в полученном растворе.
О т в е т. р.в-во(Na2SO4) = 3,3 %,
р.в-во(NaOH) = 0,9 %.
• Более сложными являются задачи на
нахождение массы (или объема) вещества, которое
нужно добавить к раствору другого вещества для
того, чтобы его концентрация изменилась в
результате произошедшей реакции.
В этом случае алгоритм решения следующий:
1) нужно обозначить за x количество
добавленного вещества – реагента;
2) выразить через х количества
прореагировавшего с реагентом вещества и
полученного в результате реакции газа или
осадка;
3) найти количество растворенного вещества в
исходном растворе и его количество, оставшееся
после реакции (оставш
= 1 –
прор);
4) выразить через х массу оставшегося в
растворе вещества;
5) найти массу раствора, полученного после
реакции:
mр-р получ = mреаг + mр-р1 –
mосадок (газ);
mр-р получ = mр-р1 + mр-р2 –
m осадок (газ).
6) все данные подставить в формулу:
р.в-во2 = mоставш / mр-р получ.
7) найти количество вещества реагента, его массу
или объем.
Задача 8. Найти массу карбоната
кальция, которую следует добавить к 600 г раствора
азотной кислоты с массовой долей 31,5 %, чтобы
массовая доля кислоты уменьшилась до 10,5 %.
| Дано:
mр-р1(HNO3)
|
Найти: m(CaCO3). |
Р е ш е н и е
(СаСО3) = х
моль; (HNO3)прор
= 2х моль;
(СО2) = х
моль, m(CO2) = 44x г;
m(CaCO3) = M• = 100 (г/моль)•х (моль) = 100х г;
mр.в-во1(HNO3) = mр-р1•р.в-во1 = 600
(г)•0,315 = 189 г;
1(HNO3)
= m р.в-во /М = 189 (г) / 63 (г/моль) = 3 моль,
оставш(HNO3)
= 1 –
прор = 3 – 2х
моль,
mоставш(HNO3) = М• = 63 (г/моль)•(3 – 2х) =
(189 – 126х) г;
mр-р получ = m(CaCO3) + mр-р1(HNO3) –
m(CO2) = 100x + 600 – 44x = 600 + 56x,
р.в-во2(HNO3)
= mоставш(HNO3) / mр-р получ.
0,105 = (189 – 126х) / (600 + 56х),
х = 0,955 моль, (СаСО3)
= 0,955 моль,
m(CaCO3) = M• = 100 (г/моль)•0,955 (моль) = 95,5 г.
О т в е т. m(CaCO3) = 95,5 г.
Задача 9. Найти массу кристаллогидрата CaCl2•6H2O,
которую необходимо добавить к 47 мл 25%-го раствора
карбоната натрия ( = 1,08 г/мл), чтобы получить раствор, в
котором массовая доля карбоната натрия
составила бы 10 %.
| Дано:
Vр-р1(Na2CO3)
|
Найти: m(CaCl2•6H2O). |
Р е ш е н и е
(СaCl2•6H2O)
= x моль, (CaCl2)
= x моль,
прор(Na2CO3)
= х моль, (СаСО3)
= х моль;
m(CaCl2•6H2O) = M• = 219 (г/моль)•х (моль) = 219х г;
m(CaCO3) = M• = 100x г;
mр-р1(Na2CO3) = Vр-р1•р-р1 = 47 (мл)• 1,08
(г/мл) = 50,76 г,
mр.в-во1(Na2CO3) = mр-р1• р.в-во1 = 50,76
(г)•0,25 = 12,69 г,
1(Na2CO3)
= mр.в-во1 / M = 12,69 (г) / 106 (г/моль) = 0,12
моль,
оставш(Na2CO3)
= 1 –
прор = 0,12 – х,
mоставш(Na2CO3) = M• = 106(0,12 – x) =
12,69 – 106x;
mр-р получ = m(CaCl2•6H2O) + mр-р1(Na2CO3) –
m(CaCO3),
219x + 50,76 – 100x = 50,76 + 119x,
р.в-во2 = mоставш(Na2CO3)
/ mр-р получ,
0,1 = 12,69 – 106х / 50,76 + 119х,
х = 0,0646 моль.
m(CaCl2•6H2O) = М• = 219 (г/моль)•0,0646 (моль) = 14,14 г.
О т в е т. m(CaCl2•6H2O) = 14,4 г.
Задача 10. Какой объем 30%-го раствора
аммиака ( = 0,892
г/мл) необходимо добавить к 200 мл 40%-го раствора
соляной кислоты ( = 1,198 г/мл), чтобы массовая доля
кислоты уменьшилась вчетверо?
О т в е т. Vр-р(NH3) = 108,2 мл.
Задача 11. Какой объем углекислого газа
нужно добавить к 100 мл 20%-го раствора гидроксида
натрия ( = 4,1
г/мл), чтобы массовая доля гидроксида натрия
уменьшилась вдвое?
О т в е т. V(CO2) = 10,9 л.
Задача 12. Найти объем раствора соляной
кислоты ( = 1,05
г/мл) с массовой долей 10 %, который нужно
добавить к 350 г раствора гидроксида калия с
массовой долей 10,5 %, чтобы концентрация щелочи
составила 3 %.
О т в е т. Vр-р(HCl) = 135,6 мл.
• Внимание: растворенное вещество –
реагент!
При решении задач на растворы нужно помнить о
том, что при обычных условиях с водой реагируют
следующие вещества:
1) щелочные и щелочно-земельные металлы,
например:
2Na + 2H2O = 2NaOH + H2;
2) оксиды щелочных и щелочно-земельных металлов,
например:
СаО + Н2О = Са(ОН)2;
3) оксиды неметаллов, например:
SO3 + H2O = H2SO4;
4) многие бинарные соединения – гидриды,
карбиды, нитриды и другие, например:
KН + Н2О = KОН + Н2.
Растворение вещества-реагента в воде.
Растворенным веществом в данном случае будет
продукт взаимодействия вещества-реагента с
водой. Масса раствора будет складываться из
массы реагента и массы воды:
mр-р = mреаг + mH2O.
Если в результате реакции выделился газ, то
mр-р = mреаг + mH2O –
mгаз.
Задача 13. В каком объеме воды нужно
растворить 11,2 л оксида серы(IV), чтобы получить
раствор сернистой кислоты с массовой долей 1 %?
| Дано:
V(SO2) = 11,2 л,
|
Найти: V(H2O). |
Р е ш е н и е
(SO2) = V / VM
= 11,2 (л) / 22,4 (л/моль) = 0,5 моль, следовательно, (H2SO3) = 0,5
моль.
mр.в-во(H2SO3) = M• = 82 (г/моль)•0,5 (моль) =
41 г,
mр-р(H2SO3) = mр.в-во(H2SO3)
/ р.в-во(H2SO3)
= 41 (г) / 0,01 = 4100 г;
m(H2O) = mр-р(H2SO3) –
m(SO2),
m(SO2) = M• = 64 (г/моль)•0,5 (моль) = 32 г,
m(H2O) = 4100 (г) – 32 (г) = 4068 г,
V(H2O) = m/ = 4068 (г) / 1 (г/мл) = 4068 мл, или 4 л 68 мл.
О т в е т. V(H2O) = 4068 мл.
Задачи, в которых неизвестна масса
вещества-реагента, необходимого для образования
раствора с определенной концентрацией.
Алгоритм решения следующий:
1) принять количество растворенного реагента за
х моль;
2) согласно уравнению реакции выразить через х
количества продуктов реакции;
3) найти через х массы реагента и продуктов
реакции;
4) найти массу раствора;
5) подставить все данные в формулу для расчета
массовой доли вещества в растворе:
р.в-во(продукт)
= mр.в-во(продукт) / mр-р.
Задача 14. Найти массу гидрида лития,
которую нужно растворить в 100 мл воды, чтобы
получить раствор с массовой долей гидроксида
лития 5 %.
| Дано:
V(H2O) = 100 мл,
|
Найти: m(LiH). |
Р е ш е н и е
Пусть (LiH) = x
моль,
тогда (LiOH) = x
моль, (Н2) = х
моль.
m(LiH) = M•
= 8 (г/моль)•х (моль) = 8х (г),
m(LiOH) = M•
= 24 (г/моль)•х (моль) = 24х г,
m(H2) = M• = 2 (г/моль)•х = 2х г.
mр-р = m(LiH) + m(H2O) – m(H2),
m(H2O) = V• = 100 (мл)•1 (г/мл) = 100 г.
mр-р = 8х + 100 – 2х = 6х + 100.
р.в-во(LiOH)
= mр.в-во(LiOH) / mр-р,
0,05 = 24х / (6х + 100); 0,3х + 5 = 24х,
х = 0,21, (LiH) =
0,21 моль.
m(LiH) = M•
= 8 (г/моль)•0,21 (моль) = 1,7 г.
О т в е т. m(LiH) = 1,7 г.
Растворение вещества-реагента в растворе.
В этом случае растворяемое вещество реагирует
с водой, которая присутствует в растворе. Масса
растворенного вещества во втором растворе
складывается из массы вещества в первом растворе
и массы вещества – продукта реакции:
mр.в-во1 = mр-р1•р.в-во1,
mр.в-во2 = mр.в-во1• mр.в-во(прод.),
mр-р2 = mр-р1 + mреаг,
или mр-р2 = mр-р1 + mреаг –
mгаз.
р.в-во2
= mр.в-во2 / mр-р2.
Задача 15. К 200 г 10%-го раствора
ортофосфорной кислоты добавили 28,4 г фосфорного
ангидрида. Найти массовую долю кислоты в
получившемся растворе.
| Дано:
mр-р1(H3PO4)
m(P2O5) = 28,4 г. |
Найти: |
Р е ш е н и е
(P2O5) =
m / M = 28,4 (г) / 142 (г/моль) = 0,2 моль,
прод(Н3РО4)
= 0,2 (моль)•2 = 0,4 моль.
mпрод(Н3РО4) = М• = 98 (г/моль)•0,4 (моль) =
39,2 г,
mр.в-во1(Н3РО4) = mр-р1•р.в-во1 = 200 (г)
•0,1 = 20 г,
mр.в-во2(Н3РО4) = mр.в-во2(Н3РО4)
+ mпрод(Н3РО4) = 20 (г) + 39,2 (г) = 59,2
г;
mр-р2(Н3РО4) = mр-р1(Н3РО4)
+ mреаг(Р2О5) = 200 (г) + 28,4 (г) = 228,4
г.
р.в-во2(Н3РО4)
= mр.в-во2(Н3РО4) / mр-р2(Н3РО4)
= 59,2 (г) / 228,4 (г) = 0,2592, или 25,92 %.
О т в е т: (Н3РО4) = 25,92 %.
Задача 16. Найти массу фосфорного
ангидрида, которую необходимо добавить к 70 г 10%-го
раствора ортофосфорной кислоты, чтобы получить
40%-й раствор.
| Дано:
mр-р1(Н3РО4)
|
Найти: m(P2O5). |
Р е ш е н и е
Пусть (Р2О5)
= х моль,
тогда (Н3РО4)
= 2х моль.
mпрод(Н3РО4) = М• = 98 (г/моль)•2х
(моль) = 196х г.
mреаг(Р2О5) = М• = 142 (г/моль)•х
(моль) = 142х г,
mр.в-во1(Н3РО4) = mр-р1•р.в-во1 = 70 (г)•
0,1 = 7 г,
mр.в-во2(Н3РО4) = mр.в-во1(Н3РО4)
+ mпрод(Н3РО4) = 7 + 196х, 000000
mр-р2(Н3РО4) = mр-р1(Н3РО4)
+ mреаг(Р2О5) = 70 + 142х,
р.в-во2(Н3РО4)
= mр.в-во2(Н3РО4) / mр-р2(Н3РО4),
0,4 = (7 + 196х) / (70 + 142х),
х = 0,15, (Р2О5)
= 0,15 моль.
m(P2O5) = M• = 142 (г/моль)•0,15 (моль) = 21,3 г.
О т в е т. m(P2O5) = 21,3 г.
Задача 17. В 240 мл воды опустили 69 г натрия.
Найти массовую долю продукта в растворе.
О т в е т. прод = 39,2 %.
Задача 18. Найти массовую долю кислоты в
растворе, полученном при растворении 33,6 л
сернистого газа в 320 г 5%-го раствора сернистой
кислоты.
О т в е т. р.в-во2(Н2SО3) = 33,4 %.
Задача 19. Какую массу оксида серы(VI) нужно
растворить в 150 мл воды, чтобы получить 60%-й
раствор серной кислоты?
О т в е т. m(SO3) = 144 г.
Задача 20. Найти массу оксида серы(VI),
которую необходимо растворить в 99 г 40%-й серной
кислоты, чтобы получить 80%-й раствор.
О т в е т. m(SO3) = 93 г.
Задача 21. Какую массу оксида фосфора(V)
нужно растворить в 120 г воды, чтобы получить 40%-й
раствор ортофосфорной кислоты?
О т в е т. m(P2O5) = 49 г.
Задача 22. К 180 г 50%-го раствора
ортофосфорной кислоты добавили 42,6 г оксида
фосфора(V). Найти массовую долю кислоты в
полученном растворе.
О т в е т. р.в-во2(Н3РО4) = 66,8 %.
Задача 23. В 20 г воды растворили 3,5 г оксида
натрия. Вычислите массовую долю растворенного
вещества.
О т в е т. (NaOH) = 19,2 %.
Задача 24. К 120 г 8%-го раствора гидроксида
натрия добавили 18,6 г оксида натрия. Вычислите
массовую долю гидроксида натрия в
образовавшемся растворе.
О т в е т. р.в-во(NaOH) = 24,2 %.
Задача 25. Найти массу оксида серы(VI),
которую нужно добавить к 2 л 8%-го раствора серной
кислоты ( = 1,06
г/мл), чтобы массовая доля серной кислоты стала
равной 20 %.
О т в е т. m(SO3) = 248,2 г.
Задача 26. Какую массу фосфора необходимо
сжечь в кислороде, чтобы, растворив полученный
оксид в 1000 г раствора ортофосфорной кислоты с
массовой долей 50 %, получить раствор этой
кислоты с массовой долей 75 %?
О т в е т. m(P) = 173,2 г.
Задача 27. Какую массу натрия необходимо
растворить в 120 мл воды для получения раствора
щелочи с массовой долей 18 %?
О т в е т. m(Na) = 13,8 г.
Г.С.ОСНОВСКАЯ,
учитель химии средней школы № 7
(г. Великие Луки, Псковская обл.)
С помощью стехиометрических
коэффициентов схема химической реакции
переходит в ее уравнение, которое в
явном виде отражает закон сохранения
количества атомов каждого вида при
переходе от исходных веществ (реагентов)
к продуктам реакции.
Стехиометрические коэффициенты позволяют
установить связь между количествами
участвующих в реакции веществ на основе
следующего правила:
коэффициенты в химическом уравнении
задают молярные пропорции
(отношения), в которых вступают в реакцию
исходные вещества (реагенты) и образуются
продукты реакции.
Рассмотрим в качестве примера реакцию
синтеза аммиака:
3H2+ N2= 2NH3 ,
для которой согласно приведенному
правилу можно записать
,
где индексы
«пр.» и «обр.» соответствуют количествам
прореагировавших и образовавшихся
веществ. Последнее соотношение можно
представить в ином виде:
а) для веществ H2и N2:
или в другой форме
;
б) для веществ H2и NH3:или
;
в) для веществ N2и NH3:или
.
Легко видеть,
что все пропорции можно объединить и
записать в виде:
=
.
Последнее
равенство является основным расчетным
уравнением, связывающим количества
прореагировавших веществ и образовавшихся
продуктов реакции. При необходимости
в это уравнение можно из условия задачи
ввести массы и объемы участников реакции,
используя обычные соотношения.
Например, для реакции
4FeS2(т) + 11О2= 2Fe2O3(т)
+ 8SO2(г)
основное расчетное
уравнение имеет вид:
и если в него
ввести обычно задаваемые в задачах для
твердых веществ их массы, а для газов –
объемы, то оно примет следующую форму:
Методика вычислений
с использованием основного расчетного
уравнения химической реакции включает
в себя несколько общих моментов:
1) Прежде
всего определяют опорное вещество, по
количеству которого проводят весь
последующий расчет. В условии задачи
для него задана или масса, или объем,
или концентрация, которые, в свою очередь,
позволяют вычислить число молей опорного
вещества. Как правило, это не составляет
большого труда, а исключение относится
к так называемым задачам на избыток и
недостаток, когдаопорное вещество
нужно выбрать издвух исходных.Дело в том, что при приготовлении
реакционной смеси исходные вещества
можно смешивать в любых пропорциях, но
реагировать друг с другом они будут
всегда в строго определенных пропорциях,
которые устанавливают для них
стехиометрические коэффициенты в
уравнении химической реакции. В этих
условиях вполне возможна ситуация,
когда одно из исходных веществ прореагирует
полностью, а часть другого останется
не прореагировавшей и тогда говорят,
что первое вещество взято в недостатке
по отношению ко второму и, наоборот,
второе вещество находится в избытке по
отношению к первому. В данном случае в
качестве опорного вещества следует
выбрать исходное вещество, взятое в
недостатке, поскольку именно его
количество будет определять как окончание
реакции, так и количества образующихся
продуктов.
Как
определить опорное вещество, если в
задаче указаны данные (массы, объемы и
др.) для обоих исходных веществ? Пусть
в реакцию вступают два вещества А и В
аА
+ вВ → продукты реакции ,
а
исходные количества этих веществ 0
(А) и 0
(В) можно
вычислить из условия задачи.
Для
ответа на поставленный вопрос нужно
сравнить два числа
,
где возможны три варианта:
I
вар.
,
тогда исходная реакционная смесь
называется стехиометрической и в
качестве опорного вещества может быть
выбрано любое из них – А или В;
II
вар.
,
тогда вещество А взято в избытке и
опорным будет вещество В;
III
вар.
,
тогда вещество В будет в избытке и
опорным является вещество А.
Окончание необратимых химических
реакций в первом варианте происходит
в момент одновременного исчезновения
обоих исходных веществ, а в двух других
– в момент исчезновения вещества,
взятого в недостатке, причем в конечной
смеси веществ, наряду с продуктами
реакции, будет присутствовать не
прореагировавший остаток вещества,
взятого в избытке.
2)
Из основного расчетного уравнения
вытекает простое
правило определения числа молей
вступивших
в реакцию исходных веществ и образовавшихся
продуктов по числу молей опорного
вещества:
для
определения числа молей прореагировавшего
или образовавшегося в реакции вещества
необходимо число молей опорного вещества
разделить на его стехиометрический
коэффициент и этот результат умножить
на стехиометрический коэффициент
определяемого вещества.
Для
реакции 2Al + 6HCl = 2AlCl3
+ H2,
где
опорным веществом, например, является
алюминий можно записать:
Определив
количества интересующих нас веществ,
легко рассчитать их массы, объемы и
концентрации, то есть те характеристики
участников химической реакции, которые
фигурируют в условии задачи.
Таким
образом, общая схема расчета по уравнению
химической реакции может быть представлена
в виде:
-
Необратимая
реакция.
Пусть
и
начальные количества реагентов А и В и
,
т.е. вещество А взято в избытке, тогда
a
A
+ в
В
= с
С
+
d
D
|
начало реакции: |
(избыток) |
(недостаток) |
0 |
0 |
|
|
окончание |
|
0 |
|
|
-
Обратимая
реакция.
В
этом случае реакция заканчивается
установлением химического равновесия
и равновесная смесь содержит как продукты
реакции, так и остаток исходных веществ.
Пусть к моменту установления равновесия
образовалось, например, х
моль продукта С – это опорное вещество,
то
a
A
+ в
В
с
С
+
d
D
|
Начало |
|
|
0 |
0 |
|
Равновесие: |
|
|
|
|
Пример 1. Раствор, содержащий 20,0 г
гидроксида натрия поглотил 6,72 л
углекислого газа (н. у.). Определите
продукты реакции и их количества.
При
поглощении раствором щелочи кислотных
оксидов (СО2 ,SO2
,P2O5и др.) или водородных соединений (H2Sи др.), которым соответствуют многоосновные
кислоты, на первом этапе при избытке
щелочи всегда образуются средние соли,
которые на втором этапе при наличии
избытка поглощаемого реагента частично
или полностью переходят в кислые соли:
СО2
(газ)
+ 2
NaOH =
Na2CO3
+
Н2О
|
начало реакции: |
|
|
0 |
|
|
|
||||
|
окончание |
|
0 |
|
Остаток
углекислого газа реагирует с карбонатом
натрия:
Na2CO3
+ СО2
(газ)
+
Н2О
=
2
NaHСО3
|
начало реакции: |
0,25 (избыток) |
0,05 (недостаток) |
0 |
|
окончание |
|
0 |
|
Итак,
в растворе присутствует смесь солей:
0,1 моль NaHCO3
и 0,2 моль Na2CO3.
Пример
2. В стакан
с 200 мл раствора фосфорной кислоты с
молярной концентрацией 0,5 моль/л внесли
6 г гидроксида натрия. Определите состав
раствора после окончания реакции.
При
нейтрализации щелочью (NaOH,
KOH,
NH3
и др.) многоосновных кислот происходит
последовательное замещение атомов
водорода на металл или аммонийную группу
и состав продуктов реакции зависит от
соотношения количеств реагентов. В
нашем случае, если
–
образуетсяNaH2PO4
; если 1: 2 , то Na2HPO4
и если 1:
3 , то Na3PO4.
В промежуточных вариантах возникает
смесь солей.
Найдем
исходные количества реагентов:
;
,
– имеет место промежуточный вариант
между 1: 1 и 1: 2 , поэтому реакция идет в
два этапа:
H3PO4
+ NaOH = NaH2PO4
+ H2O
|
начало реакции: |
0,1 (недостаток) |
0,15 (избыток) |
0 |
|
окончание |
0 |
|
0,1 |
далее
остаток щелочи реагирует с NaH2PO4
NaH2PO4
+ NaOH = Na2HPO4
+ H2O
|
начало реакции: |
0,1 (избыток) |
0,05 (недостаток) |
0 |
|
окончание |
|
0 |
0,05 |
Итак,
в растворе после реакции присутствует
смесь солей – по 0,05 моль NaH2PO4
и Na2HPO4
.
Успех в проведении расчетов по цепочкам
химических уравненийв случае, когда
продукт одной реакции является исходным
веществом для другой, зависит от
правильного выбора последовательности
переходов от одного уравнения к другому.
Выбрав согласно условию задачи опорное
вещество, стрелками удобно указать
последовательность расчета, помня при
этом, что вещество, полученное в предыдущей
реакции, в том же количестве используется
в последующей если, естественно, в ходе
всего многостадийного процесса нет
потерь и выход каждой реакции 100 %.
Пример 3.
Сколько литров хлора и водорода (н.у.)
необходимо для получения хлороводорода,
способного нейтрализовать раствор
щелочи, образующийся при растворении
в воде 13,7 г бария.
Составим уравнения
всех реакций и стрелками укажем
последовательность расчета:
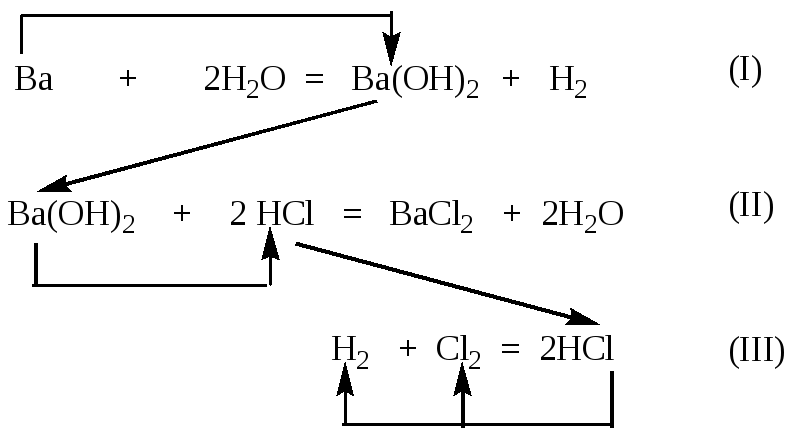
Опорное вещество барий
и его количество
(Ва) =
.
Цепочка расчетов:
уравнение (I) — (Ba(OH)2/
I) ==>
уравнение (II) — (HCl
/ II)=> уравнение (III) –
(Cl2) =(H2) =,
тогда V(H2)
= V(Cl2) = 0,1 моль· 22,4 л/моль = 2,24 л.
При решении
задач на смеси веществнеобходимо
прежде всего для каждого компонента
смеси отдельно записать все химические
реакции, в которых он может участвовать
в соответствии с условием задачи. В
качестве опорных веществ обычно выбирают
вещества исходной смеси и их количества
(число молей) обозначают как неизвестные
– x, y, z, …., а затем составляют уравнения
материального баланса по количеству,
массе или объему ( для газов) участников
химических реакций, где два последних
необходимо выразить через неизвестные.
Число балансовых уравнений должно быть
равно числу неизвестных. На последнем
этапе решается полученная система
алгебраических уравнений.
Пример 4.При сгорании 13,44 л (н. у.)
смеси водорода, метана и угарного газа
образовалось 8,96 л углекислого газа и
14,4 г воды. Определить количества газов
в смеси.
Уравнения реакций:
2H2+ O2= 2H2O
(I)
CH4
+ 2O2
= CO2
+ 2H2O
(II)
2CO
+ O2 =
2CO2
(III)
Опорные вещества –
CH4, H2и CO; обозначим их
количества
ν(H2)
= x; ν(СH4)
= y; ν(CO) = z.
Составим три
балансовых уравнения по числу неизвестных:
а) баланс по объему
смеси:
V (H2) +
V(CH4) + V(CO) = 13,44 л, введем в него
неизвестные:
xVm+ yVm+ zVm= 13,44 или x + y + z =0,6
моль;
б) баланс по количеству
CO2:
ν(CO2/
II) + ν(CO2/
III) = νобщ.(CO2),
но
;
ν(CO2/
II) = ν(CH4)
= y; ν(CO2/
III) = z,
тогда
y + z = 0,4.
в) баланс по количеству
H2O:
ν(H2O/
I) + ν(H2O/
II) = νобщ.(H2O),
но
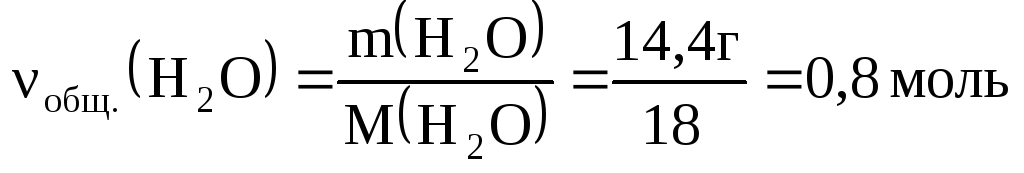
;
,
тогда
x + 2y = 0,8.
Итак, получаем систему
уравнений вида
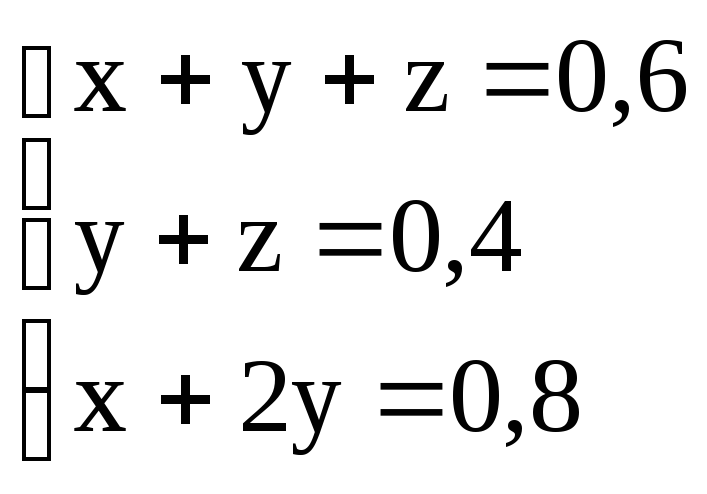
которая легко решается
устно
x = 0,2 моль; y =
0,3 моль; z = 0,1 моль.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества.
Для расчета массы (объема, количества вещества) продукта реакции, если данные по одному из веществ представлены в виде раствора с определенной массовой долей этого растворенного вещества, следует воспользоваться нижеследующим алгоритмом:
1) Прежде всего следует найти массу растворенного вещества. Возможны две ситуации:
* В условии даны масса раствора и массовая доля растворенного вещества (концентрация). В этом случае масса растворенного вещества рассчитывается по формуле:
* В условии даны объем раствора вещества, плотность этого раствора и массовая доля растворенного вещества в этом растворе. В таком случае следует воспользоваться формулой для расчета массы раствора:
После чего следует рассчитать массу растворенного вещества по формуле 1.
2) Рассчитать количество вещества (моль) участника реакции, масса которого стала известна из расчетов выше. Для этого воспользоваться формулой:
3) Записать уравнение реакции и убедиться в правильности расставленных коэффициентов.
4) Рассчитать количество моль интересующего участника реакции исходя из известного количества другого участника реакции, зная, что количества веществ любых двух участников реакции A и B относятся друг к другу как коэффициенты перед этими же веществами в уравнении реакции, то есть:
Если в условии требовалось рассчитать количество вещества, то действия на этом заканчиваются. Если же требуется найти его массу или объем, следует переходить к следующему пункту.
5) Зная количество вещества, определенное в п.4, мы можем рассчитать его массу по формуле:
Также, если вещество является газообразным и речь идет о нормальных условиях (н.у.), его объем может быть рассчитан по формуле:
Рассмотрим пару примеров расчетных задач по этой теме.
Пример 1
Рассчитайте массу осадка, который образуется при добавлении к 147 г 20%-ного раствора серной кислоты избытка раствора нитрата бария.
Решение:
1) Рассчитаем массу чистой серной кислоты:
m(H2SO4) = w(H2SO4) ∙ m(р-ра H2SO4)/100% = 147 г ∙ 20% /100% = 29,4 г
2) Рассчитаем количество вещества (моль) серной кислоты:
n(H2SO4) = m(H2SO4) / M(H2SO4) = 29,4 г/98 г/моль = 0,3 моль.
3) Запишем уравнение взаимодействия серной кислоты с нитратом бария:
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
4) В результате расчетов стало известно количество вещества серной кислоты. Осадок представляет собой сульфат бария. Зная, что:
n(BaSO4)/n(H2SO4) = k(BaSO4)/k(H2SO4), где n — количество вещества, а k — коэффициент в уравнении реакции,
можем записать:
n(BaSO4) = n(H2SO4) ∙ k(H2SO4)/k(BaSO4) = 0,3 моль ∙ 1/1 = 0,3 моль
5) Тогда масса осадка, т.е. сульфата бария, может быть рассчитана следующим образом:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
Пример 2
Какой объем газа (н.у.) выделится при растворении необходимого количества сульфида железа (II) в 20%-ном растворе соляной кислоты с плотностью 1,1 г/мл и объемом 83 мл.
Решение:
1) Рассчитаем массу раствора соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) ∙ ρ(р-ра HCl) = 83 мл ∙ 1,1 г/мл = 91,3 г
Далее рассчитаем массу чистого хлороводорода, входящего в состав кислоты:
m(HCl) = m(р-ра HCl) ∙ w(HCl)/100% = 91,3 г ∙ 20%/100% = 18,26 г
2) Рассчитаем количество вещества хлороводорода:
n(HCl) = m(HCl)/M(HCl) = 18,26 г/36,5 г/моль = 0,5 моль;
3) Запишем уравнение реакции сульфида железа (II) с соляной кислотой:
FeS + 2HCl = FeCl2 + H2S↑
4) Исходя из уравнения реакции следует, что количество прореагировавшей соляной кислоты с количеством выделившегося сероводорода связано соотношением:
n(HCl)/n(H2S) = 2/1, где 2 и 1 — коэффициенты перед HCl и и H2S соответственно
Следовательно:
n(H2S) = n(HCl)/2 = 0,5/2 = 0,25 моль
5) Объем любого газа, находящегося при нормальных условиях, можно рассчитать по формуле V(газа) = Vm ∙ n(газа), тогда:
V(H2S) = Vm ∙ n(H2S) = 22,4 л/моль ∙ 0,25 моль = 5,6 л
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо массой 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Спойлер
[свернуть]
Спойлер
[свернуть]
Пример 2. Определите массу алюминия, прореагировавшего с кислородом, если в результате реакции образовалось вещество Al2O3 химическим количеством 3,5 моль.
Спойлер
[свернуть]
Спойлер
[свернуть]
Пример 3. Рассчитайте объем (н. у.) кислорода, необходимого для полного сгорания фосфора массой 93 г.
Спойлер
[свернуть]
Надеюсь урок 14 «Расчеты по уравнениям химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Химические реакции».
Количество — прореагировавшее вещество
Cтраница 2
При протекании этих реакций количество прореагировавшего вещества пропорционально количеству света. Второй тип фотохимических реакций характеризуется большими значениями квантового выхода. Эти реакции возбуждаются светом и далее идут счень быстро; все они являются экзотермическими.
[16]
И в этом случае количество прореагировавшего вещества возрастает с концентрацией нитрата, но еще значительно медленнее, чем это имело место при возрастающих концентрациях альдегида.
[17]
Обозначим через X — количество прореагировавшего вещества, а — начальное количество вещества, а — реакционная поверхность каждого зародыша.
[18]
При протекании этих реакций количество прореагировавшего вещества пропорционально количеству света. Второй тип фотохимических реакций характеризуется большими значениями квантового выхода. Эти реакции возбуждаются светом и далее идут очень быстро; все они являются экзотермическими.
[20]
Числитель последней дроби пропорционален количеству прореагировавшего вещества, а знаменатель равен затраченной энергии. Следовательно, ф является мерой количества вещества, прореагировавшего на единицу затраченной энергии. Как видно из табл. 10, при изких давлениях ( 10 мм рт. ст.) и малых силах тока разряд малоэффективен для всех углеводородов; с ростом этих величин ф становится примерно одинаковым для всех углеводородов.
[21]
Выделение реакционного тепла, пропорционального количеству прореагировавших веществ, делает возможным определение протяженности зоны реакции по изменению температуры ДХЭ по высоте реактора. Уровень, на котором прекращается рост температуры, соответствует полной утилизации хлора из ДХЭ, то есть верхней границе зоны реакции.
[22]
Тепловой эффект химического превращения определяется количеством прореагировавших веществ и удельным тепловым эффектом реакции.
[23]
Скорость химической реакции принято выражать количеством прореагировавшего вещества в единицу времени. Однако в условиях школы определение концентрации реагирующих веществ затруднительно, мало наглядно и трудно понимаемо, поэтому мы сочли возможным рекомендовать учительству демонстрацию опытов по скорости химической реакции не по количеству израсходованного, а по количеству полученного вещества в единицу времени.
[24]
Как видно из табл. 7, количество прореагировавшего вещества контролировалось двумя независимыми методами.
[25]
При помощи радиоактивных индикаторов легко определять количество прореагировавшего вещества, однако в данном случае метод меченых атомов только облегчает эксперимент. Значительно важнее определять константы скорости обратимых реакций при равновесии, так как в этом случае только метод меченых атомов может разрешить эту проблему.
[26]
Как известно, экспоненциальный закон нарастания количества прореагировавшего вещества ( или образования конечного продукта) действительно наблюдается во многих случаях при окислении углеводородов в газовой фазе.
[27]
Численное значение константы скорости реакции равно количеству прореагировавшего вещества в единицу времени, если концентрации реагирующих веществ равны по 1 молю.
[28]
Соотношение между количеством поглощенной энергии и количеством прореагировавшего вещества впервые было установлено К. А. Тимирязевым, доказавшим, что эти количества строго подчиняются закону сохранения энергии. Эйнштейн вывел формулу, являющуюся математическим выражением закона фотохимической эквивалентности, согласно которому каждая молекула, реагирующая под действием света, поглощает только один квант световой энергии. Следовательно, в любой элементарной реакции может принимать участие только один квант света, т.е. число прореагировавших молекул должно равняться числу поглощенных квантов.
[29]
Соотношение между количеством поглощенной энергии и количеством прореагировавшего вещества выражается законом фотохимической эквивалентности, который был выведен ( 1912) термодинамическим путем Эйнштейном и является по существу выражением закона сохранения энергии применительно к рассматриваемым процессам. По этому закону каждая молекула, реагирующая под действием света, поглощает один квант радиации, вызывающий реакцию.
[30]
Страницы:
1
2
3
4