Для того чтобы это сделать вам нужно знать 3 вещи:
- Как определить число протонов и нейтронов в атоме?
- Как определить общее число электронов в атоме?
- Что такое изотоп.
Вкратце напомню.
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Число нейтронов вычисляется по формуле:
N = A — Z
Где N — число нейтронов, A — атомная масса элемента (в целых числах), Z — заряд ядра атома (число протонов) или порядковый номер атома в периодической таблице Менделеева.
Что такое изотоп?
Изотопы это разновидности атомов химического элемента, которые имеют одинаковый заряд ядра (порядковый номер в таблице), но разные массовые числа.
Проще говоря, у изотопов в ядре атома одинаковое число протонов, но разное число нейтронов.
Таким образом, число протонов и электронов у изотопов такое же, как и у обычных атомов, разница лишь в количестве нейтронов.
Примеры
Сколько электронов, протонов и нейтронов содержит атом изотопа титана 50Ti?
Титан имеет порядковый номер 22. Значит в ядре содержится 22 протона, а в атоме 22 электрона.
Число нейтронов: N = 50 – 22 = 28 нейтронов.
Сколько электронов содержит нейтральный атом изотопа полония?
В данном случае нам даже не нужно знать массовое число изотопа, т.к. речь идет только об электронах. Порядковый номер полония 84, значит в ядре атома 84 протона, а в атоме 84 электрона.
Определите число протнов, нейтронов и электронов для изотопа 55Mn.
Порядковый номер марганца 25. Значит в ядре атома 25 протонов, а в атоме 25 электронов.
Найдем число нейтронов: N = 55 – 25 = 30 нейтронов.
Определите число протонов изотопа калия.
В этом случае массовое число изотопа не имеет значения, т.к. речь идет о протонах, число которых у изотопов одинаково. Калий имеет порядковый номер в таблице 19, значит у любого изотопа калия будет 19 протонов.
Похожие вопросы:
– Какие атомы имеют одинаковое число нейтронов?
– Как определить общее число электронов в атоме?
Как вычислить число протонов в ядре изотопа
Атомы состоят из субатомных частиц — протонов, нейтронов и электронов. Протоны представляют собой положительно заряженные частицы, которые находятся в центре атома, в его ядре. Вычислить число протонов изотопа можно по атомному номеру соответствующего химического элемента.
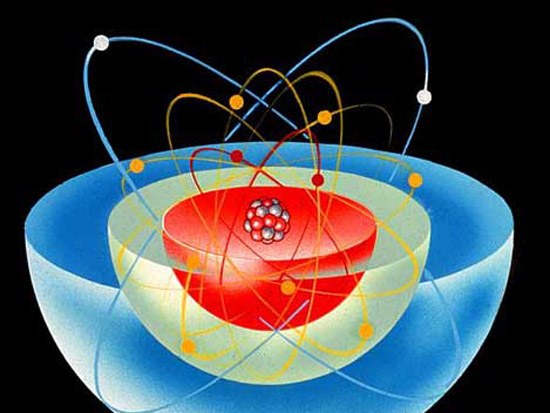
Для описания свойств атома и его структуры используется модель, известная под названием «Модель атома по Бору». В соответствии с ней структура атома напоминает солнечную систему — тяжелый центр (ядро) находится в центре, а более легкие частицы движутся по орбите вокруг него. Нейтроны и протоны образуют положительно заряженное ядро, а отрицательно заряженные электроны движутся вокруг центра, притягиваясь к нему электростатическими силами.
Элементом называют вещество, состоящее из атомов одного типа, он определяется числом протонов в каждом из них. Элементу присваивают свое имя и символ, например, водород (H) или кислород (О). Химические свойства элемента зависят от числа электронов и, соответственно, числа протонов, содержащихся в атомах. Химические характеристики атома не зависят от числа нейтронов, так как нейтроны не имеют электрического заряда. Однако их число влияет на стабильность ядра, изменяя общую массу атома.
Изотопами называют атомы отдельных элементов с различным числом нейтронов. Данные атомы химически идентичным, однако обладают разной массой, также они отличаются своей способностью испускать излучение.
Атомный номер (Z) — это порядковый номер химического элемента в периодической системе Менделеева, он определяется числом протонов в ядре. Каждый атом характеризуется атомным номером и массовым числом (А), которое равно суммарному числу протонов и нейтронов в ядре.
Элемент может иметь атомы с различным числом нейтронов, но количество протонов остается неизменным и равно числу электронов нейтрального атома. Для того, чтобы определить, сколько протонов содержится в ядре изотопа, достаточно посмотреть на его атомный номер. Число протонов равно номеру соответствующего химического элемента в периодической таблице Менделеева.
В качестве примера можно рассмотреть изотопы водорода. В природе наиболее распространены атомы водорода с одним протоном и без нейтронов. В то же время существуют изотопы водорода с одним или двумя нейтронами, они имеют соответствующие названия. Однако у них у всех один протон, что соответствует порядковому номеру водорода в периодической таблице. Изотоп водорода с одним нейтроном и массовым числом 2 называют дейтерием или тяжелым водородом, он стабилен. Тритий, изотоп водорода с массовым числом 3 и двумя нейтронами, радиоактивен. Его иногда называют сверхтяжелым водородом, а ядро трития — тритоном.
Источники:
- Радиация, Введение в радиационную защиту
Химический элемент
Химический элемент — совокупность атомов с одним и тем же зарядом ядра, числом протонов в ядре и электронов
в электронной оболочке. Закономерную связь химических элементов отражает периодическая таблица Д.И. Менделеева.
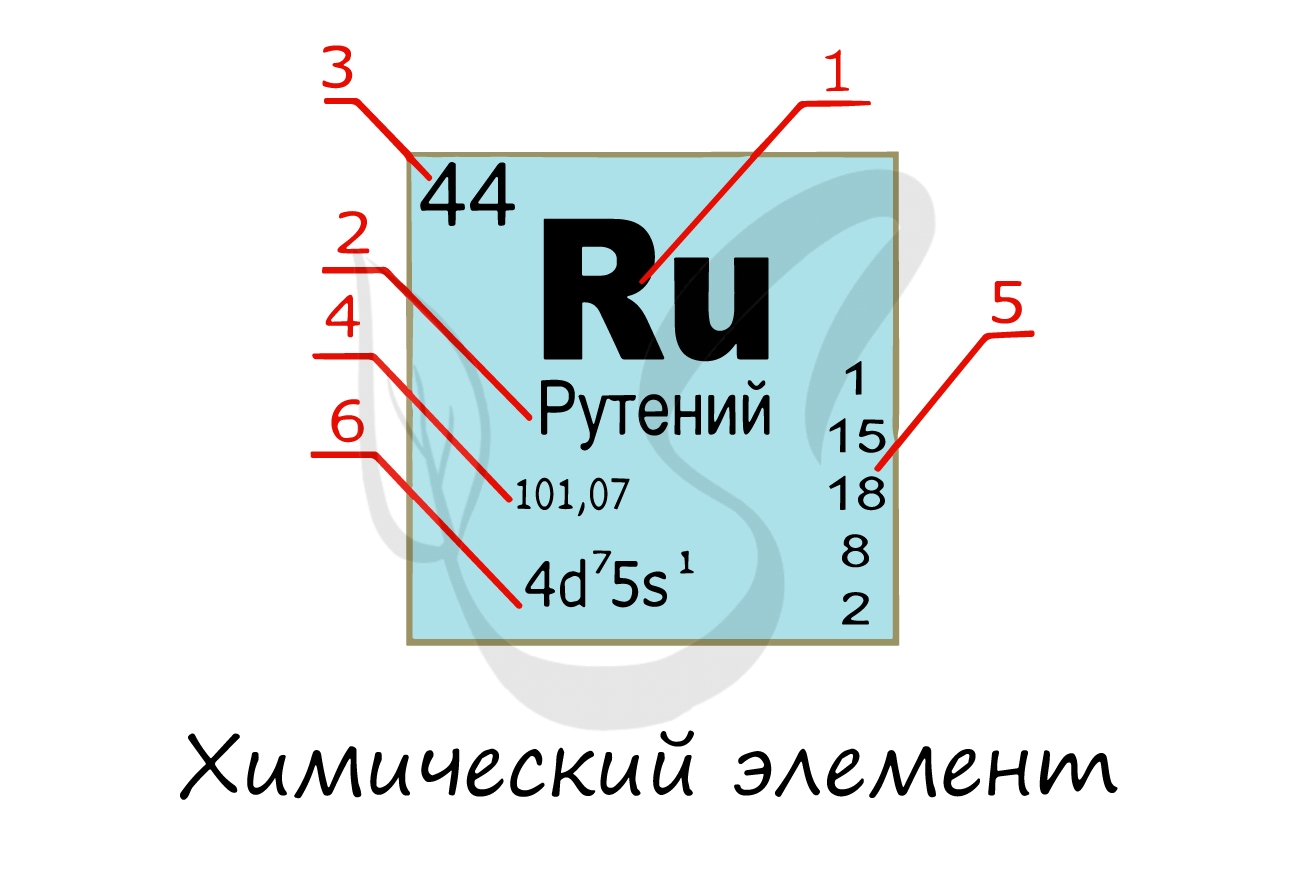
Изучая подобную карточку химического элемента, можно узнать о нем многое:
- Обозначение химического элемента
- Русское наименование
- Порядковый номер = заряд атома = число электронов = число протонов
- Атомная масса
- Распределение электронов по энергетическим уровням
- Электронная конфигурация внешнего уровня
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего
уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную
конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов
равно числу электронов.
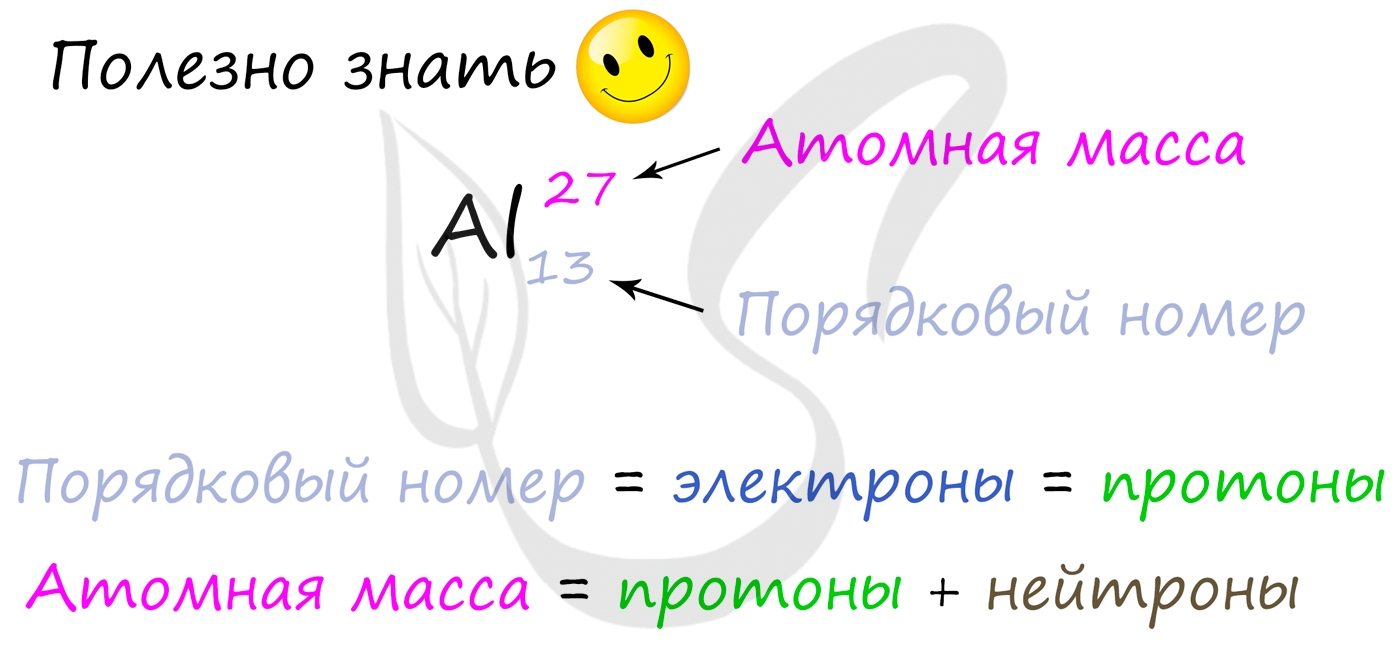
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
27 — 13 = 14
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия,
кислорода, меди. Решение вы найдете ниже.

Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Изотопы (греч. isos — одинаковый + topos — место) — общее название разновидностей одного и того же химического элемента,
имеющих одинаковый заряд ядра (число протонов), но разное число нейтронов.
Вероятно, вы не задумывались, но вся таблица Д.И. Менделеева и представленные в ней химические элементы — это самые распространенные
на земле изотопы.
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
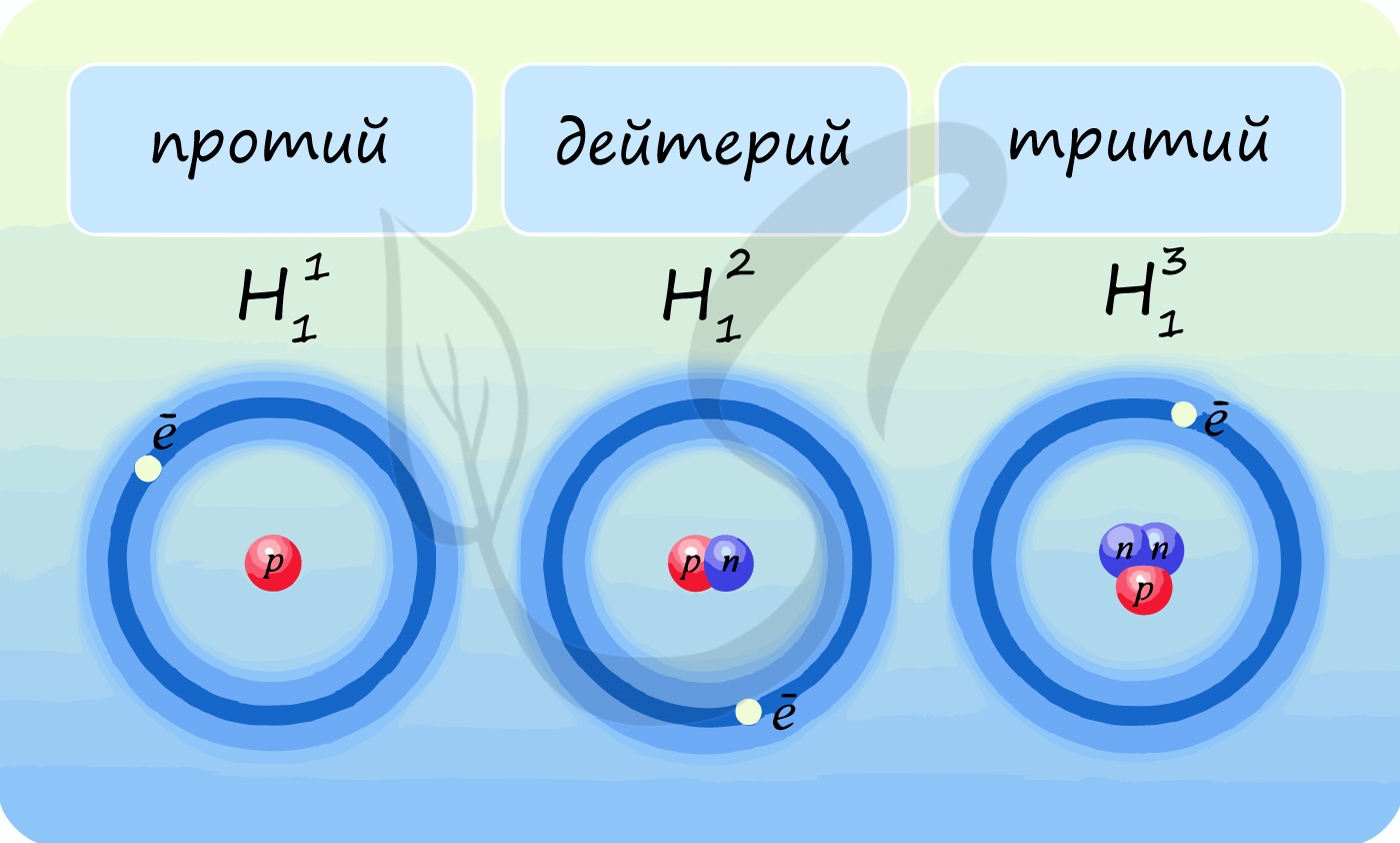
В таблице Д.И. Менделеева представлен самый распространенный из трех — протий. Он содержит 1 протон и 1 электрон, нейтроны отсутствуют. У
дейтерия 1 протон, 1 нейтрон и 1 электрон. У трития 1 протон, 2 нейтрона, 1 электрон.
Теперь очевидно, что изотопы — атомы одного и того же химического элемента, различающиеся числом нейтронов.
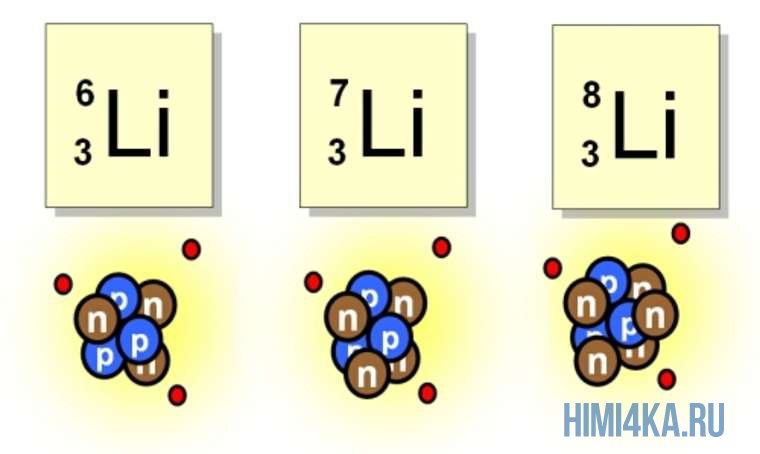
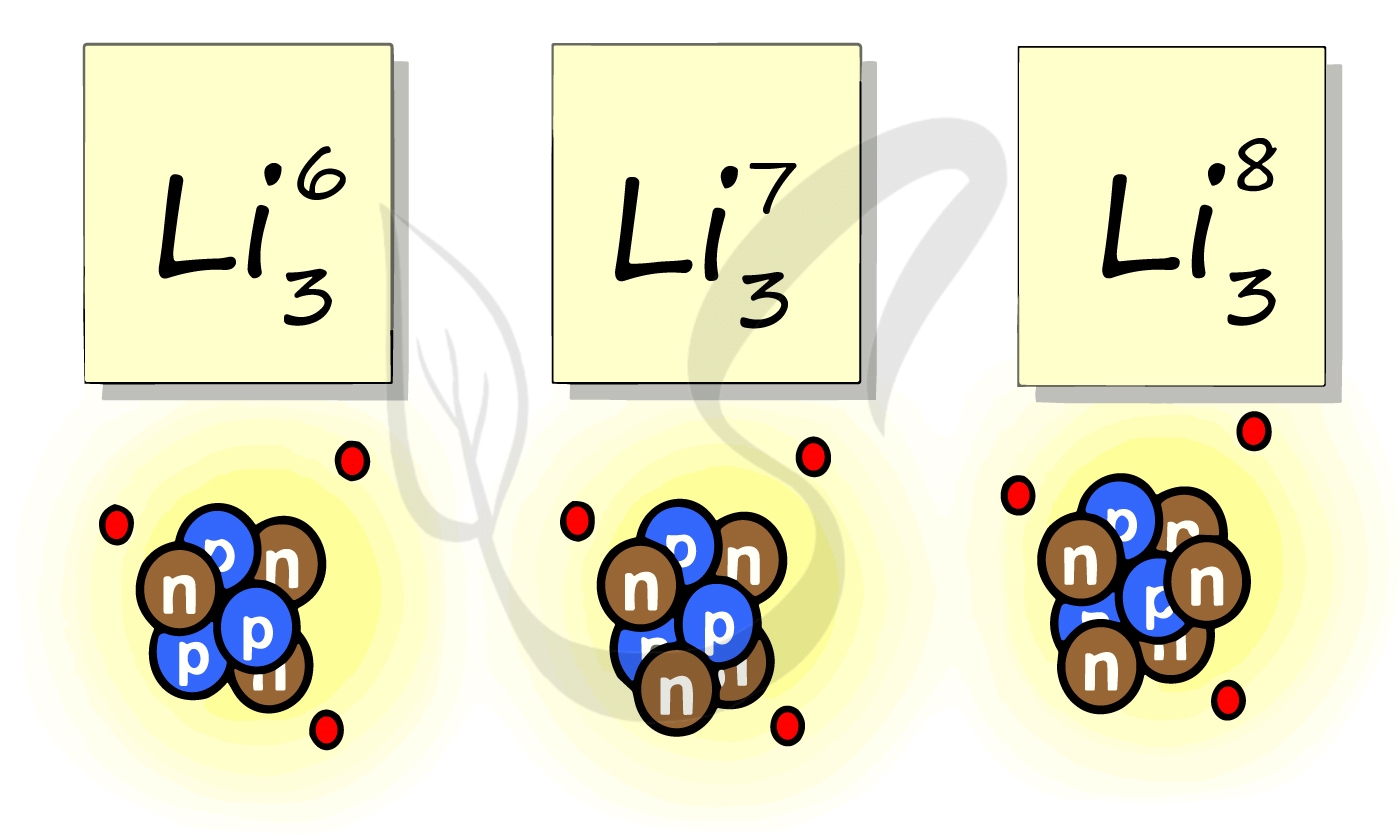
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который
включен в таблицу Д.И. Менделеева.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Matter comes in many different sizes, shapes and colors. Consider chlorine, a yellowish gas, or lead, a gray-black solid, or mercury, a silvery liquid. Three very different elements, each material made of only one kind of atom. The differences in matter comes down to the tiniest differences in atomic structure.
TL;DR (Too Long; Didn’t Read)
Understand that isotopes of an element have different mass numbers but the same number of protons. Using the Periodic Table, find the atomic number of the element. The atomic number equals the number of protons. In a balanced atom, the number of electrons equals the number of protons. In an unbalanced atom, the number of electrons equals the number of protons plus the opposite of the ion charge. Calculate the number of neutrons by subtracting the atomic number from the mass number. If the mass number of a specific isotope isn’t known, use the atomic mass from the Periodic Table, rounded to the nearest whole number, minus the atomic number to find the average number of neutrons for the element.
Structure of Atoms
Three main particles form every atom. Protons and neutrons cluster in the nucleus at the center of the atom. Electrons form a spinning cloud around the nucleus. Protons and neutrons make up the mass of atoms. Electrons, miniscule compared to the protons and neutrons, contribute very little to the overall mass of atoms.
Atoms and Isotopes
Atoms of the same element have the same number of protons. All copper atoms have 29 protons. All helium atoms have 2 protons. Isotopes occur when atoms of the same element have different masses. Since the number of protons of an element doesn’t change, the difference in mass occurs because of different numbers of neutrons. Copper, for example, has two isotopes, copper-63 and copper-65. Copper-63 has 29 protons and a mass number of 63. Copper-65 has 29 protons and mass number 65. Helium has 2 protons and almost always has a mass number of 4. Very rarely, helium forms the isotope helium-3, which still has 2 protons but has a mass number of 3.
One method of writing the formula for an isotope shows the element name or symbol followed by the mass number, as helium-4 or He-4. Another shorthand identification of isotopes shows the mass number as a superscript and the atomic number as a subscript, both shown preceding the atomic symbol. For example, 42He indicates the helium isotope with mass number 4.
Periodic Table of Elements
The arrangement of the Periodic Table of Elements provides essential information to finding the number of protons, neutrons and electrons in atoms. The modern Periodic Table puts the elements in order of their protons. The first element on the table, hydrogen, has one proton. The last element (at least for now) on the table, Oganesson or Ununoctium, has 118 protons.
How Many Protons?
The atomic number on the Periodic Table identifies the number of protons in any atom of that element. Copper, atomic number 29, has 29 protons. Finding the atomic number of an element reveals the number of protons.
How Many Neutrons?
The difference between isotopes of an element depends on the number of neutrons. To find the number of neutrons in an isotope, find the mass number of the isotope and the atomic number. The atomic number, or number of protons, is found on the Periodic Table. The atomic mass, also found on the Periodic Table, is the weighted average of all the isotopes of the element. If no isotope is identified, the atomic mass can be rounded to the nearest whole number and used to find the average number of neutrons.
For example, the atomic mass of mercury is 200.592. Mercury has several isotopes with mass numbers ranging from 196 to 204. Using the average atomic mass, calculate the average number of neutrons by first rounding the atomic mass from 200.592 to 201. Now, subtract the number of protons, 80, from the atomic mass, 201-80, to find the average number of neutrons, 121.
If the mass number of an isotope is known, the actual number of neutrons can be calculated. Use the same formula, mass number minus atomic number, to calculate the number of neutrons. In the case of mercury, the most common isotope is mercury-202. Use the equation, 202-80=122, to find that mercury-202 has 122 neutrons.
How Many Electrons?
A neutral isotope has no charge, meaning that the positive and negative charges balance in a neutral isotope. In a neutral isotope, the number of electrons equals the number of protons. Like finding the number of protons, finding the number of electrons in a neutral isotope requires finding the atomic number of the element.
In an ion, an isotope with a positive or negative charge, the number of protons doesn’t equal the number of electrons. If protons outnumber electrons, the isotope has more positive charges than negative charges. In other words, the number of protons exceeds the number of electron by the same number as the positive charge. If the number of electrons exceeds the number of protons, the ion charge will be negative. To find the number of electrons, add the opposite of the charge imbalance to the number of protons.
For example, if an isotope has a -3 charge, as with phosphorus (atomic number 15), then the number of electrons is three greater than the number of protons. Calculating the number of electrons then becomes 15+(-1)(-3) or 15+3=18, or 18 electrons. If an isotope has a +2 charge, as with strontium (atomic number 38), then the number of electrons is two less than the number of protons. In this case, the calculation becomes 38+(-1)(+2)=38-2=36, so the ion has 36 electrons. The usual shorthand for ions shows the charge imbalance as a superscript following the atomic symbol. In the phosphorus example, the ion would be written as P-3.
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
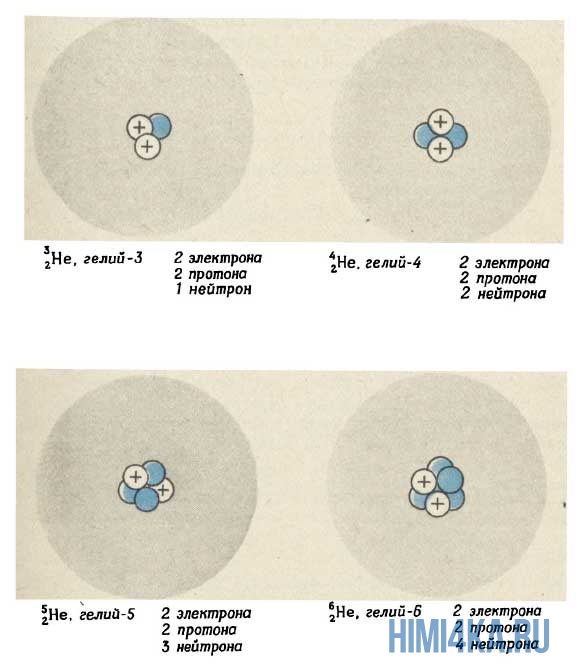
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
- ∆m=(Zmp+Nmn)-Mя
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
- ∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
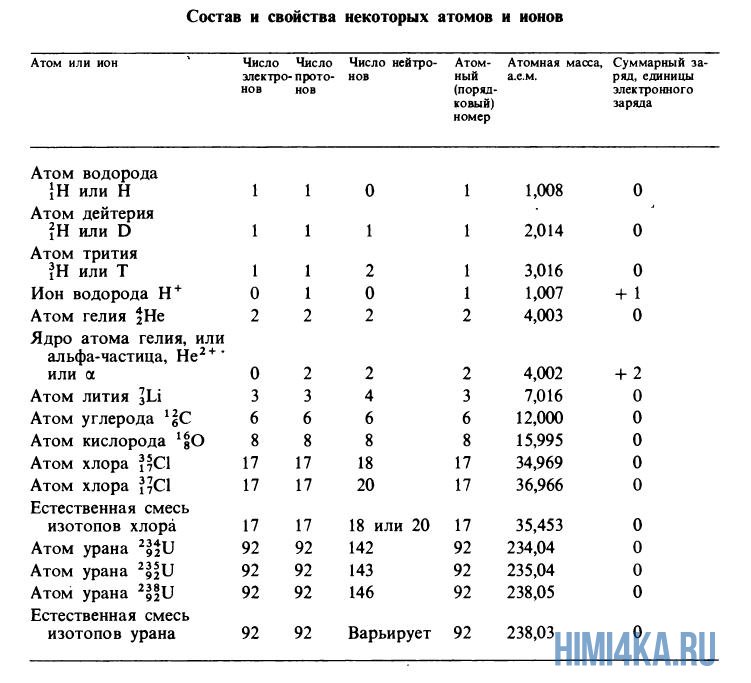
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.