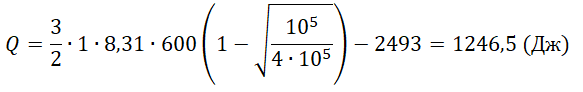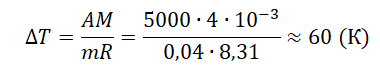На этой странице вы узнаете
- В чем прелесть фазовых переходов?
- Что лучше выбрать: Mercedes или BMW?
Люди научились летать в космос, покорять недра Земли и погружаться в глубины океана. Эти и другие достижения возможны благодаря способности извлекать максимум пользы из имеющихся ресурсов,а именно получать тепловую энергию различными доступными способами. Сегодня мы разберем задачи, которые заставят тепловые процессы играть на нашей стороне.
Тепловые машины и их КПД
Рекомендация: перед тем как приступить к выполнению задач неплохо было бы повторить тему «Уравнение состояния идеального газа» . Но ключевую теорию, на которой основано решение задач, сейчас разберем вместе.
Вспомним, что фазовые переходы — это переход из одного агрегатного состояния в другое. При этом может выделяться большое количество теплоты.
Именно благодаря этому они и стали такими полезными для нас. Например, в ядерных реакторах воду используют в качестве рабочего тела, то есть она нагревается вследствие энергии, полученной из ядерных реакций, доходит до температуры кипения, а затем под большим давлением уже в качестве водяного пара воздействует на ротор генератора, который вращается и дает нам электроэнергию! На этом основан принцип работы атомных электростанций.
А самый простой пример фазового перехода — образование льда на лужах в морозные ноябрьские дни. Правда о выделении тепла здесь речи не идет.
Мы не почувствуем, как испарится капелька у нас на руке, потому что это не требует много тепла от нашего тела. Но мы можем наблюдать, как горят дрова в мангале, когда мы жарим шашлык, потому что выделяется огромное количество теплоты. А зачем мы вообще рассматриваем эти фазовые переходы? Все дело в том, что именно фазовые переходы являются ключевым звеном во всех процессах, где нас просят посчитать КПД, от них нашему рабочему телу и подводится теплота нагревателя.

Человечество придумало такие устройства, которые могут переработать тепловую энергию в механическую.
Тепловые двигатели, или тепловые машины, — устройства, способные преобразовывать внутреннюю энергию в механическую.
Их устройство довольно просто: они на входе получают какую-то энергию (в основном — энергию сгорания топлива), а затем часть этой теплоты расходуется на совершение работы механизмом. Например, в автомобилях часть энергии от сгоревшего бензина идет на движение. Схематично можно изобразить так:
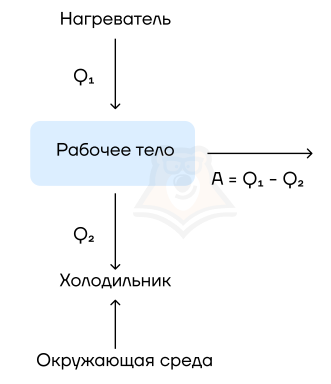
Рабочее тело — то, что совершает работу — принимает от нагревателя количество теплоты Q1, из которой A уходит на работу механизма. Остаток теплоты Q2 рабочее тело отдает холодильнику, по сути — это потеря энергии.
Физика не была бы такой загадочной, если б все в ней было идеально. Как и в любом процессе или преобразовании, здесь возможны потери, зачастую очень большие. Поэтому «индикатором качества» машины является КПД, с которым мы уже сталкивались в механике:
Коэффициент полезного действия (КПД) тепловой машины — это отношение полезной работы двигателя к энергии, полученной от нагревателя.
(eta) — КПД,
A — работа газа (Дж),
Q1 — количество теплоты, полученное от нагревателя (Дж).
Мы должны понимать, что КПД на практике никогда не получится больше 1, поскольку всегда будут тепловые потери.
Полезную работу можно расписать как Q1 — Q2 (по закону сохранения энергии). Тогда формула примет вид:
(eta = frac{Q_1 — Q_2}{Q_1} = 1 — frac{Q_2}{Q_1})
Давайте попрактикуемся в применении данной формулы на задаче номер 9 из ЕГЭ.
Задача. Тепловая машина, КПД которой равен 60%, за цикл отдает холодильнику 100 Дж. Какое количество теплоты за цикл машина получает от нагревателя? (Ответ дайте в джоулях).
Решение:
Давайте сначала вспомним нашу формулу для КПД:
(eta = frac{Q_1 — Q_2}{Q_1}),
где (Q_1) — это теплота, которую тело получает от нагревателя, (Q_2) — теплота, которая подводится к холодильнику.
Тогда отсюда можно вывести искомую теплоту нагревателя:
(eta Q_1 =Q_1-Q_2)
(eta Q_1 — Q_1= -Q_2)
(Q_1=frac{- Q_2}{eta-1}=frac{-100}{0,6-1}=250 Дж).
Ответ: 250 Дж
Цикл Карно
Мы знаем, что потери — это плохо, поэтому должны предотвращать их. Как это сделать? Нам ничего делать не нужно, за нас уже все сделал Сади Карно, французский физик, разработавший цикл, в котором машины достигают наивысшего КПД. Этот цикл носит его имя и состоит из двух изотерм и двух адиабат. Рассмотрим, как этот цикл выглядит в координатах p(V).
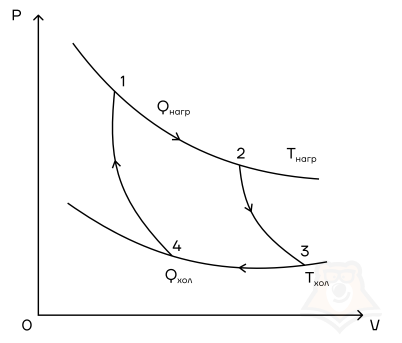
- Температура верхней изотермы 1-2 — температура нагревателя (так как теплота в данном процессе подводится).
- Температура нижней изотермы 3-4 — температура холодильника (так как теплота в данном процессе отводится).
- 2-3 и 4-1 — это адиабатические расширение и сжатие соответственно, в них газ не обменивается теплом с окружающей средой.
Цикл Карно — цикл идеальной тепловой машины, которая достигает наивысшего КПД.
Формула, по которой можно рассчитать ее КПД выражается через температуры:
T1 — температура нагревателя,
T2 — температура холодильника.
Не то круто, что красиво, а то, что по Карно работает! Поэтому присматривайте такой автомобиль, у которого высокий КПД.
Интересно, что максимальный уровень КПД двигателя внутреннего сгорания автомобилей на данный момент всего около 43%. По официальным заявлениям компания Nissan Motor с 2021 года испытывает прообраз двигателя нового поколения с планируемым КПД 50%.
Приступим к задачам
Задачи на данную тему достаточно часто встречаются в задании 27 из КИМа ЕГЭ. Давайте разберем некоторые примеры.
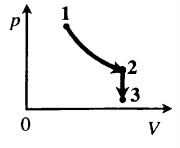
Задание 1. Одноатомный газ совершает циклический процесс, как показано на рисунке. На участке 1–2 газ совершает работу A12 = 1520 Дж. Участок 3–1 представляет собой адиабатный процесс. Количество теплоты, отданное газом за цикл холодильнику, равно |Qхол| = 4780 Дж. Найдите работу газа |A13| на адиабате, если количество вещества постоянно.
Решение:
Шаг 1. Первое, с чего лучше начинать задачи по термодинамике — исследование процессов.
Посмотрим на участок 1-2 графика: продолжение прямой проходит через начало координат, поэтому график функционально можно записать, как p = aV, где a — какое-то число, константа. Графиком является не изотерма, поскольку график изотермы в координатах p-V — гипербола. Из уравнения Менделеева-Клапейрона следует: (frac{pV}{T} = const). Отсюда можно сделать вывод, что возрастает температура, так как растут давление и объем. Температура и объем растут, значит, увеличивается и внутренняя энергия и объем соответственно.
Участок 2-3: процесс изохорный, поскольку объем постоянен, следовательно, работа газом не совершается. Рассмотрим закон Шарля: (frac{p}{T} = const). Давление в этом процессе растет, тогда растет и температура, поскольку дробь не должна менять свое значение. Делаем вывод, что внутренняя энергия тоже увеличивается.
Участок 3-1: адиабата по условию, то есть количество теплоты в этом переходе равна нулю из определения адиабатного процесса. Работа газа отрицательна, так как газ уменьшает объем.
Оформим все данные в таблицу.
Определим знаки Q, используя первый закон термодинамики: Q = ΔU + A.

Из этих данных сразу видно, что количество теплоты, отданное холодильнику — это количество теплоты в процессе 2-3.
Шаг 2. Первый закон термодинамики для процесса 1-2 запишется в виде:
Q12 = ΔU12 + A12.
Работа A12 — площадь фигуры под графиком процесса, то есть площадь трапеции:
(A_{12} = frac{p_0 + 2p_0}{2} * V0 =frac{3p_0V_0}{2}).
Запишем изменение внутренней энергии для этого процесса через давление и объем. Мы выводили эту формулу в статье «Первое начало термодинамики»:
(Delta U_{12} = frac{3}{2}(2p_0 * 2V_0 — p_0V_0) = frac{9p_0V_0}{2}).
Заметим, что это в 3 раза больше работы газа на этом участке:
(Delta U_{12} = 3A_{12} rightarrow Q_{12} = 4A_{12}).
Шаг 3. Работа цикла — площадь фигуры, которую замыкает график, тогда . A = A12 — |A31|. С другой стороны, работа цикла вычисляется как разность между энергиями нагревателя и холодильника: A = Q12 — |Q31|.
Сравним эти формулы:
Q12 -|Q31| = A12 — |A31|,
подставим выражения из предыдущего пункта:
4A12 — |Q31| = A12 — |A31| (rightarrow) |A31| = -3A12 + |Q31| = -31520 + 4780 = 220 Дж.
Ответ: 220 Дж
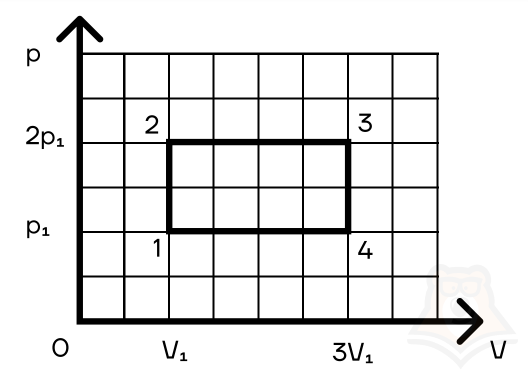
Задание 2. Найти КПД цикла для идеального одноатомного газа.
Решение:
Шаг 1. КПД цикла определим по формуле: (eta = frac{A}{Q}), где Q — количество теплоты от нагревателя, а А — работа газа за цикл. Найдем А как площадь замкнутой фигуры: A = (2p1 — p1)(3V1 — V1) = 2p1V1.
Шаг 2. Найдем процесс, который соответствует получению тепла от нагревателя. Воспользуемся теми же приемами, что и в прошлой задаче:
Посмотрим на участок 1-2 графика: давление растет, объем не меняется. По закону Шарля (frac{p}{T} = const) температура тоже растет. Работа газа равна 0 при изохорном процессе, а изменение внутренней энергии положительное.
2-3: давление не меняется, растет объем, а значит, работа газа положительна. По закону Гей-Люссака (frac{V}{T} = const) температура тоже растет, растет и внутренняя энергия.
3-4: давление уменьшается, следовательно, и температура уменьшается. При этом процесс изохорный и работа газа равна 0.
4-1: давление не меняется, объем и температура уменьшаются — работа газа отрицательна и внутренняя энергия уменьшается.
Оформим данные в таблицу:
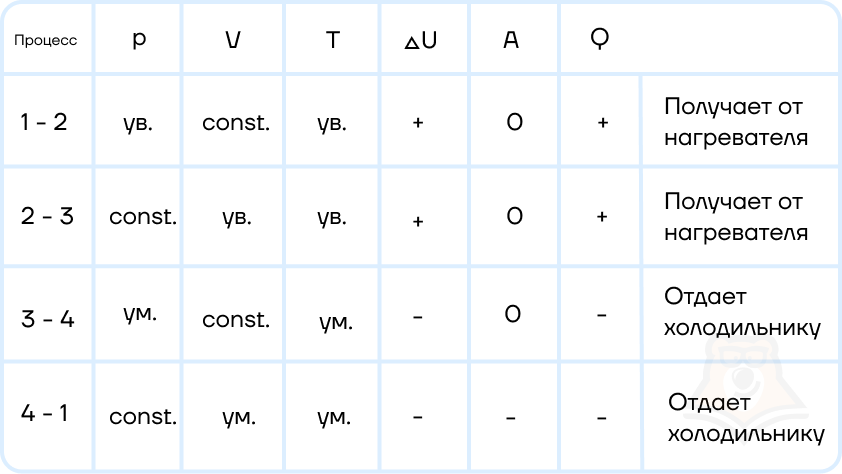
Отметим, что необходимое Q = Q12 + Q23.
Шаг 3. Запишем первый закон термодинамики для процессов 1-2 и 2-3:
(Q_{12} = U_{12} + A_{12} = Delta U_{12} = frac{3}{2}(2p_1V_1 -p_1V_1) = frac{3}{2}p_1V_1).
(Q_{23} = Delta U_{23} + A_{23}), работу газа найдем как площадь под графиком: A23 = 2p1(3V1 — V1) = 4p1V1.
(Delta U_{12} = frac{3}{2}(2p_1 * 3V_1 — 2p_1V_1) = 6p_1V_1).
(Q_{23} = Delta U_{23} + A_{23} = 10p_1V_1).
Шаг 4. Мы готовы считать КПД: (eta = frac{A}{Q} = frac{A}{Q_{12} + Q_{23}} = frac{2p_1V_1}{frac{3}{2}p_1V_1 + 10p_1V_1} = frac{4}{23} approx 0,17).
Ответ: 17%
Теперь вас не должно настораживать наличие графиков в условиях задач на расчет КПД тепловых машин. Продолжить обучение решению задач экзамена вы можете в статьях «Применение законов Ньютона» и «Движение точки по окружности».
Фактчек
- Тепловые двигатели — устройства, способные преобразовывать внутреннюю энергию в механическую.
- Тепловая машина принимает тепло от нагревателя, отдает холодильнику, а рабочим телом совершает работу.
- Коэффициент полезного действия (КПД) тепловой машины — это отношение полезной работы двигателя к энергии, полученной от нагревателя.
(eta = frac{A}{Q_1} = frac{Q_1 — Q_2}{Q_1} = 1 — frac{Q_2}{Q_1}) - Цикл Карно — цикл с максимально возможным КПД: (eta = frac{T_1 — T_2}{T_1} = 1 — frac{T_2}{T_1})
- Не забываем, что работа считается, как площадь фигуры под графиком.
Проверь себя
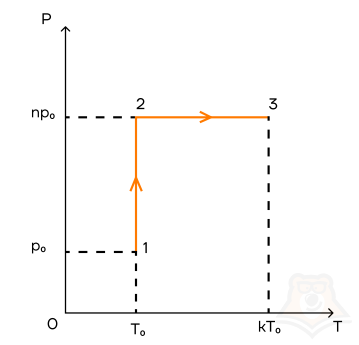
Задание 1.
1 моль идеального газа переходит из состояния 1 в состояние 2, а потом — в состояние 3 так, как это показано графике. Начальная температура газа равна T0 = 350 К. Определите работу газа при переходе из состояния 2 в состояние 3, если k = 3, а n = 2.
- 5672 Дж
- 4731 Дж
- 5817 Дж
- 6393 Дж
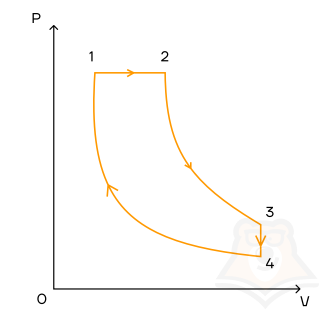
Задание 2.
1 моль идеального одноатомного газа совершает цикл, который изображен на pV-диаграмме и состоит из двух адиабат, изохоры, изобары. Модуль отношения изменения температуры газа при изобарном процессе ΔT12 к изменению его температуры ΔT34 при изохорном процессе равен 1,5. Определите КПД цикла.
- 0,6
- 0,5
- 0,8
- 1
Задание 3.
В топке паровой машины сгорело 50 кг каменного угля, удельная теплота сгорания которого равна 30 МДж/кг. При этом машиной была совершена полезная механическая работа 135 МДж. Чему равен КПД этой тепловой машины? Ответ дайте в процентах.
- 6%
- 100%
- 22%
- 9%
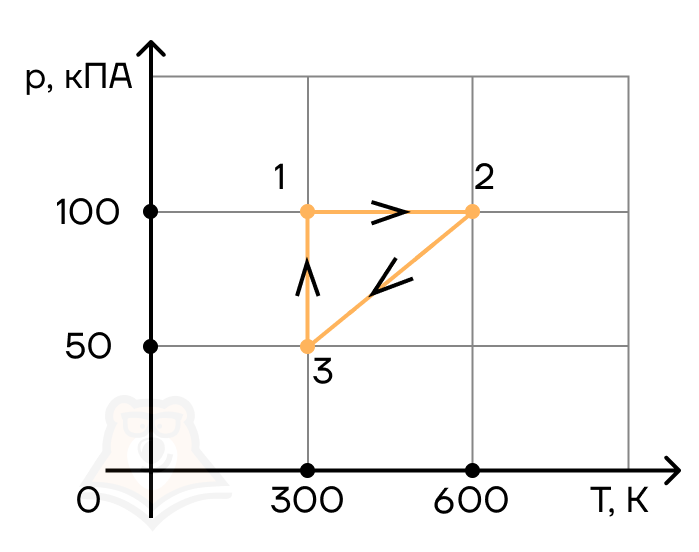
Задание 4.
С двумя молями одноатомного идеального газа совершают циклический процесс 1–2–3–1 (см. рис.). Чему равна работа, совершаемая газом на участке 1–2 в этом циклическом процессе?
- 4444 Дж
- 2891 Дж
- 4986 Дж
- 9355 Дж
Ответы:1 — 3; 2 — 1; 3 — 4; 4 — 3.
Описание презентации по отдельным слайдам:
-
1 слайд
1
Алгоритм решения задач на определение к.п.д. теплового цикла по графику зависимости давления от объема.
-
2 слайд
2
Задача на определение коэффициента полезного действия по графику зависимости давления от объема.
P
2P0
P0
V0
0
3V0
2V0
1
2
3
4
V
Рассчитайте КПД тепловой машины, использующей в качестве рабочего тела одноатомный идеальный газ и работающей по циклу, изображен-ному на рисунке. -
3 слайд
3
Задача на определение коэффициента полезного действия по графику зависимости давления от объема.
P
2P0
P0
V0
0
3V0
2V0
1
2
3
4
V
Рассчитайте КПД тепловой машины, использующей в качестве рабочего тела одноатомный идеальный газ и работающей по циклу, изображенному на рисунке.
Подсказка№1
Подсказка№2
Алгоритм решения
Решение -
4 слайд
4
Подсказка №1
P
2P0
P0
V0
0
3V0
2V0
1
2
3
4
VСледовательно, необходимо определить в каждом процессе по изменению температуры получено, или отдано количество теплоты.
Расчет количества теплоты производят исходя из первого закона термодинамики. -
5 слайд
5
Подсказка №2
P
2P0
P0
V0
0
3V0
2V0
1
2
3
4
V
Работа, выполненная в каком-либо процессе, численно равна площади фигуры заключенной под графиком в координатах P(V). Площадь заштрихованной фигуры равна работе в процессе 2-3, а площадь закрашенной фигуры — работе в процессе 4-1, причем именно эта работа газа отрицательна, т.к. от 4 к 1 объём уменьшается.
Работа за цикл равна сумме этих работ. Следовательно работа газа за цикл численно равна площади этого цикла. -
6 слайд
6
Алгоритм решения задачи.
P
2P0
P0
V0
0
3V0
2V0
1
2
3
4
V
1. Записать формулу КПД.
2. Определить работу газа по площади фигуры процесса в координатах P,V.
3. Проанализировать в каком из процессов поглощается , а не выделяется количество теплоты.
4.Используя 1 закон термодинамики, подсчитать полученное количество теплоты.
5. Подсчитать КПД. -
7 слайд
7
P
2P0
P0
V0
0
3V0
2V0
1
2
3
4
V
1. Записать формулу КПД.
2. Определить работу газа по площади фигуры процесса в координатах P,V.
Решение -
8 слайд
8
P
2P0
P0
V0
0
3V0
2V0
1
2
3
4
V
1. Процесс1 –2 . V = const, P T Q поглощается
2. Процесс 2 – 3. P = const, V , T Q поглощается
3. Процесс 3 – 4. V = const, P , T Q выделяется
4. Процесс 4 – 1. P = const, V , T Q выделяется
3. Проанализировать в каком из процессов поглощается , а не выделяется количество теплоты. -
9 слайд
9
P
2P0
P0
V0
0
3V0
2V0
1
2
3
4
V
Для процесса 1-2
4. Используя 1 закон термодинамики, подсчитать полученное количество теплоты.
следовательно
Для изохорного процесса
Вычтем из нижнего уравнения верхнее -
10 слайд
10
4. Используя 1 закон термодинамики, подсчитать полученное количество теплоты.
Для процесса 2-3
P
2P0
P0
V0
0
3V0
2V0
1
2
3
4
V -
11 слайд
11
P
2P0
P0
V0
0
3V0
2V0
1
2
3
4
V -
12 слайд
12
P
2P0
P0
V0
0
3V0
2V0
1
2
3
4
V
5. Подсчитать КПД.
Первое начало термодинамики (первый закон термодинамики) представляет собой закон сохранения энергии в тепловых процессах.
Первое начало термодинамики
Внутренняя энергия идеального газа изменяется двумя способами: за счет теплопередачи или при совершении работы.
±ΔU=±Q±A‘
Пояснение:
- +∆U — внутренняя энергия газа увеличивается.
- –∆U — внутренняя энергия газа уменьшается.
- +Q — газ нагревают (газу передают количество теплоты).
- –Q — газ охлаждается (газ отдает тепло окружающей среде).
- +A’ — газ сжимает внешняя сила.
- –A’ — газ расширяется, совершая работу.
Внимание! Знак перед работой показывает, как процесс совершения работы влияет на изменение внутренней энергии газа.
Пример №1. В некотором процессе внутренняя энергия газа уменьшилась на 300 Дж, а газ совершил работу 500 Дж. Какое количество теплоты было сообщено газу?
Чтобы рассчитать количество теплоты, сообщенное газу, нужно найти разность между изменением внутренней энергии и работой, совершенным газом. Для этого нужно правильно определить их знаки. Так как внутренняя энергия уменьшилась, она отрицательна. Но работа положительна. Поэтому газу было сообщено следующее количество теплоты:
Q = A – U = 500 – 300 = 200 (Дж)
Зависимость физических величин
Выясним, от чего зависят величины, входящие в формулу первого начала термодинамики. Изменение внутренней энергии идеального газа зависит от изменения температуры:
ΔU=32νRΔT
Работа идеального газа зависит от изменения его объема:
A‘=pΔV
Первое начало термодинамики для изопроцессов
| Изотермический процесс (T = const) |
ΔU=0, Q=A‘ |
| Изохорный процесс (V = const) |
A‘=0, ΔU=Q |
| Изобарное расширение газа (p = const) |
ΔU=Q−pΔV ΔU=Q−νRΔT |
| Адиабатный (система не получает тепло извне и не отдает его окружающей среде, или Q = 0) |
Q=0, ΔU=A‘ |
Пример №2. Идеальный одноатомный газ находится в сосуде с жесткими стенками объемом 0,6 куб. м. При нагревании его внутренняя энергия увеличилась на 18 кДж. На сколько возросло давление газа?
18 кДж = 18000 Дж
Внутреннюю энергию газа можно определить по формуле:
ΔU=32νRΔT
Отсюда изменение температуры равно:
ΔT=2ΔU3νR
Уравнение состояния идеального газа для 1 и 2 состояния:
p1V=νRT1
p2V=νRT2
Отсюда давления равны:
p1=νRT1V
p2=νRT2V
Разность давлений:
p2−p1=νRT2V−νRT1V=νRVΔT=νRV·2ΔU3νR=2ΔU3V
p2−p1=2·180003·0,6=20000 (Па)=20 (кПа)
Графические задачи на первое начало термодинамики
Рассмотрим графический способ решения задачи на первое начало термодинамики на конкретном примере.
Задача: Один моль идеального одноатомного газа сначала изотермически расширился (T1 = 300 К). Затем газ охладили, понизив давление в 3 раза (см. рисунок). Какое количество теплоты отдал газ на участке 2–3?
Порядок решения:
1. Определить температуры для всех указанных точек, учитывая графики процессов, масштаб и условие задачи.
T1 = T2 = 300 К; T3 = 100 К
2. Определить, к какому изопроцессу относится тот участок графика, о котором спрашивают в задаче.
Участок 2–3 на графике — это изохорный процесс, так как давление остается постоянным.
3. Записать для него первое начало термодинамики.
В данном процессе:
ΔU=Q
4. Учитывая характер изменения величин, правильно расставить знаки: −ΔU=−Q.
5. Подставляя в первое начало термодинамики формулы для расчета изменения внутренней энергии и работы газа, решить задачу.
Формула изменения внутренней энергии газа:
ΔU=32νRΔT
Формула работы газа:
A‘=pΔV
Так как процесс изохорный, работа газа равна нулю. Поэтому количество теплоты, отданное газом на участке 2–3, равно изменению внутренней энергии газа:
Изменение внутренней энергии равно:
Q23=32νRΔT23=32·1·8,31·200=2493 (Дж)
Задание EF17492
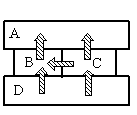
- A
- B
- C
- D
Алгоритм решения
- Определить тип теплопередачи.
- Вспомнить, как происходит этот тип теплопередачи.
- Сделав анализ рисунка, установить, какой брусок имеет указанную в задаче температуру.
Решение
Так как это твердые тела, поверхности которых соприкасаются друг с другом, и перенос тепла происходит без переноса вещества, то этот вид теплопередачи является теплопроводностью. Тепло всегда направлено от более нагретого тела к менее нагретому.
На рисунке видно, что самым нагретым телом является нижний брусок, так как он только отдает тепло, но не принимает его. Средний брусок справа менее нагрет, чем нижний, так как принимает от него тепло. Но он более теплый по сравнению со средним бруском слева, так как он делится с ним теплом. И оба этих бруска отдают свою энергию верхнему бруску, который сам только принимает тепло, но не отдает его. Следовательно, именно он имеет температуру +40 оС.
Ответ: A
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17758
Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅105 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение состояния идеального газа.
3.Записать формулу для расчета внутренней энергии газа.
4.Используя первое начало термодинамики, выполнить общее решение задачи.
5.Подставив известные данные, вычислить неизвестную величину.
Решение
Запишем исходные данные:
• Начальная температура газа: T1 = 600 К.
• Начальное давление: p1 = 4∙105 Па.
• Конечное давление: p2 = 105 Па.
• Работа, совершенная газом: A = 2493 Дж.
Аргон является одноатомным газом. Поэтому для него можно использовать уравнение состояния идеального газа:
pV=νRT
Внутренняя энергия одноатомного идеального газа пропорциональна температуре:
U=32νRT
Внутренняя энергия аргона до расширения и после него:
U1=32νRT1
U2=32νRT2
Согласно условию задачи, температура при расширении обратно пропорциональна объёму. Следовательно:
T=constV
T1V1=T2V2
Выразим конечную температуру:
T2=T1V1V2
Составим уравнение состояния газа для состояний аргона 1 и 2:
p1V1=νRT1
p2V2=νRT2
Отсюда:
νR=p1V1T1=p2V2T2
Отсюда отношение объема аргона в состоянии 1 к объему газа в состоянии 2 равно:
V1V2=p2T1p1T2
Подставим это отношение в формулу для конечной температуры:
T2=T1V1V2=p2T12p1T2
Отсюда:
T2=T1√p2p1
Отсюда внутренняя энергия газа в состоянии 2 равна:
U2=32νRT1√p2p1
Уменьшение внутренней энергии аргона составило (изначально она была выше):
ΔU=U1−U2=32νRT1−32νRT1√p2p1=32νRT1(1−√p2p1)
В соответствии с первым началом термодинамики уменьшение внутренней энергии равно сумме совершённой работы и количества теплоты, отданного газом:
ΔU=Q+A
Следовательно, газ отдал следующее количество теплоты:
Q=ΔU−A=32νRT1(1−√p2p1)−A
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17562
Газу передали изохорно количество теплоты 300 Дж. Как изменилась его внутренняя энергия в этом процессе?
Ответ:
а) увеличилась на 300 Дж
б) уменьшилась на 300 Дж
в) увеличилась на 600 Дж
г) уменьшилась на 600 Дж
Алгоритм решения
1.Записать исходные данные.
2.Записать первое начало термодинамики.
3.Установить, как меняется внутренняя энергия идеального газа.
Решение
Запишем исходные данные:
• Количество теплоты, переданное газу: Q = 300 Дж.
Первое начало термодинамики:
ΔU=Q+A
Так как по условию задачи это изохорный процесс, то работа равна 0. Следовательно, изменение внутренней энергии газа равно количеству теплоты:
ΔU=Q=300 (Дж)
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17597
Находясь в цилиндре двигателя, газ получил от нагревателя количество теплоты, равное 10 кДж. Затем он расширился, совершив работу 15 кДж. В результате всех этих процессов внутренняя энергия газа уменьшилась на
Ответ:
а) 5 кДж
б) 10 кДж
в) 15 кДж
г) 25 кДж
Алгоритм решения
1.Записать исходные данные.
2.Записать первое начало термодинамики.
3.Установить, как меняется внутренняя энергия идеального газа.
Решение
Запишем исходные данные:
• Количество теплоты, переданное газу: Q = 10 кДж.
• Работа, совершенная газом: A = 15 кДж.
Первое начало термодинамики:
ΔU=Q+A
В этой формуле за работу принимается та работа, что совершается над газом. Но в данном случае газ сам совершает работу. Поэтому первое начало термодинамики примет вид:
ΔU=Q−A=10−15=−5 (кДж)
Знак «–» указывает на то, что внутренняя энергия газа уменьшилась на 5 кДж.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17579
При постоянном давлении гелий нагрели, в результате чего он совершил работу 5 кДж? Масса гелия 0,04 кг. Насколько увеличилась температура газа?
Ответ:
а) 60 К
б) 25 К
в) 15 К
г) 3 К
Алгоритм решения
1.Записать исходные данные и перевести единицы измерения величин в СИ.
2.Записать первое начало термодинамики.
3.Записать формулу для расчета работы газа.
4.Выполнить решение задачи в общем виде.
5.Подставить известные данные и выполнить вычисления искомой величины.
Решение
Запишем исходные данные:
• Газ совершил работу: A = 5 кДж.
• Масса гелия: m = 0,04 кг.
5 кДж = 5000 Дж
Первое начало термодинамики:
ΔU=Q+A
Учтем, что не над газом совершают работу, а сам газ совершает ее:
Отсюда:
ΔU=Q−A
Так как газ нагревали изобарно, часть тепла ушла на изменение внутренней энергии газа, а часть — на совершение этим газом работы.
Работа, совершенная газом, равна:
A=pΔV=mMRΔT
Молярная масса гелия равна 4∙10–3 кг/моль.
Отсюда:
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 3.9k
1. Изопроцессы и адиабатный процесс
Напомним, что согласно первому закону термодинамики количество теплоты Q, переданное газу, связано с изменением внутренней энергии газа ∆U и работой газа Aг соотношением
Q = ∆U + Aг. (1)
Часто требуется применять первый закон термодинамики к газовым процессам, представляющим собой последовательность изопроцессов (иногда добавляется еще адиабатный процесс).
Рассмотрим, как находить величины, фигурирующие в формуле (1), в этих процессах. Напомним, что каждая из тих величин может быть положительной, отрицательной или равной нулю.
Если график газового процесса задан не в координатах (p, V), то желательно начертить график этого же процесса в координатах (p, V), потому что с помощью этого графика легко найти работу газа. Напомним, что работа газа при расширении численно равна площади под графиком зависимости p(V), при сжатии газа – площади под тем же графиком, но взятой о знаком минус.
В большинстве задач на эту тему рассматривается однотомный идеальный газ. Напомним, что его внутренняя энергия выражается формулой
U = (3/2)νRT, (2)
где ν – количество вещества (число молей), R – универсальная газовая постоянная, T – абсолютная температура.
? 1. Чему равно изменение внутренней энергии газа в изотермическом процессе?
Из формулы (2) и уравнения состояния идеального газа
pV = νRT (3)
следует, что внутреннюю энергию одноатомного идеального газа можно выразить также формулой
U = (3/2)pV. (4)
С помощью этой формулы можно находить изменение внутренней энергии одноатомного идеального газа, если известны начальные и конечные значения давления и объема газа.
Например, если начальные значения давления и объема обозначить p1 и V1, а конечные – p2 и V2, то
∆U = (3/2) (p2V2 – p1V1). (5)
? 2. Чему равно изменение внутренней энергии при изохорном процессе, если объем газа равен V, а давление изменилось от p1 до p2?
? 3. Чему равно изменение внутренней энергии при изобарном процессе, если давление газа равно p, а объем изменился от V1 до V2?
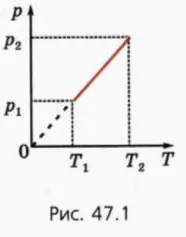
? 4. На рисунке 47.1 изображен график зависимости p(T) для ν молей одноатомного идеального газа при изохорном переходе из состояния 1 в состояние 2. Даны начальные значения давления и температуры газа p1 и T1, конечная температура T2.
а) Чему равно конечное давление газа p2?
б) Чему равен объем газа V?
в) Начертите график этого же процесса в координатах (p, V).
г) Чему равна работа газа Aг?
д) Чему равно изменение внутренней энергии ∆U газа?
е) Чему равно полученное газом количество теплоты Q?
? 5. На рисунке 47.2 изображен график зависимости V(T), для ν молей одноатомного идеального газа при изобарном переходе из состояния 1 в состояние 2. Даны начальные значения объема и температуры газа V1, и T1, конечная температура T2.
47.2
а) Чему равен конечный объем газа V2?
б) Чему равно давление газа p?
в) Начертите график этого же процесса в координатах (p, V).
г) Чему равна работа газа Aг?
д) Чему равно изменение внутренней энергии газа?
е) Чему равно полученное газом количество теплоты Q?
? 6. Используя результаты предыдущих заданий, сравните значения количества теплоты, полученного одним и тем же количеством вещества газа в изохорном и изобарном процессе при нагревании от температуры T1 до температуры T2.
а) В каком случае количество теплоты больше? Во сколько раз больше?
б) Объясните этот результат, используя закон сохранения энергии.
Рассмотрим теперь изотермический и адиабатный процессы.
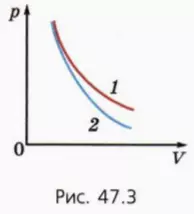
? 7. На рисунке 47.3 приведены графики зависимости p(V) для данной массы газа при изотермическом и адиабатном процессах. Какой график описывает адиабатный процесс? Поясните свой ответ.
? 8. В каком случае совершенная газом работа больше: когда он расширяется изотермически или адиабатно? Начальные объемы газа одинаковы, конечные объемы тоже одинаковы. Поясните свой ответ.
? 9. Как связаны полученное газом количество теплоты Q и работа газа Aг при изотермическом процессе?
Нахождение работы газа при изотермическом расширении выходит за рамки школьного курса физики. Но в задачах часто используется связь между Q и Aг в изотермическом процессе, выведенная вами при выполнении предыдущего задания.
? 10. В вертикальном цилиндре под поршнем массой 1 кг находится идеальный газ. При изотермическом расширении газа поршень поднялся на 5 см. Примите, что трением между поршнем и стенкой цилиндра можно пренебречь.
а) Чему равна работа газа?
б) Чему равно переданное газу количество теплоты?
? 11. Как связаны работа газа Aг и изменение его внутренней энергии ∆U при адиабатном процессе? (Напомним, что при адиабатном процессе отсутствует теплопередача, то есть Q = 0.)
Нахождение работы газа при адиабатном процессе также выходит за рамки школьного курса, но связь между Aг и ∆U в этом процессе широко используется при решении задач.
? 12. При адиабатном расширении 2 молей одноатомного идеального газа газ совершил работу 100 Дж.
а) Как изменилась при этом внутренняя энергия газа?
б) Как изменилась температура газа?
2. Циклические процессы
Циклические газовые процессы состоят из нескольких этапов, причем конечное состояние газа совпадает с начальным. Обычно рассматриваются случаи, когда этапами циклического процесса являются изопроцессы и адиабатный процесс.
Вопросы при этом ставятся, например, такие.
- На каких этапах процесса газ получает тепло, а на каких – отдает?
- Чему равно полученное газом или отданное им количество теплоты?
- Чему равно изменение внутренней энергии газа на различных этапах процесса?
- Чему равна работа газа за один цикл?
- Чему равен КПД цикла?
Для простейшего циклического процесса, состоящего из двух изохор и двух изобар, мы уже нашли ответы на эти вопросы (см. § 43). Рассмотрим теперь более сложный цикл.
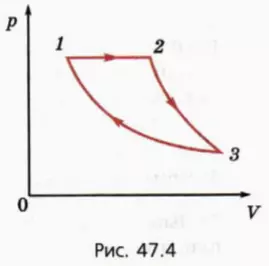
На рисунке 47.4 изображен график циклического процесса, происходящего с некоторой массой одноатомного идеального газа.
На этапе 2–3 газ адиабатно расширяется, а на этапе 3–1 изотермически сжимается.
Известно, что при изобарном расширении газ совершает работу A, а при изотермическом сжатии отдает холодильнику количество теплоты Qхол. Требуется найти КПД цикла.
Проанализируем сначала этот циклический процесс качественно. По определению КПД цикла равен отношению работы, совершенной газом за один цикл, к количеству теплоты, переданному газу за этот цикл.
Работа, совершенная газом за один цикл, равна разности работы, совершенной газом при его расширении, и работы, совершенной над газом при его сжатии.
? 13. На каких этапах процесса газ совершает работу, а на каких этапах работу совершают над газом?
? 14. На каких этапах процесса газ получает тепло?
Перейдем теперь к количественному описанию. Заметим, то в подобных задачах как работу газа, так и количество теплоты удобно выражать через число молей газа и значения абсолютной температуры газа в различных состояниях газа, даже если эти значения не заданы (в таком случае они сократятся, если найдено правильное решение).
Обозначим T1, T2 и T3 значения абсолютной температуры соответственно в состояниях 1, 2, 3. Поскольку процесс 3–1 изотермический, T1 = T3.
? 15. Рассмотрим сначала изобарный процесс 1–2.
а) Выразите работу газа через давление p в этом процессе и значения объемов газа в состояниях 1 и 2.
б) Выразите эту работу через число молей газа и значения абсолютной температуры в состояниях 1 и 2.
в) Выразите изменение внутренней энергии газа в процессе 1–2 через число молей газа и значения абсолютной температуры в состояниях 1 и 2.
г) Выразите количество теплоты, полученное газом в процессе 1–2, через число молей газа и значения абсолютной температуры в состояниях 1 и 2.
д) Как связано переданное газу количество теплоты с работой, совершенной газом?
? 16. Рассмотрим адиабатный процесс 2–3.
а) Каково соотношение между работой газа в этом процессе и изменением его внутренней энергии?
б) Выразите работу газа в этом процессе через число молей газа и значения абсолютной температуры в состояниях 2 и 3.
в) Найдите соотношение между работой газа в процессе 1–3 и работой газа в процессе 2–3.
? 17. Рассмотрим изотермический процесс 3–1.
а) Найдите соотношение между работой газа в этом процессе и количеством теплоты, полученным газом. Учтите, что в данном случае обе эти величины отрицательны.
б) Выразите работу Aвнеш, совершенную в этом процессе над газом, через количество теплоты Qхол, отданное газом холодильнику.
Используя результаты, полученные при выполнении предыдущих заданий, получаем, что работу Aц, совершенную газом за дин цикл, можно выразить через заданные величины:
3. Расширение газа под поршнем
Трением между поршнем и стенкой сосуда можно пренебречь
Если цилиндрический сосуд с газом расположен вертикально и трением между поршнем и стенками сосуда можно пренебречь, то при медленном нагревании процесс является изобарным. Работа газа
Aг = mgh,
где m – масса поршня, h – расстояние, на которое поднялся поршень. Используя первый закон термодинамики
Q = ∆U + Aг,
можно связать перемещение поршня с переданным газу количеством теплоты Q и изменением его внутренней энергии ∆U. Ее можно выразить через изменение температуры ∆T и число молей газа.
? 18. Одноатомный идеальный газ находится в вертикальном цилиндрическом сосуде под поршнем массой 2 кг. Когда газу передали количество теплоты, равное 10 Дж, поршень поднялся на 5 см, а температура газа увеличилась на 2 К. Трением между поршнем и стенкой сосуда можно пренебречь. Сколько молей газа содержится в сосуде?
Учет трение между поршнем и стенкой сосуда
Типичная ошибка при решении подобных задач состоит в ом, что не учитывают силу трения покоя. Дело в том, что при увеличении давления газа под поршнем он не сдвинется с места до тех пор, пока равнодействующая приложенных к нему сил не превысит максимальную силу трения покоя, которую обычно принимают равной силе трения скольжения. Только поле этого поршень начнет двигаться, и газ начнет расширяться.
Рассмотрим пример. Пусть теперь сосуд расположен горизонтально: в таком случае вес поршня не играет роли.
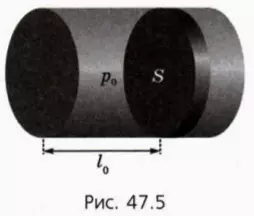
? 19. В горизонтальном цилиндрическом сосуде, закрытом поршнем, находится одноатомный идеальный газ. Начальное давление газа равно p0, начальное расстояние от дна сосуда до поршня равно l0, площадь поршня S (рис. 47.5).
При движении поршня на него со стороны стенки сосуда действует сила трения скольжения Fтр. Будем считать, что сосуд находится в вакууме (то есть на поршень не действует сила атмосферного давления). В начальный момент поршень находится в равновесии. Газу передают некоторое количество теплоты.
а) Какое соотношение между p0, Fтр и S следует из условия, что в начальный момент поршень находится в равновесии?
б) При каком давлении p газа поршень начнет двигаться?
в) Насколько должна увеличиться внутренняя энергия газа, чтобы поршень начал двигаться?
г) Какое количество теплоты Q надо сообщить газу, чтобы поршень начал двигаться?
д) Чему будет равно давление p газа, когда поршень будет двигаться равномерно?
е) Какую работу A совершит газ при равномерном перемещении поршня на расстояние d?
ж) Насколько увеличится при этом внутренняя энергия газа по сравнению с ее начальным значением?
з) Какое количество теплоты Q надо передать газу в начальном состоянии, чтобы поршень сдвинулся на расстояние d?
Дополнительные вопросы и задания
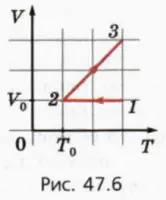
20. На рисунке 47.6 изображен процесс, происходящий с ν молями одноатомного идеального газа.
а) Начертите график этого процесса в координатах (p, V).
б) Чему равны работа газа, изменение его внутренней энергии и переданное ему количество теплоты в процессе 1–2? Учтите, что эти значения могут быть отрицательными.
в) Чему равны работа газа, изменение его внутренней энергии и переданное ему количество теплоты в процессе 2–3?
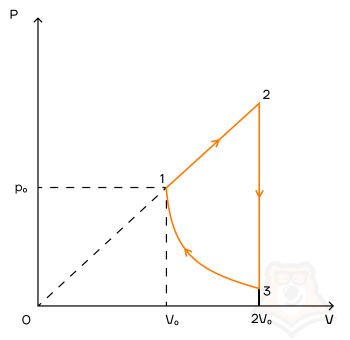
21. На рисунке 47.7 изображен график цикла, происходящего с одноатомным идеальным газом. Найдите КПД цикла.
Задачи с графиками: работа газа и внутренняя энергия
Задачи средней сложности, для решения нужна только внимательность. Никаких «подвохов»- все математически четко и понятно.
Задача 1.
Температура идеального газа в состоянии 1 была . Чему равна температура в состоянии 3 после осуществления процесса 1-2-3, изображенного на диаграмме
?
К.
К задаче 1
Процесс 1-2 – изохорный. Запишем закон Шарля.
Процесс 2-3 – не изотермический, поэтому просто запишем уравнение состояния:
Откуда
Ответ: 1800 К.
Задача 2.
Идеальный одноатомный газ, находящийся при нормальных условиях, переводят из состояния 1 в состояние 2 двумя способами: 1-3-2 и 1-4-2. Найдите отношение количеств теплоты, которые необходимо сообщить 1 кмоль газа в этих двух процессах.
К задаче 2
Рассмотрим переход 1-3-2. Процесс 1-3 – изохора, работа не совершается. Но температура растет, определим, как.
Процесс 3-2 – изобара. Работа в процессе 3-2 равна
Изменение температуры составило . Следовательно, можем определить изменение внутренней энергии:
Теперь найдем общее количество теплоты, переданное газу при таком переходе:
Процесс перехода 1-4-2 отличается только совершенной работой. Определим ее:
Определим отношение количеств теплоты:
Ответ: .
Задача 3.
Идеальный одноатомный газ, взятый в количестве 1 моль, переводят из состояния 1 в состояние 4. Какое количество теплоты сообщили в этом процессе газу? Масса газа во время процесса не меняется.
К задаче 3
Определим сначала изменение внутренней энергии, для этого составим объединенный газовый закон для точек 1 и 4.
Изменение внутренней энергии равно
Теперь определим работу. Работу удобно определить как площадь под кривой процесса. Разобьем эту площадь на удобные «куски» — трапеции.
К задаче 3. Определяем работу
Теперь найдем общее количество теплоты, переданное газу:
Ответ: 1450 Дж.
Задача 4.
На рисунке представлена диаграмма цикла с одноатомным идеальным газом, взятым в количестве 0,3 моль. Участки и
— адиабаты. Определите работу, совершенную газом на участке
.
К задаче 4
Участок по условию – адиабата, то есть передачи тепла газу на этом участке не происходит, следовательно, работа будет совершена за счет «внутренних резервов» — то есть внутренней энергии. Нужно, следовательно, найти, как она изменилась.
Задачу можно решить двумя способами. Во-первых, просто определить температуры в точках и
, это легко сделать из данных графика с помощью уравнения Менделеева-Клапейрона, и затем посчитать
. Но, так как
, а
,то изменение внутренней энергии будет равно
Ответ: 1350 Дж.
Задача 5.
Один моль одноатомного идеального газа расширяется сначала изобарно, а затем по линейному закону, причем прямая линия проходит через начало координат .
. Найдите
, если количество тепла, сообщенное газу на участке 1-2, в 4 раза меньше работы, совершенной на участке 2-3.
К задаче 5
Определим количество тепла, сообщенное газу на участке 1-2, и работу, совершенную на участке 2-3.
Для изобарного процесса 1-2 запишем закон Гей-Люссака:
Откуда
Следовательно, изменение внутренней энергии газа равно
Работа на этом участке равна площади под графиком, под участком 1-2:
Тогда тепло, переданное газу, равно
Теперь рассмотрим процесс 2-3. Нам нужно определить лишь работу газа на этом участке. Площадь под этим участком – трапеция, поэтому
Из подобия треугольников и
запишем:
Тогда
Так как по условию , то
Так как , то
Сократим, что возможно:
Из первой записанной нами формулы (закона Гей-Люссака) следует, что
Тогда
Или
Введем замену :
Понятно, отрицательный корень нас не интересует.
Ответ: .