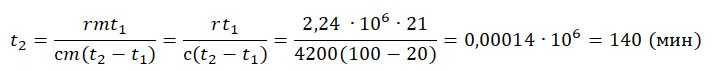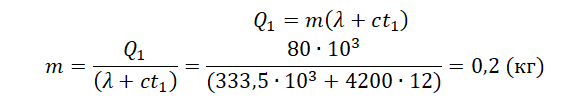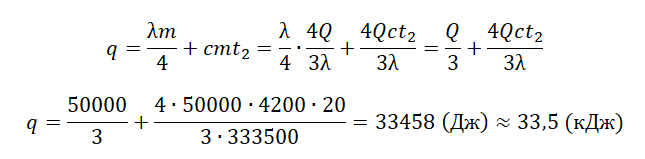Твердые кристаллические вещества переходят в жидкое состояние посредством плавления. Чтобы расплавить вещество, необходимо сообщить ему некоторое количество теплоты. И, наоборот, при кристаллизации (переходе жидкости в твердое состояние) энергия выделяется в окружающую среду.
Проведем аналогию с переходом жидкости в пар. Этот переход может быть осуществлен двумя способами: испарением или кипением. Кипение является тем же испарением, но более интенсивным. Очевидно, что для того, чтобы происходил процесс кипения, жидкости необходимо сообщать какое-то количество теплоты. Это количество теплоты будет идти на образование пара.
На данном уроке мы познакомимся с новым определением — удельной теплотой парообразования и конденсации. Вы узнаете формулу для расчета количества теплоты, необходимого для парообразования жидкости и научитесь ею пользоваться.
Удельная теплота парообразования
Вы уже знаете, что кипение происходит при определенной для каждой жидкости температуре. Количество теплоты, которое потребуется сообщить этим жидкостям одинаковой массы для превращения их в пар тоже будет различно.
Опытным путем было выяснено следующее. Если мы возьмем воду массой $1 space кг$ при температуре $100 degree C$, то нам потребуется затратить $2.3 cdot 10^6 space Дж$ энергии для полного превращения этой воды в пар.
Температура кипения во время всего процесса остается постоянной. Следовательно, нам необходимо подводить к кипящей жидкости определенное количество теплоты. Для воды это энергия в $2.3 cdot 10^6 space Дж$.
Удельная теплота парообразования — это физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить жидкость массой $1 space кг$ в пар без изменения температуры.
- Обозначается буквой $L$
- Единица измерения удельной теплоты парообразования — $1 frac{Дж}{кг}$
- При температуре кипения внутренняя энергия вещества в парообразном состоянии больше внутренней энергии вещества такой же массы в жидком состоянии
Удельная теплота парообразования некоторых жидкостей
В таблице 1 приведены экспериментально полученные величины удельной теплоты парообразования некоторых жидкостей.
| Вещество | $L, frac{Дж}{кг}$ |
| Вода | $2.3 cdot 10^6$ |
| Аммиак (жидкий) | $1.4 cdot 10^6$ |
| Спирт | $0.9 cdot 10^6$ |
| Эфир | $0.4 cdot 10^6$ |
| Ртуть | $0.3 cdot 10^6$ |
| Воздух (жидкий) | $0.2 cdot 10^6$ |
Удельная теплота парообразования эфира равна $0.4 cdot 10^6 frac{Дж}{кг}$. Что это означает?
Возьмем $1 space кг$ эфира при его температуре кипения ($35 degree C$). Для того чтобы полностью превратить его в пар, нам потребуется $0.4 cdot 10^6 space Дж$.
Обратите внимание, что удельная теплота парообразования показывает количество теплоты, необходимое для превращения жидкости, взятой при ее температуре кипения, в пар.
Удельная теплота конденсации
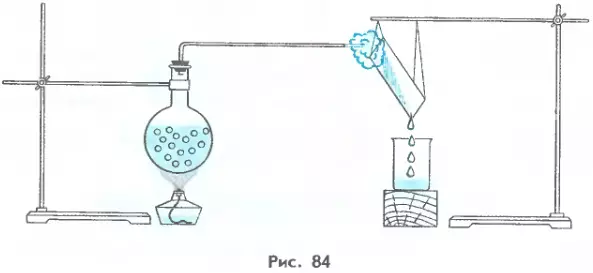
Нужно ли сообщать пару энергию при его конденсации? Давайте рассмотрим простой опыт (рисунок 1).
Нальем в сосуд воду и закроем его пробкой. Через пробку проведем трубку и направим ее на кусочек охлажденного стекла. Доведем воду до кипения с помощью горелки.
Пар, поднимающийся над кипящей водой, будет конденсироваться, соприкасаясь с холодным стеклом. Если мы дотронемся до стекла, то обнаружим, что оно очень сильно нагрелось.
Так энергия пара передается стеклу. В результате этой потери энергии пар конденсируется. Если бы температура стекла была равна температуре пара, то теплопередача бы не происходила, и конденсат не образовывался бы.
Это говорит о том, что при конденсации пар отдает, выделяет энергию.
Более точные опыты также показывают, что
Конденсируясь, пар отдает то количество энергии, которое пошло на его образование.
Значит, при превращении $1 space кг$ водяного пара в воду при температуре $100 degree C$ выделяется $2.3 cdot 10^6 space Дж$ энергии.
Это довольно большая энергия, поэтому человечество стремится ее использовать. Например, на крупных тепловых электростанциях паром, который уже прошел через турбины, нагревают воду. Ее, в свою очередь, используют для отопления зданий и бытовых нужд.
Расчет количества теплоты, необходимого для парообразования
Чтобы вычислить количество теплоты $Q$, необходимое для превращения в пар жидкости любой массы, взятой при температуре кипения, нужно удельную теплоту парообразования $L$ умножить на массу $m$:
$Q = Lm$.
Из этой формулы при расчетах мы можем выражать массу ($m = frac{Q}{L}$) и удельную теплоту парообразования ($L = frac{Q}{m}$).
Для расчета количества теплоты, которое выделит пар массой $m$ при температуре кипения в ходе конденсации, используется эта же формула.
Упражнения
Упражнение №1
У вас есть вода массой $2 space кг$ с температурой $20 degree C$. Рассчитайте, какое количество энергии потребуется для ее превращения в пар.
Дано:
$m = 2 space кг$
$t_1 = 20 degree C$
$t_2 = 100 degree C$
$c = 4200 frac{Дж}{кг cdot degree C}$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$Q — ?$
Показать решение и ответ
Скрыть
Решение:
Сначала нам потребуется нагреть воду до температуры кипения, затратив на это количество энергии $Q_1$:
$Q_1 = cm (t_2 — t_1)$.
$Q_1 = 4200 frac{Дж}{кг cdot degree C} cdot 2 space кг cdot (100 degree C — 20 degree C) = 8400 frac{Дж}{degree C} cdot 80 degree C = 672 space 000 space Дж approx 0.7 cdot 10^6 space Дж$.
Теперь рассчитаем количество энергии $Q_2$, затраченное для превращения воды в пар:
$Q_2 = Lm$.
$Q_2 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 2 space кг = 4.6 cdot 10^6 space Дж$.
Рассчитаем общее количество энергии, которое нам потребуется:
$Q = Q_1 + Q_2 = 0.7 cdot 10^6 space Дж + 4.6 cdot 10^6 space Дж = 5.3 cdot 10^6 space Дж$.
Ответ: $Q = 5.3 cdot 10^6 space Дж$.
Упражнение №2
Вычислите, какое количество энергии выделится при охлаждении водяного пара массой $2 space кг$ от $100 degree C$ до $0 degree C$.
Дано:
$m = 2 space кг$
$t_1 = 100 degree C$
$t_2 = 0 degree C$
$c = 4200 frac{Дж}{кг cdot degree C}$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$Q — ?$
Показать решение
Скрыть
Решение:
Температура $100 degree C$ — это температура парообразования воды и конденсации водяного пара. При понижении температуры пар сначала сконденсируется в жидкость, а жидкость продолжит охлаждаться.
Количество теплоты, выделенное при этом будет равно:
$Q = Q_1 + Q_2$, где
$Q_1$ — количество выделенной теплоты при конденсации пара,
$Q_2$ — количество теплоты, выделенное при охлаждении жидкости до $0 degree C$.
$Q_1 = Lm$.
$Q_1 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 2 space кг = 4.6 cdot 10^6 space Дж$.
$Q_2 = cm (t_1 — t_2)$.
$Q_2 = 4200 frac{Дж}{кг cdot degree C} cdot 2 space кг cdot (100 degree C — 0 degree C) = 8400 frac{Дж}{degree C} cdot 100 degree C = 840 space 000 space Дж approx 0.8 cdot 10^6 space Дж$.
$Q = 4.6 cdot 10^6 space Дж + 0.8 cdot 10^6 space Дж= 5.4 cdot 10^6 space Дж$.
Ответ: $Q = 5.4 cdot 10^6 space Дж$.
Упражнение №3
Из чайника выкипела вода объемом $0.5 space л$. Начальная температуры этой воды составляла $10 degree C$. Какое количество энергии оказалось излишне затраченным? Плотность воды — $1000 frac{кг}{м^3}$.
Дано:
$V = 0.5 space л$
$rho = 1000 frac{кг}{м^3}$
$L = 2.3 cdot 10^6 frac{Дж}{кг}$
СИ:
$0.5 cdot 10^{-3} space м^3$
$Q — ?$
Посмотреть решение и ответ
Скрыть
Решение:
После закипания воды в чайнике огонь выключают. Если его не выключить, то процесс кипения продолжится, и вода из чайника будет испаряться. Так как превращение воды в пар не является целью кипячения воды, энергию, которая ушла на парообразование можно считать излишне затраченной. Рассчитаем ее по формуле: $Q = Lm$.
Массу мы можем выразить через плотность и объем:
$m = rho V$.
Тогда наша формула примет вид:
$Q = Lrho V$.
$Q = 2.3 cdot 10^6 frac{Дж}{кг} cdot 1000frac{кг}{м^3} cdot 0.5 cdot 10^{-3} space м^3 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 0.5 space кг = 1.15 cdot 10^6 space Дж$.
Ответ: $Q = 1.15 cdot 10^6 space Дж$.
Задачи на парообразование и конденсацию
с решениями
Формулы, используемые на уроках «Задачи на парообразование и конденсацию».
Название величины |
Обозначение |
Единица измерения |
Формула |
Масса |
m |
кг |
m = Q / L |
Температура |
t |
°С |
|
Температура кипения |
tкип |
°С |
|
Удельная теплоемкость |
c |
Дж/кг°С |
|
Удельная теплота парообразования |
L |
Дж/кг |
L = Q / m |
Кол-во теплоты при нагревании |
Q |
Дж |
Q=cm(t2–t1) |
Кол-во теплоты при парообразовании |
Q |
Дж |
Q = Lm |
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
Какое количество энергии требуется для обращения воды массой 150 г в пар при температуре 100 °С?
Задача № 2.
Какое количество энергии требуется для превращения воды массой 2 кг, взятой при температуре 20 °С, в пар?
Задача № 3.
Какое количество энергии нужно затратить, чтобы воду массой 5 кг, взятую при температуре 0 °С, довести до кипения и испарить её?
Задача № 4.
Какую энергию нужно затратить, чтобы расплавить кусок свинца массой 8 кг, взятый при температуре 27 °С?
Задача № 5.
Какое количество энергии требуется для превращения в пар спирта массой 200 г, взятого при температуре 18 °С?
Задача № 6.
Какое количество энергии требуется для превращения в пар воды массой 5 кг, взятой при температуре 20 °С?
Задача № 7.
Какое количество теплоты необходимо сообщить воде массой 10 г, взятой при температуре 0 °С, для того, чтобы нагреть ее до температуры кипения и испарить?
Задача № 8.
Из чайника выкипела вода объемом 0,5 л, начальная температура которой была равна 10 °С. Какое количество теплоты оказалось излишне затраченным?
Задача № 9.
Кофейник вместимостью 1,2 л заполнили водой при температуре 15 °С и поставили на плиту. Какое количество теплоты пошло на нагревание и кипение воды, если после снятия с плиты в результате испарения в кофейнике объем воды стал на 50 см3 меньше? (Изменение плотности воды с изменением температуры не учитывать.)
Задача № 10.
Какое количество теплоты выделяется при конденсации водяного пара массой 10 кг при температуре 100 °С и охлаждении образовавшейся воды до 20 °С?
Задача № 11.
Какое количество теплоты необходимо, чтобы из льда массой 2 кг, взятого при температуре -10 °С, получить пар при 100 °С?
Задача № 12.
Сколько энергии понадобится, чтобы полностью испарить 100 грамм ртути, взятой при температуре 27 °С?
Краткая теория для решения Задачи на парообразование и конденсацию.
Это конспект по теме «Задачи на парообразование и конденсацию». Выберите дальнейшие действия:
- Посмотреть конспект по теме Кипение. Удельная теплота парообразования
- Вернуться к списку конспектов по Физике.
- Проверить свои знания по Физике.
Если, добившись кипения воды в сосуде, выключить под ним нагреватель (см. рис. 82), кипение воды быстро прекратится. Температура воды начнет понижаться, и через некоторое время она станет такой же, как у окружающего воздуха.
Для того чтобы вода не переставала кипеть, ее температура должна поддерживаться неизменной. А для этого вода должна непрерывно получать достаточное количество теплоты. Только в этом случае она будет продолжать кипеть, и это кипение не прекратится до тех пор, пока вся вода не обратится в пар.
Опытами установлено, что для полного обращения в пар 1 кг воды (при температуре кипения) необходимо затратить 2,3 МДж энергии. Для обращения в пар других жидкостей той же массы требуется иное количество теплоты. Например, для спирта оно составляет 0,9 МДж.
Физическая величина, показывающая, какое количество теплоты необходимо для превращения в пар 1 кг жидкости при постоянной температуре, называется удельной теплотой парообразования.
Удельную теплоту парообразования обозначают буквой r и измеряют в джоулях на килограмм (Дж/кг):
r — удельная теплота парообразования.
Удельную теплоту парообразования некоторых веществ можно найти в таблице 12.
Из этой таблицы, например, видно, что удельная теплота парообразования эфира равна 0,4*106 Дж/кг. Это число показывает, что для превращения в пар 1 кг эфира (при его температуре кипения) необходимо затратить 0,4*106 Дж энергии. Точно такое же (по модулю) количество теплоты будет выделено парами эфира (той же массы и при той же температуре) при их конденсации.
Для превращения в пар 2 кг жидкости требуется в 2 раз большее количество теплоты, для превращения в пар 3 кг жидкости — в 3 раза большее и т. д.
Чтобы найти количество теплоты, необходимое для превращения в пар жидкости произвольной массы т, взятой при температуре кипения, надо удельную теплоту парообразования этой жидкости умножить на ее массу:
Q = rm. (42.1)
Количество теплоты, которое выделяет пар массой m, конденсируясь при температуре кипения, определяется той же формулой, но со знаком «минус»:
Q = –rm. (42.2)
1. Почему после выключения нагревателя кипение жидкости прекращается? 2. Что такое удельная теплота парообразования? 3. Удельная теплота парообразования воды равна 2,3 МДж/кг. Что показывает это число? 4. Опишите явления, происходящие в опыте, изображенном на рисунке 84. 5. Какая энергия выделяется при конденсации паров спирта массой 1 кг при температуре 78 °С?
Логично предположить, что если требуется отдельная
энергия на плавление, то требуется отдельная энергия на парообразование. Как и
обычно, для разных веществ эта энергия разная. Итак, удельной теплотой парообразования
называется физическая величина, которая показывает, какое количество теплоты
необходимо сообщить одному килограмму жидкости при температуре кипения, чтобы
превратить её в пар.
Соответственно, единицей измерения данной величины
является джоуль на килограмм:
В таблице указана удельная теплота парообразования для
некоторых веществ.
Поскольку при парообразовании тело получает энергию,
можно сделать вывод, что внутренняя энергия тела в газообразном состоянии
больше, чем внутренняя энергия тела той же массы в жидком состоянии. Поэтому,
при конденсации пар отдаёт то количество энергии, которое потребовалось для его
образования.
Чтобы вычислить количество теплоты,
необходимое для превращения жидкости в пар взятой при температуре кипения,
нужно удельную теплоту парообразования умножить на массу:
Примеры решения задач.
Задача 1. Какое
количество теплоты выделится при конденсации 2,5 кг эфира?
Задача 2. На
парообразование 200 мл ртути потратили 810 кДж. Найдите плотность ртути.
Задача 3. В
кастрюлю положили 4 кг льда, растопили его и закипятили. На это ушло 12282 кДж.
Найдите начальную температуру льда.
Для решения этой задачи, нужно в первую очередь
подумать: из чего складывается количество теплоты, потраченное на превращение
льда в пар. Сначала нужно довести лёд до температуры плавления, потом
расплавить его, довести полученную воду до температуры кипения и превратить её
в пар. Итак, данный процесс делится на 4 этапа, для каждого из которых требуется
определённое количество теплоты.
Фазовые переходы — это термодинамические процессы, приводящие к изменению агрегатного состояния вещества.
Плавление и отвердевание
ОпределениеПлавление — переход вещества из твердого состояния в жидкое.
Для расчета количества теплоты, необходимого для процесса плавления, следует применять формулу:
Q=λm
m — масса вещества, λ (Дж/кг) — удельная теплота плавления.
Плавление каждого вещества происходит при определенной температуре, которую называют температурой плавления. Все проводимое тепло идет на разрушение кристаллической решетки, при этом увеличивается потенциальная энергия молекул. Кинетическая энергия остается без изменения и температура в процессе плавления не изменяется.
Удельная теплота плавления показывает, какое количество теплоты необходимо сообщить 1 кг данного вещества, чтобы перевести его из твердого состояния в жидкое при условии, что оно уже нагрето до температуры плавления. В процессе отвердевания 1 кг данной жидкости, охлажденной до температуры отвердевания, выделится такое же количество теплоты.
Внимание! Удельная теплота плавления — табличная величина.
ОпределениеОтвердевание, или кристаллизация — переход состояния из жидкого состояния в твердое (это процесс, обратный плавлению).
Отвердевание происходит при той же температуре, что и плавление. В процессе отвердевания температура также не изменяется. Количество теплоты, выделяемое в процессе отвердевания:
Q=−λm
Парообразование и конденсация
ОпределениеПарообразование, или кипение — переход вещества из жидкого состояния в газообразное.
Количество теплоты, необходимое для процесса кипения, вычисляют по формуле:
Q=rm
m — масса вещества, r (Дж/кг) — удельная теплота парообразования.
Парообразование происходит при определенной температуре, которую называют температурой кипения. В отличие от испарения, процесс парообразования идет со всего объема жидкости. Несмотря на то, что к кипящему веществу подводят тепло, температура не изменяется. Все затраты энергии идут на увеличение промежутком между молекулами. Температура кипения зависит от рода вещества и внешнего атмосферного давления.
Удельная теплота парообразования показывает, какое количество теплоты необходимо затратить, чтобы перевести в пар 1 кг жидкости, нагретой до температуры кипения. Такое же количество теплоты выделится в процессе конденсации 1 кг пара, охлажденного до температуры конденсации.
Внимание! Удельная теплота парообразования — табличная величина.
ОпределениеКонденсация — процесс, обратный кипению. Это переход вещества из газообразного состояния в жидкое.
Конденсация происходит при температуре кипения, которая также не изменяется во время всего процесса. Количество теплоты, выделяемое в процессе конденсации:
Q=−rm
Тепловые процессы при нагревании и охлаждении
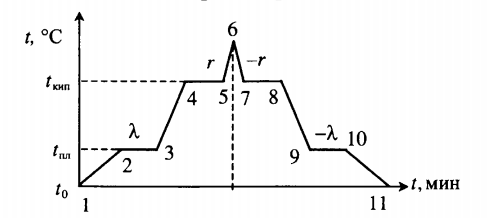
Все фазовые переходы, а также процессы нагревания и остывания вещества можно отобразить графически. Посмотрите на график фазовых переходов вещества:
Он показывает зависимость температуры вещества от времени в процессе его нагревания и остывания. Опишем процессы, отображаемые на графике, в таблице.
| Процесс | Что происходит | Количество выделенной теплоты |
| 1–2 | Нагревание твердого тела |
Q=cтm(tпл−t0) ст — удельная теплоемкость вещества в твердом состоянии. |
| 2–3 | Плавление при температуре плавления (tпл) |
Q=λm |
| 3–4 | Нагревание жидкости |
Q=cжm(tкип−tпл) сж — удельная теплоемкость вещества в жидком состоянии. |
| 4–5 | Кипение при температуре кипения (tкип) |
Q=rm |
| 5–6 | Нагревание пара |
Q=cпm(t−tкип) сп — удельная теплоемкость вещества в газообразном состоянии. |
| 6–7 | Охлаждение пара |
Q=cпm(tкип−t) |
| 7–8 | Кипение при температуре кипения (tкип) |
Q=−rm |
| 8–9 | Охлаждение жидкости |
Q=cжm(tпд−tкип) |
| 9–10 | Отвердевание при температуре плавления (tпл) |
Q=−λm |
| 10–11 | Охлаждение твердого тела |
Q=cтm(t0−tпл) |
Внимание! На участках 2–3 и 9–10 вещество частично находится в жидком и твердом состояниях, а на 4–5 и 7–8 — в жидком и газообразном.
Частные случаи тепловых процессов
| Что происходит | График | Формула количества теплоты |
| Полностью растопили лед, имеющий отрицательную температуру. | 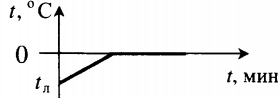 |
Q=cлm(tпл−tл)+λm cл — удельная теплоемкость льда, tл — начальная температура льда. |
| Лед, взятый при отрицательной температуре, превратили в воду при комнатной температуре. | 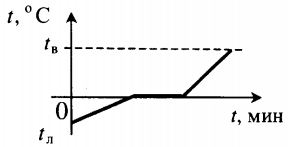 |
Q=cлm(tпл−tл)+λm+cвm(tв−tпл) cв — удельная теплоемкость воды. |
| Взяли лед при температуре 0 оС и полностью испарили. |  |
Q=λm+cвm(tкип−tпл)+rm |
| Взяли воду при комнатной температуре и половину превратили в пар. | 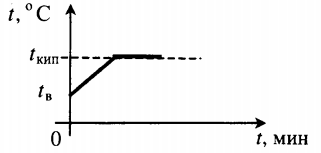 |
Q=cвm(tкип−tв)+rm2 |
Подсказки к задачам
| Единицы измерения | Температуру можно оставлять в градусах Цельсия, так как изменение температуры в градусах Цельсия равно изменению температуры в Кельвинах. |
| Кипяток | Вода, которая при нормальном атмосферном давлении имеет температуру в 100 оС. |
| Объем воды 5 л | m = 5 кг, так как:
m=ρV=103· Внимание! Равенство V (л) = m (кг) справедливо только для воды. |
Пример №1. Какое количество теплоты нужно сообщить льду массой 2 кг, находящемуся при температуре –10 оС, чтобы превратить его в воду и нагреть ее до температуры +30 оС?
Можно выделить три тепловых процесса:
- Нагревание льда до температуры плавления.
- Плавление льда.
- Нагревание воды до указанной температуры.
Поэтому количество теплоты будет равно сумме количеств теплоты для каждого из этих процессов:
Q=Q1+Q2+Q3
Q=cлm(0−t1)+λm+cвm(t2−0)
Удельные теплоемкости и удельную теплоту плавления смотрим в таблицах:
- Удельная теплоемкость льда = 2050 Дж/(кг∙К).
- Удельная теплоемкость воды = 4200 Дж/(кг∙К).
- Удельная теплота плавления льда = 333,5∙103 Дж/кг.
Отсюда:
Q=2050·2(0−(−10))+333,5·103·2+4220·2·30=961200 (дж)=961,2 (кДж)
Уравнение теплового баланса
Суммарное количество теплоты, которое выделяется в теплоизолированной системе равно количеству теплоты (суммарному), которое в этой системе поглощается.
Математически уравнение теплового баланса с учетом знаков количества теплоты записывается так:
Qотд=−Qпол
Отданное количество теплоты меньше нуля (Qотд < 0), а полученное количество теплоты положительно (Qполуч > 0).
Подсказки к задачам на уравнение теплового баланса
| Теплообмен происходит в калориметре | Потерями энергии можно пренебречь. |
| Жидкость нагревают в некотором сосуде | Начальные и конечные температуры жидкости и сосуда совпадают. |
| В жидкость опускают термометр | Через некоторое время он покажет конечную температуру жидкости и термометра. |
| Мокрый снег | Содержит воду и лед при 0 оС. Учтите, что лед плавится, если он находится при температуре 0 оС и получает энергию от более нагретого тела. Вода кристаллизируется при температуре 0 оС, если она отдает энергию более холодному телу. Если лед и вода находятся при температуре 0 оС, то никаких агрегатных переходов между ними не происходит. |
Частные случаи теплообмена
| В воду комнатной температуры бросили ком снега, содержащий некоторое количество воды, после чего установилась некоторая положительная температура. | 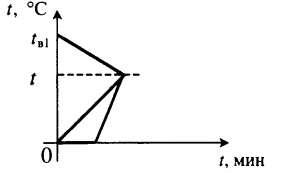
Уравнение теплового баланса: Q1+Q2+Q3=0 cвmв1(t−tв1)+cвmв2(t−0)+λmл+cвmл(t−0)=0 |
| Для получения некоторой положительной температуры воды используют горячую воду и лед, имеющий отрицательную температуру. | 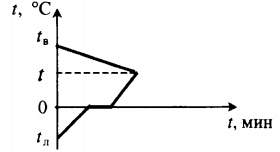
Уравнение теплового баланса: Q1+Q2=0 cвmв(t−tв)+cлmл(0−tл)+λmл+cвmл(t−0)=0 |
| В воду комнатной температуры бросают раскаленное твердое тело, в результате часть воды испаряется. | 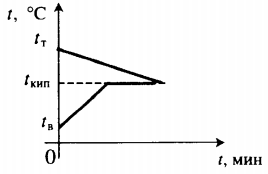
Уравнение теплового баланса: Q1+Q2=0 cтmт(100−tт)+cвmв(100−tв)+rmп=0 |
| Воду комнатной температуры нагревают до кипения, вводя пар при t = 100 оС. | 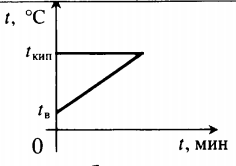
Уравнение теплового баланса: Q1+Q2=0 −rmп+cвmв(100−tв)=0 |
| Лед, имеющий температуру плавления, нагревают до положительной температуры, вводя пар при t = 100 оС. | 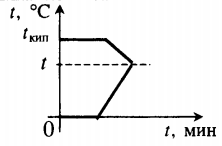
Уравнение теплового баланса: Q1+Q2=0 −rmп+cвmп(t−tкип)+λmл+cвmл(t−tпл)=0 |
Пример №2. В кастрюлю, где находится вода объемом 2 л при температуре 25 оС, долили 3 л кипятка. Какая температура воды установилась?
2 л = 2 кг
3 л = 3 кг
Количество теплоты, отданное кипятком, равно количеству теплоты, принятому более прохладной водой. Поэтому:
cm1(t−t0)=−cm2(t−tкип)
Или:
m1(t−t0)=−m2(t−tкип)
m1t+m2t=m1t0+m2tкип
(m1+m2)t=m1t0+m2tкип
t=m1t0+m2tкипm1+m2
t=2·25+3·1002+3=3505=70 (°C)
Взаимные превращения механической и внутренней энергии
Если в тексте задачи указан процент одного вида энергии, перешедший в другой, то он указывается в виде десятичной дроби перед этой энергией, которой тело обладало вначале.
Частные случаи закона сохранения энергии
| При неупругом ударе о стенку пуля нагрелась |
mv22=cmΔt |
| Тело падает с некоторой высоты и в момент падения нагревается |
mgh=cmΔt |
| В результате того, что пуля пробивает стену, ее скорость уменьшается, 50% выделившейся при этом энергии идет на нагревание пули |
0,5(mv202−mv22)=cmΔt |
| Летящая пуля при ударе о стенку расплавилась. Начальная температура пули меньше температуры плавления |
mv22=cmΔt+λm |
| Капля воды, падая с некоторой высоты, в момент удара испарилась. Температура капли у поверхности земли меньше температуры кипения. На нагрев пошло 60% выделившейся механической энергии |
0,6mgh=cmΔt+rm |
| Вследствие сгорания топлива ракета поднялась на некоторую высоту |
qmтоп=mрgh |
| Вследствие сгорания топлива снаряд приобрел некоторую скорость, и на это было затрачено 25% энергии |
0,25qmтопmсv22 |
Пример №3. Свинцовая дробинка, летящая со скоростью 100 м/с, попадает в доску и входит в нее. 52% кинетической энергии дробинки идет на ее нагревание. На сколько градусов нагрелась дробинка? Удельная теплоемкость свинца 130 Дж/(кг∙К).
Запишем закон сохранения энергии для этого случая:
0,52mv22=cmΔt
Δt=0,52v22c=0,52·10022·130=20 (К)
Примеры КПД
| Устройство | Полезная энергия (работа), затраченная энергия (полная работа) | КПД |
| Электронагреватель, электроплитка, электрочайник, кипятильник. |
Qполезн=cmΔT Иногда: Qполезн=cmΔT+rm Wзатр=Pt (произведение мощности на время) |
η=cmΔTPt100% |
| Газовая горелка, паровая турбина, спиртовка, плавильная печь. |
Qполезн=cmΔT Qзатр=qmтоп |
η=cmΔTqmтоп100% |
| Двигатель автомобиля, самолета. |
Aполезн=Nt=Nsv Qзатр=qmтоп |
η=cmΔTvqmтоп100 |
| Ружье с пороховым зарядом, пушка |
Eполезн=mv22 Qзатр=qmпор |
η=mv22qmпор100 |
Внимание! Если в задаче указано время, в течение которого происходит один тепловой процесс, а спрашивают о времени протекания другого, то считайте, что мощность нагревателя или холодильника постоянна:
Q1t1=Q2t2
Пример №4. Для нагревания на электроплитке некоторого количества воды от 20 до 100 оС потребовалась 21 минута. Сколько времени после этого необходимо для полного испарения воды? Удельная теплоемкость воды 4200 Дж (кг∙К), удельная теплота парообразования 2,24 МДж/кг.
Будем считать, что мощность электроплитки постоянна. Поэтому:
Q1t1=Q2t2
Количество теплоты, сообщенное воде при нагревании:
Q1=сm(t2−t1)
Количество теплоты, которое нужно сообщить, чтобы вода полностью испарилась:
Q1=rm
Отсюда:
сm(t2−t1)t1=rmt2
Задание EF17544
Кусок льда, имеющий температуру 0°С, помещён в калориметр с электронагревателем. Чтобы превратить этот лёд в воду с температурой 12°С, требуется количество теплоты 80 кДж. Какая температура установится внутри калориметра, если лёд получит от нагревателя количество теплоты 60 кДж? Теплоёмкостью калориметра и теплообменом с внешней средой пренебречь.
Ответ:
а) 0°С
б) 4°С
в) 6°С
г) 9°С
Алгоритм решения
1.Записать исходные данные и перевести единицы измерения величин в СИ.
2.Записать уравнение теплового баланса для первого случая.
Решение
Запишем исходные данные:
• Начальная температура льда: t0 = 0 oC.
• Конечная температура воды в первом случае: t1 = 12 oC.
• Количество теплоты, выделенное электронагревателем в первом случае: Q1 = 80 кДж.
• Количество теплоты, выделенное электронагревателем во втором случае: Q2 = 60 кДж.
Составим уравнение теплового баланса для первого случая:
Q1=λm+cmt1
Внимание! Вместо разности температур используется значение только конечной температуры, так как начальная температура равна 0.
Найдем массу льда из уравнения теплового баланса для первого случая. Учтем что:
• Удельная теплоемкость воды: c = 4200 Дж/(кг∙К).
• Удельная теплота плавления льда: λ = 333,5 кДж/(кг∙К).
Отсюда:
Чтобы расплавить кусок льда массой 0,5 кг, нужно затратить следующее количество теплоты:
Лед не расплавится весь, так как ему будет сообщено лишь 60 кДж теплоты. Поэтому в калориметре температура будет равна 0 оС.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18791
Внимательно прочитайте текст задания и выберите верный ответ из списка
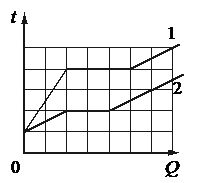
Используя данные графиков, выберите из предложенного перечня два верных утверждения и укажите их номера.
Ответ:
а) Температура плавления первого тела в 1,5 раза больше, чем второго.
б) Тела имеют одинаковую удельную теплоёмкость в твёрдом агрегатном состоянии.
в) Удельная теплоёмкость второго тела в твёрдом агрегатном состоянии
в 3 раза больше, чем первого.
г) Оба тела имеют одинаковую удельную теплоту плавления.
д) Тела имеют одинаковую удельную теплоёмкость в жидком агрегатном состоянии.
Алгоритм решения
- Проанализировать каждое из утверждений.
- Проверить истинность утверждений с помощью графика.
- Выбрать и записать верные утверждения.
Решение
Проверим первое утверждение, согласно которому, температура плавления первого тела в 1,5 раза больше, чем второго.
Если это было бы так, то количество клеток до горизонтального участка графика 1 относилось к количеству клеток до горизонтального участка графика 2 как 3 к 2. Но мы видим, что до 1 графика 4 клетки, до 1 — 2. Следовательно, температура плавления первого тела в 2 раза больше, чем второго.
Первое утверждение неверно.
Проверим второе утверждение, согласно которому тела имеют одинаковую удельную теплоёмкость в твёрдом агрегатном состоянии.
Если бы это было так, то соответствующие участки графиков совпадали бы. Только в таком случае температура тел увеличивалась на одну и ту же температуру при получении одного и того же количества теплоты. Но мы видим, что это не так.
Второе утверждение неверно.
Проверим третье утверждение, согласно которому удельная теплоёмкость второго тела в твёрдом агрегатном состоянии в 3 раза больше, чем первого.
Если это было бы так, то первое тело при сообщении телам одинакового количества теплоты нагревалось бы втрое быстрее второго. И это действительно так, потому что температура второго во время нагревания в твердом состоянии увеличилась только на 1 клетку, в то время как температура первого тела — на 2 клетки.
Третье утверждение верно.
Проверим четвертое утверждение, согласно которому оба тела имеют одинаковую удельную теплоту плавления.
Если это было бы так, то протяженность горизонтальных участков обоих графиков была бы одинаковой. Но это не так. Протяженность этого участка для тела 1 составляет 3 клетки, для тела 2 — 2 клетки.
Четвертое утверждение верно.
Проверим пятое утверждение, согласно которому тела имеют одинаковую удельную теплоёмкость в жидком агрегатном состоянии.
Если бы это было так, то соответствующие участки графиков были параллельными. Только при таком условии при повышении температуры на одно и то же количество градусов тела бы получли одинаковое количество теплоты. И это действительно так.
Пятое утверждение верно.
Вывод: верным утверждения «в» и «д».
Ответ: вд
pазбирался: Алиса Никитина | обсудить разбор
Задание EF22685
В сосуде лежит кусок льда. Температура льда t1 = 0 °C. Если сообщить ему количество теплоты Q = 50 кДж, то 3/4 льда растает. Какое количество теплоты q надо после этого сообщить содержимому сосуда дополнительно, чтобы весь лёд растаял и образовавшаяся вода нагрелась до температуры t2 = 20 °C? Тепловыми потерями на нагрев сосуда пренебречь.
Алгоритм решения
1.Записать исходные данные и перевести единицы измерения в СИ.
2.Записать уравнение теплового баланса.
3.Выполнить решение в общем виде.
4.Определить и вычислить искомую величину.
Решение
Запишем исходные данные:
• Начальная температура льда: t1 = 0 oC.
• Конечная температура воды: t2 = 20 oC.
• Количество теплоты, переданное льду изначально: Q = 50 кДж.
• Удельная теплоемкость воды: c = 4200 Дж/(кг∙К).
• Удельная теплота плавления льда: λ = 333,5 кДж/(кг∙К).
50 кДж = 50000 Дж
333,5 кДж = 333500 Дж
Составим уравнение теплового баланса:
Qобщ=Q+q
где q — количество теплоты, необходимое для того, чтобы окончательно растопить лед и нагреть воду:
q=Q2+Q3
Мы знаем, что изначально было растоплено 3/4 льда. Поэтому:
Q=3λm4
Отсюда масса льда равна:
m=4Q3λ
На растопку оставшегося льда уйдет следующее количество теплоты:
Q2=λm4
На нагревание воды уйдет следующее количество теплоты:
Q3=cmt2
Внимание! Вместо разности температур используется значение только конечной температуры, так как начальная температура равна 0.
Отсюда:
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 13.3k