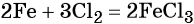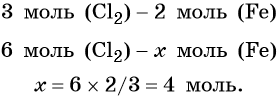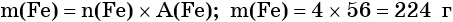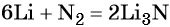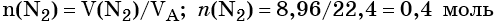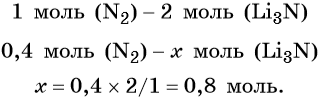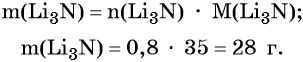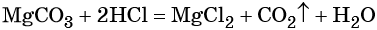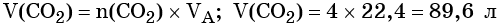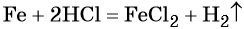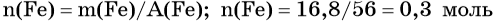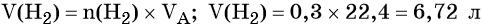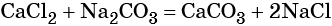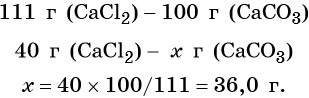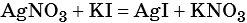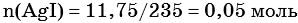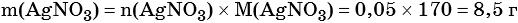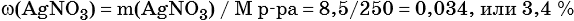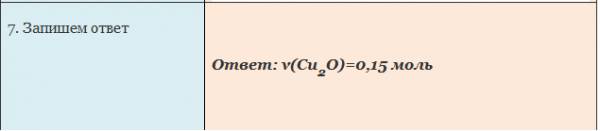Download Article
Download Article
In order for water to support life, there must be oxygen dissolved into the liquid. This oxygen is not part of the water molecule, H2O, but is oxygen gas, O2, dissolved in the water. There are a few ways to measure this dissolved oxygen content. One is by titration, another is with a meter, and you can also measure it using colorimetric methods, where a reactive substance responds to the oxygen levels.
-
1
Gather your materials. For this measurement, you need 2 flasks with stoppers, a calibrated pipette, a graduated pipette, manganese sulfate, water, alkali-iodide-azide, sulfuric acid, sodium thiosulfate, and a starch solution.[1]
-
2
Collect a sample. Take a 300 mL sample of water. This can be from a tap, a stream, a pond, or any other water source. Collect the sample in a flask with a stoppered top.[2]
Advertisement
-
3
Mix manganese sulfate with the water. Use a calibrated pipette to add 2 milliliters (0.068 fl oz) of manganese sulfate into the sample. Put the tip of the pipette just beneath the surface of the water before releasing the contents. Stopper your bottle and mix the manganese sulfate by inverting the bottle several times slowly.[3]
- If you drop the contents into the water they will come in contact with the air and this will introduce oxygen into the sample and alter results.
- If any air bubbles occur, then the sample is contaminated and you will need to start over.
-
4
Add alkali-iodide-azide to the sample. Next, add 2 milliliters (0.068 fl oz) of alkali-iodide-azide to the sample using a calibrated pipette. The tip of the pipette should be just below the surface of the water before ejecting the contents. Stopper the bottle and mix the alkali-iodide-azide by inverting the bottle slowly several times.[4]
- If oxygen is present you will observe the formation of floc. This is an orange-ish solid that will settle in the bottom of the flask.
-
5
Fix with sulfuric acid. Use a pipette to measure 2 milliliters (0.068 fl oz) of concentrated sulfuric acid. Drop the sulfuric acid into the solution. Do not place the tip of the pipette into the water. Mix the acid by inverting the flask several times. The floc should redissolve.[5]
- Wear gloves and goggles for safety when working with sulfuring acid. Avoid contact with skin and eyes. Do not ingest. Do not inhale.
-
6
Titrate 201 mL of sample. Measure exactly 201 mL of sample into a new flask. Place this sample beneath a graduated pipet filled with sodium thiosulfate. Add sodium thiosulfate until the sample turns a pale yellow color.[6]
- Write down the initial amount of sodium thiosulfate in the pipet.
- Stir the solution continually as you titrate.
-
7
Introduce starch solution. A starch solution will react with the iodine present in the sample to form a blue color. You only need to add 2 milliliters (0.068 fl oz) of starch solution. Stir or swirl the solution well.[7]
- Starch solution can be made by mixing water with corn or potato starch, or you can buy one premade.
-
8
Continue to titrate. Once the sample turns blue, continue titrating with sodium thiosulfate. Add the titrant slowly, as one drop will make a difference at the end of the titration. You should stop titrating when the blue color is gone from the sample.[8]
- Hold the sample up against a white background in order to look for blue color.
-
9
Understand the results. When the titration is complete, write down the amount of sodium thiosulfate left in the pipet. Subtract this amount from the initial amount of sodium thiosulfate to find how many mL of sodium thiosulfate you used to titrate the sample. The amount of sodium thiosulfate in mL is equal to the dissolved oxygen content in mg/L.[9]
- For example, if you used 8 mL of sodium thiosulfate, that would correspond to a dissolved oxygen content of 8 mg/L.
Advertisement
-
1
Calibrate the meter. Manually adjust the meter to read zero by turning the screw in the middle of the meter. Next, connect the probe and turn the meter on for fifteen minutes for optimum performance. Adjust the redline with the control knob to align with the 31 °C (87.8 °F) line and set the central line to 0.[10]
- All meters are calibrated differently. See the manufacturer’s instructions for variations that are specific to your meter.
- Meters are calibrated in Celsius not Fahrenheit.
-
2
Measure a sample of water. Place the probe into a sample of water that you wish to measure. Allow the meter to stabilize. Write down your reading. Check the sample a few times to make sure the meter is calibrated.[11]
-
3
Analyze the measurement. Understand that running water will have a higher dissolved oxygen content than still water. Higher altitudes mean less dissolved oxygen. Consider these things when you look at your measurement to be sure that the measurement makes sense given the sample you are taking.[12]
Advertisement
-
1
Choose your reagent. There are two reagents used to do colorimetric analysis of dissolved oxygen. One is indigo carmine and the other is rhodazine D. If you expect low levels of dissolved oxygen, rhodazine D is a good choice. Use indigo carmine for higher levels of dissolved oxygen.[13]
-
2
Introduce the reagent to your sample. Once you have chosen a reagent, introduce it to a sample of water. Drop the reagent into the sample of water and watch for a color change. The deeper the color, the more dissolved oxygen present.[14]
- Indigo carmine will produce a deep blue color.
- Rhodazine D will produce a deep pink color.
-
3
Measure the oxygen levels by matching the colors of the solution to the key. If you are using rhodazine D, record the dissolved oxygen range promptly at 30 seconds after adding the reagent. The same holds true for measuring small ranges of dissolved oxygen with indigo carmine. If you are measuring a sample with higher levels of dissolved oxygen, wait 2 minutes and record the result.[15]
Advertisement
Add New Question
-
Question
How do I determine if there is a low or high level of dissolved oxygen?
Bess Ruff is a Geography PhD student at Florida State University. She received her MA in Environmental Science and Management from the University of California, Santa Barbara in 2016. She has conducted survey work for marine spatial planning projects in the Caribbean and provided research support as a graduate fellow for the Sustainable Fisheries Group.
Environmental Scientist
Expert Answer
Each of the methods above provides a means of determining the level of dissolved oxygen in water. The first two will provide a numerical calculation of the level from which you can discern exactly whether it’s high or low. The colorimetric approach will give you a general sense of the level of dissolved oxygen depending on the color produced by the reagent.
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
-
Make sure all containers are marked with metric system measurements.
Advertisement
-
Dispose of all chemicals ethically and safely.
-
All of these chemicals are extremely dangerous to human and animal well being. Use a lab coat, goggles, and latex gloves when performing the operation.
-
Sulfuric acid is a corrosive substance. Store in glass bottles and use extra caution.
Advertisement
References
About This Article
Article SummaryX
To measure the dissolved oxygen level of water with a meter, first manually adjust the meter to read zero. Next, connect the probe and turn the meter on for 15 minutes. Then, use the control knob to align the red line with the 31 degree Celsius line and set the central line to 0. Once you’ve finished calibrating the meter, place the probe into some water and write down the measurements on the meter. To learn how to estimate the oxygen level with colorimetric methods, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 97,338 times.
Reader Success Stories
-
Murekye Vince
Mar 8, 2020
«This article has helped me to be smart when I research in the lab to test for DO as a parameter.»
Did this article help you?
Напомню общую формулу:
w (э) = x*Ar (э) / Mr (вещества), где
w (э) – массовая доля элемента
x – индекс элемента в формуле вещества
Ar – относительная атомная масса элемента
Mr – относительная молекулярная масса вещества.
w (H) = 2*Ar (H) / Mr (H2O)
Mr (H2O) = 2*Ar (H) + Ar (O) = 2*1 + 16 = 18
w (H) = 2*1 / 18 = 0,1111 = 11,11%
Логично, что w (O) = 100% – w (H)
w (O) = 100 – 11,11 = 88,99 (%)
Ответ: w (H) = 11,11%, w (O) = 88,99%.
1. Почему вода считается самым важным веществом на Земле?
2. Охарактеризуйте физические свойства воды.
3. Укажите правильные ответы. Испарение воды с поверхности рек, озёр, морей это: а) химический процесс; б) физический процесс; в) причина образования облаков; г) причина дождей.
4. Во сколько раз молекула воды тяжелее молекулы водорода и легче молекулы кислорода?
6. Рассчитайте массу воды (кг) в вашем организме, приняв, что её массовая доля в теле человека составляет в среднем 63%.
7. Какие способы вы могли бы предложить для разделения такой однородной смеси, как морская вода?
8. Составьте рассказ на тему «Круговорот воды в природе» по рисунку 97.
9. Какие источник загрязнения природных вод вам известны? Приведите примеры экологических катастроф, вызывающих загрязнение водоёмов.
10. Найдите в учебном пособии два уравнения химических реакций, в результате которых образуется вода. Укажите тип каждой реакции.
Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Расчёты по уравнениям химических реакций.
Стехиометрия – количественные соотношения между вступающими в реакцию веществами.
Если реагенты вступают в химическое взаимодействие в строго определенных количествах, а в результате реакции образуются вещества, количество которых можно расчитать, то такие реакции называются стехиометрическими.
Законы стехиометрии:
Коэффициенты в химических уравнениях перед формулами химических соединений называются стехиометрическими.
Все расчёты по химическим уравнениям основаны на использовании стехиометрических коэффициентов и связаны с нахождением количеств вещества (чисел молей).
Количество вещества в уравнении реакции (число молей) = коэффициенту перед соответствующей молекулой.
Моль – это такое количество вещества, в котором содержится определённое число частиц (молекул, атомов, ионов), равное постоянной Авогадро:
Выход реакции η – отношение реальной массы продукта mp к теоретически возможной mт, выраженное в долях единицы или в процентах.
Если в условии выход продуктов реакции не указан, то в расчетах его принимают равным 100% (количественный выход).
Схема расчёта по уравнениям химических реакций:
- Составить уравнение химической реакции.
- Над химическими формулами веществ написать известные и неизвестные величины с единицами измерения.
- Под химическими формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
- Составить и решить пропорцию.
Пример. Вычислить массу и количество вещества оксида магния, образовавшегося при полном сгорании 24 г магния.
1. Составим уравнение химической реакции:
2. Под формулами веществ укажем количество вещества (число молей), которое соответствует стехиометрическим коэффициентам:
3. Определим молярную массу магния:
Относительная атомная масса магния Ar(Mg) = 24.
Т.к. значение молярной массы равно относительной атомной или молекулярной массе, то M(Mg) = 24 г/моль.
4. По массе вещества, заданной в условии, вычислим количество вещества:
5. Над химической формулой оксида магния MgO, масса которого неизвестна, ставим x моль, над формулой магния Mg пишем его молярную массу:
6. Составим пропорцию:
По правилам решения пропорции:
Количество оксида магния ν(MgO) = 1 моль.
8 класс. Химия. Расчеты массы вещества по уравнению химической реакции
8 класс. Химия. Расчеты массы вещества по уравнению химической реакции
- Оглавление
- Занятия
- Обсуждение
- О курсе
Вопросы
Задай свой вопрос по этому материалу!
Поделись с друзьями
Комментарии преподавателя
Соотношение количеств веществ, участвующих в реакции
Коэффициенты в уравнении реакции показывают не только число молекул каждого вещества, но и соотношение количеств веществ, участвующих в реакции. Так, по уравнению реакции: 2H2 + O2 = 2H2O – можно утверждать, что для образования определенного количества воды (например, 2 моль) необходимо столько же моль простого вещества водорода (2 моль) и в два раза меньше моль простого вещества кислорода (1 моль). Приведем примеры подобных расчетов.
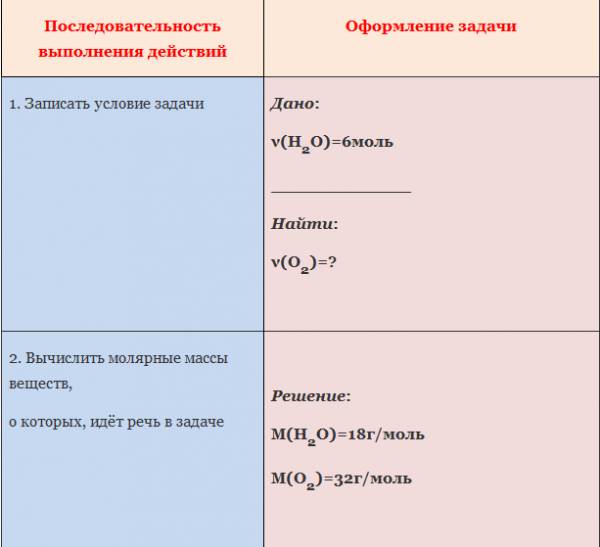
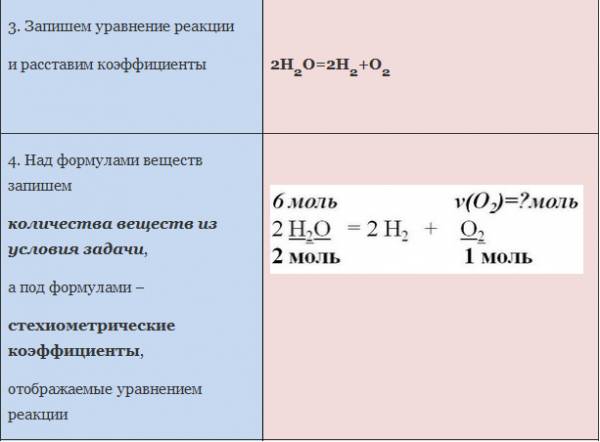
ЗАДАЧА 1. Определим количество вещества кислорода, образующегося в результате разложения 4 моль воды.
АЛГОРИТМ решения задачи:
1. Составить уравнение реакции
2. Составить пропорцию, определив количества веществ по уравнению реакции и по условию задачи (обозначить неизвестное количество вещества за х моль).
3. Составить уравнение (из пропорции).
4. Решить уравнение, найти х.
Рис. 1. Оформление краткого условия и решения задачи 1
ЗАДАЧА 2. Какое количество кислорода потребуется для полного сжигания 3 моль меди?
Воспользуемся алгоритмом решения задач с использованием уравнения химической реакции.
Рис. 2. Оформление краткого условия и решения задачи 2.
I. Используя алгоритм, решите самостоятельно следующие задачи:
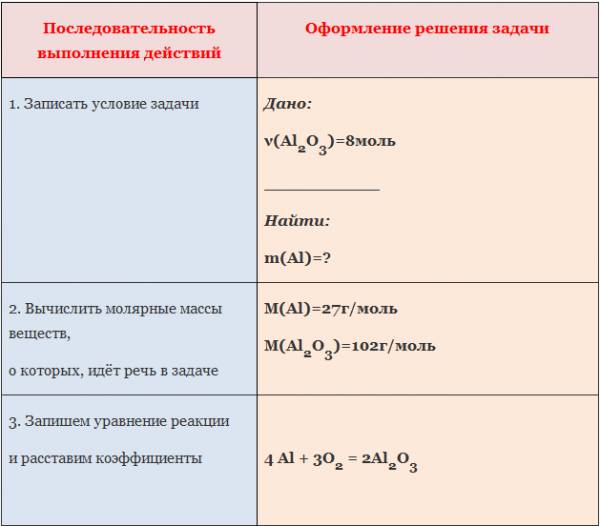
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2=2Al2O3).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2=2Na2O).
Алгоритм №1
Вычисление количества вещества по известному количеству вещества, участвующего в реакции.
Пример. Вычислите количество вещества кислорода, выделившегося в результате разложения воды количеством вещества 6 моль.
II. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2=SO2).
2. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2=2LiCl).
Внимательно изучите алгоритм и запишите в тетрадь
Алгоритм №2
Вычисление массы вещества по известному количеству другого вещества, участвующего в реакции.
Пример: Вычислите массу алюминия, необходимого для получения оксида алюминия количеством вещества 8 моль.
III. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S).
2. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2 = Cu + H2O).
Внимательно изучите алгоритм и запишите в тетрадь
Алгоритм №3
Вычисление количества вещества по известной массе другого вещества, участвующего в реакции.
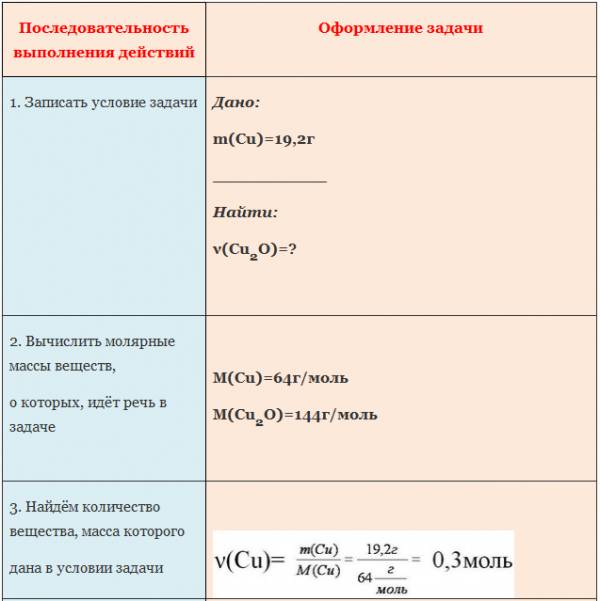
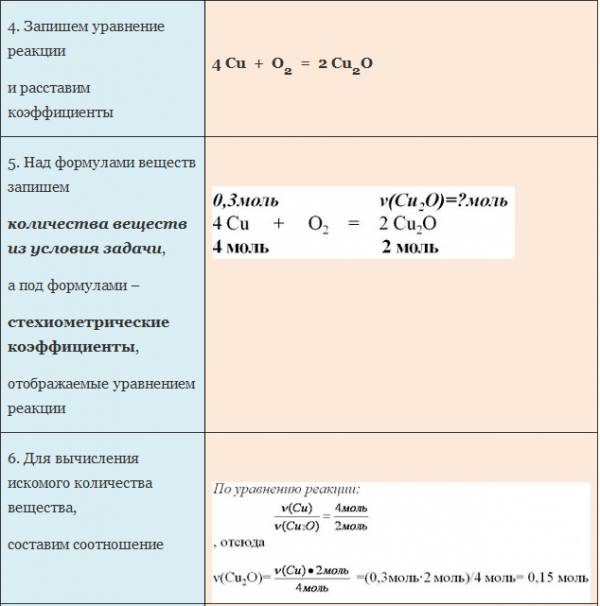
Пример. Вычислите количество вещества оксида меди (I), если в реакцию с кислородом вступает медь массой 19,2г.
Внимательно изучите алгоритм и запишите в тетрадь
IV. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу кислорода, необходимую для реакции с железом массой 112 г
Алгоритм №4
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
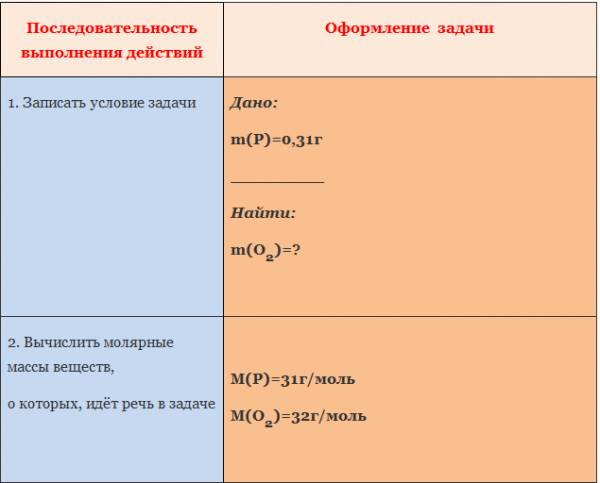
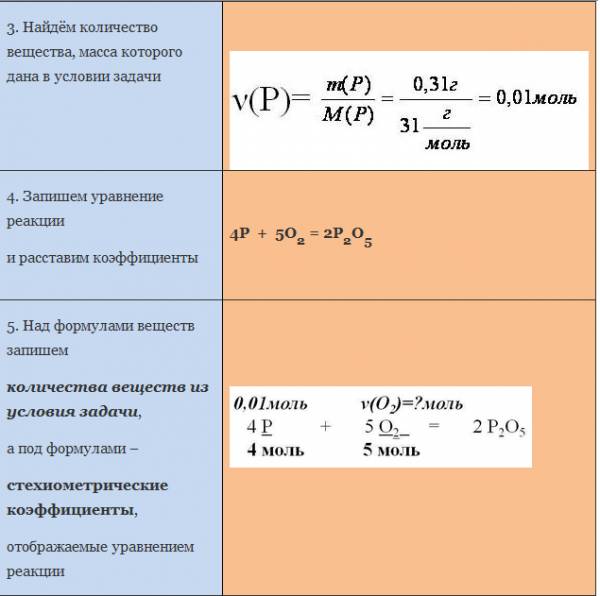
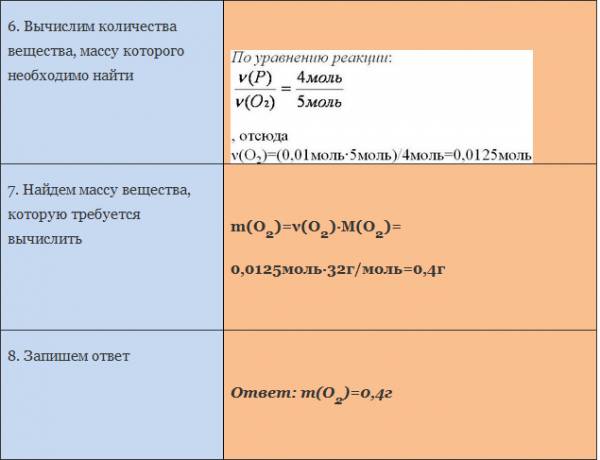
Пример. Вычислите массу кислорода, необходимую для сгорания фосфора, массой 0,31г.
Рассмотрим уравнение реакции образования воды из простых веществ:
Можно сказать, что из двух молекул водорода и одной молекулы кислорода образуется две молекулы воды. С другой стороны, эта же запись говорит о том, что для образования каждых двух молей воды нужно взять два моля водорода один моль кислорода.
Мольное соотношение участников реакции помогает производить важные для химического синтеза расчеты. Рассмотрим примеры таких расчетов.
ЗАДАЧА 1. Определим массу воды, образовавшуюся в результате сгорания водорода в 3,2 г кислорода.
Чтобы решить эту задачу, сначала необходимо составить уравнение химической реакции и записать над ним данные условия задачи.
Если бы мы знали количество вещества вступившего в реакцию кислорода, то смогли бы определить количество вещества воды. А затем, рассчитали бы массу воды, зная ее количество вещества и молярную массу. Чтобы найти количество вещества кислорода, нужно массу кислорода разделить на его молярную массу.
Молярная масса численно равна относительной молекулярной массе. Для кислорода это значение составляет 32. Подставим в формулу: количество вещества кислорода равно отношению 3,2 г к 32 г/моль. Получилось 0,1 моль.
Для нахождения количества вещества воды оставим пропорцию, используя мольное соотношение участников реакции:
на 0,1 моль кислорода приходится неизвестное количество вещества воды, а на 1 моль кислорода приходится 2 моля воды.
Отсюда количество вещества воды равно 0,2 моль.
Чтобы определить массу воды, нужно найденное значение количества воды умножить на ее молярную массу, т.е. умножаем 0,2 моль на 18 г/моль, получаем 3,6 г воды.
Рис. 1. Оформление записи краткого условия и решения Задачи 1
Помимо массы, можно рассчитывать объем газообразного участника реакции (при н.у.), используя известную вам формулу, в соответствие с которой объем газа при н.у. равен произведению количества вещества газа на молярный объем. Рассмотрим пример решения задачи.
ЗАДАЧА 2. Рассчитаем объем кислорода (при н.у.), выделившийся при разложении 27г воды.
Запишем уравнение реакции и данные условия задачи. Чтобы найти объем выделившегося кислорода, нужно найти сначала количество вещества воды через массу, затем по уравнению реакции определить количество вещества кислорода, после чего можно рассчитать его объем при н.у.
Количество вещества воды равно отношению массы воды к ее молярной массе. Получаем значение 1,5 моль.
Составим пропорцию: из 1,5 моля воды образуется неизвестное количество кислорода, из 2 молей воды образуется 1 моль кислорода. Отсюда количество кислорода равно 0,75 моля. Рассчитаем объем кислорода при н.у. Он равен произведению количества кислорода на молярный объем. Молярный объем любого газообразного вещества при н.у. равен 22,4 л/моль. Подставив числовые значения в формулу, получим объем кислорода, равный 16,8 л.
Рис. 2. Оформление записи краткого условия и решения Задачи 2
Зная алгоритм решения подобных задач, можно рассчитать массу, объем или количество вещества одного из участников реакции по массе, объему или количеству вещества другого участника реакции.
ИСТОЧНИКИ
исчтоник конспекта — http://interneturok.ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/raschety-massy-veschestva-po-uravneniyu-himicheskoy-reaktsii
источник видео — http://www.youtube.com/watch?v=wZbj-o5J5Vs
источник видео — http://www.youtube.com/watch?v=8sPwPk7a7p0
источник видео — http://www.youtube.com/watch?v=ygaarSGQDwE
источник видео — http://www.youtube.com/watch?v=Gv-jZX0wZxE
Файлы
Нет дополнительных материалов для этого занятия.
источники:
http://www.calc.ru/Raschty-Po-Uravneniyam-Khimicheskikh-Reaktsiy.html
http://www.kursoteka.ru/course/2183/lesson/6956/unit/18148/1

Определите сколько атомов водорода и кислорода содержится в 1моль воды H2O
Светило науки — 773 ответа — 14833 помощи
в 1 моле содержится молекул 6,02*10^23, тогда атомов кислорода будет 6,02*10^23 а атомов водорода в два раза больше:2*6,02*10^23=1,204*10^24

Светило науки — 8 ответов — 524 помощи
Число Авогадро (6,02*10 в 23-й степени) как раз и говорит о том, сколько частиц (молекул атомов, ионов и т.д.) содержится в одном моле ЛЮБОГО вещества!
Поскольку одна молекула воды содержит один атом кислорода, то 1 моль воды …соответственно атомов, а атомов водорода — вдвое больше!Н2(два атома водорода)О(один атом кислорода)
Дано: m(Н2О)=72 г
Найти: n(О2)-?
Решение
1-й способ
Находим количество вещества воды массой 72 г по формуле: n=m/M, где M ― молярная масса
Mr(Н2О)=2•Ar(Н)+Ar(O)=2•1+16=18, поэтому M(Н2О)=18 г/моль
n(Н2О)=m(Н2О):M(Н2О)=72 г : 18 г/моль=4 моль
Составляем химическое уравнение:
2H2 + O2 = 2H2O
По уравнению реакции n(O2):n(H2O)=1:2, то есть с 1 моль кислорода образуется 2 моль воды, следовательно, количество вещества кислорода в 2 раза меньше количества вещества воды, поэтому
n(O2)=n(H2O):2=4 моль:2=2 моль
2-й способ
1. Составим химическое уравнение:
х моль 72 г
2H2 + O2 = 2H2O
1 моль 36 г
Над формулами соединений О2 и H2O записываем неизвестное количество вещества кислорода (х моль) и приведенную в условии задачи массу воды (72 г), а под формулами соединений – количество вещества и массу количества вещества согласно коэффициентам в химическом уравнении.
Mr(Н2O)=2•Ar(Н)+Ar(O)=2•1+16=18, поэтому M(Н2O)=18 г/моль,
масса 1 моль=18 г, а масса 2 моль=36 г
2. Количество вещества кислорода рассчитываем с помощью пропорции:
х моль / 1 моль = 72 г / 36 г, отсюда
х=n(O2)=72 г • 1 моль : 36 г=2 моль
Ответ: 2 моль кислорода