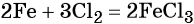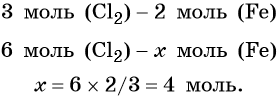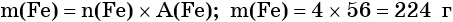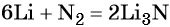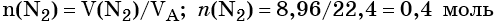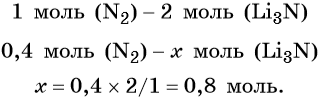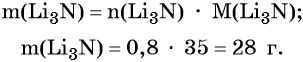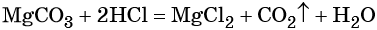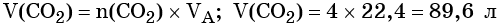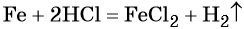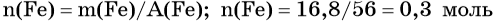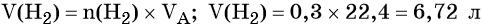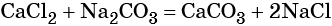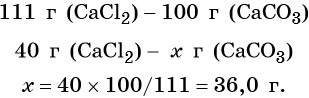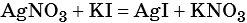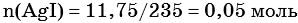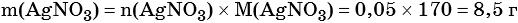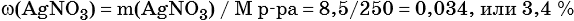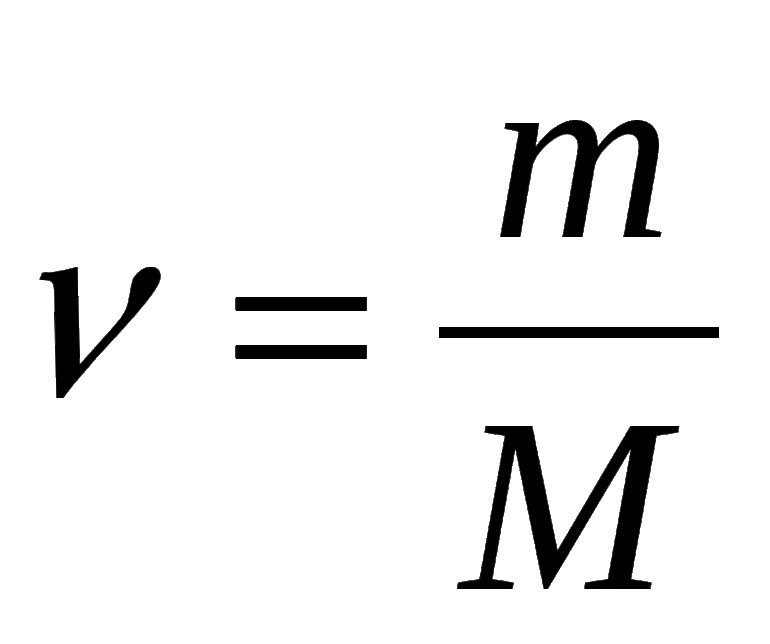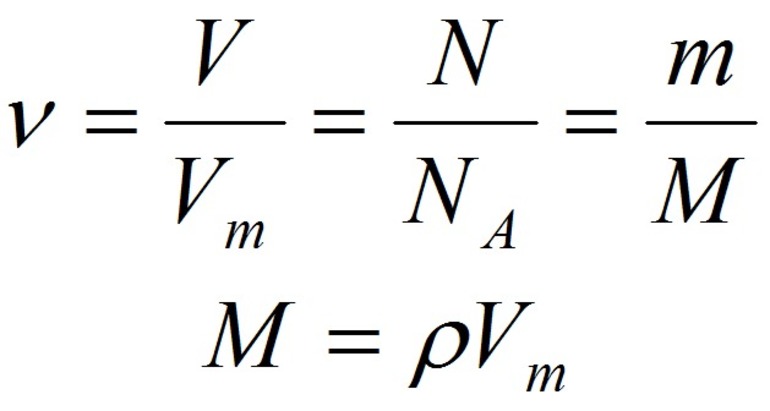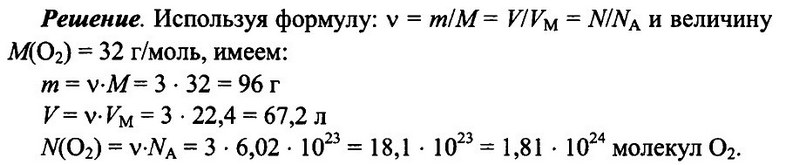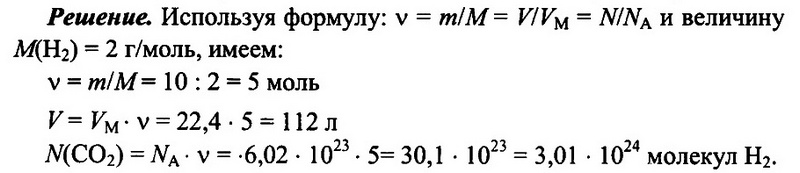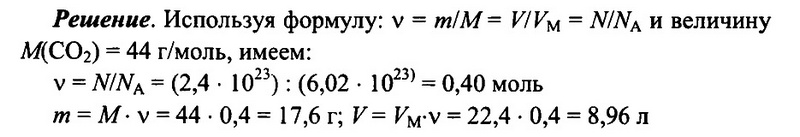Итак, количество вещества в химии обозначается греческой буквой «ню».
Помню, как в 9-м классе мой учитель физики Игорь Юрьевич учил меня правильно писать букву «ню». До этого она у меня получалась немного коряво.
Но поскольку на БВ не проходят греческие буквы, я буду обозначать количество вещества латинской буквой v. Латинская v очень похожа на греческую «ню».
Рассмотрим следующие случаи.
1) Если нам известно количество частиц вещества, то количество вещества можно найти по формуле:
v = n/NA
где
v — количество вещества;
n — количество частиц вещества. Это безразмерная величина, то есть это просто число. Правда, это число бывает очень большим, например, 5*(10^24).
NA — постоянная Авогадро. Постоянная Авогадро представляет собой универсальную константу. NA = 6,022*(10^23) моль^(–1).
2) Если нам известна масса вещества, то количество вещества находится по следующей формуле:
v = m/M
где
v — количество вещества;
m — масса вещества;
M — молярная масса вещества находится по химической формуле вещества, при помощи периодической системы Д. И. Менделеева, путём суммирования атомных масс всех входящих в молекулу атомов с учётом имеющихся индексов.
3) Если нам известен объём газообразного вещества, то мы можем найти количество вещества газа по такой формуле:
v = V/Vm
где
v — количество вещества;
V — объём газа;
Vm — молярный объём газов. Молярный объём газов — это универсальная константа. Vm = 22,414 л/моль = 22414 м3/моль.
Повторюсь, что формула v = V/Vm верна только для газов!
Наконец, рассмотрим Ваш случай.
Вам по условию даны объём и объёмная доля.
Я рискну предположить, что у Вас задача примерно такого рода:
«Объём газовой смеси составляет 240 л. Объёмная доля кислорода в смеси равна 45%. Вычислите количество вещества кислорода в смеси».
Такая задача решается в два действия.
1) Находим объём кислорода:
V (O2) = V0 * ф / 100 = 240 л * 45 / 100 = 108 л.
(Ф — это объёмная доля, она обозначается греческой буквой «фи». Вместо неё приходится писать русскую ф).
2) Находим количество вещества кислорода. Кислород — это газ, значит, мы имеем право воспользоваться формулой v = V/Vm.
v (O2) = V/Vm = 108 л : 22,414 л/моль = 4,818 моль. Округление произведено до тысячных.
Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Определим V(CO2):
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
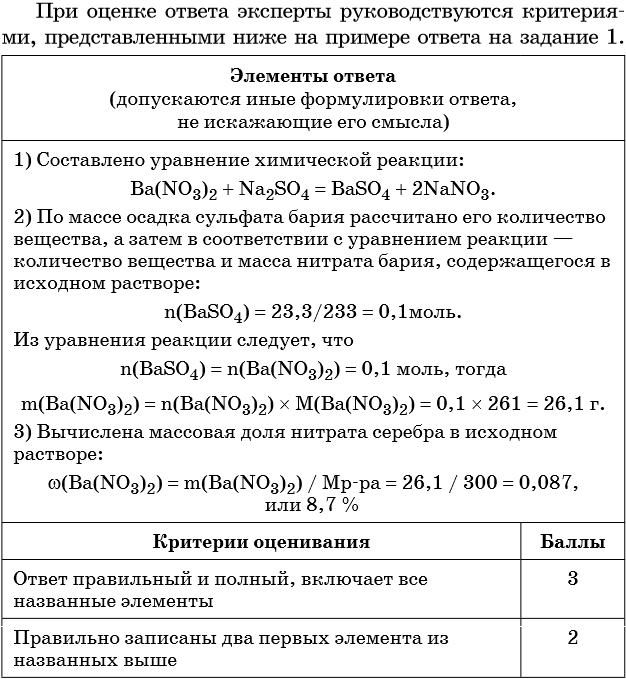
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Тренировочные задания
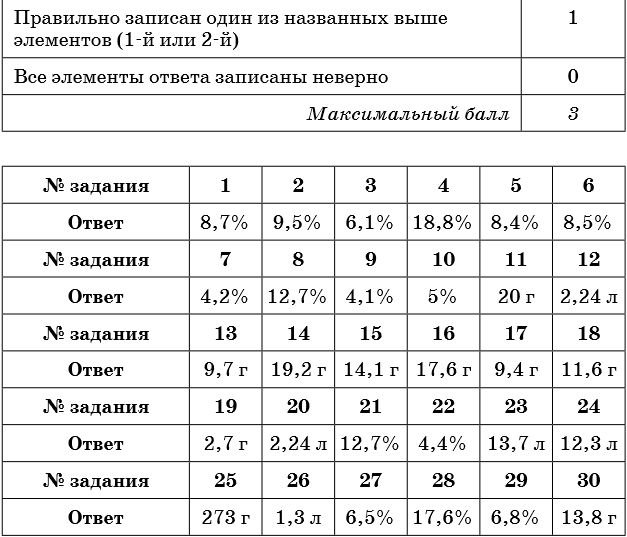
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Ответы
Общее понятие
Физическая величина применяется для вычисления количества конструкционных частиц в материальной субстанции. Понятие используется в случае, когда для численного определения количества вещества в химии требуется описание микроскопического строения формы материи.
Представление процессов в этом ключе нужно при проведении электролиза, получении азота и идеального газа, а также в других областях физики, которые рассматривают варианты превращения и передачи энергии.
Количество вещества является удобным понятием при характеристике различных химических процессов в отличие от массы. Это случается из-за того, что структурные электрические частицы реагируют независимо от их массы в объемах, которые являются кратными целым числам.
Примером служит процесс горения водорода, где число кислорода требуется в 2 раза меньше: О 2 + 2Н 2 = 2Н 2 О.
В этой реакции водородная масса меньше кислородной примерно в 8 раз из-за того, что атомная масса водорода меньше в 16 раз аналогичного показателя кислорода. Применение понятия количества элементов снижает неудобство при составлении уравнений. При этом взаимное соотношение между объемом веществ выражается уравнительным коэффициентом.
Формулы, которые применяются:
- Количество вещества закон Авогадро определяет на основании объема: n = V / V m, где V — объем порции газа в нормальном состоянии, а V m означает молярную величину объема субстанции в аналогичных условиях и равняется 22,4 л/моль.
- Другая формула показывает определение количества в зависимости от количества конструктивных элементов с применением постоянной Авогадро: n = N / N a, где N — число звеньев, а N a — постоянная константа Авогадро.
- В зависимости от массы и молярного веса расчет ведется по формуле: n = m / M, где m — масса субстанции, а М представляет его молярную массу.
Непосредственное число молекул не используется при расчете, т. к. это количество в реальности очень большое. Вместо обозначения молекул в штуках, применяется измерение в молях. Фактическое содержание единиц в 1 моле материи носит наименование числа Авогардо, при этом Na = 6,022141 х 1023 шт./моль.
Значение моля
Вес отдельных структурных элементов формы материи отличается, поэтому одинаковые объемы имеют различные массовые показатели. Моль — это количество материи, которое содержит число молекул, являющееся аналогичным количеству углеродных атомов в 12 г углекислого газа.
Массовый показатель не служит мерой количества субстанции, например:
- 1025 водородных молекул весят 33,5 г;
- 1025 кислородных частиц имеют массу 531,5 г.
Один моль составляет столько же нейтральных частиц, сколько их есть в 1 грамме водорода, такое положение принимается для удобства химических расчетов. При использовании наименования конструктивные элементы конкретизируются.
Понятия молекулы и моля взаимосвязаны между собой. Второе слово означает число, осязаемое множество и массу, а нейтральная частица рассматривается в качестве маленькой тяжести. Моль рассматривается в виде такого количества, которое можно отнести к понятию большой массы, состоящей из небольших весов отдельных элементов.
Молярная и молекулярная масса применяются не только к субстанциям, которые в основе конструкции имеют молекулы, но и к ионным и атомарным материальным формам.
Использование массы нейтральных частиц
В прошлом веке обнаружился научный факт, что если 2 газа содержатся в емкостях с одним и тем же объемом, то количество молекул остается одинаковым в этих субстанциях при соблюдении идентичного давления и нормальной температуры. Это значит, что важные характеристики тела определяются количеством структурных частиц, а не общим весом.
Количественное значение молярной массы M и показатели относительного молекулярного веса остаются равными, но первый предел измеряется в г/моль или моль, а вторая записывается в молях. Константа Авогадро обеспечивает пропорциональность и позиционирует переход к молярному соотношению.
Для расчета количества структурных элементов используется понятие молярной массы. Оно означает массу, которую составляет 1 моль вещества и получается от произведения молекулярной массы на количественный состав молекул в моле (число Авогардо). Молярная масса, для измерения которой используется единица грамм/ ммоль, является аналогичной по числу с относительным весом нейтральных частиц.
Примеры отмеривания равных молекулярных пропорций:
- 1 моль воды соответствует 6 х 1023 молекул Н 2 О.
- 1 моль хлора — 6 х 1023 атомов Fe.
- 1 моль ионов хлора — 6 х 1023 ионов Cl.
- 1 моль хлора — 6 х 1023 молекул Cl 2.
- 1 моль электронов е— — 6 х 1023 электронов е—.
Разница между молярной и молекулярной массой заключается в том, что они одинаковы в численном соотношении, но отличаются постоянной размерностью. Используется суммирование молярных масс составляющих элементов смеси для нахождения этой величины у многокомпонентных соединений. Для расчета молярной массы воды применяется калькулятор: М (Н 2 О) = М (О) + М (Н) = (16 + 2.1) = 18 моль.
Показатель относительного веса
Относительная молекулярная масса представляет собой вес молекулы, который выражается в атомных единицах. В расчетах используются не абсолютные веса, а относительные, т. к. масса молекулы очень мала. Например, молекула воды весит 3.10~26 кг, и частицы остальных веществ имеют значения подобного порядка. Нахождение показателя можно провести онлайн в соответствии с международными стандартами, которые сравнивают массы структурных элементов с 1/12 долей веса углеродного атома.
Успешное решение задачи связывается с тем, что углекислый газ является компонентом различных химических веществ. Принимается, что 1 атомная единица (1 а. е. м) соответствует весу водородного атома. Относительный атомный вес рассчитывается как масса неделимой частицы, выраженная в атомных единицах, при этом значение показателя берется из таблицы Д. И. Менделеева.
Относительные молекулярные массы сложных соединений находятся суммированием аналогичных показателей веса составляющих компонентов. Для подсчета требуется знание химической формулы и значение относительных атомных масс входящих элементов.
Например, молекулярный вес метана СН 4 равен 16 а. е. м (4+12), значит, при горении вещества применяется формула 2О + СН 4 = СО 2 + 2Н 2 О. Из 1 моля метана выходит 2 единицы воды, при этом 16 г газа служит для получения 36 г воды (пропорциональное соответствие).
Химические реакции
При реакции горения метана на каждую молекулу вещества требуется использовать 2 частицы кислорода. Но в условиях открытого воздуха содержание кислорода всегда является достаточным для прохождения реакции. В ограниченных условиях подводных или космических работ требуется точное определение количества вещества и молекул реагентов. Например, если в топку космического агрегата попадает больше кислорода, чем требуется, то снижается тяга и перерасходуется топливо.
Примеры использования относительного веса в реакциях:
- Сероводород имеет формулу H 2 S. Молекулярная масса его частицы рассчитывается в виде суммы относительных масс атомов, являющихся компонентами M r (H 2 S) = A r (S) + 2· Ar (H). Для расчета молекулярной массы используется уравнение Mr (H 2 S) = 2х1+32 = 2+32 = 34.
- Гелий в нормальных обстоятельствах работает, как идеальный газ, поэтому значение молярной массы рассчитывается по формуле Клайперона — Менделеева pV = mRT /М, где p — давление газа, V — объем, M — масса субстанции, Т — значение абсолютной температуры, R — постоянная константа, составляет 8,3.
- Серная кислота применяется в виде двухосновной сильной кислоты H 2 SO 4. Она отвечает за степень серного окисления. В технических реакциях используется смесь с водой и ангидридом серы S О 3. Молярная масса составляет 98,08 ± 0,006 г/миллимоль.
Химики применяют такие пропорции взаимодействия, которые имеют в составе равное число молекул для удобства работы. Точность весов в лаборатории составляет 1 мг, поэтому получается, что 1 млн молекул не всегда удается взвесить. Значит, выбирается не миллион, а другая порция, в которой число n больше этого количества.
Подсчет количества элементов
Примером простой реакции, когда в результате взаимодействия двух продуктов образовывается третья субстанция, является формула А + Б = В. Остается решить весовое количество веществ А и Б, чтобы хватило для реагирования и не осталось исходных материалов, в ином случае продукт В будет загрязнен одним из начальных компонентов.
В качестве примера подходит реакция с участием кальция: Н 2 О + С а О = С а (ОН) 2. Если простейшие формы А и Б состоят из различных атомных наборов Н 2 О и С а О, которые отличаются по весу. Соответственно, в них содержится неодинаковое число частиц, при реакции часть из них не будет использована. Если берется пропорция С а О с содержанием N молекул и порция воды с N частиц, то после взаимодействия не останется никаких веществ и получится количество N молекул.
Отсчет невидимых молекул можно выполнить с помощью взвешивания вещества, для этого требуется вес одной частицы. На весы помещается определенное количество субстанции в граммах, чтобы отмерить требуемое число молекул. Для определения величины вещества в граммах требуется сложить вес составляющих атомов, показатели которых приводятся в периодической таблице.
Атомный вес кальция составляет 40 а. е. м, кислорода — 16 а. е. м, значит, молекулярный вес Са О будет 56 а. е. м. (40+16). Неудобно брать малые количества, например, по 10 молекул субстанции для проведения реакции, поэтому нужно взвесить по миллиону структурных частиц каждого компонента. Для этого высчитывается вес будущей порции, для удобства делается переход из килограммов в граммы, при этом вес 1 а. е. м составляет 1,67х10-24 г. Для подсчета веса умножается это число на 56, получается 56х (1,67-24г) = 93,5х10-24.
Чтобы получить вес, который должен быть на весах, полученный результат умножается на миллион молекул, возникает результат 93,5х10-18 г. При увеличении количества оксида кальция и воды в одинаковое число раз порции частиц возрастают пропорционально, например, 0,1 моль кальция прореагирует с 0,1 молем воды, увеличение кальция до 10 моль потребует повышения числа моль воды также до 10.
Константа Авогадро для газов
Закон Авогадро всегда точно выполняется как для газов в идеальном состоянии, так и для реальных газообразных смесей. Для последних субстанций понятие моля выражается в том, что любой объем газа всегда соответствует определенному количеству молекул. Примером служит реакция, где из аммиака и хлористого водорода выходит аммония хлорид в форме кристаллической твердой субстанции: NH 3 (газ) + HCL (газ) = NH 4 CL (крист.).
Для реагирования требуются одинаковые объемы газообразных веществ, т. к. после окончания реакции не должно оставаться избытка:
- В результате проведения опыта в замкнутом пространстве выяснилось, что при взрыве нужно 2 части водорода и одна порция кислорода, при этом получается 2 объема водяных паров в газовой консистенции О 2 + 2Н 2 = 2Н 2 О (все субстанции в виде газа).
- Одна порция водорода при реакции с 1 частью хлора преобразовывается в хлористый водород Cl 2 + H 2 = 2 HCL (все компоненты в газообразной форме).
Выводом из этого эксперимента следует то, что газы вступают в реакцию, и требуется объемные отношения с применением целочисленных показателей. Частицы в газе не связываются прочными контактами в отличие от атомов твердых субстанций. Занимаемый объем в похожих условиях зависит от количества молекул, но не от определенного типа газа. Исходя из этого положения, равные объемы газообразных субстанций всегда реагируют друг с другом без остатка.
M ( X ) = m ( X ) n ( X ) . Молярная масса численно равна массе 1 моль вещества. Выразим из формулы молярной массы химическое количество n : n ( X ) = m ( X ) M ( X ) — химическое количество вещества можно вычислить, если его массу разделить на молярную массу.
Как найти массу вещества если известно количество молей?
Масса одного моля вещества называется МОЛЯРНОЙ МАССОЙ. Она бозначается буквой М и имеет размерность г/моль. Количество молей вещества n находят из отношения массы m этого вещества (г) к его молярной массе М (г/моль). Например, число молей в m г воды составляет: n = m/18.
Как найти количество вещества Если известен объём?
= V / V m, где V — объём газа при нормальных условиях, а V m — молярный объём газа при тех же условиях, равный 22,4 л/моль.
Как найти объем в химии зная количество вещества?
Как найти объем в химии?
- V = n*Vm.
- Vm = 22.4 л/моль
Как найти массу вещества в растворе формула?
Масса раствора определяется по формуле m (раствора)= m (масса растворенного вещества)/ w (массовая доля растворенного вещества). Или m = r (плотность раствора — г/см3) * V (объем раствора).
Как найти количество вещества Зная массу и объем?
n=m/M — Массу вещества (в граммах) разделить на его молярную массу (в г/моль). 2) По объёму. n=V/Vm — Отношением объёма вещества к его молярному объёму (используется для газов).
Как найти массу вещества по количеству?
Молярная масса численно равна массе 1 моль вещества. Выразим из формулы молярной массы химическое количество n : n ( X ) = m ( X ) M ( X ) — химическое количество вещества можно вычислить, если его массу разделить на молярную массу.
Как выбран за единицу количества вещества моль?
Значение одного моля определяется через число Авогадро, один моль — количество вещества, содержащее 6,022 140 76⋅1023 частиц (атомов, молекул, ионов, электронов или любых других объектов).
Как найти молярную массу пример?
Молярная масса вещества равна сумме молярных масс элементов, входящих в состав его молекул. Например, молярная масса метана CH4 определяется следующим образом: М(CH4) = M(C) + 4·M(H) = 12 + 4 = 16 г/моль. Это означает, что 16 г CH4 содержат 6,02·1023 молекул (1 моль).
Как найти объём по химии?
Объем твердого вещества определяется по формуле V = m/плотность. Объем газа вычисляется по формуле V = n*Vm , где молярное количество n = m/M.
Что означает буква N в химии?
Число частиц (атомов, молекул, протонов, электронов и т. … Химическое количество вещества — физическая величина, пропорциональная числу частиц, содержащихся в данной порции вещества. Обозначается буквой n . Единица измерения — моль.
Что такое 22 4 в химии?
Итак, 22,4 л – МОЛЯРНЫЙ ОБЪЕМ ГАЗОВ при нормальных условиях. Это очень важная величина, которую следует запомнить. … Остается выяснить, как была определена постоянная Авогадро – число молекул газа в 22,4 л газа и в 1 моле любого вещества.
Решение задач на количество вещества,
массу и объем
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, какое количества вещества содержится, какое число молекул содержится, определите объем (н.у.), определите массу, какова масса порции, определите молярную массу, назовите вещество, найдите молярную массу, определите абсолютную массу молекулы, сколько атомов содержится, определите относительную плотность.
ФОРМУЛЫ ДЛЯ РЕШЕНИЯ ЗАДАЧ
Количество вещества характеризует число структурных единиц (атомов, молекул, ионов), которое содержится в определенном образце данного вещества. Единицей измерения количества вещества является моль. Количество вещества (ν) связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями:

Vm = 22,4 л/моль (мл/ммоль, м3/кмоль) при н.у.,
Na = 6,02 • 1023 (постоянная Авогадро),
а молярная масса (М) численно равна относительной молекулярной массе вещества:
Наличие подобной взаимосвязи позволяет, зная одну из величин (количество вещества, массу, объем, число структурных величин) определить все другие величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Задача № 1.
Какое количество вещества содержится в 33 г оксида углерода (IV)?
Ответ: ν(СО2) = 0,75 моль.
Задача № 2.
Какое число молекул содержится в 2,5 моль кислорода?
Ответ: N(O2) = 1,505 • 1024.
Задача № 3.
Определите объем (н. у.), который займут 0,25 моль водорода.
Задача № 4.
Какую массу будет иметь порция оксида серы (IV), объем которой 13,44 л (н. у.)?
Задача № 5.
Имеется 3 моль кислорода О2 при н.у. Определите массу кислорода, его объем, а также число имеющихся молекул кислорода.
Ответ: m = 96 г; V = 67.2 л; N(O2) = 1,81 • 1024.
Задача № 6.
Имеется 10 г водорода Н2. Определите количество водорода, его объем при н.у., а также число имеющихся молекул водорода.
Ответ: 5 моль; 112 л; 3,01 • 1024.
Задача № 7.
Имеется 56 л хлора Сl2 при н.у. Определите количество вещества хлора, его массу и число имеющихся молекул хлора.
Ответ: 2,5 моль; 177,5 г; 1,5 • 1024.
Задача № 8.
Имеется 2,4 • 1023 молекул оксида углерода (IV) СO2. Определите количество вещества углекислого газа, его массу, а также объем (н.у.) углекислого газа.
Ответ: 0,4 моль; 17,6 г; 8,96 л.
Задача № 9.
Какова масса порции оксида азота (IV), содержащей 4,816 • 1023 молекул? Каков ее объем (н. у.)?
Задача № 10.
Масса порции простого вещества, содержащей 1,806 • 1024 молекул, равна 6 г. Определите молярную массу данного вещества и назовите его.
Внимание! В данном конспекте рассматриваются задачи обычной сложности. Чтобы перейти к конспекту решения сложных задач на количественные характеристики и задачи с кратким ответом нажмите на кнопку ниже…
Сложные задачи на количество …
Решение задач на количество вещества, массу и объем. Выберите дальнейшие действия:
- Перейти дальше: Решение задач с долей вещества в смеси, в соединении
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.