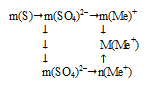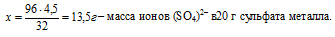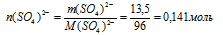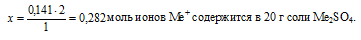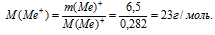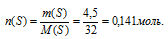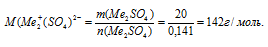Как определить число ионов
Ион – это электрически заряженная частица. Она образуется, когда атом или молекула притягивает к себе дополнительные электроны или же отдает свои. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами. Частицы образуются в растворах в ходе процесса, который называется электролитической диссоциацией. Но это может происходить и при воздействии высокой температуры, электрического тока и т.д. При диссоциации даже крохотного количества вещества образуется определенное число ионов.

Инструкция
Поставлена следующая задача: имеется 40 г поваренной соли. Ее растворили в воде. Сколько ионов при этом образовалось, если допустить, что все атомы поваренной соли подверглись диссоциации?
Напишите формулу этого вещества: NaCl. Посчитайте его молекулярную массу, сложив атомные веса натрия и хлора: 23 + 35,5 = 58,5 а.е.м. (атомных единиц массы). Поскольку молярная масса любого вещества численно равна его молекулярной массе, только выражается в другой размерности (г/моль), то 1 моль поваренной соли (хлористого натрия) будет весить приблизительно 58,5 г.
Вычислить, сколько молей хлористого натрия содержится в 40 г. Произведите деление: 40/58,5 = 0,6838 , или 0,68 моля.
Воспользуйтесь универсальным числом Авогадро, которое равно 6,022*10^23. Это количество элементарных частиц – молекул, атомов или ионов, содержащихся в одном моле любого вещества. В вашем случае до диссоциации хлористый натрий состоял из молекул. Следовательно, в 1 моле этого вещества содержится примерно 6,022*10^23 его молекул. Но у вас 0,68 моля. Произведите умножение: 0,68*6,022*10^23 = 4,095*10^23. Вот столько молекул содержится в 40 г хлористого натрия.
При диссоциации каждая молекула поваренной соли образует два иона: положительно заряженный ион натрия и отрицательно заряженный ион хлора. Поэтому, умножьте полученный результат на 2: 2*4,095*10^23 = 8,19*10^23. Вот столько ионов образовалось при диссоциации 40 г поваренной соли. Задача решена.
Полезный совет
По точно такому же алгоритму можно определить количество ионов любого вещества, принимая во внимание следующие условия:
— вещество должно быть растворимым;
— учитывайте индексы катионов и анионов. Например, при подсчете количества ионов сульфата калия – К2SO4, помните, что каждая его молекула образует три иона.
Источники:
- молекула поваренной соли
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Химия
Аполлинарий
2 год назад
определите количество вещества сульфат-ионов в одном моле серной кислоты, сульфата бария, сульфата алюминия
ОТВЕТЫ
Фетис
Oct 23, 2021
SO4-сульфат ион
H2SO4- на одном моле один моль сульфат иона
ВаSO4- на одном моле один моль сульфат иона
Al2(SO4)3 -на одном моле 3 моль сульфат иона
СПАСИБО
173
Способы определения молекулярной формулы соли, если известна степень окисления металла
Задача 114.
В 20 г сульфата некоторого металла содержится 4,5 г атомов серы. Определите формулу соли, если известно, что металл проявляет в этом соединении степень окисления (+1).
Дано: масса образца сульфата некоторого металла: m(соли) = 20 г; масса серы в образце: m(S) = 4,5 г; степень окисления неизвестного металла: +1.
Найти: формулу сульфата.
Решение:
Для идентификации металла необходимо определить его молярную массу. Здесь возможны 2 способа решения.
I способ (последовательно-разветвленный алгоритм).
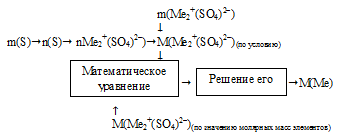
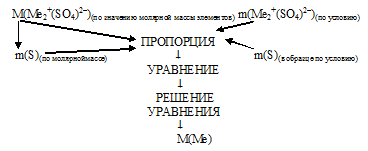
Схематично алгоритм данного способа можно записать следующим образом:
Применим предложенный алгоритм.
1) m(S) → m(SО4)2–
По степени окисления металла в сульфате определяем общую формулу искомого вещества Ме2+(SO4)2–. В кислотном остатке серной кислоты (SО4)2– соотношение атомов строго определено уже известными индексами. Поэтому мы легко сможем определить массу кислотного остатка в 20 г сульфата металла по массе серы:
М(SО4)2– = М(S) . 1 + М(О) . 4 = 32 . 1 + 16 . 4 = 96 г/моль.
Масса 1 моль кислотного остатка (SО4)2– составляет 96 г1.
Составим пропорцию:
вклад серы в 96 г ионов (SО4)2– составляет 32 г (по молярной массе)
вклад серы в х г ионов (SО4)2– составляет 4,5 г (по условию)
2) m(SО4)2– → n(SО4)2–
Находим количество вещества ионов (SО4)2–
3) n(SО4)2– → n(Me+)
Находим количество вещества ионов Ме+, соответствующее содержанию ионов кислотного остатка n(SО4)2– = 0,141 моль. Используя формулу Ме2+(SО4)2–, составим пропорцию:
на 2 моль ионов Ме+ приходится 1 моль ионов (SО4)2– (по индексам в формуле)
на х моль ионов Ме+, приходится 0,141 моль ионов (SО4)2– (по условию)
4) m(SО4)2– → m(Me)+
Находим массу металла в 20 г соли Ме2SО4.
m(Ме+) = m Ме2+(SО4)2– – m(SО4)2– = 20 – 13,5 = 6,5 г.
5) Находим молярную массу атомов металла
В данном случае молярную массу ионов металла можно приравнять к молярной массе незаряженных атомов:
М(Ме+) = М(Ме) = 23 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 23г/моль. Подходит натрий. Этот элемент действительно проявляет степень окисления (+1) и образует сульфат Nа2SО4.
II способ (встречный алгоритм).
Схематично алгоритм данного способа можно записать следующим образом:
Применим данный алгоритм.
1) По степени окисления металла в сульфате определяем общую формулу искомого вещества Ме2+(SО4)2–
2) По массе серы в образце определяем ее количество вещества:
3) По записи формулы сульфата Ме2+моль ионов Ме+ содержится в 20 г соли Ме2SO4 видно, что количество вещества серы равно количеству вещества соли:
n(S) = nМе2+(SО4)2–. = 0,141 моль.
4) По значениям количества вещества и массы образца сульфата определяем значение молярной массы соли:
5) Записываем выражение для определения молярной массы для сульфата металла, исходя из значений молярных масс элементов:
М(Ме2+(SО4)2–) = М(Ме) . 2 + М(S) . 1 + М(О) . 4 =
= М(Ме) . 2 + 32 . 1 + 16 . 4 = [М(Ме) . 2 + 96] г/моль.
6) Приравниваем полученное выражение к значению молярной массы соли, полученному в четвертом действии:
М(Ме) . 2 + 96 = 142.
Получили одно математическое уравнение с одним неизвестным. Его решение дает нам молярную массу искомого металла: М(Ме) = 23 г/моль.
По таблице Д. И. Менделеева находим элемент, имеющий молярную массу 23 г/моль. Подходит натрий. Этот элемент действительно проявляет степень окисления (+1) и образует сульфат Nа2SО4.
III способ (встречный алгоритм).
Графический алгоритм данного способа будет следующим:
Применим данный алгоритм.
1) По степени окисления металла в сульфате определяем общую формулу искомого вещества Ме2+(SО4)2–. Записываем значение молярной массы для этого вещества:
М(Ме2+(SО4)2–) = М(Ме) . 2 + М(S) . 1 + М(О) .4 =
= М(Ме) . 2 + 32 . 1 + 64 . 4 = (М(Ме) . 2 + 96) г/моль.
Вклад серы в общую массу 1 моль Ме2+(SО4)2– составляет:
М(S) . 1 = 32 . 1 = 32 г.
Выбираем в качестве образца массу 1 моль Ме2+(SО4)2–:
M(Ме2+(SО4)2–) = (М(Ме) . 2 + 96) г
Масса серы в этом выбранном образце: m(S) = 32 г.
2) Составляем пропорцию:
(М(Ме) . 2 + 96) г Ме2+(SО4)2– содержит 32 г (S) (по молярной массе)
20 г Ме2+(SО4)2– содержит 4,5 г (S) (по условию)
3) Из пропорции получаем уравнение с одним неизвестным:
(M(Ме) . 2 + 96) . 4,5 = 20 . 32
4) Решая уравнение, получаем значение молярной массы искомого металла:
М(Ме) = 23,1 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 23,1 г/моль. Подходит натрий. Этот элемент действительно проявляет степень окисления (+1) и образует сульфат Nа2SО4.
Ответ: Nа2SО4.
Комментарии:
1 Молярную массу любых ионов можно считать точно так, как и молярную массу нейтральных частиц. Молярная масса любого иона отличается от молярной массы такой же незаряженной частицы на массу нескольких электронов. Если заряд иона «+n», то М(иона) < М(незаряженной частицы) на массу n электронов, если заряд иона «-n», то M(иона) > М(незаряженной частицы) на массу n электронов. Так как масса электрона значительно меньше (в 1840 раз) массы даже самого легкого атома водорода, не говоря уже о более тяжелых атомах других металлов, то массой электронов при подсчете молярной массы можно пренебречь и считать условно, что M(иона) = М(незаряженной частицы).
Химия,
вопрос задал skorodumovaana527,
8 месяцев назад
определите количество вещества сульфат-ионов в одном моле серной кислоты, сульфата бария, сульфата алюминия
Ответы на вопрос
Ответил Аноним
6
Ответ:
SO4-сульфат ион
H2SO4- на одном моле один моль сульфат иона
ВаSO4- на одном моле один моль сульфат иона
Al2(SO4)3 -на одном моле 3 моль сульфат иона
Объяснение:
Предыдущий вопрос
Следующий вопрос
Новые вопросы
Русский язык,
1 месяц назад
Как образуются видовые пары глаголов…
Физика,
1 месяц назад
почему если в воду добавить соду, вода шипит?
Математика,
8 месяцев назад
Решите пж эти премьеры …
Английский язык,
8 месяцев назад
Decide if the statements are true (T) or false (F). 1 Lizzie lives in Britain. T/F 2 Alex has lunch at school every day. T/F 3 Linda wears a school uniform. T/F 4 Yuri gets up two hours before…
Математика,
6 лет назад
В одну столовую привезли 5 одинаковых ящиков фруктов, в другую — 2 таких же ящика. В первую столовую привезли на 24 кг фруктов больше, чем во вторую. Сколько кг фруктов привезли в каждую столовую?
Математика,
6 лет назад
Придумать 2 примера в каждом минимум 5 действий решить по действиям.3 класс……………
Электролиты и их диссоциация
Электролити́ческая диссоциа́ция — это процесс распада молекул на ионы при растворении или плавлении.
Электролитическая диссоциация кислоты
Вычислите суммарное число моль ионов водорода (H+) и гидросульфит-ионов (HSO3—), которые образуются в растворе, содержащем 0,1 моль сернистой кислоты (H2SO3). Степень электролитической диссоциации кислоты в растворе по первой ступени равна 40 % (электролитической диссоциацией кислоты по второй ступени пренебречь).
Диссоциация соли
В 1 литре раствора содержится 0,1 моль хлорида калия (KCl) и 0,05 моль карбоната натрия (Na2CO3). Сколько хлорида натрия (NaCl) и карбоната калия (K2CO3) (в моль) нужно взять, чтобы приготовить 1 литр раствора такого же состава? Запишите уравнение диссоциации соли.
Хлорид цинка
Определите количество ионов, образующихся при электролитической диссоциации 1 моль хлорида цинка (ZnCl2).
Сернистая кислота (диссоциация по первой ступени)
Вычислите суммарное число моль ионов водорода (H+) и гидросульфит-ионов (HSO3—), которые образуются в растворе, содержащем 0,1 моль сернистой кислоты (H2SO3). Степень диссоциации сернистой кислоты (H2SO3) в растворе по первой ступени равна 40 % (диссоциацией по второй ступени пренебречь).
Раствор сульфата натрия
Вычислите суммарное число моль ионов натрия (Na+) и сульфат-ионов (SO42-), которые образуются в растворе сульфата натрия (Na2SO4), содержащем 4 моль сульфата натрия (Na2SO4).
Диссоциация кислоты хлорноватистой — способ решения II
Сколько моль ионов водорода образуется в растворе, содержащем 0,001 моль хлорноватистой кислоты (HClO), если степень диссоциации кислоты равна 1%?
Диссоциация кислоты хлорноватистой — способ решения I
Сколько моль ионов водорода образуется в растворе, содержащем 0,001 моль хлорноватистой кислоты (HClO), если степень диссоциации кислоты равна 1%?
Диссоциация гидроксида кальция
Сколько моль гидроксид-ионов (OH—) образуется при полной диссоциации 0,05 моль гидроксида кальция (Ca(OH)2)?
Концентрация ионов натрия в растворе хлорида натрия
Вычислите концентрацию ионов натрия (Na+) (в моль/л) в 1,17-процентном растворе хлорида натрия (NaCl), приняв плотность раствора равной 1 г/см3.
Диссоциация серной кислоты
Сколько ионов водорода и сколько молей ионов водорода образуется при полной диссоциации 4 моль серной кислоты (H2SO4)?