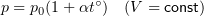2.1. Основные понятия и формулы
Количество
вещества
—
число структурных элементов (молекул,
атомов, ионов и т. п.), содержащихся в
теле или системе. Количество вещества
выражается в молях. Моль равен количеству
вещества системы, содержащей столько
же структурных элементов, сколько
содержится атомов в
0,012
кг изотопа углерода 12C.
Количество вещества тела (системы)
,
где
N
—
число структурных элементов (молекул,
атомов, ионов и т.п.), составляющих тело
(систему). Постоянная Авогадро NА=6,021023
моль-1.
Молярная масса вещества ,
где
m—масса
однородного тела (системы);
—количество
вещества (число молей) этого тела
(системы). Выражается в единицах г/моль
(или кг/моль).
Единица
массы, равная 1/12 массы атома углерода
12C,
называется атомной единицей массы
(а.е.м.). Массы атомов или молекул выраженные
в атомных единицах массы называют
соответственно относительной атомной
или относительной молекулярной массой
вещества. Относительная молекулярная
масса вещества состоит из относительных
атомных масс химических элементов,
составляющих молекулу вещества.
Относительные атомные массы химических
элементов приводятся в таблице Д. И.
Менделеева (см. также таблицу 8 приложения
данного пособия).
Молярная
масса вещества численно равна относительной
атомной или молекулярной массе данного
вещества, если размерность а.е.м. заменить
на размерность г/моль.
Количество вещества смеси n газов
или
,
где
νi,
Ni,
mi,
i
—
соответственно количество вещества,
число молекул, масса и молярная масса
i-го
компонента смеси (i=1,2,…,n).
Уравнение
Менделеева
—
Клапейрона (уравнение состояния
идеального газа)
,
где
т
—
масса газа,
—
молярная масса газа, R
—
универсальная газовая постоянная, ν
—
количество вещества, Т
—
термодинамическая температура.
Опытные
газовые законы, являющиеся частными
случаями уравнения Менделеева
—
Клапейрона для изопроцессов:
а)
закон Бойля—Мариотта
(изотермический процесс: T=const,
m=const)
или
для двух состояний газа, обозначенных
цифрами 1 и 2,
,
б)
закон Гей-Люссака (изобарический процесс:
р=const,
m=const)
или
для двух состояний
,
в)
закон Шарля (изохорический процесс:
V=const,
m=const)
или
для двух состояний
,
г)
объединенный газовый закон (m=const)
или
для двух состояний
.
Под
нормальными условиями понимают давление
po=1
атм (1,013105
Па), температуру 0оС
(T=273
K).
Закон
Дальтона, определяющий давление смеси
n
газов.
,
где
pi
—
парциальные давления компонентов смеси
(i=1,2,…,n).
Парциальным
давлением называется давление газа,
которое производил бы этот газ, если бы
только он один находился в сосуде,
занятом смесью.
Молярная масса смеси n газов
.
Массовая
доля i-го
компонента смеси газа (в долях единицы
или процентах)
,
где
т
—
масса смеси.
Концентрация молекул
,
где
N
—
число молекул, содержащихся в данной
системе;
—
плотность вещества в системе;
V
—
объем системы. Формула справедлива не
только для газов, но и для любого
агрегатного состояния вещества.
Уравнение
Ван-дер-Ваальса для реального газа
,
где
a
и b
—
коэффициенты Ван-дер-Ваальса
Для
идеального газа уравнение Ван-дер-Ваальса
переходит в уравнение Менделеева
—
Клапейрона.
Основное уравнение
молекулярно — кинетической теории газов
,
где
п
—
средняя кинетическая энергия
поступательного движения молекулы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Молекулярная физика Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;
V — объем газа;
N — число молекул;

1.3 Средняя квадратичная скорость молекул идеального газа
k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
p — давление;
V — объем газа.
1.7 Закон Шарля
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
p — давление газа.
При изменении объема от V1 до V2
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.
Итак, количество вещества в химии обозначается греческой буквой «ню».
Помню, как в 9-м классе мой учитель физики Игорь Юрьевич учил меня правильно писать букву «ню». До этого она у меня получалась немного коряво.
Но поскольку на БВ не проходят греческие буквы, я буду обозначать количество вещества латинской буквой v. Латинская v очень похожа на греческую «ню».
Рассмотрим следующие случаи.
1) Если нам известно количество частиц вещества, то количество вещества можно найти по формуле:
v = n/NA
где
v — количество вещества;
n — количество частиц вещества. Это безразмерная величина, то есть это просто число. Правда, это число бывает очень большим, например, 5*(10^24).
NA — постоянная Авогадро. Постоянная Авогадро представляет собой универсальную константу. NA = 6,022*(10^23) моль^(–1).
2) Если нам известна масса вещества, то количество вещества находится по следующей формуле:
v = m/M
где
v — количество вещества;
m — масса вещества;
M — молярная масса вещества находится по химической формуле вещества, при помощи периодической системы Д. И. Менделеева, путём суммирования атомных масс всех входящих в молекулу атомов с учётом имеющихся индексов.
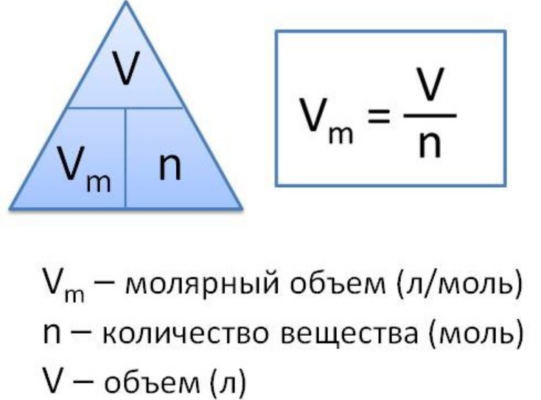
3) Если нам известен объём газообразного вещества, то мы можем найти количество вещества газа по такой формуле:
v = V/Vm
где
v — количество вещества;
V — объём газа;
Vm — молярный объём газов. Молярный объём газов — это универсальная константа. Vm = 22,414 л/моль = 22414 м3/моль.
Повторюсь, что формула v = V/Vm верна только для газов!
Наконец, рассмотрим Ваш случай.
Вам по условию даны объём и объёмная доля.
Я рискну предположить, что у Вас задача примерно такого рода:
«Объём газовой смеси составляет 240 л. Объёмная доля кислорода в смеси равна 45%. Вычислите количество вещества кислорода в смеси».
Такая задача решается в два действия.
1) Находим объём кислорода:
V (O2) = V0 * ф / 100 = 240 л * 45 / 100 = 108 л.
(Ф — это объёмная доля, она обозначается греческой буквой «фи». Вместо неё приходится писать русскую ф).
2) Находим количество вещества кислорода. Кислород — это газ, значит, мы имеем право воспользоваться формулой v = V/Vm.
v (O2) = V/Vm = 108 л : 22,414 л/моль = 4,818 моль. Округление произведено до тысячных.
Молярный объем газа

4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
Молярный объем газа
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Аэлита Коробка
5/5
-
Александр Котков
5/5
-
Настя Бабич
5/5
-
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
А какая ваша оценка?
Формулы молекулярной физики
Формула концентрации молекул
Здесь n — концентрация 

Формула плотности
Здесь 


Формула относительной молекулярной массы
Здесь 


Формула количества вещества (количества молей)
Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы
Здесь 




Формулы количества молекул
Здесь A — количество молекул (безразмерное), п — концентрация молекул 




Формулы средней квадратичной скорости молекул
Здесь 


Основное уравнение кинетической теории идеального газа
Здесь р — давление газа (Па), 



Формула средней кинетической энергии молекул
Здесь 


Связь шкал Цельсия и Кельвина
Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой
Здесь 
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева
Здесь р — давление газа (Па), V — объем 


Объединенный газовый закон — уравнение Клапейрона
при
Здесь 



Закон Бойля — Мариотта (изотермический процесс)
при
Здесь Т — абсолютная температура газа (К), m — масса газа (кг), 



Закон Гей-Люссака (изобарный процесс)
при
Здесь р — давление газа (Па), m — масса газа (кг), 




Закон Шарля
при
Здесь V — объем газа 


Связь давления идеального газа с концентрацией его молекул и температурой
Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа 
Формулы относительной влажности
Здесь 



Работа при изобарном изменении объема газа
Здесь А — работа (Дж), р — давление газа (Па), 


Внутренняя энергия идеального одноатомного газа
Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), 

Первый закон термодинамики
Здесь Q — количество теплоты, переданное термодинамической системе (Дж), 
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при
к изохорному: при V = const
к изобарному: при р = const
к адиабатному: при Q = 0
Здесь Т — абсолютная температура (К), 

Формулы количества теплоты при нагревании или охлаждении тел
Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), 





Формула количества теплоты при плавлении или кристаллизации
Здесь Q — количество теплоты (Дж), т — масса тела (кг), 
Формула количества теплоты при парообразовании или конденсации
Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива
Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя
Здесь 



Коэффициент полезного действия идеального теплового двигателя
Здесь 


Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Задачи по физике с решением
Возможно вам будут полезны эти страницы: