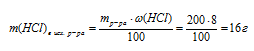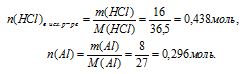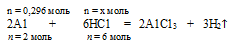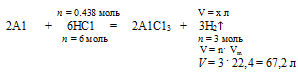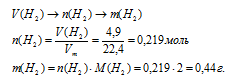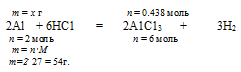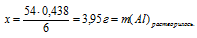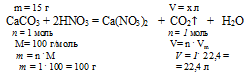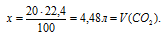Как найти объём выделившегося газа
В учебном курсе химии часто встречаются задачи, в которых требуется вычислить объем газа, выделившегося в результате химической реакции. Почти все задачи такого типа можно решить по следующему алгоритму.

Вам понадобится
- — таблица Менделеева;
- — ручка;
- — бумага для записей.
Инструкция
К примеру, вам требуется найти объем выделившегося водорода в результате реакции ортофосфорной кислоты и карбоната натрия. Самое главное для решения – правильно составить уравнение реакций. Если вы сомневаетесь, как реагируют данные в вашей задаче вещества, посмотрите в справочной литературе свойства химических веществ, участвующих в реакции.
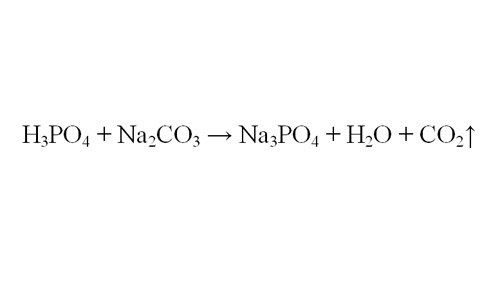
Расставьте коэффициенты в уравнении, чтобы число атомов элементов в левой и правой части уравнения совпадали. Теперь вы видите, в каком соотношении реагируют вещества. По известному количеству любого из них вы можете определить количество молей выделившегося газа. Например, если в реакцию вступило 4 моля ортофосфорной кислоты, получится 6 молей углекислого газа.
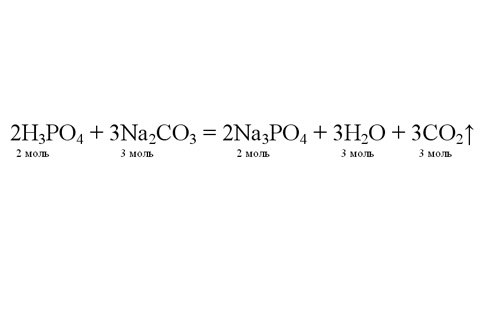
Зная количество молей газа, найдите его объем. По закону Авогадро 1 моль любого газа в нормальных условиях занимает 22,4 литра объема. Объем 6 молей газа будет равен: 6*22,4 = 134,4 литра.
Если в условии не дано количество реагента или продукта реакции, найдите из его других данных. При известной массе одного из веществ вы вычислите его количество молей по формуле: v = m/M, где v – количество вещества, моль; m – масса вещества, г; M – молярная масса вещества, г/моль. Молярную массу вы получите, сложив атомные веса элементов, составляющих вещество, из таблицы Менделеева. Например, молярная масса H3PO4: М = 3*1+31+16*4 = 98 г/моль.
Массу или количество нетрудно рассчитать из концентрации вещества, если известен объем раствора. Из молярности определите количество молей растворенного вещества по уравнению: v = V*Cм, где V – объем раствора, л; См – молярная концентрация, моль/л. Нормальность раствора связана с молярностью выражением: Сн = z*Cм, г моль-экв/л, где z – эквивалент реагента, количество протонов водорода, которое он может принять или отдать. Например, эквивалент H3PO4 – 3.
Также массу растворенного вещества вы можете найти из титра раствора: m = T*V, где Т – титр раствора, г/л; V – объем раствора. Или из плотности: m = p*V, где р – плотность раствора, г/мл.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Как найти объём выделившегося газа
В учебном курсе химии часто встречаются задачи, в которых требуется вычислить объем газа, выделившегося в результате химической реакции. Почти все задачи такого типа можно решить по следующему алгоритму.
К примеру, вам требуется найти объем выделившегося водорода в результате реакции ортофосфорной кислоты и карбоната натрия. Самое главное для решения – правильно составить уравнение реакций. Если вы сомневаетесь, как реагируют данные в вашей задаче вещества, посмотрите в справочной литературе свойства химических веществ, участвующих в реакции.
Расставьте коэффициенты в уравнении, чтобы число атомов элементов в левой и правой части уравнения совпадали. Теперь вы видите, в каком соотношении реагируют вещества. По известному количеству любого из них вы можете определить количество молей выделившегося газа. Например, если в реакцию вступило 4 моля ортофосфорной кислоты, получится 6 молей углекислого газа.
Зная количество молей газа, найдите его объем. По закону Авогадро 1 моль любого газа в нормальных условиях занимает 22,4 литра объема. Объем 6 молей газа будет равен: 6*22,4 = 134,4 литра.
Если в условиине дано количество реагента или продукта реакции, найдите из его других данных. При известной массе одного из веществ вы вычислите его количество молей по формуле: v = m/M, где v – количество вещества, моль; m – масса вещества, г; M – молярная масса вещества, г/моль. Молярную массу вы получите, сложив атомные веса элементов, составляющих вещество, из таблицы Менделеева. Например, молярная масса H3PO4: М = 3*1+31+16*4 = 98 г/моль.
Массу или количество нетрудно рассчитать из концентрации вещества, если известен объем раствора. Из молярности определите количество молей растворенного вещества по уравнению: v = V*Cм, где V – объем раствора, л; См – молярная концентрация, моль/л.Нормальность раствора связана с молярностью выражением: Сн = z*Cм, г моль-экв/л, где z – эквивалент реагента, количество протонов водорода, которое он может принять или отдать. Например, эквивалент H3PO4 – 3.
Также массу растворенного вещества вы можете найти из титра раствора: m = T*V, где Т – титр раствора, г/л; V – объем раствора. Или из плотности: m = p*V, где р – плотность раствора, г/мл.
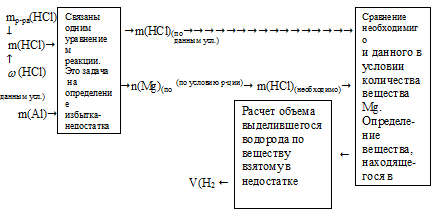
Задача 6.
Определите объем газа (н.у.), который получится, если 8 г алюминия поместить в 200 г 8% -ного раствора соляной кислоты. Найдите массу раствора после реакции.
Дано:
Определение объема выделившегося газа в реакции, если одно вещество взято в избытке
Определение избытка-недостатка
Задача 6.
Определите объем газа (н.у.), который получится, если 8 г алюминия поместить в 200 г 8% -ного раствора соляной кислоты. Найдите массу раствора после реакции.
Дано:
масса алюминия: m(А1) = 8 г;
масса соляной кислоты: mр-ра(НС1) = 200 г;
массовая доля хлороводорода в соляной кислоте: (НС1) = 8% .
Найти:
объем выделившегося газа;
массу раствора после реакции.
Решение:
2А1 + 6НС1 — 2А1С13 + ЗН2↑
Сначала необходимо определить, какое вещество будет в недостатке. По нему можно рассчитать объем выделившегося водорода. Алгоритм вычисления массы конечного раствора
зависит от того, какое вещество окажется в избытке, поэтому отразить эту часть решения заранее невозможно. Алгоритм вычисления массы конечного раствора зависит от того, какое
вещество окажется в избытке. В большинстве задач на определение избытка-недостатка при растворении металла в растворе в недостатке оказывается именно металл. В этом случае
масса конечного раствора определяется очень просто:
mкон. р-ра = т(Ме) + mисх. р-ра – mгаза.
Если же металл окажется в избытке, то его излишек не будет входить в состав конечного раствора, а опустится на дно сосуда.
Поэтому отразить весь алгоритм решения заранее невозможно.
Схематично алгоритм первой части решения будет иметь вид:
1. Определяем массу НС1 в 200 г 8% -ного исходного раствора.
2. Определяем количество веществ НС1 и А1.
3. Выберем за основу алюминий, и определим по уравнению реакции количество вещества НС1, которое необходимо для полного растворения всего (0,296 моль) алюминия.
Составляем пропорцию:
на 0,296 моль А1 должно расходоваться х моль НС1 (по условию)
на 2 моль А1 полностью расходуется 6 моль НС1 (но уравнению)

4 .Определим, какое вещество дано в недостатке.
Таблица
n(НС1) необходимо
n(НС1) дано по условию
0,888моль > 0,438 моль
В реакции участвует меньше НС1, чем необходимо для полного растворения А1, следовательно, НС1 дано в недостатке. В процессе реакции НС1 израсходуется полностью, а А1 расходуется не весь и часть его останется после реакции.
5. Рассчитаем по уравнению реакции объем (н.у.) выделившегося водорода. Для расчета используем НС1, т.к. это вещество взято в недостатке.
Составляем пропорцию:
0,438 моль НС1 дают х л Н2 (по условию)
6 моль НС1 дают 67,2 л Н2 (по уравнению)
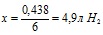
6. Определим массу выделившегося Н2 по алгоритму:
7. Определяем массу раствора после реакции.
mкон. р-ра = m(HCl)р-ра + m(Al)растворившегося – m(H2)выделившегося
При определении массы конечного раствора нужно учитывать, что алюминий находился в избытке, и часть его осталась после реакции в неизменном виде. Не прореагировавший алюминий, очевидно, не входит в состав раствора и будет находиться на дне. Поэтому нам придется определить массу растворившегося А1. Это можно сделать по уравнению реакции, используя данные по НС1.
Составляем пропорцию:
х т А1 растворяются в 0,438 моль НС1 (по условию)
54 г А1 растворяются в 6 моль НС1 (по уравнению)
Теперь возможно определить массу конечного раствора:
mкон. р-ра = 200 + 3,95 – 0,44 = 203,51 г.
Ответ: объем выделившегося водорода — 4,9 л; масса конечного раствора 203,51 г.
Определение объема образовавшегося углекислого газа
Задача 7.
Определите объем выделившегося газа при взаимодействии 20,0 г карбоната кальция с избытком азотной кислоты.
Решение:
Несмотря на то, что в условии говориться об избытке азотной кислоты, данная задача не относится к типу «на определение избытка-недостатка». В условии указана масса только одного из участников реакции (СаСО3). Указание на избыток другого участника (НNO3) показывает, что карбонат кальция расходуется полностью и объем выделившегося газа необходимо считать именно по СаСО3.
Определим объем образовавшегося углекислого газа из пропорции:
20 г А1 дают х л СО2 (по условию)
100 г А1 дают 22,4 л СО2 (по уравнению)
Ответ: V(CO2) = 4,
Задачи на избыток-недостаток:
1. Определение избытка-недостатка
2 . Алгоритм определения избытка-недостатка
Количество газов, выделяющихся при
взрыве ВВ, определяют теоретическим
путём по реакции взрывчатого превращения
и опытным.
Теоретически количество газов,
выделяющихся при взрыве ВВ, определяют
на основании закона Авогадро, согласно
которому газы взрыва, приведенные к
нормальным условиям (температура 273 К
и давление 101325 Па) имеют одинаковый
молярный объём, равный 22,4 м3/кмоль.
Объём газов взрыва 1 кмоля ВВ
V0= 22,4n,
(2.2)
где n–
суммарное число килломолей газов взрыва,
образующихся при взрыве 1 кмоля ВВ.
В технике пользуются объёмом газов, м3,
выделяющихся при взрыве 1 кг ВВ, называемымудельным объёмом(V0‘ ):
V0‘ =V0 /МВВ, (2.3)
где МВВ– молярная масса ВВ,
кг/кмоль.
Для индивидуальных ВВ молярную массу
определяют, исходя из их химических
формул. Если ВВ будут представлять собой
механическую взрывчатую смесь нескольких
компонентов, то
МВВ=МВВ1N1+МВВ2 N2+,…, +МВВnNn,
(2.4)
где МВВ1,МВВ2, …,МВВn– молярная масса одноимённых компонентов
смесевого ВВ, кг/кмоль;
N1,N2,…,NП— число кмолей одноимённых компонентов
в 1 кмоле смеси ВВ.
Если требуется вычислить удельный объём
для других температурных условий, то
пользуются уравнением
.
(2.5)
В термодинамике константы ВВ определяют
при температуре 288 К (15 ºC).
Тогда
(2.6)
Пример 1. Определить объём
газов, выделяющихся при взрыве аммиачной
селитры в нормальных условиях. Реакция
разложения аммиачной селитры:
NH4NO3
= 2H2O+N2+ 0,5O2
.
Решение. Объём газов, м3при
взрыве 1 кмоля ВВ определяем по формуле
(2.2):
V0= 22,4n= 22,4 · 3,5 = 78,4.
Удельный объём, м3/кг, газов взрыва
– по формуле (2.3)
V0‘ =V0 /МВВ = 78,4 / 80 = 0,98.
Пример 2. Определить объём
газов, выделяющихся при взрыве аммонита
6ЖВ. Реакция взрывчатого разложения
C6H2(NO2)3CH3+ 10,7NH4NO37CO2+ 23,9H2O+ 12,2N2+ 0,1O2
Решение. Исходя из этой реакции
n= 7 + 23,9 + 12,2 + 0,1 = 43,2.
Объём газов, м3, выделяющихся
при взрыве 1 кмоля ВВ, находим по формуле
(2.2)
V0 = 22,4 · 43,2 = 967,68;
по формуле (2.4) находим
МВВ= 227 · 1 + 80 · 10,7 = 1083.
Удельный объём газов, м3, выделяющихся
при взрыве 1 кг ВВ, вычисляем по формуле
(2.3):
Удельный объём газов при температуре
15 ºС (Т= 288 К) определяем по
формуле (2.6):
V15‘=V0‘· 1,055 = 0,894 · 1,055 = 0,943.
Объём газообразных продуктов взрыва
можно установить и другим методом –путём
замера давления газов в стальной бомбе
после взрыва в ней заряда ВВ. Для этого
после взрыва бомбу выдерживают в течение
60 мин для охлаждения и выравнивания
температуры её стенок с окружающей
температурой. Затем измеряют давление
внутри нее. Объём газов, приведенный к
нормальным условиям (давление 760 мм рт.
ст. и температура 273 К), вычисляют по
формуле
,
где V– объём бомбы, м3;
P– давление в бомбе после взрыва,
Па;
Т– температура газов в бомбе, К.
Затем устанавливают объём сконденсировавшихся
паров воды (бомбу продувают сухим
воздухом, который затем проходит через
сосуды с хлористым кальцием и отдаёт
последнему воду, вынесённую из бомбы),
и прибавляют его к вычисленному значению
V0, получая при этом объёмV0.На основании полученного результата
вычисляют удельный объём газов взрыва
1 кг ВВ при парообразной воде
где Q– масса взорванного заряда,
кг.
Для сохранности бомбы плотность
заряжания, т.е. отношение массы заряда
к объёму бомбы (или сосуда, в котором
взрывается заряд), принимают не более
0,02 кг/дм3.
2.4.2. Определение теплоты взрыва.
Теплота взрыва может быть определена
как теоретическим, так и опытным путём.
Ещё в середине XIX века русский академик
Г.И. Гесс, основываясь на первом законе
термодинамики, предложил метод расчёта
теплового эффекта химической реакции,
согласно которому суммарный тепловой
эффект некоторой последовательности
реакции не зависит от пути превращения
исходных веществ в конечные продукты,
а зависит только от начального и конечного
состояний системы. Применительно к
реакции взрыва этот закон Г.И. Гесса
можно сформулировать так: количество
теплоты, выделяющейся при взрыве, равно
суммарной молярной теплоте образования
продуктов взрыва за вычетом молярной
теплоты образования самого ВВ
Qт=Qпв–QВВ,
(2.7)
где Qт – молярная теплота
взрыва 1 кмоля ВВ, которая выделяется
после расширения продуктов взрыва до
нормального давления (101325 Па) и температуры
288 К, кДж/кмоль;
Qпв – молярная теплота
образования продуктов взрыва 1 кмоля
ВВ, кДж/кмоль;
QВВ – молярная теплота
образования 1 кмоля ВВ, кДж/кмоль.
Очевидно,
Qпв =q1 n1+q2n2 + ,…, +qn
nn, (2.8)
где q1, q2,…,qn
– молярная теплота образования
одноимённых продуктов взрыва (приТ=288 К иР0 =101325 Па),
кДж/кмоль;
n1, n2,…,nn –
количество кмолей одноимённых продуктов
взрыва 1 кмоля ВВ.
Для взрывчатых механических смесей
QBB=QBB1N1+QBB2
N2+ …. +QBBnNn
, (2.9)
где QBB1,QBB2 ,…,QBBn
– удельная теплота образования
одноимённых компонентов
смеси, кДж/кг.
Удельная теплота взрыва ВВ, кДж/кг,
определяется по формуле
.
(2.10)
Молярная теплота образования некоторых
ВВ и продуктов взрыва при нормальном
давлении и температуре 15˚С
приведена в табл. 2.1.
В расчётах параметров взрыва используют
теплоту, которая выделяется при взрыве
ВВ в постоянном объёме (без совершения
внешней работы). Её называют общей
энергией химического превращения ВВили потенциальной энергией взрываQV.
Молярная теплота взрыва при постоянном
объёме больше значения QТ,
вычисленного по формуле (2.7), на количество
теплотыQТ,
расходуемой на расширение газов, т.
е.
QV=QT+QТ
, (2.11)
где QТ—
количество молярной теплоты, расходуемое
на работу расширения газов взрыва,
кДж/кмоль.
При температуре, равной 288 К, QТ
=nRT = 8,32 ·
288n= 2396n
.
Таблица 2.1. Молярная теплота
образования некоторых веществ
-
Вещество
Химическая
формулаМолярная теплота образования при
температуре 15ОС (288 К)
и давлении 760 мм рт. ст. (101325Па), кДж/кмоль
Аммиачная
селитраNH4NO3
+ 371000
Динитронафталин
C10H6(NO2)2
– 23630
Нитроглицерин
C3H5(ONO2)3
+ 395000
Нитрогликоль
C2H4(ONO2)2
+ 283000
Тэн
C5H8(ONO2)4
+ 516000
Тротил
C6H2(NO2)3CH3
+ 69300
Тетрил
C6H2(NO2)3N(NO2)CH3
– 19678
Гексоген
C3H6N3(NO2)3
– 65482
Пироксилин
C24H29O9(ONO2)11
+ 2610000
Коллодионный
хлопокC24H31O11(ONO2)9
+ 2950000
Гремучая
ртутьHg(CNO)2
– 258500
Вода (пар)
H2O
+ 241500
Вода
(жидкость)H2O
+ 286000
Углекислый
газCO2
+ 395000
Оксид
углеродаCO
+ 109800
Оксид азота
NO
– 111200
Закись
азотаN2O
– 86400
Метан
CH4
+ 78000
Целлюлоза
C6H10O5
+ 839000
Оксид
алюминияAl2O3
+ 1870000
П р и м е ч а н и е. Знаком «+» обозначена
молярная теплота, затрачиваемая на
образование вещества, знаком «–» –
молярная теплота, выделяющаяся в процессе
образования вещества.
Следовательно,
молярная теплота, кДж, взрыва 1 кмоля ВВ
при постоянном объёме (т.е. в момент
взрыва — до расширения газов взрыва)
QV=QT+ 2396n.(2.12)
Для 1 кг ВВ теплота, кДж, взрыва при
постоянном объёме составит
Q΄V=QV
/ МВВ, (2.13)
Пример. Определить количество
теплоты, выделяющейся при взрыве аммонита
6ЖВ (исходные данные ВВ даны в 2.4.1, пример
2).
Решение. По формуле (2.8) молярная
теплота образования продуктов взрыва,
кДж/кмоль
Qпв= 395000· 7 + 241500·23,9 = 8536850.
По формуле (2.9) вычисляем теплоту
образования 1 кмоля ВВ. Для тротила QВВ1
= 69300 кДж/кмоль – аммиачной селитрыQВВ2= 371000 кДж/кмоль (табл. 2.1).
Тогда
QВВ= 69300·1 + 371000 10,7 = 69300 + 3969700 =
4039000.
Находим по формуле (2.7) молярную теплоту
взрыва 1 кмоля ВВ
QТ= 8536850 — 4039000 = 4497850 кДж/кмоль;
по уравнению (2.10) определим теплоту
взрыва 1 кг аммонита 6ЖВ –
QТ= 4153,1 кДж/кг;
по (2.11) – теплоту взрыва 1 кмоля аммонита
6ЖВ при постоянном объёме
QV=4497850 + 43,2·8,32·288=4497850 +
103514,1 = 4601364 кДж/кмоль;
по формуле (2.4) – молярную массу аммонита
6ЖВ
МВВ= 227·1 + 80·10,7 = 1083 кг/кмоль;
по (2.13) – удельную теплоту взрыва 1 кг
аммонита 6ЖВ при постоянном объёме
кДж/кг.
Опытным путём теплота взрыва определяется
взрыванием или сжиганием ВВ в
калориметрической бомбе, которая
помещается в водяной калориметр.
2.4.3. Определение температуры взрыва.
Максимальную температуру, до которой
могут нагреваться при взрыве продукты
взрывчатого превращения ВВ, называюттемпературой взрыва. Для аналитического
расчёта предполагается, что взрывчатое
разложение происходит при постоянном
объёме и выделяющаяся теплота целиком
расходуется на нагревание продуктов
взрыва. Тогда температура взрыва,0С
может быть вычислена по формуле
,
(2.14)
где CV– молярная теплоёмкость
газов взрыва, кДж/(кмольºС).
Молярная теплоёмкость CVдля газов в момент взрыва, т. е. до их
расширения, берётся при постоянном
объёме. Для реальных газовCV– величина переменная, зависящая от
температуры, и различная для разных
газов. Малляр и Ле-Шателье(Франция)
предложили для её определения
уравнение
CV
= a + bt,
где a– молярная
теплоёмкость продуктов взрыва при 0ºС
(273 К);
b– приращение молярной теплоёмкости
при повышении температуры на 1ºС.
Подставив указанное значение CVв формулу температуры взрыва (2.14), получим
,
или
nbt2 + nat
– QV
= 0.
Откуда
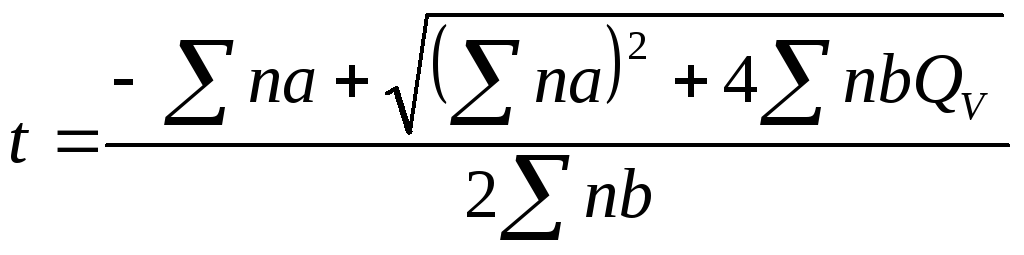
(2.15)
Продукты взрыва состоят из твердых
компонентов и газов, теплоёмкость
которых различна. Поэтому величина nаозначает суммарную молярную теплоёмкость
продуктов взрыва при температуре 0ºС,
т. е.nа
= n1a1+ n2a2
+ … + nnan. Точно так жеnbозначает
суммарное приращение молярной теплоёмкости
продуктов взрыва при повышении их
температуры на 1º, т. е.nb=n1b1+n2b2+ … +nnbn. В табл. 2.2
приведены значения параметровaиb некоторых
химических элементов и соединений.
Определить
температуру взрыва экспериментальным
путём весьма сложно вследствие
кратковременности процесса и большого
давления взрыва. Наиболее точен оптический
цветовой метод, основанный на определении
энергии по сплошному непрерывному
спектру, характерному для детонации,
или на определении отношения значений
яркости при двух длинах волн – метод
“красно-синего сравнения”.
Пример. Определить температуру,
развивающуюся при взрыве аммонита 6ЖВ
(исходные данные ВВ даны в 2.4.1, пример
2).
Решение. Температуру, развивающуюся
при взрыве аммонита 6ЖВ, определим по
формуле (2.15), а значения входящих
параметров возьмем из табл. 2.2.
О п р е д е л е н и е п р и б л и ж е н н о г
о з н а ч е н и я. Подсчитаем значения
молярной теплоёмкости газов взрыва при
0ºС и приращение молярной теплоёмкости
при повышении температуры на 1º:
na = a1n1
+ a2n2
+ … = 26·(7 + 23,9) + 20·(12,2 + 0,1) =
803,4 + 246 =1049,4 кДж/(кмольºС);
nb=b1n1+b2n2+…+0,01·(7+23,9)+0,004·(12,2+0.1)=0,31+0,049=0,359
кДж/(кмольºС).
Подставив значения параметров в формулу
(2.16), получим
С.
Температура взрыва аммонита 6ЖВ по
Кельвину
Т = 2405.35 + 273 = 2678.35 К.
О п р е д е л е н и е т о ч н о г о з н а ч
е н и я .
Таблица 2.2. Значения параметров
а и b некоторых
химических элементов и
соединений
|
Компоненты |
а, кДж/(кмоль·ºС) |
b, кДж/(кмоль·ºС) |
|
СО |
23,80 |
0,001307 |
|
СО2 |
41,52 |
0,003262 |
|
H2O |
29,85 |
0,00522 |
|
N2 |
23,45 |
0,001352 |
|
O2 |
24,07 |
0,002209 |
|
H2 |
20,478 |
0,002446 |
|
C |
3,23 |
0,00668 |
|
HCl |
23,02 |
0,00167 |
|
NO |
24,70 |
0,001213 |
|
Na2O |
52,4 |
0,0317 |
|
NaCl |
34,88 |
0,02188 |
|
NaF |
33,32 |
0,02047 |
|
Al2O3 |
94,73 |
0,016814 |
|
CaCl2 |
63,70 |
0,0043995 |
|
KCl |
37,47 |
0,0074163 |
|
CaO |
40,57 |
0,0042252 |
|
K3PO4 |
184,85 |
0,003174 |
П р и м е ч а н и е. Для расчетов можно
принимать следующие приближенные
значенияaиb: для двухатомных компонентов продуктов
взрыва (N2,COи др.) –а=20 кДж/(кмольºС),b=0,0042
кДж/(кмольºС), а для трехатомных (СО2,
Н2О и др. ) – 26 и 0,0105 кДж/(кмольºС)
соответственно.
2.4.4. Определение давления взрыва. В
случае очень высокого давления, которое
в момент взрыва возникает в зарядной
камере (шпуре, скважине), плотность газов
взрыва близка к плотности жидкости.
Поэтому при определении давления газов
взрыва нельзя пренебрегать объёмом
молекул этих газов. Кроме того, при
взрыве ВВ, содержащих твёрдые добавки,
когда твёрдые компоненты образуются в
процессе химического превращения,
необходимо учитывать также объём
твёрдого остатка.
Обычно давление, Па, газов взрыва
рассчитывают по упрощённому уравнению
Ван-дер-Ваальса. Формула применительно
к взрыву 1 кг ВВ
,
(2.16)
где Р0– нормальное атмосферное
давление при температуре 0ºС, примерно
равное 1,01·105Па;
V0‘– объём газов взрыва
1 кг ВВ при нормальных условиях (при 0ºС
и давлении 1,01·105Па);
Т– температура взрыва ВВ, К;
V– объём зарядной камеры, м3;
– коволюм газов взрыва, т. е. несжимаемый
объём молекул газов взрыва, м3;
– объём твёрдых компонентов продуктов
взрыва 1 кг ВВ (твёрдый остаток), м3.
Величина определяется
размерами молекул газа и выражает собой
неупругий, несжимаемый объём, занятый
самими молекулами. Численное значениедостаточно точно
не установлено.
Для практических расчётов рекомендуются
следующие значения при плотности ВВ более 1 кг/дм3 = 0,0006V0‘;
до 1 кг/дм3–= 0,001V0‘.
Параметр вычисляется
по формуле
,
(2.17)
где nT1,nT2, … ,
nTn — число молей
твёрдых компонентов в продуктах взрыва;
m1,m2, …,mn
– масса твёрдых компонентов продукта
взрыва, г;
S1,S2,
… ,Sn
– физическая плотность твёрдых
компонентов, кг/м3.
Теплота
образования некоторых твёрдых продуктов
взрыва при нормальном давлении и
температуре 288 К, а также их плотность
приведёны в табл. 2.3.
Для упрощения расчётов целесообразно
объём зарядной камеры заменить в формуле
(2.17) плотностью заряжания:
Δзар =
mBB/V,
где mВВ — масса заряда ВВ, кг.
При взрыве 1 кг ВВ, т. е. для условий
расчёта давления
V= 1 / Δзар
,
Подставив значение Vв уравнение
Ван-дер-Ваальса (2.16) и сделав преобразования,
получим:
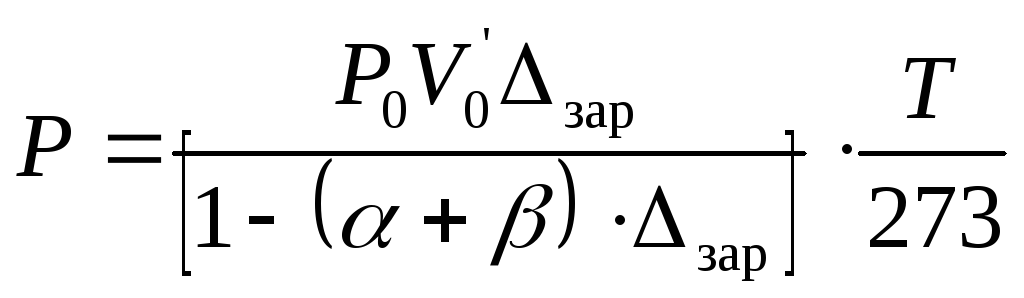
(2.18)
Таблица 2.3.
Физико-химические величины
продуктов взрыва (твёрдых компонентов)
-
Компоненты
продуктов взрываПлотность, кг/м3
Молярная теплота образования, кДж/кмоль
CaO
3370
635100
KCl
1980
436700
NaCl
2165
411100
Na2O
2390
418000
P2O5
2390
1507000
Al2O3
3900
1670200
Na3PO4
2536
1924600
CaCl2
2150
797440
Как следует из формулы (2.18), давление
газов взрыва ВВ, не содержащих в продуктах
взрыва твёрдых веществ (=0),
например, аммонита 6ЖВ, определится по
формуле:
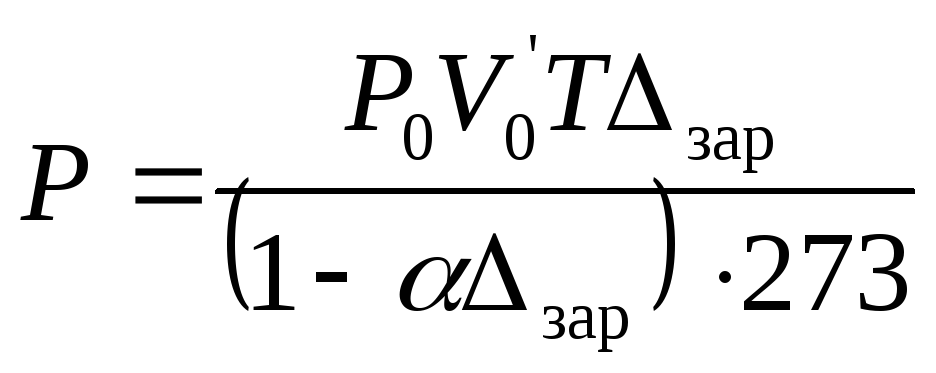
Плотность заряжания:
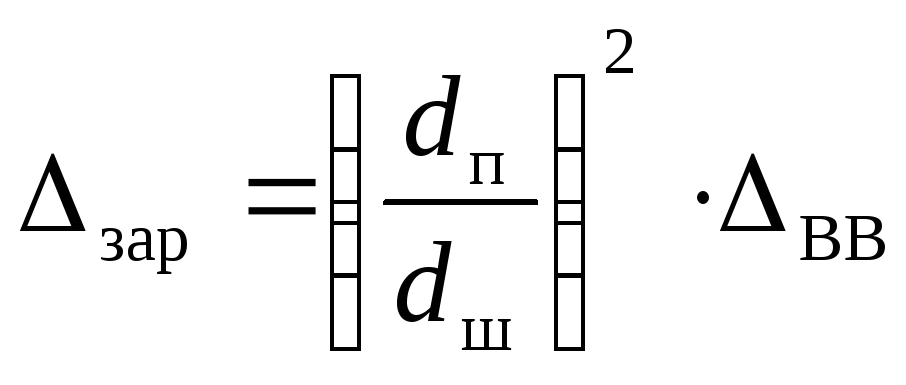
(2.19)
где dп– диаметр патронов
(заряда) ВВ, мм;
dш– диаметр зарядной камеры
(шпура), мм;
ВВ– плотность
патронирования ВВ, кг/м3.
Пример 1. Определить давление
продуктов взрыва аммонита 6ЖВ в зарядной
камере. Диаметр патронов ВВ – 32 мм,
диаметр шпура – 43 мм. Плотность ВВ –
1100 кг/м3. Остальные данные приведены
в подразделах 2.4.1– 2.4.3.
Решение.Для указанного диаметра
шпура подсчитаем плотности заряжания
по формуле (2.18)
кг/м3.
Определим давление газов взрыва по
формуле (2.20)
МПа.
Пример 2. Определить давление
продуктов взрыва аммонита Т-19 в зарядной
камере. Диаметр патронов ВВ – 36 мм,
диаметр шпура – 43 мм, плотность ВВ равна
1050 кг/м3, теплота взрыва – 3352·103Дж/кг, температура взрыва – 2503 К, удельный
объём газов взрыва – 0.724 м3/кг.
Реакция взрывного превращения имеет
вид
C5,859H34,685O28,897N17,76Na3,419Cl3,4193,419NaCl+ 17,3425H2O+ 8,88N2+ 4,6955CO2+ 1,1635CO
Решение.По формуле (2.19) определяем:
кг/м3.
По формуле (2.17) с учётом данных табл. 2.3
рассчитываем:
,
= 0,001V0‘= 72,4·10-5м3.
Подставив значение входящих параметров
в формулу (2.18), получим:
.
Выполним решение:
1. По условию задачи записываем уравнение:
2Na + 2H2O = 2NaOH + H2 — OBP, выделяется водород;
2. Вычисления:
M (Na) = m / M = 9,2 / 22,9 = 0,4 моль;
M (H2) = 2 г/моль.
3. Пропорция:
0,4 моль (Na) – X моль (Н2);
-2 моль — 1 моль отсюда, Х моль (Н2) = 0,4 * 1 / 2 = 0,2 моль.
4. Находим объём Н2:
V (H2) = 0,2 * 22,4 = 4,48 л.
Ответ: получен водород объёмом 4,48 л.