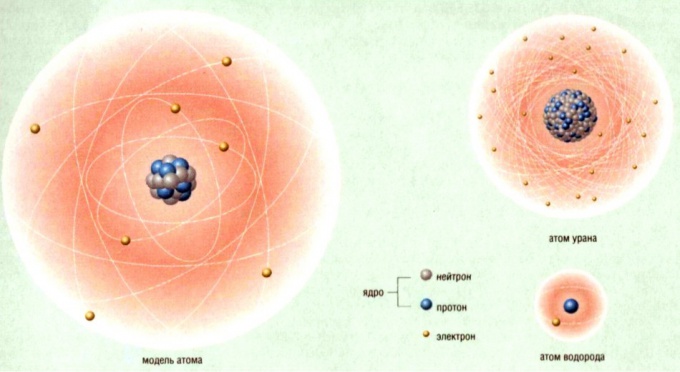
Как найти количество атомов в веществе
Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023.
Вам понадобится
- Для определения количества атомов в веществе возьмите точные весы (рычажные или электронные), таблицу Менделеева, манометр, термометр.
Инструкция
Определение количества атомов в чистом веществе
Взвесьте образец исследуемого вещества на точных весах, результат получите в граммах. Убедитесь, что оно состоит из одноатомных молекул. Затем, используя таблицу Менделеева, найдите молярную массу исследуемого вещества, выраженную в граммах на моль. Для этого найдите элемент, соответствующий веществу, из которого состоит тело, и запишите его молекулярную массу. Она и будет равна молярной массе, выраженной в граммах на моль. Например, для железа (Fe) это 55,845 г/моль. Если же точно известен изотоп, например железо 55, то можно брать целое число, правда, чистые изотопы зачастую радиоактивны. Затем массу вещества поделите на его молярную массу, а результат умножьте на 6,022*10^23. Это и будет количество атомов в данной массе вещества.
Количество атомов в сложном веществе
Если вещество состоит из многоатомных молекул, например, вода, молекула которой состоит из одного атома кислорода и двух атомов водорода, сделайте следующую последовательность действий. С помощью весов найдите массу образца. Затем запишите его химическую формулу, и с помощью таблицы Менделеева найдите молярную массу каждого из атомов, из которых состоит молекула. В случае с водой это будет водород – 1 грамм на моль, и кислород – 16 грамм на моль. Поскольку водорода 2 атома, умножьте молярную массу на это число, в результате получите общую молярную массу 18 грамм на моль. Затем массу в граммах делим на молярную массу в граммах на моль и умножаем на 6,022*10^23. Результатом будет количество молекул в веществе, это число умножьте на количество атомов в одной молекуле (для воды оно равно 3).
Количество атомов в смесях и сплавах
Если вещество представляет собой смесь нескольких веществ с известными массовыми долями, измерьте его общую массу. Затем найдите массы чистых веществ, умножив массу на соответствующие доли. Например, если бронза содержит 70% меди и 30 % олова, но для получения массы меди умножьте массу образца на 0,7, а для получения массы олова умножите массу образца на 0,3. Далее действуйте, как описано в предыдущих пунктах.
Количество атомов в газе
Если газ находится в нормальных условиях (давление 760 мм рт. ст. и температура 00С), определите объем этого газа геометрическими методами (например, чтобы найти объем газа в комнате, представляющей собой параллелепипед, перемножьте длину, ширину и высоту), выразив его в кубических метрах. Полученное число поделите на 0,0224 и умножьте на 6,022*10^23. Если молекула газа двухатомная, умножьте результат на 2.
Если известны давление, объем и температура газа (давление измеряется манометром, а температура термометром), то найдите произведение давления в Паскалях на объем в куб. метрах, поделите на значение температуры в Кельвинах, и число 8,31. Полученный результат умножьте на 6,022*10^23 и количество атомов в молекуле газа.
Видео по теме
Обратите внимание
Как найти количество атомов в веществе. Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023. Вам понадобится.
Полезный совет
Метод основан на связи между атомной (или молекулярной) массой кристаллического вещества, его плотностью, числом Авогадро и неким коэффициентом, который определяют из расстояний между атомами в кристаллической решетке. Зная это число, можно различными способами, которые и были испробованы в 1908-1910 гг., найти число N. Можно собрать α-частицы в цилиндре Фарадея, измерить их заряд и, разделив его на число частиц, получить заряд каждой из них; половина его дает нам элементарный заряд, по которому уже определяется число N…
Источники:
- как определить количество атомов
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Чтобы узнать число атомов в молекуле, достаточно знать молекулярную формулу вещества. После чего мы суммируем число всех атомов в молекуле. Число атомов конкретного химического элемента в веществе мы узнаем по нижнему индексу.
Среди простых веществ, в природе молекулы встречаются не так часто. Среди них: водород H2, азот N2, кислород O2, озон O3, йод I2. За исключением озона все эти молекулы содержат по 2 атома.
Примеры
Определить количество атомов в молекуле воды H2O.
Молекула воды содержит 2 атома водорода и 1 атом кислорода. Значит всего в молекуле содержится 3 атома.
Определить количество атомов в молекуле этана C2H6.
Молекула содержит 2 атома углерода и 6 атомов водорода. Всего в молекуле содержится 2 + 6 = 8 атомов.
Определить количество атомов в молекуле оксида азота (V) N2O5.
Молекула содержит 2 атома азота и 5 атомов кислорода. Всего в молекуле содержится 2 + 5 = 7 атомов.
Определить количество атомов в молекуле пищевой соды NaHCO3.
Молекула содержит 1 атом натрия, 1 атом водорода и 3 атома кислорода. Всего в молекуле содержится 1 + 1 + 3 = 5 атомов.
Определить число атомов в молекуле глюкозы C6H12O6.
Молекула содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Всего в молекуле содержится 6 + 12 + 6 = 24 атома.
Определить число атомов в молекуле аспаргина (одна из аминокислот) C4H8O3N2.
Как видим, молекула аспаргина содержит 4 атома углерода, 8 атомов водорода, 3 атома кислорода и 2 атома азота. Всего молекула содержит 4 + 8 + 3 + 2 = 17 атомов.
Как видим, рассчитать общее число атомов в молекуле не такая уж и сложная задача.
Число атомов, формула
Зная массу атома mа, можно вычислить число атомов в любой массе вещества.
Если
| N | число атомов определенного вещества, | |
|---|---|---|
| m | масса этого вещества, | кг |
| M | атомная масса, |
то, поскольку N = m/mа, получаем
[ N = frac{m}{M cdot 1 enspace а. е. м.} = frac{m}{M cdot 1.66057 cdot 10^{-27} enspace кг} ]
В большинстве случаев достаточно вместо точной атомной массы М в данной формуле использовать массовое число А.
Вычислить, найти число атомов в веществе по формуле 1
Число атомов |
стр. 738 |
|---|
An atom is an element. The two words are synonymous, so if you’re looking for the number of atoms in an element, the answer is always one, and only one. Scientists know of 118 different elements, which they categorize in the periodic table, a diagram that arranges them in increasing order according to the number of protons in their nuclei. This arrangement allows you to answer a significant question at a glance: «What is the number of protons in a particular element?» To answer that, you simply need to look at the place the element occupies in the chart. The place number corresponds to the number of protons.
TL;DR (Too Long; Didn’t Read)
If you have a sample that contains atoms of a single element, you can find the number of atoms by weighing it.
Elements That Form Diatomic Molecules
Some atoms can form covalent bonds with other atoms of the same element to form diatomic molecules. The best known is oxygen (O). A single oxygen atom is highly reactive, but when it forms a bond with another oxygen atom to form O2, the combination is more stable. This is the form in which oxygen exists in the earth’s atmosphere. Four other elements can combine in this way at standard temperature and pressure. They include nitrogen (N), which is the most abundant element in the atmosphere, hydrogen (H), chlorine (Cl) and fluorine (F). Two other elements, bromine (Br) and iodine (I), can form diatomic molecules at higher temperatures. All diatomic molecules contain two atoms.
Noble Gases and Metals
Some atoms, such as sodium and phosphorous, are so reactive that they are never found free in nature. However, two groups of elements, the noble gases and noble metals, are stable and can exist in samples that contain only non-bound atoms of that element. For example, a container full of argon gas (Ar) contains only argon atoms, and a bar of pure gold contains only gold (Au) atoms. If you have a large sample of a noble gas or metal, you can calculate how many atoms it contains by weighing it.
In addition to these gases and metals, carbon (C) can also exist in the free state. Diamond and graphite are the two most common forms. Among non-metals, carbon is unique in its ability to exist in this way.
Counting Atoms
To calculate the number of atoms in a sample, you need to find how many moles of the element the sample contains. A mole is a unit chemists use. It’s equal to Avogadro’s number (6.02 X 1023) of atoms. By definition, the weight of one mole of an element (its molar mass) is equal to its atomic weight in grams. The atomic weight for each element is on the periodic table right under the element’s symbol. The atomic weight of carbon is 12 atomic mass units (amu), so the weight of one mole is 12 grams.
If you have a sample that contains only atoms of a particular element, weigh the sample in grams and divide by the atomic weight of the element. The quotient tells you the number of moles. Multiply that by Avogadro’s number, and you’ll find out how many atoms the sample contains.
Examples
1. How many atoms are there in one ounce of pure gold?
An ounce is 28 grams, and the atomic weight of gold is 197. The sample contains 28 ÷ 197 = 0.14 moles. Multiplying this by Avogadro’s number tells you the number of atoms in the sample = 8.43 x 1022 atoms.
2. How many oxygen atoms are there in a gas sample that weighs 20 grams?
The same procedure applies to finding the number of atoms in a diatomic gas, even though the atoms have combined to form molecules. The atomic weight of oxygen is 16, so one mole weighs 16 grams. The sample weighs 20 grams, which is equal to 1.25 moles. Therefore, the number of atoms is 7.53 x 1023.
Совет 1: Как обнаружить число атомов в веществе
Дабы обнаружить число атомов в веществе, определите, что это за вещество. После этого обнаружьте его массу и молярную массу. Позже чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023.
Вам понадобится
- Для определения числа атомов в веществе возьмите точные весы (рычажные либо электронные), таблицу Менделеева, манометр, термометр.
Инструкция
1. Определение числа атомов в чистом веществе Взвесьте пример исследуемого вещества на точных весах, итог получите в граммах. Удостоверитесь, что оно состоит из одноатомных молекул. После этого, применяя таблицу Менделеева, обнаружьте молярную массу исследуемого вещества, выраженную в граммах на моль. Для этого обнаружьте элемент, соответствующий веществу, из которого состоит тело, и запишите его молекулярную массу. Она и будет равна молярной массе, выраженной в граммах на моль. Скажем, для железа (Fe) это 55,845 г/моль. Если же верно вестим изотоп, скажем сталь 55, то дозволено брать целое число, правда, чистые изотопы нередко радиоактивны. После этого массу вещества поделите на его молярную массу, а итог умножьте на 6,022*10^23. Это и будет число атомов в данной массе вещества.
2. Число атомов в трудном веществе Если вещество состоит из многоатомных молекул, скажем, вода, молекула которой состоит из одного атома кислорода и 2-х атомов водорода, сделайте следующую последовательность действий. С поддержкой весов обнаружьте массу примера. После этого запишите его химическую формулу, и с поддержкой таблицы Менделеева обнаружьте молярную массу всякого из атомов, из которых состоит молекула. В случае с водой это будет водород – 1 грамм на моль, и кислород – 16 грамм на моль. От того что водорода 2 атома, умножьте молярную массу на это число, в итоге получите всеобщую молярную массу 18 грамм на моль. После этого массу в граммах разделяем на молярную массу в граммах на моль и умножаем на 6,022*10^23. Итогом будет число молекул в веществе, это число умножьте на число атомов в одной молекуле (для воды оно равно 3).
3. Число атомов в смесях и сплавахЕсли вещество представляет собой смесь нескольких веществ с вестимыми массовыми долями, измерьте его всеобщую массу. После этого обнаружьте массы чистых веществ, умножив массу на соответствующие доли. Скажем, если бронза содержит 70% меди и 30 % олова, но для приобретения массы меди умножьте массу примера на 0,7, а для приобретения массы олова умножите массу примера на 0,3. Дальше действуйте, как описано в предыдущих пунктах.
4. Число атомов в газе Если газ находится в типичных условиях (давление 760 мм рт. ст. и температура 00С), определите объем этого газа геометрическими способами (скажем, дабы обнаружить объем газа в комнате, представляющей собой параллелепипед, перемножьте длину, ширину и высоту), выразив его в кубических метрах. Полученное число поделите на 0,0224 и умножьте на 6,022*10^23. Если молекула газа двухатомная, умножьте итог на 2.Если знамениты давление, объем и температура газа (давление измеряется манометром, а температура термометром), то обнаружьте произведение давления в Паскалях на объем в куб. метрах, поделите на значение температуры в Кельвинах, и число 8,31. Полученный итог умножьте на 6,022*10^23 и число атомов в молекуле газа.
Совет 2: Как определить число атомов
Вначале определите химический состав и агрегатное состояние вещества. Если изучается газ, измерьте его температуру, объем и давление либо разместите в типичные данные и измерьте только объем. Позже этого рассчитайте количество молекул и атомов . Для определения числа атомов в твердом теле либо жидкости обнаружьте их массу и молярную массу, а после этого количество молекул и атомов .
Вам понадобится
- манометр, термометр, весы и таблица Менделеева, узнать непрерывную Авогадро.
Инструкция
1. Определение числа атомов в газеС поддержкой манометра и термометра измерьте давление в Паскалях и температуру газа в Кельвинах. После этого геометрически определите объем газа в помещении либо посудине в кубических метрах. Позже этого перемножьте значения давления и объема и поделите на числовое значение температуры и число 8,31. Полученный итог умножьте на непрерывную Авогадро, которая равна 6,022*10^23.Если температура газа составляет 273,15 Кельвин (00С), а давление 760 мм.рт.ст., что является типичными условиями, довольно измерить объем газа, в котором определяется количество частиц в кубических метрах, поделить его на число 0,224 и умножить на 6,022*10^23. При обоих методах, если молекула газа многоатомная, умножьте полученное число на количество атомов в молекулах.
2. Определение числа атомов в твердом теле либо жидкости из чистого веществаНайдите массу исследуемого тела в граммах. Позже этого в таблице Менделеева обнаружьте молекулярную массу данного чистого вещества, которая будет равна его молярной массе, выраженной в граммах на моль. После этого значение массы поделите на молярную массу и умножьте на 6,022*10^23.
3. Число атомов в веществе с многоатомными молекуламиУзнайте химическую формулу вещества. После этого измерьте его массу в граммах. С поддержкой таблицы Менделеева узнайте молярную массу всего из элементов, которые входят в конструкцию молекулы исследуемого вещества. Скажем, для поваренной соли это натрий и хлор. Если в формуле не один атом одного элемента, умножьте молярную массу на их количество . Позже этого сложите все получившиеся массы – получите молярную массу данного вещества. Поделите массу вещества на его молярную массу и умножьте на 6,022*10^23. Полученное число умножьте на всеобщее число атомов в молекуле.
4. Определение числа атомов в смеси веществЕсли есть смесь, раствор либо расплав нескольких веществ, то узнайте их массовые доли в нем. После этого обнаружьте массы этих веществ. Скажем, в 10 % растворе поваренной соли содержится еще 90 % воды. Обнаружьте массу раствора, позже чего эту массу умножьте на 0,1, дабы узнать массу поваренной соли и на 0,9, дабы узнать массу воды. Позже этого действуйте как в пункте для веществ с многоатомными молекулами, а итоги по соли и воде сложите.
Видео по теме
Совет 3: Как обнаружить число атомов
Изредка перед изыскателями встает такая задача: как определить число атомов того либо другого вещества? Изначально она может показаться экстраординарно трудной, чай число атомов даже в крошечном примере какого-нибудь вещества легко колоссальное. Как же их подсчитать?
Инструкция
1. Представим, вам нужно подсчитать число атомов в куске чистого металла – скажем, железа, меди либо даже золота. Да, представьте себя на месте великого ученого Архимеда, которому царь Гиерон дал вовсе другое поручение, сказав: «Знаешь, Архимед, бесполезно я подозревал своего ювелира в мошенничестве, корона-то оказалась из чистого золота! Нашему царскому величеству сейчас желательно знать, сколько в ней золотых атомов».
2. Подлинного Архимеда задача, безусловно, ввергла бы в ступор, хоть он и был гением. Ну а вы совладали бы с нею в два счета. Вначале нужно верно взвесить корону. Представим, она весила бы ровно 2 кг, то есть 2000 граммов. Потом по таблице Менделеева установите молярную массу золота (приблизительно 197 грамм/моль.) Для облегчения расчетов чуть-чуть округлите в крупную сторону – пускай будет 200 грамм/моль. Следственно, в злополучной короне ровно 10 молей золота. Ну а потом возьмите универсальное число Авогадро (6,022х1023), умножьте на 10 и с пиршеством отнесите итог царю Гиерону.
3. Ну а если нужно подсчитать число атомов газа? Задача чуть труднее, но тоже легкорешаемая. Нужно только с довольной точностью измерить температуру, объем и давление газа.
4. А потом воспользуйтесь классно приятелем уравнением Менделеева–Клапейрона: PV = MRT/m. Обратите внимание, что M/m является ничем другим, как числом молей данного газа, от того что M – его фактическая масса, а m – молярная.
5. Подставьте вестимые вам величины в дробь PV/RT, обнаруженный итог умножьте на универсальное число Авогадро (6,022*1023) и получите число атомов газа при заданном объеме, давлении и температуре.
6. А если требуется подсчитать число атомов в примере трудного вещества? И здесь нет ничего особенно сложного. Взвесьте пример, потом напишите его точную химическую формулу, с поддержкой Таблицы Менделеева уточните молярную массу всякого компонента и вычислите точную молярную массу этого трудного вещества (учтя при необходимости индексы элементов).
7. Ну а потом узнайте число молей в исследуемом примере (поделив массу примера на молярную массу) и умножьте полученный итог на величину числа Авогадро.
Совет 4: Как обнаружить число молекул в газе
Молекула – это электрически нейтральная частица, владеющая всеми химическими свойствами, присущими данному определенному веществу. В том числе и газам: кислороду, азоту, хлору и т.д. Как дозволено определить число молекул газа?
Инструкция
1. Если вам нужно подсчитать, сколько молекул кислорода содержится в 320 граммах этого газа при типичных условиях, раньше каждого, определите, какое число молей кислорода заключено в этом числе. По таблице Менделеева, дозволено увидеть, что округленная ядерная масса кислорода – 16 ядерных единиц. От того что молекула кислорода – двухатомная, масса молекулы составит 32 ядерные единицы. Следственно, число молей 320/32 = 10.
2. Дальше вам поможет универсальное число Авогадро, названное в честь ученого, предположившего, что равные объемы безупречных газов при непрерывных условиях содержат идентичные числа молекул. Оно обозначается символом N(A) и дюже огромно – примерно составляет 6,022*10(23). Умножьте это число на вычисленное число молей кислорода и вы узнаете, что желанное число молекул в 320 граммах кислорода – 6,022*10(24).
3. А если вам знаменито давление кислорода, а также объем, занимаемый им, и температура? Как вычислить число его молекул при таких данных? И здесь нет ничего трудного. Нужно лишь записать универсальное уравнение Менделеева-Клапейрона для совершенных газов:PV = RTM/m Где P – давление газа в паскалях, V – его объем в кубических метрах, R – универсальная газовая непрерывная, M – масса газа, а m – его молярная масса.
4. Cлегка преобразуя это уравнение, вы получите:M = PVm/RT
5. От того что у вас есть все нужные данные (давление, объем, температура заданы первоначально, R = 8,31, а молярная масса кислорода = 32 грамма/моль), вы элементарно обнаружите массу газа при данном объеме, давлении и температуре. А дальше задача решается верно так же, как и в вышеописанном примере: N(A)M/m. Произведя вычисления, вы узнаете, сколько молекул кислорода содержится при заданных условиях.
6. Дозволено еще больше упростить решение, от того что в полученной дроби N(A)PVm/RTm молярные массы сокращаются, и остается: N(A)PV/RT. Подставив в формулу знаменитые вам величины, вы получите результат.
Видео по теме
Полезный совет
Ни один настоящий газ (включая кислород), безусловно же, не является совершенным, следственно уравнение Менделеева-Клапейрона дозволено применять для расчетов лишь при условиях, не дюже крепко отличающихся от типичных.
Совет 5: Как обнаружить число моль
В химических процессах участвуют мельчайшие частицы вещества – атомы, молекулы, ионы, электроны. Число таких частиц даже в дюже малом числе исследуемого примера исключительно крупно. Для того дабы избежать математических расчетов с большими числами, была введена особая единица – моль .
Вам понадобится
- – таблица Менделеева.
Инструкция
1. Моль – это количество вещества, содержащее в себе определенное число частиц (атомов, ионов, молекул), равное непрерывной Авогадро. Na = 6,02 Х 10 в 23 степени. Сама же непрерывная Авогадро определяется, как количество атомов, содержащееся в двенадцати граммах углерода.
2. Исходя из этого, дозволено рассчитать, какое количество молей содержится в веществе, если вам вестимо количество атомов либо молекул в нем. Данное значение нужно поделить на число Авогадро. К примеру, если в исследуемом примере имеется 12,04 х 10 в 23 степени молекул, то количество молей будет 2. Обозначается количество моль как n.
3. Молярная масса вещества (М) – это масса, которую имеет один моль этого вещества. Получить эти данные дозволено, пользуясь таблицей Менделеева. Для этого нужно сложить молярные массы всего элемента, рассматривая при этом имеющиеся показатели. К примеру, для метана CH4 молярная масса М будет равна 12 + 4 х 1 = 16. Измеряется данная величина в грамма, деленных на моль .
4. Для того дабы рассчитать моль , нужно помимо молярной массы знать и массу исследуемого примера. Последующие расчеты ведутся по формуле n = m/M, где m – масса вещества.
5. Если вы знаете концентрацию и объем раствора, дозволено обнаружить количество моль вещества, исходя из этих данных. Для этого вам нужно перемножить объем и концентрацию. Формула выглядит дальнейшим образом: n = c x V.
6. Если вы хотите высчитать количество молей, содержащихся в газе при типичных условиях (давлении, равном 101 325 Па, и температуре 273 К), вам нужно знать лишь объем газа. Формула в данном случае выглядит так: n = V/Vm. Vm – это молярный объем безупречного газа, непрерывная величина при типичных условиях. Равен молярный объем 22,4 литра/моль . Также нередко он измеряется в кубических дециметрах, деленных на моль .
Совет 6: Из чего состоит бронза
Бронза – металлический сплав, производимый на основе меди. При этом в качестве добавки к этому металлу при выплавке бронзы могут применяться разные металлы и другие компоненты.
Состав бронзы
Бронза – это обобщенное наименование группы металлических сплавов, всеобщей колляцией которых является применение меди в качестве основы для их изготовления. Во всех бронзовых сплавах медь играет основную роль, от того что ее доля в готовом материале традиционно составляет не менее 70%. Впрочем вследствие внесению добавок бронза приобретает добавочные свойства, скажем, становится не такой мягкой, как чистая медь. При этом в качестве добавок, то есть дополнительных компонентов бронзового сплава, изначально применялось олово, которое, однако, и по сегодняшний день остается особенно зачастую применяемым в этом качестве элементом.Такое широкое распространение именно оловянной бронзы стало следствием того, что данный вид сплава характеризуется высокой твердостью и прочностью, но при этом является касательно легкоплавким: температура его плавления составляет от 940 до 1140°C. Помимо того, дополнительным свойством оловянной бронзы, которое оказалось исключительно симпатичным для металлургической промышленности, оказалась невысокая степень ее усадки, достигаемой при плавке: она составляет лишь около 1%, что является гораздо больше низким показателем в сопоставлении с бронзой, изготовленной с использованием других добавок.Типичным рецептом оловянной бронзы является так называемая колокольная бронза, которая, как следует из наименования, применялась в том числе для изготовления колоколов. Он на 80% состоит из чистой меди, и еще на 20% – из олова. Впрочем в указанных пропорциях возможны незначительные колебания, величина которых не должна превышать 3%. Впрочем помимо олова в текущее время в качестве добавок к меди при производстве бронзы применяются и другие металлы. Так, существуют бронзовые сплавы, в которых для легирования используются алюминий, сталь, никель, кремний и другие металлы. При этом, впрочем, следует иметь в виду, что сплав меди с цинком не относится к категории бронзовых сплавов: для него существует особое наименование – латунь.
Использование бронзы
Одной из первых сфер, в которых бронза получила экстраординарно широкое распространение, стало производство оружия: изначально она использовалась в том числе для изготовления колюще-режущего оружия, впрочем после этого область ее использования сместилась в сторону оружия огнестрельного: скажем, вплотную до XIX столетия он служила основным материалом для производства пушек.Позднее областью применения бронзы стала предпочтительно культурная сфера. Так, оловянная бронза обширно использовалась для изготовления колоколов и других музыкальных инструментов. Помимо того, из нее изготавливались украшения, декоративные интерьерные элементы и сходственные изделия. Сегодня же бронза используется предпочтительно в машиностроении, где она служит материалом для изготовления деталей, испытывающих повышенную нагрузку в процессе эксплуатации.
Видео по теме
Обратите внимание!
Как обнаружить число атомов в веществе. Дабы обнаружить число атомов в веществе, определите, что это за вещество. После этого обнаружьте его массу и молярную массу. Позже чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023. Вам потребуется.
Полезный совет
Способ основан на связи между ядерной (либо молекулярной) массой кристаллического вещества, его плотностью, числом Авогадро и некоторым показателем, тот, что определяют из расстояний между атомами в кристаллической решетке. Зная это число, дозволено разными методами, которые и были попробованы в 1908-1910 гг., обнаружить число N. Дозволено собрать ?-частицы в цилиндре Фарадея, измерить их заряд и, поделив его на число частиц, получить заряд всей из них; половина его дает нам элементарный заряд, по которому теснее определяется число N…






