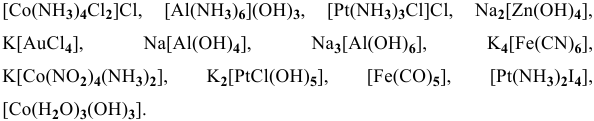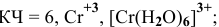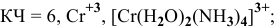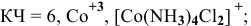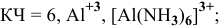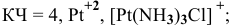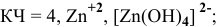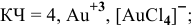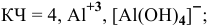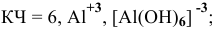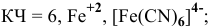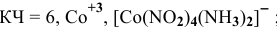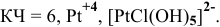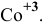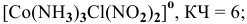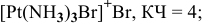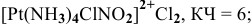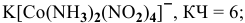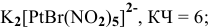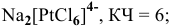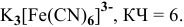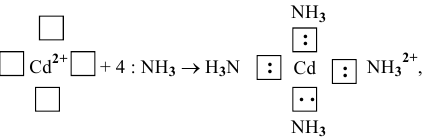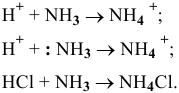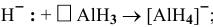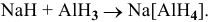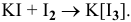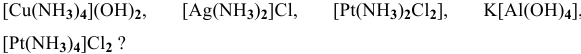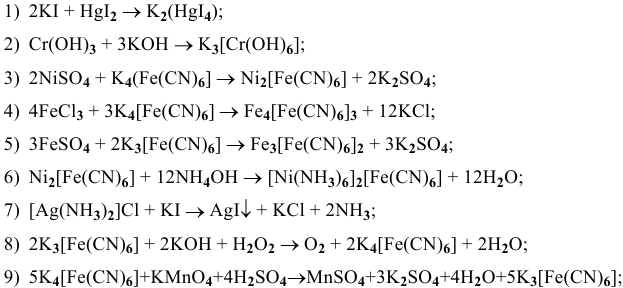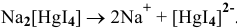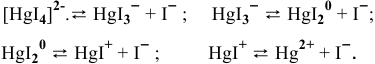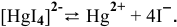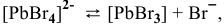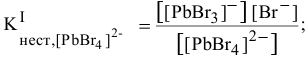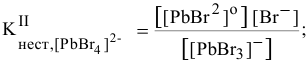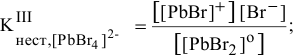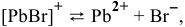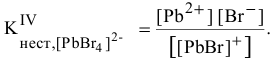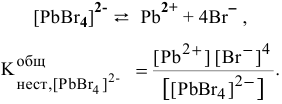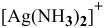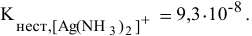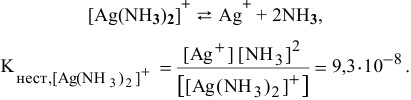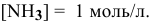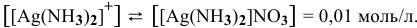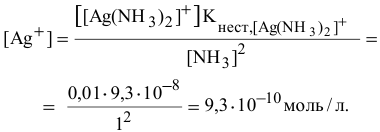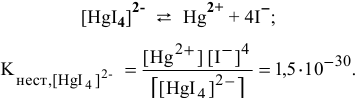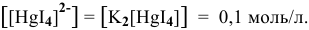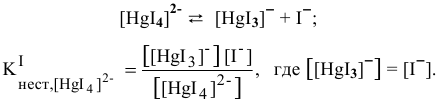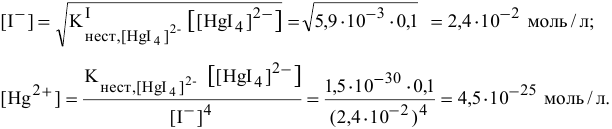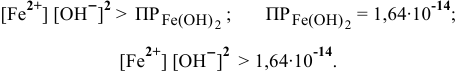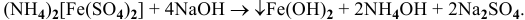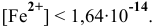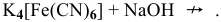-
Ионы противоположного знака, связанные с комплексным ионом, образуют внешнюю сферу.
-
Комплексный ион состоит из комплексообразователя и лигандов и образует внутреннюю сферу (внутреннюю сферу заключают в квадратные скобки).
Комплексообразователь – это d-элемент, имеющий на внешнем уровне достаточное количество свободных орбиталей (Cu+2, Ag+, Pt+4, Fe+2, Fe+3, Co+2, Co+3, Co+2)
Лиганды – это ионы и молекулы, имеющие свободные электронные пары (OH—, CN—, Cl—, NH3, H2O)
Координационное число (КЧ) — это число лигандов в комплексном ионе
Координационное число зависит:
-
от природы центрального атома;
-
заряда комплексообразователя;
-
условий образования комплексов.
Виды комплексов
Катионные
[Co(NH3)6]3+
Анионные
[CoF6]3-
Нейтральные
[Al (H2O)3(OH)3]
Соединения с комплексными анионами
K2[PtCl4] — тетрахлороплатинат (II) калия
Na2[Zn(OH)4] — тетрагидроксоцинкат натрия
Na[Cr(H2O)2F4] — тетрафтородиаквахромат (III) натрия
Соединения с комплексными катионами
[Ag(NH3)2]Cl – хлорид диамминсеребра
[Al(H2O)5OH]SO4 – сульфат гидроксопентаакваалюминия
[Pt(H2O)(NH3)2OH] NO3 – нитрат гидроксодиамминакваплатины (II)
Соединения без внешней сферы
[Al (H2O)3(OH)3] — тригидроксотриакваалюминий
[Pt(NH3)2Cl2] – дихлородиамминплатина (II)
[Co(NH3)3Cl3] – трихлоротриамминкобальт (III)
Номенклатура
-
в названиях комплексных ионов сначала указываются лиганды;
-
название комплексного иона завершается названием металла с указанием его степени окисления (римским цифрами в скобках);
-
в названиях комплексных катионов используются русские названия металлов;
-
в названиях комплексных анионов используются латинские названия металлов: Al –алюминат, Cr – хромат, Fe – феррат;
-
названия лигандов:
NH3 – аммин
H2O – аква
CO – карбонил
F— – фторо
Cl— – хлоро
CN— – циано
OH— – гидроксо
CNS— – тиоцианато
NO3— – нитрато
NO2— – нитро
-
Умножающие приставки:
2 — ди
3 – три
4 – тетра
5 – пента
6 – гекса
Примеры
K4[Fe(CN)6] – гексацианоферрат (II) калия (жёлтая кровяная соль)
K3[Fe(CN)6] – гексацианоферрат (III) калия (красная кровяная соль)
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия
[Ag(NH3)2]Cl – хлорид диамминсеребра (I)
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II)
[Cu(H2O)4]SO4 ∙ H2O – сульфат тетрааквамеди (II) (медный купорос)
Диссоциация ступенчатая
Na2[Zn(OH)4] →2Na+ + [Zn(OH)4]2-
(первая ступень – необратимо)
[Zn(OH)4]2- ↔ Zn2+ + 4OH—
(вторая ступень – обратимо)
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами. Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование гидроксокомплексов.
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4
Образование комплексных солей.
Если комплексообразователем является Fe2+ или Fe3+, то координационные числа в обоих случаях равны шести:
FeCl2 + 6KCN(изб) = K4[Fe(CN)6] + 2KCl
Fe2(SO4)3 + 12KCN(изб) = 2 K3[Fe(CN)6] + 3K2SO4
Координационные числа ртути и меди, как правило, равны четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
[Cu(NH3)4]SO4 + 4KCN(изб) = K2[Cu(CN)4] + 4NH3↑ + K2SO4
[Cu(NH3)4]SO4 + 4HCl = 4NH4Cl + CuSO4
-
-
- образования малодиссоциированного электролита:
-
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
-
-
- нагревания некоторых комплексных соединений:
-
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na[Al(OH)4] → NaAlO2 + 2H2O
-
-
- окислительно-восстановительных реакций:
-
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6] +Cr2(SO4)3 +4K2SO4 +7H2O
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например, в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-
Для комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+ → Ni2+ + 6NH3
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni2+]·[NH3]6 / [[Ni(NH3)6]2+] (1)
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн (2)
Она представляет собой константу равновесия процесса образования комплексного иона:
Ni2+ + 6NH3 ↔ [Ni(NH3)6]2+
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGTо = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3— в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2]+ = 5,7× 10— 8 при 298 К.
3) Величину ΔGo298 процесса диссоциации комплексного иона.
Решение:
1)
[Ag(NH3)2]NO3 = [Ag(NH3)2]+ + NO3—
[NO3— ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
[Ag(NH3)2]+ → Ag+ + 2NH3
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag+ и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2]+ составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
x = 1,43× 10— 10
Следовательно, [Ag+] = 1,43× 10— 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2]+ уравнением:
ΔGоT = — RTln Кн .
Значит, при Т = 298 К получаем:
ΔGо298 = — 8,314× 298× ln5,7× 10— 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10— 10, Кн.[Ag(NH3)2]+ = 5,7× 10— 8.
Решение. Осадок выпадет при условии: [Ag+][Сl— ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag+ и Сl— в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10-3, 1 и 0,25 М соответственно.
Найдем концентрацию [Ag+] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10— 10.
Значит, [Ag+] = 2,85× 10— 10 моль/л, а [Сl— ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag+][Сl— ] = 2,85× 10— 10× 0,25 = 7,1× 10— 11(моль/л)2.
Поскольку [Ag+][Сl— ] = 7,1× 10— 11 < 1,73× 10— 10, то осадок не выпадет.
Задача 3. При какой концентрации ионов S2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10— 27, Кн[Cd(CN)4]2- = 7,8× 10— 18.
Решение. Осадок выпадет при условии: [Cd2+][S2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd2+ и S2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S2-] > ПР(CdS):[Cd2+].
Na2[Cd(CN)4] = [Cd(CN)4]2- + 2Na+
Комплексный ион диссоциирует незначительно:
[Cd(CN)4]2- → Cd2+ + 4CN—
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd2+ и 4x моль/л ионов CN— . Суммарная концентрация ионов CN— равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4]2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4]2- = [Cd2+ ] · [CN—]4/ [[Cd(CN)4]2-]
x = 1,8·10— 12 .
Следовательно, [Cd2+] = 1,8·10— 12 моль/л.
Выпадение осадка начнется при [S2- ] > 7,9·10— 27: 1,8·10— 12 > 4,39·10— 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2],
[Cu(NH3)4](NO3)2,
[Cu(H2O)4]SO4
|
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия; [Cu(NH3)4](NO3)2 – нитрат тетраамминмеди (II); [Cu(H2O)4]SO4 – сульфат тетрааквамеди (II); |
2. Назовите следующие комплексные соединения
[Co(H2O)3Cl3],
[Ni(NH3)6][PtCl4].
|
[Co(H2O)3Cl3] – трихлоротриаквакобальт (III); [Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II). |
3. Составьте уравнение химической реакции:
Cr2(SO4)3 + NaOH (изб.)→
4. Составьте уравнение химической реакции:
Cd(NO3)2 + Na2SO3 (изб.)→
5. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 + Na2S →
6. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 -t→
7. Составьте уравнение химической реакции:
K4[Fe(CN)6] + Н2O2 + H2SO4 →
8. Сколько граммов серебра содержится в виде ионов в 0,04М растворе K[Ag(CN)2], содержащем в избытке 1,3 г KCN в 1 л раствора. Константа нестойкости иона [Ag(CN)2] — равна 1,4·10— 20.
9. Произойдет ли осаждение сульфида ртути, если к 1 л 0,3 М раствора K2[HgI4], содержащему избыточных 0,01 моль KI, добавить 1·10— 4 моль K2S? ПР(HgS) = 1,6·10— 52, Кн [HgI4]2- = 1,5·10— 31.
10. При какой концентрации ионов Cl— начнется выпадение осадка AgCl из 0,6М раствора [Ag(NH3)2]NO3, содержащего 1,2 моль/л избыточного аммиака, если ПР(AgCl) = 1,73·10—10, Кн [Ag(NH3)2]+ = 5,7·10— 8.
Рассмотрим
сначала строение гидроксо-комплексных
солей.
Гидроксокомплексные
соли характерны для амфотерных металлов,
например, Zn, Al, Cr, Pb, Be и других. В своём
составе гидроксо-комплексные соли
содержат два разных металла, один из
которых амфотерный (входит во внутреннюю
сферу комплексной соли), а другой не
амфотерный (входит во внешнюю сферу
комплексной соли) и несколько гидроксо-групп
( ОН — гидроксо-группа ). Число гидроксо-групп,
называется координационным ( КЧ ) и
определяется свойствами атома
комплексообразователя (амфотерного
металла). Для наиболее часто встречающихся
гидроксо-комплексных солей КЧ
атомов-комплексообразователей имеют
значения:
-
Координационные
числа атомов-комплексообразователей
( КЧ ):Zn:
4Be:
4Pb:
4Al:
4, 6Cr:
4, 6
-
Пример
1: тетрагидроксоцинкат калия
— K2[Zn(OH)4]А
том-комплексообразователь
d-элемент — Zn(
записывается первымвнутри
квадратных скобок )Координационное
число ( КЧ ) —число
лигандов, — групп атомов, связанныхс
атомом комплексообразователем вовнутренней
сфере комплексной соли.K2[Zn(OH)4]
В
нешняя
сфера комплексной соли —металл
калий: К(
за квадратными скобками )Внутренняя
сфера комплексной соли —амфотерный
металл цинк: Znи
четыре ОН — группы(
внутри квадратных скобок )
-
Пример
2: гексагидроксохромат натрия
— Na3[Cr(OH)6]А
том-комплексообразователь
d-элемент — Cr(
записывается первымвнутри
квадратных скобок )Координационное
число ( КЧ ) —число
лигандов, — групп атомов, связанныхс
атомом комплексообразователем вовнутренней
сфере комплексной соли.Na3[Cr(OH)6]
В
нешняя
сфера комплексной соли —металл
натрий: Na(
за квадратными скобками )Внутренняя
сфера комплексной соли —амфотерный
металл хром: Crи
шесть ОН — групп(
внутри квадратных скобок )
¾
15 ¾
§ 6. Как составить формулу комплексной соли по названию ?
Правила
составления формул комплексных солей
по названию.
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Пример
1: тетрагидроксоцинкат калияН
азвание
цинкат
означает,
чтоатом-комплексообразователь
— цинк: ZnЕго
записывают первымвнутри
квадратных скобок.Приставка
ТЕТРА означает, чтогидроксо-групп
четыреИх
берут в скобки и пишут индекс 4 за
скобкойK[Zn(OH)4]
С
лово
КАЛИЯ означает, что слева отквадратной
скобки надозаписать
символ калия: КНазвание
ГИДРОКСО означает, что справа откомплесообразователя
— цинка ( Zn )находятся
ОН — группы.
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и численно равен валентности металла.
Заряд ОН группы равен ( — 1 ):
-
В
алентность
цинка равна II ( постоянная ),поэтому,
заряд атома цинка равен ( + 2 )Заряд
ОН группы всегда равен ( -1 )+1 +2 -1
K[Zn(OH)4]
Валентность
калия
равна
I ( постоянная ),поэтому,
заряд атома калия равен ( + 1 )
3)
Формула комплексной соли делится на
две части: первая часть — внешняя сфера
(металл за квадратными скобками); вторая
часть — внутренняя сфера ( металл с ОН
группами внутри квадратных скобок).
Посчитайте суммы зарядов в составных
частях (за квадратными скобками и внутри
них).
-
П
ервая
часть: металл калий — К+1
К
Заряд
первой части равен: +1+1 +2 -1
K[Zn(OH)4]
+1 -2
Вторая
часть:внутренняя
сфера комплексного соединения+2
-1[Zn(OH)4]
+2 + (-1) • 4 = — 2
Заряд
второй части равен: -2
4)
Суммарный заряд всех составных частей
молекулы равен 0. Пользуясь этим определите
и проставьте индексы в формулу так,
чтобы эта закономерность была выполнена.
-
П
ервая
часть: металл калий — КЗаряд
первой части равен:+1
+1 +2 -1
K2[Zn(OH)4]
+1•2 + (-2) = 0
Вторая
часть:внутренняя
сфера комплексного соединения+2
-1[Zn(OH)4]
+2 + (-1) • 4 = — 2
Заряд
второй части равен: -2
Ч
тобы
сумма зарядов составных частей стала
равна 0, необходимо увеличить положительный
заряд. Для этого число атомов калия
должно быть равно 2. Этот индекс надо
поставить в формулу справа внизу от
атома калия.
¾
16 ¾
-
Пример
2: тетрагидроксоалюминат натрияН
азвание
АЛЮМИНат
означает,
чтоатом-комплексообразователь
— алюминий: AlЕго
записывают первымвнутри
квадратных скобок.Приставка
ТЕТРА означает, чтогидроксо-групп
четыреИх
берут в скобки и пишутиндекс
4 за скобкойNa[Al(OH)4]
Слово
НАТРИЯ означает, что слева отквадратной
скобки надозаписать
символ натрия: NaНазвание
ГИДРОКСО означает, что справа откомплесообразователя
— алюминия ( Al )находятся
ОН — группы.
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и численно равен валентности металла.
Заряд ОН группы равен ( — 1 ):
-
В
алентность
алюминия равна III(
постоянная ),поэтому,
заряд атома алюминия равен ( + 3 )Заряд
ОН группы всегда равен ( -1 )
+1 +3 -1
Na[Al(OH)4]
Валентность
натрия равна I ( постоянная ),поэтому,
заряд атома натрия равен ( + 1 )
3)
Формула комплексной соли делится на
две части: первая часть — внешняя сфера
(металл за квадратными скобками); вторая
часть — внутренняя сфера ( металл с ОН
группами внутри квадратных скобок).
Посчитайте суммы зарядов в составных
частях (за квадратными скобками и внутри
них).
-
П
ервая
часть: металл натрий — Na+1
Na
Заряд
первой части равен: +1+1 +3 -1
Na[Al(OH)4]
+1 -1
Вторая
часть:внутренняя
сфера комплексного соединения+3
-1[Al(OH)4]
+3 + (-1) • 4 = — 1
Заряд
второй части равен: -1
4)
Суммарный заряд всех составных частей
молекулы равен 0. Пользуясь этим определите
и проставьте индексы в формулу так,
чтобы эта закономерность была выполнена.
-
П
ервая
часть: металл натрий — NaЗаряд
первой части равен:+1
+1 +3 -1
Na[Al(OH)4]
+1 • 1 + (-1) = 0
Вторая
часть:внутренняя
сфера комплексного соединения+3
-1[Al(OH)4]
+3 + (-1) • 4 = — 1
Заряд
второй части равен: -1
Cумма
зарядов составных частей равна 0, поэтому,
индексы ставить не требуется.
¾
17 ¾
-
Пример
3: гексагидроксохромат (III) натрияН
азвание
ХРОМат
означает,
чтоатом-комплексообразователь
— хром: CrЕго
записывают первымвнутри
квадратных скобок.Приставка
ГЕКСА означает, чтогидроксо-групп
ШеСТЬИх
берут в скобки и пишутиндекс
6 за скобкойNa[Cr(OH)6]
Слово
НАТРИЯ означает, что слева отквадратной
скобки надозаписать
символ натрия: NaНазвание
ГИДРОКСО означает, что справа откомплесообразователя
— хрома ( Cr )находятся
ОН — группы.
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и численно равен валентности металла.
Заряд ОН группы равен ( — 1 ):
-
В
алентность
хрома равна III(
указана в названии ),поэтому,
заряд атома хрома равен ( + 3 )Заряд
ОН группы всегда равен ( -1 )+1 +3 -1
Na[Cr(OH)6]
Валентность
натрия равна I ( постоянная ),поэтому,
заряд атома натрия равен ( + 1 )
3)
Формула комплексной соли делится на
две части: первая часть — внешняя сфера
(металл за квадратными скобками); вторая
часть — внутренняя сфера ( металл с ОН
группами внутри квадратных скобок).
Посчитайте суммы зарядов в составных
частях (за квадратными скобками и внутри
них).
-
П
ервая
часть: металл натрий — Na+1
Na
Заряд
первой части равен: +1+1 +3 -1
Na[Cr(OH)6]
+1 -3
Вторая
часть:внутренняя
сфера комплексного соединения+3
-1[Cr(OH)6]
+3 + (-1) • 6 = — 3
Заряд
второй части равен: -3
4)
Суммарный заряд всех составных частей
молекулы равен 0. Пользуясь этим,
определите и проставьте индексы в
формулу так, чтобы эта закономерность
была выполнена.
-
П
ервая
часть: металл натрий — NaЗаряд
первой части равен:+1
+1 +3 -1
Na3[Cr(OH)6]
+1•3 + (-3) = 0
Вторая
часть:внутренняя
сфера комплексного соединения+3
-1[Cr(OH)6]
+3 + (-1) • 6 = — 3
Заряд
второй части равен: -3
Ч
тобы
сумма зарядов составных частей стала
равна 0, необходимо увеличить положительный
заряд. Для этого число атомов натрия
должно быть равно 3. Этот индекс надо
поставить в формулу справа внизу от
атома натрия.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Способы получения кислых солей
1. Кислые соли образуются при взаимодействии средних солей с кислотами.
Например, если к раствору сульфата натрия добавить раствор серной кислоты, из полученного раствора можно выкристаллизовать гидросульфат натрия:
Нерастворимые в воде природные карбонаты (известняк и другие) в присутствии воды и углекислого газа (угольной кислоты) превращаются в растворимые гидрокарбонаты.
Например, карбонат кальция превращается в гидрокарбонат:
.
В результате этой химической реакции возрастает жёсткость природной воды, обусловленная присутствием растворимых солей кальция и магния, образуются карстовые пещеры, а также происходит разрушение коралловых рифов.
Видеофрагмент:
Взаимопревращение карбонатов и гидрокарбонатов
2. Кислые соли образуются при неполной нейтрализации многоосновных кислот.
Например, при взаимодействии гидроксида натрия с серной кислотой в соотношении количества вещества (1 : 1) образуется гидросульфат натрия:
NaOH+H2SO4→NaHSO4+H2O
.
Если гидроксид кальция взаимодействует с фосфорной (ортофосфорной) кислотой в
соотношении количества вещества (1 : 2), образуется дигидрофосфат кальция:
CaOH2+2H3PO4→CaH2PO42+2H2O
.
3. Кислые соли образуются при действии избытка кислотного оксида на основание.
Например, если гидроксид натрия реагирует с оксидом углерода((IV)) в соотношении количества вещества (1 : 1), образуется гидрокарбонат натрия:
Способы получения основных солей
1. Основные соли образуются при взаимодействии щелочей с растворимыми в воде солями.
Например, если смешать растворы хлорида кальция и гидроксида кальция, из полученного раствора можно выкристаллизовать гидроксохлорид кальция:
CaOH2+CaCl2→2CaOHCl
.
2. Основные соли образуются при взаимодействии избытка основания с кислотой.
Например, гидроксохлорид кальция образуется при неполной нейтрализации гидроксида кальция соляной кислотой:
CaOH2+HCl→CaOHCl+H2O
.
3. Гидроксокарбонат меди((II)), свинца((II)), цинка и некоторых других металлов образуется при взаимодействии растворов солей этих металлов с растворами карбонатов.
Например, при взаимодействии раствора сульфата меди((II)) (медного купороса) с раствором карбоната натрия (соды) образуется осадок гидроксокарбоната меди:
.
Видеофрагмент:
Получение основного карбоната меди
Получение комплексных солей
1. Комплексные соли образуются при действии растворов щелочей на амфотерные гидроксиды.Например, при действии раствора гидроксида калия на гидроксид цинка образуется тетрагидроксоцинкат калия:
2KOH+ZnOH2→K2ZnOH4
.
При действии разбавленного раствора гидроксида натрия на гидроксид алюминия образуется тетрагидроксоалюминат натрия:
2. Ещё один способ получения комплексных солей — действие растворов щелочей на амфотерные оксиды.
Например, при действии раствора гидроксида натрия на оксид цинка образуется тетрагидроксоцинкат натрия:
Комплексные соли образуются также при растворении в щёлочи цинка или алюминия.
Одним из продуктов реакции в этом случае является водород:
,
.
Комплексные соединения
Задача 107
Назвать следующие комплексные соединения. Определить координационное число, заряд комплексообразователя и заряд внутренней сферы: 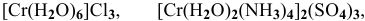
Решение:
а) Катионные комплексы:
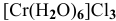
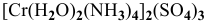
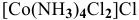
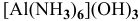
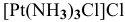
б) Анионные комплексы:
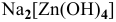
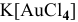
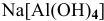
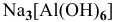
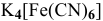
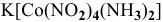
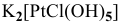
в) Нейтральные комплексы: 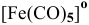
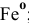
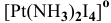
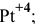
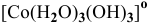
Задача 108
Написать формулы следующих комплексных соединений по их названиям. Определить координационное число и заряд внутренней сферы.
Решение:
Далее приводятся одновременно названия комплексных соединений и их формулы:
1) трихлоромононитродиамминплатина — 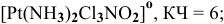
2) динитромонохлоротриамминкобальт —
3) монобромотриамминплатина(П) бромид —
4) монохлоромононитротетраамминплатина(1У) хлорид —
5) гексаамминжелеза(Ш) иодид — 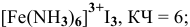
6) тетранитродиамминкобальтат(Ш) калия —
7) монобромопентанитроплатинат (1V) калия —

9) гексацианоферрат(Ш) калия —
Задача 109
Применив метод валентных схем, найти координационное число 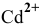
Решение:
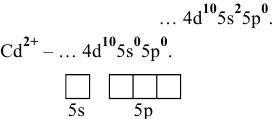
Электронная конфигурация атома 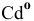
Для катиона
Обладая 4 свободными квантовыми ячейками, катион 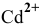
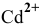
Например:
т.е.
Аналогично:
Задача 110
Обладая какой степенью окисления, водород может входить в состав комплексных ионов ?
Решение:
В состоянии окисления +1 водород может играть роль акцептора электронной пары, значит, он может образовывать комплекс, играя роль лиганда, с комплексообразователем, играющим роль донора, т.е. имеющим свободную электронную пару, например:
В состоянии окисления -1 водород должен играть роль донора, например:
Задача 111
Почему растворимость иода выше в растворе KI, чем в воде?
Решение:
Более высокая растворимость иода в водном растворе KI по сравнению с растворимостью в воде объясняется образованием комплекса 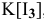
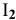
Задача 112
Исходя из каких веществ и каким способом можно получить следующие комплексные соединения: 
Решение:
1) 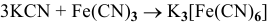
2) 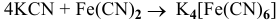
3) 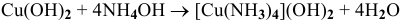
4) 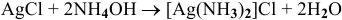
5) 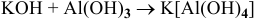
6) 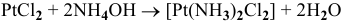
7) 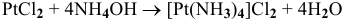
Задача 113
Составить и уравнять следующие схемы реакции.
Решение:
Далее приводятся уже составленные и уравненные химические реакции:
Задача 114
Написать уравнения электролитической диссоциации следующих комплексных соединений: 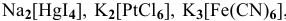
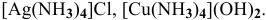
Пример решения: Комплексная соль 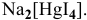
Комплексное соединение диссоциирует на ион внутренней сферы и ионы внешней сферы как сильный электролит:
Комплексный ион диссоциирует как слабый электролит — диссоциация ступенчатая:
Суммарное уравнение диссоциации комплексного иона следующее:
Задача 115
Написать математическое выражение констант нестойкости следующих комплексных ионов: 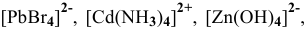
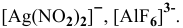
Пример решения: Для комплексного иона 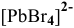
I ступень
II ступень 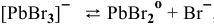
III ступень 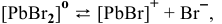
IV ступень
Суммарное уравнение диссоциации комплексного иона:
Задача 116
Рассчитать концентрацию ионов 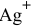
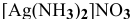
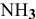
Решение:
Константа нестойкости комплексного иона
Суммарное уравнение его диссоциации:
Концентрация ионов, создаваемая диссоциацией комплексного иона, ничтожна по сравнению с созданной концентрацией 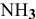
Предположив, что диссоциация комплексной соли на комплексный ион и ионы внешней сферы протекает полностью, находим концентрацию иона по формуле
Находим концентрацию ионов серебра:
Задача 117
Рассчитать концентрацию ионов 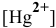
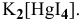
Решение:
Суммарное уравнение диссоциации 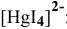
Предположив, что диссоциация комплексной соли на комплексный ион и ионы внешней сферы протекает полностью, находим концентрацию комплексного иона по формуле
Концентрацию ионов 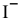
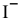
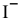
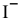
Отсюда
Задача 118
Можно ли получить осадок 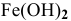
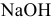
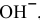
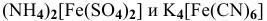
Решение:
Осаждение малорастворимого соединения начинается тогда, когда достигается величина произведения растворимости. Необходимое условие осаждения 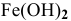
Так как [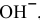
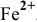
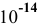
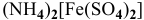
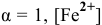
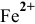
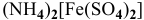
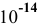
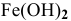
Для комплексной соли 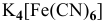
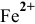
Таким образом, осаждение 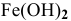
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны: