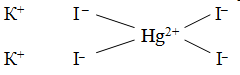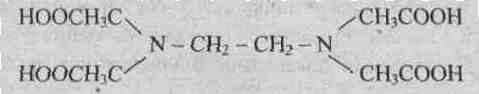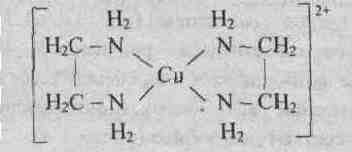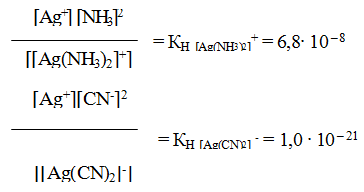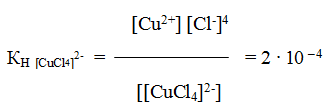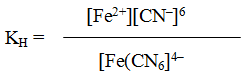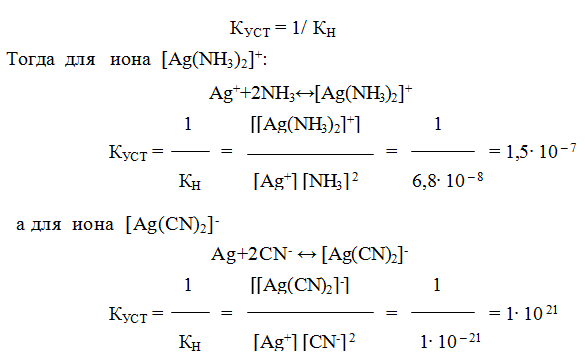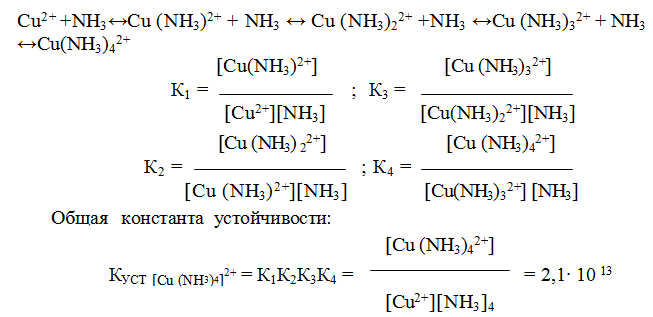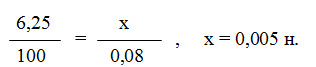Комплексные соединения
Общая химия. Учебное пособие — Таирова А.Р., Кузнецов А.И. — 2005
- 9.1. Определение комплексных соединений
- 9.2. Комплексообразователи
- 9.3.Лиганды
- 9.4. Номенклатура комплексных соединений
- 9.5. Диссоциация комплексных соединений
- 9.6. Константы устойчивости комплексов
- 9.7.Роль комплексных соединений
- 9.8. Комплексонометрия. Жесткость воды
9.1. Определение комплексных соединений. Такие соединения, как оксиды, кислоты, основания, соли образованы из атомов в результате возникновения между ними химической связи. Это соединения обычные, или соединения первого порядка.
Однако имеются вещества, которые образованы в результате соединения друг с другом нейтральных молекул без возникновения новых связующих электронных пар. Например:
K2S04 + A12 (S04)3 = K2S04·AI2 (SО4)3 = 2KA1 (SO4)2
CuSO4 + 5H2O = CuSO4 · 5H2O
CuS04 + 4NH3 = CuSО4·4NH3 = [Cu (NH3)4] SO4
Fe (CN)3 + 3KCN = Fe (CN)3·3KCN = K3 [Fe (CN)6]
HgI2 + 2KI = HgI2·2KI = K2[HgI4]
Это молекулярные соединения, или соединения высшего порядка. Одни из них диссоциируют в водном растворе на простые ноны, например:
КА1 (SО4)2 ↔ K+ + А13+ + 2 SО42 —
другие — на сложные (комплексные) ионы, состоящие, в свою очередь, из более простых ионов, как, например:
К3 [Fe (CN)6] ↔ЗК + + [Fe (CN)6]3-
Молекулярные соединения, образующие комплексные ионы, способные к существованию как в растворе, так и в кристалле, называют комплексными. Но такое определение применимо лишь в известных пределах. Оно не охватывает соединений типа неэлектролитов, например карбонилов металлов —Ni(CO)4 и др., а потому не является и полным.
Чтобы объяснить, почему происходит присоединение одних простых молекул к другим, швейцарский химик А. Вернер ввел понятие о главной и побочной валентности. Тогда образование, скажем, K2[HgI4] можho представить так: ион ртути за счет своей главной валентности (обозначается сплошной линией), равной двум, присоединяет два иодид-иона, а за счет побочной — (обозначается пунктиром) — дополнительно еще два иодид-иона. По Вернеру, это может быть изображено формулой
В настоящее время главную валентность надо объяснить ионной или ковалентной связью, а побочную – ковалентной связью, возникшей по донорно-акцепторному механизму (см. раздел 4.8.2.). Исходя из механизма образования комплексных соединений, им можно дать более точное, не имеющее исключений определение: комплексные соединения – это соединения, характеризующиеся наличием хотя бы одной ковалентной связи, возникшей по донорно-акцепторному механизму.
Комплексообразование происходит во всех случаях, когда из менее сложных систем образуются системы более сложные. Согласно координационной теории А. Вернера в структуре комплексного соединения различают координационную (внутреннюю) сферу, состоящую из центральной частицы – комплексообразователя (ион или атом) – и окружающих ее лигандов (ионы противоположного знака или молекулы). Ионы, находящиеся за пределами координационной сферы, образуют внешнюю сферу комплексного соединения. Число лигандов вокруг комплексообразователя называется его координационным числом. Внутренняя сфера (комплекс) может быть анионом, катионом и не иметь заряда. Например, в комплексном соединении K3[Fe(CN)6] внешняя сфера – 3К+, внутренняя сфера [Fe(CN)6]3-, где Fe3+ — комплексообразователь, a 6CN – лиганды, причем, 6 – координационное число. Таким образом, комплексное соединение (как правило) в узлах кристаллической решетки содержит комплекс, способный к самостоятельному существованию и в растворе.
9.2. Комплексообразователи. Комплексообразователями служат атомы или ионы, имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением заряда иона и уменьшением его размера. К наиболее распространенным комплексообразователям относятся ионы d-элементов VII, VIII, I и II групп периодической таблицы элементов.
9.3.Лиганды. К числу лигандов относятся простые анионы, такие как F— , СI—, Вr—, I—, S2-, сложные анионы, например CN– , NCS – , NO2—) , молекулы, например Н2О, NH3, C. Ионы или отдельные атомы ионов и молекул лигандов имеют неподеленные пары электронов. В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды, они подразделяются на монодентантные (одна орбиталь), например NН3, СI—, бидентантные, например N2H4или En, полидентантные, например этилендиаминтетрауксусная кислота (ЕДТА), являющаяся шестидентантным лигандом
Динатриевая соль ЕДТА и сама кислота относятся к классу соединений, называемых комплексонами. Би- и полидентантные лиганды при взаимодействии с комлексообразователями образуют замкнутые циклы, называемые хелатными, поэтому и комплексы с би- и полидентантными лигандами называют хелатными (или клешневидными), например
Пример 1. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях: a) K4[Fe(CN)6]; б) Na[Ag(NO2)2]; в) K2[MoF8]; г) [Сr(Н2O)2(NН3)3С1]С12.
Решение. Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (H2O, NН3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
| Заряд иона | К.ч. | Степень окисления | |
| а) | -4 | 6 | +2 |
| б) | -1 | 2 | +1 |
| в) | -2 | 8 | +6 |
| г) | +2 | 6 | +3 |
9.4. Номенклатура комплексных соединений. Название комплексного катиона записывается одним словом, начинающимся с названия отрицательного лиганда с прибавлением буквы «о», затем приводятся нейтральные молекулы и центральный атом с указанием римской цифрой его степени окисления для металлов переменной валентности. Для молекул Н2О (аква), NН3 (аммин), СО (карбонил), NO (нитрозил) даются особые названия, указанные в скобках.
Число лигандов обозначают греческими приставками (ди-, три-, тетра- и т.д.) или бис-, трис-, тетракис-, пентакис- и гексакис- для 2, 3, 4, 5 и 6 соответственно у сложных лигандов. Например, соединение [Zn(NH3)2Cl]CI называется хлорид хлородиамин цинка (II), а [Ni(En)2]Cl2 – хлорид бис(этилендиамин) никеля (II).
Комплексный анион записывается аналогично названию катиона, но с добавлением суффикса -«am» к названию комплексообразователя, например K2[Zn(CN)4] — тетрацианоцинкат (II) калия. Нейтральный комплекс записывается подобно катиону, например комплекс [Ni(CО)4] называется тетракарбонил никеля (II). Соответственно по типу лигандов комплексы называют аквакомплексы (лиганд Н2О), аминокомплексы (лиганд NH3), ацидокомплексы (лиганды анионы кислот), комплексонатные комплексы (лиганды-комплексоны) и т.д.
9.5. Диссоциация комплексных соединений. Комплексные соединения — неэлектролиты в водных растворах диссоциации не подвергаются. У них отсутствует внешняя сфера комплекса, например: [Zn(NH3)2Cl2], [Co(NH3)3(NO3)3], [Pt (NH3)2C12]. В водной среде такие молекулы гидратируются как единое образование.
Комплексные соединения — электролиты при диссоциации в водных растворах образуют комплексные ионы, например:
[Ag (NH3)2] CI ↔[Ag (NH3)2]+ +С1– ; К [Ag (CN)2 ↔K+ + [Ag (CN)2]—
Такая диссоциация протекает полностью, ионы гидратируются. Комплексные ионы в свою очередь подвергаются вторичной диссоциации:
[Ag(NH3)2]+ ↔Ag++2NH3 (a)
[Ag (CN)2] — ↔ Ag+ +2CN— (б)
Однако эта диссоциация обычно протекает в незначительной степени. Применяя закон действующих масс к обратимым процессам (а) и (б), получаем выражения констант нестойкости комплексных ионов:
Константа нестойкости комплексного иона характеризует прочность (устойчивость) внутренней сферы комплексного соединения. В приведенных примерах комплекс [Ag(CN)2]— более прочен, чем
комплекс [Ag(NH3)2]+, так как имеет меньшее значение КН.
Соединения с малоустойчивой внутренней сферой называют двойными солями. Обозначают их иначе, чем комплексные соединения, а именно — как соединения молекул, например K2SO4∙A12(SO4)3. Принципиальной же разницы между двойными солями и комплексными соединениями нет. В растворе двойной соли имеется некоторое количество комплексных ионов (например, [Al (SO4)2]—). Двойная соль отличается от комплексной соли лишь диссоциацией комплексного иона: у первой она практически полная, а у второй — незначительная.
Двойные соли — довольно распространенные соединения. К ним относятся соль Мора (NH4)2SO4∙FeSO4∙6H2O, двойной хлорид калия и меди 2КС1 ∙ СuС12 ∙ 2Н2О и многие другие. Если, например, растворить в воде двойной хлорид, то происходит диссоциация
2КС1∙СuС12∙2Н2О↔2К++Сu2+ + 4С1—+2Н2О
и все образовавшиеся в растворе ионы можно обнаружить с помощью соответствующих реакций. Но если это соединение рассматривать как комплексное, то его формулу надо изобразить как K2[CuС14]∙2H2О. Диссоциация K2[CuС14]∙2H2О протекает по уравнению:
К2 [CuCl4] ∙ 2H2O↔ 2К + + [CuC14]2 — + 2Н2О
и
[CuCl4]2-↔Cu2+ + 4Cl—
Образующийся комплексный ион устойчив только в концентрированных растворах, и его константа нестойкости при комнатной температуре
Сравним значение КН [CuCl4]2- со значением константы нестойкости одного из комплексных ионов меди, например КН[Cu(NH3)4]2+ = 4,6 ∙ 10 – 14. Тогда мы увидим, что КН [CuCl4]2- > КН[Cu(NH3)4]2+ на несколько порядков, а чем меньше константа нестойкости комплекса, тем больше его устойчивость.
Пример 1. Напишите выражение для константы нестойкости комплекса [Fе(СМ)6]4-.
Решение. Если комплексная соль гексацианоферрат (II) калия, являясь сильным электролитом, в водном растворе необратимо диссоциирует на ионы внешней и внутренней сфер
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]4–
то комплексный ион диссоциирует обратимо и в незначительной степени на составляющие его частицы:
[Fe(CN)6]4– ↔ Fe2+ + 6CN–
Обратимый процесс характеризуется своей константой равновесия, которая в данном случае называется константой нестойкости (Кн) комплекса:
Чем меньше KH, тем более прочен данный комплекс.
9.6. Константы устойчивости комплексов. Для характеристики устойчивости (прочности) комплексного иона применяют также величину, обратную константе нестойкости. Ее называют константой устойчивости (КУСТ) или константой образования комплекса. Величины КН и КУСТ взаимосвязаны:
Очевидно, чем выше КУСТ, тем прочнее комплексный ион и тем больше его концентрация при равновесии.
Следует подчеркнуть, что как диссоциация комплексного иона, так и его образование являются процессами обратимыми и протекают ступенчато, как у слабых электролитов. Каждой ступени соответствует определенная величина константы устойчивости — К1, К2 …, Кn. Ион [Ag(NH3)2] + будет иметь две константы устойчивости — K1 и K2:
У иона [Cu(NH3)4]2+ будет четыре константы устойчивости, так как комплексообразователь в четыре стадии присоединяет лиганд NH3
Таким образом, при образовании комплексов в растворе происходит последовательное (стадийное) внедрение лигандов во внутреннюю сферу комплексообразователя с соответствующим отщеплением молекул воды, так как исходный ион Сu2+ был гидратирован (он имел состав [Cu(H2O)4]2+). При диссоциации комплекса [Cu(NH3)4]2+, наоборот, происходит соответствующая замена лигандов на молекулы воды. Поскольку концентрация воды при таких процессах не изменяется, ее не включают в выражение констант устойчивости или констант нестойкости.
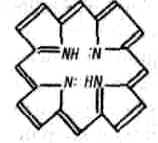
9.7.Роль комплексных соединений. Комплексные соединения широко распространены в природе. В состав многих растений и живых организмов входят соединения с макроциклическими лигандами. В упрощенном виде тетрадентантный макроцикл порфин представлен на рис. 3.3
Рис. 3.3. Структура молекул порфина
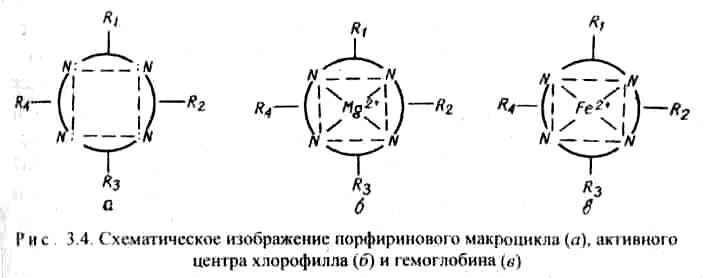
Комплексы с участием порфина называются порфи-ринами. Они отличаются друг от друга центральными ионами-комплексообразователями и заместителями, присоединенными к атомам углерода на периферии лиганда. В наиболее простом виде порфиновый цикл представлен четырьмя атомами азота, соединенными углеродными цепями (рис. 3.3). Кроме того, имеются четыре или более заместителей — радикалов R1, R2, R 3, R4. В зеленом катализаторе фотосинтеза — хлорофилле роль комплексообразователя выполняет магний (рис. 3.4). Макроциклический комплекс железа входит в состав гемоглобина (рис. 3.4).
Железо координирует кислород в комплексе гемоглобина и переносит его по организму с кровью. Связь кислорода с железом в комплексе не очень прочная и поэтому кислород в организме легко реагирует с восстановителями. Недостаток железа в организме приводит к болезни — анемии. Макроциклы крови могут взаимодействовать с каталитическими ядами, например, монооксидом углерода СО, что приводит к отравлению организма.
Сложные лиганды-комплексоны широко используются в энергетике для очистки парогенераторов от накипи, в медицине — для очистки почек от камней, для выведения ядов из организма, таких как Hg2+ Pb2+ Cd2+, в химии — как катализаторы некоторых реакций, например восстановления кислорода, в аналитической химии, в частности, при определении жесткости воды.
9.8. Комплексонометрия. Жесткость воды. Жесткость воды выражается суммой миллиэквивалентов ионов Са2+ и Mg2+, содержащихся в 1 л воды (ммоль/л). Один миллимоль жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+.
Пример 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2.
Приведенные примеры решают, применяя формулу Ж = m / (mЭ ∙ V)
где: т – масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости, мг;
mэ, – молярная масса эквивалента этого вещества;
V – объем воды, л.
Решение. В 1 л воды содержится 202,5 : 500 = 0,405 г Са(НСО3)2, что составляет 0,405 : 81 = 0,005 ммоль/л. 81 г/моль — эквивалентная масса Са(НСО3)2. Следовательно, жесткость воды 5ммоль. (Ж = т / (mэV)= 202 500 / (81 • 500) = 5 ммоль. 81 – эквивалентная масса Са(НСО3)2, равная половине его молярной массы).
Пример 2. Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль?
Решение. Молярная масса CaSO4 136,14 г/моль; молярная масса эквивалента равна 136,14:2 = 68,07 г/моль. В 1 м3 воды жесткостью 4 ммоль содержится 4 · 1000 = 4000 ммоль, или 4000 · 68,07 = 272 280 мг = 272,280 г CaSO4. Из формулы Ж = m / (mэV),m = 468,071000 = 272 280 мг = 272,280 г CaSO4).
Пример 3. Какую массу соды надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 5 ммоль?
Решение. В 500 л воды содержится 500 · 5 = 2500 моль солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2500 · 53 = 132 500 мг = 132,5 г соды (53 г/моль — молярная масса эквивалента Na2CO3).
Пример 4. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н. раствора НС1.
Решение. Вычисляем молярную концентрацию эквивалентов раствора гидрокарбоната кальция. Обозначив число эквивалентов растворенного вещества в 1 л раствора, через х, составляем пропорцию:
Таким образом, в 1 л исследуемой воды содержится 0,005·1000 = 5 ммоль гидрокарбоната кальция или 5 ммоль Са2+-ионов. Карбонатная жесткость воды 5 ммоль.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами. Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование гидроксокомплексов.
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4
Образование комплексных солей.
Если комплексообразователем является Fe2+ или Fe3+, то координационные числа в обоих случаях равны шести:
FeCl2 + 6KCN(изб) = K4[Fe(CN)6] + 2KCl
Fe2(SO4)3 + 12KCN(изб) = 2 K3[Fe(CN)6] + 3K2SO4
Координационные числа ртути и меди, как правило, равны четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
[Cu(NH3)4]SO4 + 4KCN(изб) = K2[Cu(CN)4] + 4NH3↑ + K2SO4
[Cu(NH3)4]SO4 + 4HCl = 4NH4Cl + CuSO4
-
-
- образования малодиссоциированного электролита:
-
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
-
-
- нагревания некоторых комплексных соединений:
-
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na[Al(OH)4] → NaAlO2 + 2H2O
-
-
- окислительно-восстановительных реакций:
-
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6] +Cr2(SO4)3 +4K2SO4 +7H2O
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например, в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-
Для комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+ → Ni2+ + 6NH3
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni2+]·[NH3]6 / [[Ni(NH3)6]2+] (1)
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн (2)
Она представляет собой константу равновесия процесса образования комплексного иона:
Ni2+ + 6NH3 ↔ [Ni(NH3)6]2+
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGTо = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3— в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2]+ = 5,7× 10— 8 при 298 К.
3) Величину ΔGo298 процесса диссоциации комплексного иона.
Решение:
1)
[Ag(NH3)2]NO3 = [Ag(NH3)2]+ + NO3—
[NO3— ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
[Ag(NH3)2]+ → Ag+ + 2NH3
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag+ и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2]+ составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
x = 1,43× 10— 10
Следовательно, [Ag+] = 1,43× 10— 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2]+ уравнением:
ΔGоT = — RTln Кн .
Значит, при Т = 298 К получаем:
ΔGо298 = — 8,314× 298× ln5,7× 10— 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10— 10, Кн.[Ag(NH3)2]+ = 5,7× 10— 8.
Решение. Осадок выпадет при условии: [Ag+][Сl— ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag+ и Сl— в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10-3, 1 и 0,25 М соответственно.
Найдем концентрацию [Ag+] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10— 10.
Значит, [Ag+] = 2,85× 10— 10 моль/л, а [Сl— ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag+][Сl— ] = 2,85× 10— 10× 0,25 = 7,1× 10— 11(моль/л)2.
Поскольку [Ag+][Сl— ] = 7,1× 10— 11 < 1,73× 10— 10, то осадок не выпадет.
Задача 3. При какой концентрации ионов S2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10— 27, Кн[Cd(CN)4]2- = 7,8× 10— 18.
Решение. Осадок выпадет при условии: [Cd2+][S2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd2+ и S2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S2-] > ПР(CdS):[Cd2+].
Na2[Cd(CN)4] = [Cd(CN)4]2- + 2Na+
Комплексный ион диссоциирует незначительно:
[Cd(CN)4]2- → Cd2+ + 4CN—
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd2+ и 4x моль/л ионов CN— . Суммарная концентрация ионов CN— равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4]2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4]2- = [Cd2+ ] · [CN—]4/ [[Cd(CN)4]2-]
x = 1,8·10— 12 .
Следовательно, [Cd2+] = 1,8·10— 12 моль/л.
Выпадение осадка начнется при [S2- ] > 7,9·10— 27: 1,8·10— 12 > 4,39·10— 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2],
[Cu(NH3)4](NO3)2,
[Cu(H2O)4]SO4
|
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия; [Cu(NH3)4](NO3)2 – нитрат тетраамминмеди (II); [Cu(H2O)4]SO4 – сульфат тетрааквамеди (II); |
2. Назовите следующие комплексные соединения
[Co(H2O)3Cl3],
[Ni(NH3)6][PtCl4].
|
[Co(H2O)3Cl3] – трихлоротриаквакобальт (III); [Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II). |
3. Составьте уравнение химической реакции:
Cr2(SO4)3 + NaOH (изб.)→
4. Составьте уравнение химической реакции:
Cd(NO3)2 + Na2SO3 (изб.)→
5. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 + Na2S →
6. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 -t→
7. Составьте уравнение химической реакции:
K4[Fe(CN)6] + Н2O2 + H2SO4 →
8. Сколько граммов серебра содержится в виде ионов в 0,04М растворе K[Ag(CN)2], содержащем в избытке 1,3 г KCN в 1 л раствора. Константа нестойкости иона [Ag(CN)2] — равна 1,4·10— 20.
9. Произойдет ли осаждение сульфида ртути, если к 1 л 0,3 М раствора K2[HgI4], содержащему избыточных 0,01 моль KI, добавить 1·10— 4 моль K2S? ПР(HgS) = 1,6·10— 52, Кн [HgI4]2- = 1,5·10— 31.
10. При какой концентрации ионов Cl— начнется выпадение осадка AgCl из 0,6М раствора [Ag(NH3)2]NO3, содержащего 1,2 моль/л избыточного аммиака, если ПР(AgCl) = 1,73·10—10, Кн [Ag(NH3)2]+ = 5,7·10— 8.
Координационные числа ионов — комплексообразователей
|
Заряд |
Комплексообразователь |
К.ч. |
|
+1 +2 +3,+4 |
Ag+, Cu2+, Pt4+, |
2 4 6 |
Таблица
44
Основные комплексообразователи в кс
|
Комплексообразователь |
Заряд |
Примеры |
|
Металл |
n+ |
H[AuCl4], |
|
Металл |
0 |
[Ni |
|
Металл |
n- |
Na[Co(CO)4] |
|
Неметалл |
n+ |
H2[SiF6], |
|
Неметалл |
0 |
[Cl2(H2O)6], |
|
Неметалл |
n- |
K[I(I2)3], |
Рис.
28. Строение анионного комплекса
–гексацианоферрат(III)
калия
Комплексы
(комплексные,
координационные соединения)
— это молекулы
или ионы, обладающие высокой симметрией,
имеющие атом в центре симметрии
— центральный
атом, комплексообразователь, электронная
валентность которого больше
стехиометрической.
При
растворении и диссоциации внутренняя
координационная сфера сохраняет
относительную стабильность: [Ag(NH3)2]Cl
↔ [Ag(NH3)2]+
+ Cl—.
Известны комплексные соединения без
внешней координационной сферы:
[Co(NH3)6Cl3]—
такие комплексные соединения являются
неэлектролитами.
Классификации
КС
1.
по заряду комплексов:
катионного
типа —
[Co(NH3)6]Cl3,
[Cu(NH3)4]
SO4
анионного
типа –
K3[Fe(CN6)],
H2[PtCl6],
[Co(CN)6
]3-
нейтральные
(внутрикомплексные) соединения –
[Pt(NH3)2Cl4],
[Co(NH3)4Сl2]0.
2.
по принадлежности к классу:
кислоты
— H[AuCl4],
основания
— [Ag(NH3)2]OH,
соли
— [Ni(NH3)6]SO4;
3.
по природе лиганда:
гидроксокомплексы
— K2[Zn(OH)4],
комплексы
смешанного типа — K[Co(NH3)2Cl4],
[Pt(NH3)4(H2O)2]Cl4,
[Pt(NH3)3Cl]Cl,
K[Pt(NH3)Cl3].
аммиакаты:
лиганды – молекулы аммиака, реже аминов
или гидразина:
[Cu(NH3)4]
SO4,
[Cо(NH3)6]
Сl3,
[Pt(CH3NH2)2]
SO4,
[Pt(N2H43)4]
Cl2.
аквакомплексы:
лиганды – молекулы воды:
[Co(H2O)6]
SO4,
[Al(H2O)6]Cl3,
[Fe(H2O)6]Cl3
ацидокомплексы:
лиганды – любые анионы кислот:
K4[Fe(CN)6)],
K2[PtCl4]
полигалогениды:
K[I(I2)].
4.
по внутренней структуре
одноядерные:
нехелатные, хелатные, с мостиковыми
легандами
многоядерные:
кластерные, изополикислотные
гетерополикислотные.
Номенклатура
IUPAC
КС.
Читаются
и записываются справа налево.
Первым
в именительном падеже называют анион,
затем в родительном падеже – катион.
В
названии комплексного иона сначала
перечисляются лиганды, затем — центральный
ион.
Число
лигандов указывается греческими
числительными: 1- моно, 2-ди, 3-три, 4-тетра,
5-пента, 6-гекса, 7-гепта, 8-окса.
К
латинскому названию лигандов добавляют
окончание «о»:
Cl—
— хлоро
, NO2——
нитрито, I——
иодо, Br—
— бромо, S2O32-—
тиосульфато, CO32-—
карбонато, C2O42-—
оксалато, CN—циано,
S2-сульфидо,
SCN——
тиоцианато, OH—
— гидроксо
Нейтральные
лиганды называют как соответствующие
молекулы: NO
— нитрозил, CO
— карбонил.
Исключения:
H2O—
аква, NH3—
амин.
В
названии аниона:
латинское название элемента –
комплексообразователя, степень окисления
+ суффикс «ат» — К2[PtCl6]-
гексахлороплатинат
(IV)
калия.
В
названии катиона:
центральный ион называют русским
названием с указанием степени окисления
+ анион, который называют первым:
[Cu(NH3)4]
SO4
– сульфат
тетрааммин меди (II);
Названия
нейтральных КС: [Cr(OH)3(
H2O)(NC5H5)2]
–
акватригидроксодипиридин хром (III);
[Pt(NH3)2Cl4]
– диамминтетрахлорплатина (IV).
Исторические
названия: [Co(NH3)5Cl]Х2
–
пурпуреосоли; K3[Fe(CN)6]-
красная кровяная соль; K4[Fe(CN)6)]-
жёлтая кровяная соль; [Pt(C2)H4]Cl3
– cоль
Цейзе; [Pt(NH3)5Cl]Cl2
–соль Чугаева.
Устойчивость
и равновесие в растворах комплексных
соединений
Большинство
КС растворимо и диссоциирует в водных
растворах по схеме:
[Ag(NH3)2]Cl
®[Ag(NH3)2]++Cl—
— первичная диссоциация (сильный
электролит)
Вторичная
диссоциация, протекает обратимо (слабый
электролит) [Ag(NH3)2]+«
Ag(NH3)++
NH3
-1 ступень
Ag(NH3)+
«
Ag+
+ NH3
-2 ступень
Суммарный
процесс:
[Ag(NH3)2]+
«
Ag++2NH3
Комплексные
соединения в растворах диссоциируют
на внешнюю и внутреннюю координационные
сферы практически полностью по типу
сильных электролитов (первичная
диссоциация). Диссоциация внутренней
координационной сферы носит название
вторичной, является обратимым процессом
и проходит по типу слабых электролитов.
Момент наступления равновесия
характеризуется константой равновесия,
которая в случае комплексного иона
носит название константы нестойкости
(КН)
. Каждая ступень ионизации имеет свою
КН.
Величина, обратная константе нестойкости,
называется константой устойчивости:
Ку
= 1/Кн.
Значения
констант нестойкости различных
комплексных ионов колеблются в широких
пределах и могут служить мерой устойчивости
комплекса (приложение 6). Чем
меньше значение Кн,
тем более прочен данный комплекс.
Комплексные
соединения обладают различной прочностью
внутренней координационной сферы.
Наряду с соединениями, внутренняя сфера
которых отличается значительной
прочностью и для которых диссоциация
ничтожно мала, существуют соединения
с крайне непрочной внутренней сферой.
Растворы этих соединений практически
не содержат комплексных ионов, так как
они полностью диссоциируют на свои
составные части, это — двойные
соли.
Смещение
равновесия
Усилить
диссоциацию комплексных ионов, а иногда
даже полностью разрушить можно путем
разбавления раствора, нагревания (т.к.
процесс эндотермический), добавлением
реактива, который связывает лиганд или
комплексообразователь в малорастворимое
или малодиссоциирущее вещество.
Равновесие
в растворе всегда смещается в сторону,
где находится менее растворимое вещество
или более слабый электролит.
[Ag(NH3)2]Cl
+ HNO3
→ AgCl↓ + NH4NO3
КН=6,8·10-8
ПР =1,8·10-10
Так
как ПР < КН,
то равновесие смещается в сторону
продуктов реакции (комплексное соединение
разрушается, образуется белый осадок
хлорида серебра).
Применение
окислителей и восстановителей которые
либо полностью разрушают КС либо изменяют
степень окисления комплексообразователя.
К4[Fe(CN)6]
+ Cl2
→ K3[Fe(CN)6]
+ KCl
Природа
химической связи в комплексных соединениях
Первой
теорией, объясняющей образование КС
была теория
ионной (гетерополярной) связи В.
Косселя и А. Магнуса: многозарядный ион
– комплексообразователь (d-элемент)
обладает сильным поляризующим действием;
лиганды – легко поляризующиеся ионы
или нейтральные молекулы. Между
комплексообразователем и лигандом
возникают электростатические силы
притяжения, которые вызывают деформацию
электронных облаков комплексообразователя
и лигандов и их взаимное перекрывание.
В результате действия электростатических
сил притяжения и отталкивания в КС
образуется устойчивая группировка
атомов, обладающая минимальной
потенциальной энергией и определённым
образом ориентированная в пространстве.
С
одной стороны теория объяснила линейную
структуру при к.ч.=2, плоский треугольник
при к.ч.=3, тетраэдр при к.ч.=4, правильный
октаэдр при к.ч.=6. Согласно этой теории
наиболее прочные комплексные соединения
образуют ионы с большим зарядом и малым
радиусом. С другой стороны она не
объясняла существование неполярных
лиганд и комплексообразователей с
нулевой степенью окисления, а также
магнитные и оптические свойства КС.
Для
объяснения образования и свойств
комплексных соединений в настоящее
время применяются теория валентных
связей (ВС), теория кристаллического
поля (ТКП) и теория молекулярных орбиталей
(МО).
В
нач. 30-х г.г. XX
в. Л. Полинг применил метод
валентных связей,
основные принципы которого сводились
к следующему:
—
связь между комплексообразователем и
лигандом осуществляется по
донорно-акцепторному механизму
(комплексообразователь имеет свободные
орбитали – акцептор электронов, лиганды
– доноры электронных пар);
—
орбитали комплексообразователя
подвергаются гибридизации, определяющей
пространственную геометрию КС;
—
наряду с s-связями
между комплексообразователем и лигандом
(электронная плотность смещена к
комплексообразователю) образуются
p-связи
(электронная плотность смещена к
лигандам).
Если
на d—
подуровне центрального атома нет или
присутствует 10 электронов, то такой
подуровень имеет сферическую электрическую
симметрию. Лиганды на поверхности сферы
независимо от своего положения находятся
под действием одинаковых электростатических
сил. В этом случае d—
электроны не будут оказывать влияния
на положение, занимаемое лигандом.
Комплексы с «внешней» гибридизацией
более лабильны, обладают повышенной
реакционной способностью (рис. 29).
МВС
ограничивается качественными объяснениями
строения и свойств комплексных соединений.
Рис.
29. Образование комплексных ионов по
методу валентной связи
В
1929 г. Г. Бете создал основы теории
кристаллического поля (ТКП),
которая развивает воззрения об
электростатическом взаимодействии
между d—элементом
– центральным ионом и ионами
противоположного знака или полярными
молекулами. При этом учитывается
квантовомеханическая природа электронов
комплексообразователя, но лиганды
рассматриваются бесструктурно, как
источники электростатического поля (в
этом недостаток теории).
ТКП
позволяет объяснить окрашенность
комплексов, магнитные и другие свойства:
бесцветны
комплексы с d10—конфигурацией
(Cu+,
Ag+,
Cd2+,
Hg2+,
Zn2+);
окрашены
– с незаполненной d—конфигурацией
(Cu2+,
Fe2+,
Ti3+,
Cr3+
и др.), когда электроны переходят с низшей
d-орбитали
на d-орбиталь
с более высокой энергией.
Теория
поля лигандов (ТПЛ)
учитывает и ковалентный и ионный
характеры химической связи и для описания
КС использует метод МО, где структура
комплексообразователя и лигандов
рассматриваются как единое целое.
Сложное электростатическое взаимодействие
проявляется в том, что если на (n-1)
d-подуровне
комплексообразователя имеется от 1 до
9 электронов, то разные d-орбитали,
вследствие их определённой направленности
в пространстве, испытывают разное
воздействие со стороны лигандов.
В
отсутствии внешнего электростатического
поля все пять d-орбиталей
пятикратно вырождены, т.е. имеют одинаковую
энергию. При тесном соприкосновении с
лигандами электростатическое или
кристаллическое поле последних возбуждает
d-электроны
комплексообразователя, повышая их
уровни энергии, т.е. происходит снятие
вырождения.
Вид снятия вырождения зависит от
координационного числа комплексообразователя.
Разные
d-орбитали,
вследствие их определённой направленности
в пространстве, испытывают разное
воздействие со стороны лигандов. Для
3d-элементов
экспериментально установлен
спектрохимический
ряд, в котором
лиганды расположены в порядке уменьшения
силы поля
лигандов:
CO>
CN—
>NO2—>
Сильное
поле
>NC—>
NH3>
NCS—>
H2O
>C2O42->
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #