Как найти концентрацию молекул
Концентрация частиц – это величина, показывающая, сколько частиц вещества находится в каком-либо объеме. Она вычисляется по формуле: c = N/V, ее размерность 1/м^3. Часто возникает необходимость определить концентрацию молекул, причем исследуемое вещество может быть в любом агрегатном состоянии: твердом, жидком или газообразном.

Инструкция
Представьте, что любознательный царь Гиерон дал своему придворному математику еще одну корону, приказав: «Вот она-то точно из чистого золота. Определи, Архимед, какова концентрация молекул в ней». Гениального ученого такая задача поставила бы в тупик. Ну, а вы решите ее очень быстро. Предположим, корона весила бы ровно 1,93 килограмма, занимая при этом объем в 100 см^3.
Прежде всего найдите, сколько молей золота содержится в таком количестве вещества. С помощью таблицы Менделеева вы узнаете молекулярную массу золота: 197 а.е.м. (атомных единиц массы). А масса одного моля любого вещества (в граммах) численно равна его молекулярной массе. Следовательно, один моль золота весит 197 грамм. Разделив фактическую массу короны на молярную массу золота, вы получите: 1930/197 = 9,79. Или, округленно, 9,8 молей золота.
Умножьте количество молей на универсальное число Авогадро, показывающее, сколько элементарных частиц содержится в моле любого вещества. 9,8*6,022*10^23 = 5,9*10^24. Вот сколько молекул золота приблизительно содержится в короне.
Ну, а теперь найти концентрацию молекул проще простого. 100 кубических сантиметров – это 0,0001 м^3. Разделим: 5,9*10^24/0,0001 = 5,9*10^28. Концентрация молекул золота равна 5,9*10^28/м3.
Теперь предположим, что вам задана такая задача: при давлении Р, средняя квадратичная скорость молекул углекислого газа равна V. Требуется определить концентрацию его молекул. И здесь нет ничего сложного. Существует так называемое основное уравнение кинетической теории идеального газа: Р = V^2m0C/3, где C – концентрация молекул газа, а m0 – масса одной его молекулы. Следовательно, искомая концентрация С находится так: С = 3P/m0V^2.
Единственная неизвестная величина – m0. Ее можно узнать в справочнике по химии или физике. Можно также вычислить по формуле: m0 = M/Na, где М – молярная масса углекислого газа (44 грамм/моль), а Na – число Авогадро (6,022х1023). Подставив все величины в формулу, вычислите искомую концентрацию С.
Видоизмените условие задачи. Предположим, вам известны только температура Т и давление Р углекислого газа. Как по этим данным найти концентрацию его молекул? Давление и температура газа связаны формулой: P = CkT, где С – концентрация молекул газа, а К – постоянная Больцмана, равная 1,38*10^-23. То есть С = P/kT. Подставив в формулу известные величины, вы вычислите концентрацию С.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
КОЛИЧЕСТВО
И КОНЦЕНТРАЦИЯ ВЕЩЕСТВА:
ВЫРАЖЕНИЕ
И ПЕРЕСЧЕТЫ ИЗ ОДНОЙ ФОРМЫ В ДРУГУЮ
Основы
теории
1. Основные
термины и определения
Масса
и количества вещества.
Массу
вещества (m)
измеряют в граммах, а количество
вещества (n)
в молях. Если обозначить вещество буквой
Х,
то тогда его масса может быть обозначена
как m
(X),
а количество – n
(X).
Моль
– количество
вещества, которое содержит столько
определенных структурных единиц
(молекул, атомов, ионов и т.д.), сколько
атомов содержится в 0,012 кг изотопа
углерода-12.
При
использовании термина моль
следует указывать частицы, к которым
относится этот термин. Соответственно,
можно говорить «моль молекул», «моль
атомов», «моль ионов» и т.д. (например,
моль молекул водорода, моль атомов
водорода, моль ионов водорода). Так как
0,012 кг углерода-12 содержит ~ 6,022х1023
атомов углерода (постоянная Авогадро),
то моль
– такое количество вещества, которое
содержит 6,022х1023
структурных элементов (молекул, атомов,
ионов и др.).
Отношение
массы вещества к количеству вещества
называют молярной
массой.
M
(X)
= m (X)
/ n(X)
То
есть, молярная
масса (М)
– это масса
одного моля вещества.
Основной системной 1
единицей молярной массы является
кг/моль, а на практике – г/моль. Например,
молярная масса самого легкого металла
лития М
(Li)
= 6,939 г/моль, молярная масса газа метана
М
(СН4)
= 16,043 г/моль. Молярная масса серной
кислоты рассчитывается следующим
образом M
(Н2SО4)
= 196 г
/ 2 моль
= 96 г/моль.
Любое
соединение (вещество), кроме молярной
массы, характеризуется относительной
молекулярной или
атомной массой.
Существует и эквивалентная
масса Е,
равная молекулярной, умноженной на
фактор эквивалентности (см. далее).
Относительная
молекулярная масса
(Mr)
– это молярная
масса соединения, отнесенная к 1/12
молярной массы атома углерода-12.
Например, Мr(СН4)
= 16,043. Относительная молекулярная масса
– величина безразмерная.
Относительная
атомная масса
(Ar)
– это
молярная масса атома вещества, отнесенная
к 1/12 молярной массы атома углерода-12.
Например, Ar(Li)
= 6,039.
Концентрация.
Отношение количества или массы вещества,
содержащегося в системе, к объему или
массе этой системы называют концентрацией.
Известно несколько способов выражения
концентрации. В России чаще всего
концентрацию обозначают заглавной
буквой С, имея в виду прежде всего
массовую
концентрацию,
которая по праву считается наиболее
часто применяемой в экологическом
мониторинге форма выражения концентрации
(именно в ней измеряют величины ПДК).
Массовая
концентрация
(С или β)
–
отношение
массы компонента, содержащегося в
системе (растворе), к объему этой системы
(V).
Это самая распространенная у российских
аналитиков форма выражения концентрации.
β
(Х) = m
(X)
/ V
(смеси)
Единица
измерения массовой концентрации –
кг/м3 или
г/м3,
кг/дм3
или г/дм3
(г/л), кг/см3,
или г/см3
(г/мл), мкг/л
или мкг/мл и т.д. Арифметические пересчеты
из одних размерностей в другие не
представляет большой сложности, но
требуют внимательности. Например,
массовая концентрация хлористоводородной
(соляной) кислоты С
(HCl)
= 40 г / 1
л = 40 г/л = 0,04 г/мл = 4·10–
5
мкг/л и т.д. Обозначение массовой
концентрации С
нельзя путать с обозначением мольной
концентрации (с),
которая рассматривается далее.
Типичными
являются соотношения β
(Х): 1000 мкг/л = 1 мкг/мл = 0,001 мг/мл.
В
объемном анализе (титриметрии)
употребляется одна из форм массовой
концентрации – титр.
Титр
раствора
(Т) – это
масса вещества,
содержащегося в одном кубическом
сантиметре или в
одном миллилитре
раствора.
Единицы
измерения титра — кг/см3,
г/см3,
г/мл и др.
Моляльность
(b)
— отношение
количества растворенного вещества (в
молях) к массе растворителя (в
кг).
b(Х)
= n(X)
/ m
(растворителя)
= n(X)
/ m
(R)
Единица
измерения моляльности —
моль/кг. Например, b
(HCl/H2O)
= 2 моль/кг. Моляльная концентрация
применяется в основном для концентрированных
растворов.
Мольная
(!)
доля
(х) – отношение
количества вещества данного компонента
(в молях), содержащегося в системе, к
общему количеству вещества (в молях).
х
(Х)
= n(X)
/ n(X)
+ n(Y)
Мольная
доля может быть выражена в долях единицы,
процентах (%), промилле (тысячная часть
%) и в миллионных (млн –1,
ppm),
миллиардных (млрд –1,
ppb),
триллионных (трлн –1,
ppt)
и др. долях, но единицей измерения все
равно является отношение – моль
/ моль.
Например, х
(С2Н6)
= 2 моль / 2 моль + 3 моль = 0,4 (40 %).
Массовая
доля (ω)
– отношение
массы данного компонента, содержащегося
в системе, к общей массе этой системы.
ω
(Х)
= m(X)
/ m(смеси)
Массовая
доля измеряется в отношениях кг/кг
(г/г).
При этом она может быть выражена в долях
единицы, процентах (%), промилле, миллионных,
миллиардных и т.д. долях. Массовая доля
данного компонента, выраженная в
процентах, показывает, сколько граммов
данного компонента содержится в 100 г
раствора.
Например,
условно ω
(KCl)
= 12 г / 12 г +
28 г = 0,3 (30%).
0бъемная
доля (φ)
– отношение
объема компонента, содержащегося в
системе,
к общему объему системы.
φ
(Х)
= v(X)
/ v(X)
+ v(Y)
Объемная
доля измеряется в отношениях л/л или
мл/мл и тоже может быть выражена в долях
единицы, процентах, промилле, миллионных
и т.д. долях. Например, объемная доля
кислорода газовой смеси составляет φ
(О2)
=0,15 л / 0,15 л + 0,56 л.
Молярная
(мольная)
концентрация
(с) – отношение
количества вещества (в молях), содержащегося
в системе (например, в растворе), к объему
V этой системы.
с(Х)
= n(X)/
V
(смеси)
Единица
измерения молярной концентрации моль/м3
(дольная производная, СИ – моль/л).
Например, c (H2S04)
= 1 моль/л, с (КОН)
= 0,5 моль/л. Раствор, имеющий концентрацию
1 моль/л, называют молярным
раствором
и обозначают как 1 М раствор (не надо
путать эту букву М, стоящую после цифры,
с ранее указанным обозначением молярной
массы, т.е. количества вещества М).
Соответственно раствор, имеющий
концентрацию 0,5 моль/л, обозначают 0,5 М
(полумолярный р-р); 0,1 моль/л – 0,1 М
(децимолярный р.р); 0,01 моль/л – 0,01 М
(сантимолярный р-р) и т.д.
Эта форма выражения
концентрации также очень часто применяется
в аналитике.
Нормальная
(эквивалентная)
концентрация (N),
молярная
концентрация эквивалента
(Сэкв.)
– это отношение
количества вещества эквивалента в
растворе (моль)
к объему этого раствора (л).
N
= Сэкв
(Х)
= n
(1/Z
X)
/ V
(смеси)
Количество
вещества (в молях), в котором реагирующими
частицами являются эквиваленты,
называется количеством
вещества эквивалента nэ
(1/Z
X)
= nэ
(Х).
Единица
измерения нормальной концентрации
(«нормальности») тоже моль/л (дольная
производная, СИ). Например, Сэкв.(1/3
А1С13)
= 1 моль/л. Раствор, в одном литре которого
содержится 1 моль вещества эквивалентов,
называют нормальным и обозначают 1 н.
Соответственно могут быть 0,5 н
(«пятидецинормальный»); 0,01 н
(сантинормальный») и т.п. растворы.
Следует
отметить, что понятие эквивалентности
реагирующих веществ в химических
реакциях является одним из базовых для
аналитической химии. Именно на
эквивалентности как правило основаны
вычисления результатов химического
анализа (особенно в титриметрии).
Рассмотрим несколько связанных с этим
базовых с т.з. теории аналитики понятий.
Фактор
эквивалентности
– число, обозначающее, какая доля
реальной частицы веществ Х (например,
молекулы вещества X) эквивалентна одному
иону водорода (в данной кислотно-основной
реакции) или одному электрону (в данной
окислительно-восстановнтельной реакции)
Фактор эквивалентности fэкв (Х)
рассчитывают на основании стехиометрии
(соотношении участвующих частиц) в
конкретном химическом процессе:
fэкв (Х)
= 1/ Zx
где
Zx.
— число замещенных
или присоединенных
ионов водорода (для кислотно-основных
реакций) или число отданных или принятых
электронов (для окислительно-восстановительных
реакций);
Х — химическая
формула вещества.
Фактор эквивалентности
всегда равен или меньше единицы. Будучи
умноженным на относительную молекулярную
массу, он дает значение эквивалентной
массы (Е).
Для реакции
H2SО4
+
2 NaOH = Na2SО4
+
2 H2
fэкв (H2SО4)
= 1/2, fэкв (NaOH)
= 1
fэкв (H2SО4)
= 1/2, т.е. это означает, что ½ молекулы
серной кислоты дает для данной реакции
1 ион водорода (Н+),
а соответственно fэкв (NaOH)
= 1 означает, что одна молекула NaOH
соединяется в данной реакции с одним
ионом водорода.
Для
реакции
10
FeSО4
+
2 KMnО4
+
8 H2SО4
=
5
Fe2(SО4)3
+ 2 MnSО4
+ K2SО4
+
8 H2О

+ 8Н+
+5е—
→ Мп2+
– 2e—
+ 4 Н2О
5 Fe2+
– 2e—
→ Fe3+
fэкв (KMnО4)
= 1/5 (кислая среда), т.е. 1/5 молекулы KMnО4
в данной
реакции
эквивалентна 1 электрону. При этом
fэкв (Fe2+)
= 1, т.е. один ион железа (II)
также эквивалентен 1 электрону.
Эквивалент
вещества Х
– реальная
или условная частица, которая в данной
кислотно-основной реакции эквивалентна
одному нону
водорода или в данной
окислительно-восстановительной реакции
– одному электрону.
Форма
записи эквивалента: fэкв
(Х) Х (см. табл.), или упрощенно Эх,
где Х –химическая формула вещества,
т.е. [Эх =
fэкв
(Х) Х]. Эквивалент безразмерен.
Эквивалент
кислоты (или
основания) – такая условная частица
данного вещества, которая в данной
реакции титрования высвобождает один
ион водорода или соединяется с ним, или
каким-либо другим образом эквивалентна
ему.
Например,
для первой из вышеуказанных реакций
эквивалент серной кислоты — это условная
частица вида ½ H2SО4
т.е.
fэкв (H2SО4)
= 1/Z=
½;
ЭH2SО4
= ½ H2SО4.
Эквивалент
окисляющегося
(или восстанавливающегося) вещества
— это такая условная частица данного
вещества, которая в данной химической
реакции может присоединять один электрон
или высвобождать его, или быть каким-либо
другим образом эквивалентна этому
одному электрону.
Например,
при окислении перманганатом в кислой
среде эквивалент марганцевокислого
калия – это условная частица вида 1/5
КМпО4,
т.е. ЭКМпО4
=1/5КМпО4.
Так
как эквивалент вещества может меняться
в зависимости от реакции, в которой это
вещество
участвует, необходимо
указывать соответствующую реакцию.
Например,
для реакции Н3РО4+
NaOH
= NaH2PО4
+ H2O
эквивалент
фосфорной кислоты Э Н3РО4
== 1 Н3РО4.
Для
реакции Н3РО4+
2 NaOH
= Na2
HPО4
+ 2 H2O
ее
эквивалент Э Н3РО4
== ½ Н3РО4,.
Принимая
во внимание, что понятие моля
позволяет пользоваться любыми видами
условных частиц, можно дать понятие
молярной
массы эквивалента вещества
X. Напомним, что моль
– это количество вещества, содержащее
столько реальных или условных частиц,
сколько атомов содержится в 12 г изотопа
углерода 12
С (6,02 10 23).
Под реальными частицами следует понимать
атомы, ионы, молекулы, электроны и т.п.,
а под условными – такие как, например,
1/5 молекулы КМпО4
в случае О/В реакции в кислой среде или
½ молекулы H2SО4
в реакции
с гидроксидом натрия.
Молярная
масса эквивалента вещества
– масса
одного моля эквивалентов этого вещества,
равная произведению фактора эквивалентности
fэкв (Х)
на молярную
массу вещества М
(Х)1.
Молярную
массу эквивалента обозначают как М
[fэкв (Х)
Х] или с учетом равенства Эх
=
fэкв (Х)
Х ее обозначают М [Эх]:
М
(Эх)=
fэкв (Х)
М (Х); М [Эх]
= М (Х) /Z
Например,
молярная масса эквивалента КМпО4
М
(ЭКМпО4)
=1/5КМпО4
= М 1/5
КМпО4
=
31,6 г/моль.
Это
означает, что масса одного моля условных
частиц вида 1/5КМпО4
составляет 31,6 г/моль. По аналогии молярная
масса эквивалента серной кислоты М ½
H2SО4
= 49 г/моль;
фосфорной кислоты М ½
H3
РО4
= 49 г/моль
и т.д.
В
соответствии с требованиями Международной
системы (СИ) именно молярная
концентрация
является основным способом выражения
концентрации растворов, но как уже
отмечалось, на практике чаще применяется
массовая
концентрация.
Рассмотрим основные
формулы и соотношения между способами
выражения концентрации растворов (см.
табл. 1 и 2).
Таблица 1
Содержание
- § 20. Атомы и молекулы, их характеристики (окончание)
- Концентрация молекул
- Молекулярная физика
§ 20. Атомы и молекулы, их характеристики (окончание)
Концентрация молекул
7. Постоянная Авогадро. Поскольку молекулы имеют малые размеры, их число в любом макроскопическом теле очень велико.
Число молекул в единице объёма называют концентрацией. Концентрация n вычисляется по формуле
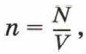
где N — число молекул в теле, V — его объём.
Концентрацию молекул в теле также можно определить, зная плотность вещества ρ и массу молекулы этого вещества m0. Поскольку 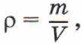
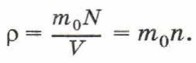
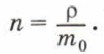
Если плотность воды ρ = 1000 кг/м 3 , а масса молекулы воды m0 = 3 • 10 -26 кг, то концентрация молекул воды равна:
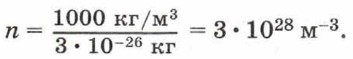
Плотность газов существенно меньше, чем плотность жидкостей, поэтому и концентрация молекул газов меньше, чем концентрация молекул жидкости. Так, если плотность водорода 9 • 10 -2 кг/м 3 , масса молекулы водорода 3,3 • 10 -27 кг, то концентрация молекул водорода равна 2,68 • 10 25 м -3 . Концентрация молекул любого газа при нормальных условиях (нормальном атмосферном давлении и температуре 0 °С) одинакова и равна приведённому для водорода значению. Это число называют постоянной Лошмидта: L = 2,68 • 10 25 м -3 .
Чтобы представить себе, насколько велико это число, предположим, что в воздушном шаре сделали настолько тонкий прокол, что за каждую секунду через него проходит 10 молекул. В этом случае, для того чтобы вышли все молекулы, потребуется 30 миллиардов лет.
Из определения моля следует, что 1 моль любого вещества содержит одинаковое число молекул (атомов). Это число называют постоянной Авогадро.
Постоянная Авогадро NА — число молекул или атомов в количестве вещества 1 моль.
Постоянную Авогадро можно рассчитать, зная, что углероду количеством вещества 1 моль соответствует масса 0,012 кг, а масса одной молекулы углерода m 0С = 1,995 • 10 -26 кг. Тогда в одном моле углерода содержится число молекул:
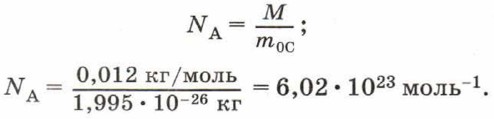
Поскольку в одном моле любого вещества содержится одинаковое число молекул, то при одинаковых условиях 1 моль любого газа занимает одинаковый объём.
Объём, занимаемый при нормальном атмосферном давлении любым газом количеством вещества 1 моль, равен 0,0224 м 3 .
1. Сформулируйте первое положение молекулярно-кинетической теории строения вещества.
2. Поясните выражение: «Молекула — мельчайшая частица вещества, сохраняющая его химические свойства».
3. Опишите опыт, позволяющий оценить размеры молекулы. Предложите способ измерения объёма капли масла.
4. Что называют относительной молекулярной массой; количеством вещества; молярной массой; концентрацией молекул; постоянной Авогадро?
6. Каков порядок значений размеров, массы молекул, их концентрации, числа молекул в одном моле вещества?
1Д. Подготовьте краткое сообщение об исследованиях М. В. Ломоносова, результаты которых внесли вклад в развитие учения о строении вещества. Воспользуйтесь для этого интернет-ресурсами и другими источниками информации. Докажите, что результаты исследований М. В. Ломоносова имели принципиальное значение для развития взглядов на строение вещества.
2. Сравните количество вещества, содержащееся в телах равной массы из алюминия и железа.
3. Найдите число атомов в алюминиевой ложке массой 30 г.
4. Деталь площадью 30 см 2 покрыли слоем серебра толщиной 2 мкм. Сколько атомов серебра содержится в покрытии?
5. Сравните массы и объёмы двух тел, сделанных из свинца и меди, если в них содержатся равные количества вещества.
6. Вычислите постоянную Авогадро, если известно, что масса молекулы кислорода 5,312 • 10 -26 кг.
Почему мы уверены в существовании молекул и атомов, ведь мы их не видим?
Источник
Молекулярная физика
Формулы молекулярной физики
Формула концентрации молекул
Здесь n — концентрация 

Формула плотности
Здесь 


Формула относительной молекулярной массы
Здесь 


Формула количества вещества (количества молей)
Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы
Здесь 




Формулы количества молекул
Здесь A — количество молекул (безразмерное), п — концентрация молекул 




Формулы средней квадратичной скорости молекул
Здесь 


Основное уравнение кинетической теории идеального газа
Здесь р — давление газа (Па), 



Формула средней кинетической энергии молекул
Здесь 


Связь шкал Цельсия и Кельвина
Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой
Здесь 
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева
Здесь р — давление газа (Па), V — объем 


Объединенный газовый закон — уравнение Клапейрона
при
Здесь 



Закон Бойля — Мариотта (изотермический процесс)
при
Здесь Т — абсолютная температура газа (К), m — масса газа (кг), 



Закон Гей-Люссака (изобарный процесс)
при
Здесь р — давление газа (Па), m — масса газа (кг), 




Закон Шарля
при
Здесь V — объем газа 


Связь давления идеального газа с концентрацией его молекул и температурой
Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа 
Формулы относительной влажности
Здесь 



Работа при изобарном изменении объема газа
Здесь А — работа (Дж), р — давление газа (Па), 


Внутренняя энергия идеального одноатомного газа
Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), 

Первый закон термодинамики
Здесь Q — количество теплоты, переданное термодинамической системе (Дж), 
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при
к изохорному: при V = const
к изобарному: при р = const
Здесь Т — абсолютная температура (К), 

Формулы количества теплоты при нагревании или охлаждении тел
Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), 





Формула количества теплоты при плавлении или кристаллизации
Здесь Q — количество теплоты (Дж), т — масса тела (кг), 
Формула количества теплоты при парообразовании или конденсации
Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива
Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя
Здесь 



Коэффициент полезного действия идеального теплового двигателя
Здесь 


Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Возможно вам будут полезны эти страницы:





















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Источник
Газ обладает высокой реакционной способностью по сравнению с жидкими и твердыми телами ввиду большой площади его активной поверхности и высокой кинетической энергии образующих систему частиц. При этом химическая активность газа, его давление и некоторые другие параметры зависят от концентрации молекул. Рассмотрим в данной статье, что это за величина и как ее можно вычислить.
О каком газе пойдет речь?
В данной статье будут рассмотрены так называемые идеальные газы. В них пренебрегают размерами частиц и взаимодействием между ними. Единственным процессом, который происходит в идеальных газах, являются упругие столкновения между частицами и стенками сосуда. Результатом этих столкновений является возникновение абсолютного давления.
Любой реальный газ приближается по своим свойствам к идеальному, если уменьшать его давление или плотность и увеличивать абсолютную температуру. Тем не менее существуют химические вещества, которые даже при низких плотностях и высоких температурах далеки от идеального газа. Ярким и всем известным примером такого вещества является водяной пар. Дело в том, что его молекулы (H2O) являются сильно полярными (кислород оттягивает на себя электронную плотность от атомов водорода). Полярность приводит к появлению существенного электростатического взаимодействия между ними, что является грубым нарушением концепции идеального газа.
Универсальный закон Клапейрона-Менделеева
Чтобы уметь рассчитывать концентрацию молекул идеального газа, следует познакомиться с законом, который описывает состояние любой идеальной газовой системы независимо от ее химического состава. Этот закон носит фамилии француза Эмиля Клапейрона и русского ученого Дмитрия Менделеева. Соответствующее уравнение имеет вид:
P*V = n*R*T.
Равенство говорит о том, что произведение давления P на объем V всегда для идеального газа должно быть прямо пропорционально произведению температуры абсолютной T на количество вещества n. Здесь R — это коэффициент пропорциональности, который получил название универсальной газовой постоянной. Она показывает величину работы, которую 1 моль газа выполняет в результате расширения, если его на 1 К нагреть (R=8,314 Дж/(моль*К)).
Концентрация молекул и ее вычисление
Согласно определению под концентрацией атомов или молекул понимают количество частиц в системе, которое приходится на единицу объема. Математически можно записать:
cN = N/V.
Где N — общее число частиц в системе.
Прежде чем записать формулу для определения концентрации молекул газа, вспомним определение количества вещества n и выражение, которое связывает величину R с постоянной Больцмана kB:
n = N/NA;
kB = R/NA.
Используя эти равенства, выразим отношение N/V из универсального уравнения состояния:
P*V = n*R*T =>
P*V = N/NA*R*T = N*kB*T =>
cN = N/V = P/(kB*T).
Таким образом мы получили формулу для определения концентрации частиц в газе. Как видно, она прямо пропорционально зависит от давления в системе и обратно пропорционально от абсолютной температуры.
Поскольку количество частиц в системе велико, то концентрацией cN пользоваться неудобно при выполнении практических расчетов. Вместо нее чаще используют молярную концентрацию cn. Она для идеального газа определяется так:
cn = n/V = P/(R *T).
Пример задачи
Необходимо рассчитать молярную концентрацию молекул кислорода в воздухе при нормальных условиях.
Для решения этой задачи вспомним, что в воздухе находится 21 % кислорода. В соответствии с законом Дальтона кислород создает парциальное давление 0,21*P0, где P0 = 101325 Па (одна атмосфера). Нормальные условия также предполагают температуру 0 oC (273,15 К).
Мы знаем все необходимые параметры для вычисления молярной концентрации кислорода в воздухе. Получаем:
cn(O2) = P/(R *T) = 0,21*101325/(8,314*273,15) = 9,37 моль/м3.
Если эту концентрацию привести к объему 1 литр, то мы получим значение 0,009 моль/л.
Чтобы понять, сколько молекул O2 содержится в 1 литре воздуха, следует умножить рассчитанную концентрацию на число NA. Выполнив эту процедуру, получим огромное значение: N(O2) = 5,64*1021 молекул.
Молекулярно-кинетическая теория (МКТ) — раздел молекулярной физики, изучающий свойства вещества на основе представлений об их молекулярном строении и определенных законах взаимодействия между атомами (молекулами), из которых состоит вещество.
Основные положения МКТ
? Все вещества состоят из молекул
Это было подтверждено с помощью фотографий, полученных с использованием электронного микроскопа.
? Между молекулами есть промежутки
Существование промежутков доказывают разные объемы жидкостей до смешивания и после нее. Так, объем смеси воды и спирта меньше суммы объемов воды и спирта до их смешивания.
При нагревании промежутки между молекулами увеличиваются, а при охлаждении уменьшаются. Исключение составляет вода и резина. У воды промежутки между молекулами при охлаждении увеличиваются. У резины промежутки между молекулами при нагревании уменьшаются.
? Молекулы движутся
Движение молекул доказывает существование явления диффузии.
Определение
Диффузия — перемешивание веществ без постороннего воздействия.
Чем быстрее молекулы движутся, тем выше температура вещества. И наоборот. Поэтому скорость диффузии зависит от температуры вещества.
Броуновское движение — тепловое движение частиц под действием молекул вещества, в котором эти частицы взвешены.
?Молекулы взаимодействуют
Доказательством служит склеивание двух плоских стекол, смоченных водой. На расстоянии, сравнимых с размерами молекул, заметнее проявляется притяжение. При уменьшении расстояний заметнее проявляется отталкивание.
Свойства твердых, жидких и газообразных веществ
|
Агрегатное состояние вещества |
Сохраняет объем |
Сохраняет форму |
Особые свойства |
|
Твердое тело |
+ |
+ |
– |
|
Жидкость |
+ |
– |
Текучесть |
|
Газ |
– |
– |
Летучесть |
Строение твердых, жидких и газообразных веществ
|
Твердое тело |
Жидкость |
Газ |
|
|
Строение |
|
|
|
|
Расстояние между молекулами |
Сравнимо с размером молекул |
Чуть больше, чем в твердом состоянии |
Многократно превышает размеры молекул |
|
Характер движения |
Колебательное |
Скачкообразное |
Хаотическое |
|
Скорости молекул |
Малы |
Скорее малы |
Огромны |
|
Взаимодействие между молекулами |
Наибольшее |
Меньше, чем у твердых тел |
Наименьшее |
Важно! Химический состав молекул не зависит от агрегатного состояния.
Микроскопические параметры вещества
К микроскопическим параметрам вещества относят параметры одной частицы этого вещества.
Относительная атомная масса
Определение
Относительная атомная масса — значение массы атома, выраженное в атомных единицах массы (а.е.м.).
Относительная атомная масса обозначается Ar. Это безразмерная величина, определяющаяся как отношение массы атома данного элемента к 1⁄12 массе нейтрального атома изотопа углерода 12C:
Ar=m0112m0C
m0 — масса одного атома, m0С — масса атома углерода.
Внимание! Относительную атомную массу можно узнать из таблицы Менделеева.
Пример №1. Определить по таблице Менделеева относительную атомную массу хлора.
В таблице Менделеева относительная атомная масса указывается под названием химического элемента:
Видно, что Ar = 35,453 а.е.м. При решении задач это значение обычно округляют до 35,5 а.е.м.
Относительная молекулярная масса
Определение
Относительная молекулярная масса — масса молекулы, выраженная в а.е.м.
Относительная молекулярная масса обозначается Mr. Это безразмерная величина, равная сумме относительных масс атомов, входящих в состав молекулы:
Mr=∑Ar
Пример №2. Определить относительную молекулярную массу озона.
В молекуле озона содержится 3 атома кислорода. Следовательно:
Mr=3Ar=16·3=48 (а.е.м.)
Количество вещества
Определение
Количество вещества — физическая величина, отображающая количество молекул (атомов) в веществе.
Количество вещества обозначается как ν («ню»). Единица измерения — моль.
Моль — количество вещества, в котором содержится столько же молекул (атомов), сколько содержится атомов в 12 г углерода.
Количество вещества определяется формулой:
ν=NNA
N — количество молекул (атомов) в веществе, NA — количество частиц в одном моле вещества (постоянная Авогадро).
Единица измерения постоянной Авогадро — 1/моль, или моль–1. В 1 моле содержится 6∙1023 частиц вещества. Именно столько атомов содержит 1 моль (или 12 г) углерода.
Пример №3. В баллоне находится 3∙1025 молекул газа. Определите количество вещества в баллоне.
ν=NNA=3·10256·1023=0,5∙102=50 (моль)
Молярная масса
Определение
Молярная масса — масса одного моля вещества.
Молярная масса обозначается как M. Единица измерения — килограмм на моль (кг/моль, но можно использовать и грамм на моль!). Численно молярная масса равна произведению относительной молекулярной массы на 10–3 (только для килограмма!):
M=Mr•10−3
Пример №4. Определить молярную массу озона.
Относительная молекулярная масса озона равна 48 а.е.м. Поэтому:
M=Mr•10−3=48•10−3 (кгмоль)
Масса молекулы
Масса молекулы — масса одной молекулы вещества, выраженная в килограммах (кг).
Масса молекулы обозначается как m0. Численно она равна отношению молярной массы к количеству частиц вещества в одном моле (или отношению массы вещества к количеству частиц, содержащихся в нем):
m0=MNA=mN
Отсюда отношение количества молекул к постоянной Авогадро равно отношению массы вещества к его молярной массе. Следовательно, количество вещества можно определить также формулой:
ν=mM
Пример №5. Определить массу одной молекулы озона.
m0=MNA=486•1023=8•10−23 (кг)
Плотность, масса вещества и концентрация частиц
Определение
Плотность вещества — масса одного кубического метра вещества.
Плотность вещества обозначается как ρ. Единица измерения — килограммы на кубический метр (кг/м3). Численно плотность равна отношению массы вещества к объему, который оно занимает:
ρ=mV
m — масса вещества, которое занимает объем V.
Определение
Концентрация частиц — физическая величина, равная отношению числа частиц к объему, который они занимают.
Концентрация частиц обозначается как n. Единица измерения — 1/м3. Определяется формулой:
n=NV
Поэтому плотность можно выразить через объем, равный отношению числа частиц к концентрации этих частиц:
ρ=mV=mnN
При делении массы вещества на количество содержащихся в нем частиц мы получим массу одной частицы — m0. Поэтому плотность вещества также равна:
ρ=mnN=m0n
Отсюда концентрация вещества также равна:
n=ρm0
Масса вещества определяется произведением плотности вещества на его объем (или количеством вещества на молярную массу):
m=ρV=νM
Пример №6. Определить массу 5 молей озона.
m=νM=5•48•10−3=240•10−3=0,24 (кг)
Через массу вещества можно также выразить количество этого вещества:
ν=mM=ρVM
Количество атомов и молекул
Количество молекул N определяется произведением количества вещества на число частиц в одном моле или произведением концентрации частиц на объем вещества:
Nмол=νNA=nV
Количество атомов в веществе выражается формулой:
Nатом=kNмол
k — количество атомов в одной молекуле.
Пример №7. В баллоне находится 4 моль газа. Сколько примерно молекул газа находится в баллоне?
Nмол=νNA=4∙6∙1023=24∙1023 (молекул)
Подсказки к задачам
Если двухатомный газ перешел в одноатомное состояние, то 1 моль газа превращается в 2 моля:
ν2 = 2ν1
Но молярная масса при этом уменьшается вдвое:
M2 = 0,5M1
Чтобы перевести плотность из г/см3 в кг/м3, нужно умножить ее значение в г/см3 на 1000:
1 г/см3∙1000 = 1 кг/м3
Если 1 каплю масла объемом V вылить в воду, и она растечется, образовав пленку толщиной в 1 молекулу и площадью S, то диаметр молекулы d будет равен:
d=VS
Объем капли можно вычислить по формуле:
V=mρ
Площадь пятна:
S=πR2=πD24
Задание EF18524
Расстояние между молекулами вещества много больше размеров самих молекул. Двигаясь во всех направлениях, молекулы быстро распределяются по всему сосуду. В каком состоянии находится вещество?
Ответ:
а) в газообразном
б) в жидком
в) в твёрдом
г) в газообразном или жидком
Алгоритм решения
- Выделить из описания параметры, характер которых может указывать на вид агрегатного состояния вещества.
- Установить, какому агрегатному состоянию соответствуют указанные значения этих параметров.
Решение
В условиях задачи обозначается:
- расстояние между молекулами вещества;
- характер движения молекул;
- свойство вещества, связанное с характером заполнения им сосуда.
Если расстояние между молекулами намного больше размеров самих молекул, то вещество находится в газообразном состоянии. Это подтверждают хаотичное движение молекул и способность вещества заполнять весь предоставленный ему объем.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18208
Молекулы газов находятся в среднем на больших расстояниях друг от друга по сравнению с их размерами, силы взаимодействия между ними незначительны. Этим можно объяснить следующие свойства газов.
А. Газ не сохраняет своей формы.
Б. Газ не сохраняет своего объёма.
В. Газ имеет большую сжимаемость.
Какое(-ие) из утверждений правильно(-ы)?
Алгоритм решения
- Установить, как влияет большое расстояние между молекулами на свойства газов.
- Выбрать правильные варианты ответов и записать их в алфавитном порядке.
Решение
Так как между молекулами газа большое расстояние, они слабо взаимодействуют друг с другом. Практически полное отсутствие сил притяжения позволяет двигаться им хаотически, что способствует быстрому заполнению газом объема сосуда. Причем неважно, какой объем и какую форму имеет сосуд. Следовательно, верными ответами можно считать как А, так и Б.
Теперь проверим последний вариант. Газы действительно обладают большой сжимаемостью. Это можно объяснить тем, что отталкиваются молекулы при расстояниях, которые меньше размеров самих молекул. Но в газах это расстояние намного больше. Поэтому, прежде чем возникнет отталкивание, газ можно будет легко сжать в несколько раз. Следовательно, ответ В тоже верен.
Ответ: АБВ
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 4.8k