Концентрация ионов натрия в растворе хлорида натрия
Вычислите концентрацию ионов натрия (Na+) (в моль/л) в 1,17-процентном растворе хлорида натрия (NaCl), приняв плотность раствора равной 1 г/см3.
Решение задачи
Вычислим массу раствора хлорида натрия по формуле, устанавливающей связь между массой и объемом:
Получаем:
m = 1000 мл ∙ 1 г/мл = 1000 (г).
Найдем массу хлорида натрия (NaCl), содержащегося в 1 л раствора, для этого составим пропорцию:
в 100 г раствора содержится 1,17 г NaCl
в 1000 г раствора содержится г NaCl
Откуда:
Учитывая, что молярная масса хлорида натрия (NaCl) равна 58,5 г/моль, рассчитаем химическое количество хлорида натрия (NaCl), используя формулу, устанавливающую связь между химическим количеством вещества и массой:
Получаем:
Из уравнения диссоциации хлорида натрия (NaCl) (отмечу, что соли в разбавленных растворах диссоциируют полностью):
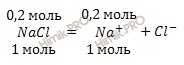
Найдем молярную концентрацию ионов натрия по формуле:
Получаем:
Ответ: концентрацию ионов натрия 0,2 моль/л.
Расчет концентрации ионов в растворе нескольких веществ
В
данном случае равновесие, устанавливающееся
при диссоциации слабого электролита,
может быть смещено под действием ионов,
образующихся при диссоциации другого
электролита, если эти ионы также являются
продуктом диссоциации первого электролита.
Пример
5
Рассчитать
концентрацию ионов ClO—
в растворе, 500 мл которого содержат 0.005
моля HClO
и 0.0005 моля HCl.
Решение
Концентрации
веществ в данном растворе равны
См(HClO)
= (
HClO)/V=0.005
моль/0.5 л =0.01 моль/л;
См(HCl)
= (
HCl)/V
= 0.0005 моль/0.5 л = 0.001 моль/л.
Их
схемы диссоциации
HClO
H+
+ ClO—,
HCl
H+
+ Cl—
видно,
что при диссоциации обоих веществ
образуется ион H+.
Однако, если диссоциация HCl
необратима, то диссоциация HClO
является обратимым процессом, описываемым
константой равновесия
Ка=
[H+][OCl—]/[HClO]
= 510-8.
Равновесная
концентрация водорода будет определяться
диссоциацией обоих веществ:
[H+]1=
См(HClO)
— слабый электролит (1);
[H+]2=
См(HCl)
= См(HCl)
= 0.001 моль/л – сильный электролит (=1);
[H+]
= [H+]1
+ [H+]2
= = [H+]1
+ 0.001 = х +0.001.
Равновесные
концентрации ионов ClO—
и молекул НClO
определяются диссоциацией первого
вещества:
[OCl—]=
См(HClO)
= [H+]1=
х,
[HClO]
= См(HClO)
— х = 0.01- х,
а
равновесная концентрация ионов Cl—
— диссоциацией второго вещества:
[Cl—]=
См(HCl)
= 0.01 моль/л.
Подставляя
значения равновесных концентраций в
выражение для константы равновесия,
получим уравнение
(х+0.001)х
/ (0.01-х) = 510-8.
Его
можно решить как квадратичное уравнение,
однако целесообразно предположить, что
х
0.001 и, следовательно, х
0.01, тогда
0.001х
/ 0.01 = 510-8,
откуда
х = [OCl—]=
510-7
моль/л, что действительно удовлетворяет
указанному выше предположению.
Задачи для самостоятельного решения
-
Вычислить
концентрацию ионов натрия и сульфат-ионов
в 5%- растворе сульфата натрия (=1.042
г/мл). -
Сколько
воды необходимо прибавить к 100 мл 0.01 М
раствора синильной кислоты HCN,
чтобы степень диссоциации кислоты
возросла в 4 раза? Как изменится рН
раствора? -
Во
сколько раз изменится степень диссоциации
HCN,
если к полученному в предыдущей задаче
раствору добавить 0.1 г HNO3?
-
Определить
рН 0.01М раствора гидроксида калия. -
Перекись
водорода Н2О2
является слабой кислотой. Вычислить
степень диссоциации и рН 1М раствора
перекиси водорода, если Ка=1.410-12. -
Рассчитать
концентрацию ионов НО2—
в растворе, 1 л которого содержит 1 моль
перекиси водорода и 0.001 моля HCl.
-
Вычислить
концентрацию хлорид-ионов в 0.03 М растворе
хлорида бария. -
Рассчитать
концентрации всех ионов, образующихся
при диссоциации H2S
в его 0.05 М растворе. -
К
0.2 М раствору HCN
добавили такое количество KCN,
что концентрация соли в растворе стала
равна 0.02 моль/л. Как изменится при этом
степень диссоциации синильной кислоты?
-
Определить
рН2%- раствора гидроксида натрия (=1.021
г/мл). -
Найти
концентрацию NH4OH,
при которой ее степень диссоциации
равна 2%. Вычислить концентрацию ионов
водорода в таком растворе. -
Как
изменится рН, если к 1 л 1 М раствора
гидроксида аммония прибавить 100 мл
20%- раствора хлорида аммония (=1.057
г/мл)?
-
Какой
раствор имеет более щелочную среду:
2%- раствор КОН (=1.016
г/мл) или 1.6%- раствор NaOH
(=1.016
г/мл)? -
Степень
диссоциации хлорноватистой кислоты
HClO
в ее 0.001 М растворе равна 0.71%. Определите
константу диссоциации и рН раствора. -
Рассчитать
концентрацию ионов ClO—
в растворе, 150 мл которого содержат 1.5
10-3
молей HClO
и 1.5 10-3
молей HCl.
-
Вычислить
концентрацию ClO4—
ионов в растворе, содержащем 3 г хлорной
кислоты HClO4
в 300 мл раствора. -
Определить
константу диссоциации плавиковой
кислоты HF
и рН раствора, если ее степень диссоциации
в 0.25 М растворе равна 5.1%. -
В
каком объемном отношении необходимо
смешать растворы из заданий 6.1 и 6.2,
чтобы степень диссоциации HF
уменьшилась в 6 раз?
-
Какую
массу КОН надо растворить в 1 л воды,
чтобы рН полученного раствора стал
равен 12? -
Степень
диссоциации бромноватистой кислоты
HBrO
в растворе и рН раствора соответственно
равны 0.04% и 5.3. Определить концентрацию
раствора кислоты и константу ее
диссоциации. -
Какую
массу КBrO
надо добавить к 1 л раствора HBrO
из предыдущего задания, чтобы концентрация
ионов водорода уменьшилась в 5 раз
-
Рассчитать
концентрации ионов бария и хлорид-ионов
в 3%- растворе хлорида бария BaCl2
(=1.025
г/мл). -
Во
сколько раз изменится степень диссоциации
и на сколько единиц изменится рН, если
раствор слабого электролита разбавить
в 100 раз? -
Во
сколько раз изменится степень диссоциации
слабого электролита, если в раствор
добавить соль, имеющую со слабым
электролитом одинаковые ионы, а
концентрации соли и слабого электролита
равны? Задачу решить в общем виде.
-
Вычислить
концентрацию нитрат-ионов в 0.02 М растворе
Al(NO3)3. -
Определить
концентрации всех ионов в 0.01 М растворе
угольной кислоты. -
К
0.1 М раствору HClO
добавили такое количество КClO,
что концентрация соли в растворе стала
равна 0.005 моль/л. Как изменилась степень
диссоциации кислоты?
-
Вычислить
концентрацию ионов Sr2+
и NO3—
в 8%- растворе Sr(NO3)2
(=1.072г/мл). -
Какой
объем воды необходимо прибавить к 300
мл 0.0025 М- раствора H2S,
чтобы степень диссоциации кислоты
возросла в 3 раза? Как изменится рН
раствора? -
Во
сколько раз изменится степень диссоциации
кислоты в полученном в предыдущей
задаче растворе, если к нему добавить
1 г серной кислоты?
-
Рассчитать
рН 0.3%- раствора HClO4
(=1.002
г/мл). -
Вычислить
степень диссоциации и рН в 0.01 М растворе
HClO. -
Рассчитать
концентрацию ионов ClО—
в растворе, 1 мл которого содержит
110-5
моля HClO
и 110-6
моля HCl.
-
Рассчитать
рН 0.2%- раствора Ва(ОН)2
(=1.002
г/мл). -
Рассчитать
концентрацию HClO,
при которой ее степень диссоциации
равна 0.2%. Вычислить рН такого раствора. -
Как
изменится рН раствора предыдущей
задачи, если к 2 л раствора прибавить 1
мл 2%- раствора KClO
(=1.013
г/мл)?
-
Какой
раствор имеет более кислую среду: 1%
-раствор HCl
(=1.003
г/мл) или 1%- раствор HClO4
(=1.005
г/мл)? -
Определить
константу диссоциации и степень
диссоциации NH4OH,
если рН его 0.1 М раствора равен 11.13. -
Рассчитать
концентрацию ионов аммония в растворе,
300 мл которого содержат 0.1 моля NH4OH
и 0.1 моля КОН.
-
Какую
массу гидроксида натрия необходимо
растворить в 3 л воды, чтобы рН полученного
раствора стал равен 11.5? -
Степень
диссоциации HClO
в растворе и рН раствора равны
соответственно 0.63% и 5.1. Рассчитать
концентрацию раствора и константу
диссоциации кислоты. -
Какую
массу КClO
надо добавить к 1 л раствора кислоты из
предыдущей задачи, чтобы концентрация
ионов водорода уменьшилась в 7 раз?
-
Вычислить
концентрацию ионов натрия и ионов
водорода в растворе, 200 мл которого
содержит 0.8 г гидроксида натрия. -
Определить
константу диссоциации NH4OH
и рН раствора, если степень диссоциации
этого основания в 0.2 М растворе равна
0.95%. -
В
каком объемном отношении следует
смешать растворы из заданий 15.1 и 15.2,
чтобы степень диссоциации NH4OH
уменьшилась в 20 раз?
-
Рассчитать
концентрации ионов калия и ионов HPO42-
в 3% -растворе K2HPO4
(=1.021
г/мл). -
Какой
объем воды необходимо прибавить к 20 мл
0.1 М- раствора NH4OH,
чтобы степень диссоциации этого
основания возросла в 10 раз? Как изменится
рН раствора? -
Как
изменится степень диссоциации NH4OH,
если к полученному в предыдущей задаче
раствору добавить 1 г NаOH?
-
Вычислить
концентрацию ионов бария и нитрат-ионов
в 0.003 М- растворе Ва(NО3)2. -
Рассчитать
концентрации ионов Н+,
Н2РО3—
и НРО32-
в 0.8 М- растворе фосфористой кислоты,
если ее константы диссоциации равны
Ка1=1.6
10-3
и Ка2=6.310-7. -
К
0.15 М- раствору NH4OH
добавили такое количество NH4Cl,
что концентрация соли в растворе стала
равна 0.2 моль/л. Рассчитать рН полученного
раствора.
-
Рассчитать
рН 0.2%- раствора азотной кислоты (=1.001
г/мл). -
Рассчитать
степень диссоциации и рН 0.1 М раствора
НСN. -
Рассчитать
концентрацию ионов СN—
в растворе, 2 л которого содержат 0.1 моля
НСN
и 0.0005 моля HCl.
-
Рассчитать
концентрацию ионов SO42-
в 3%- растворе Al2(SO4)3
(=1.025
г/мл). -
Рассчитать
степень диссоциации и концентрацию
угольной кислоты в растворе, если рН
раствора равен 4.5. -
Какую
массу азотной кислоты достаточно
растворить в 100 мл 0.02 М раствора угольной
кислоты, чтобы степень диссоциации
Н2СО3
уменьшилась в 150 раз?
-
Рассчитать
рН 0.1%- раствора соляной кислоты (=1.00
г/мл). -
Определить
константу диссоциации и степень
диссоциации HBrO,
если рН 0.001 М раствора этой кислоты
равен 5.85. -
Рассчитать
концентрацию ионов BrO—
в растворе, 200 мл которого содержат 0.01
моля HBrO
и 0.005 моля HBr.
-
Какую
массу LiOH
необходимо растворить в 1 л воды, чтобы
рН полученного раствора стал равен 11? -
Степень
диссоциации NH4OH
в растворе и рН раствора равны
соответственно 1.8% и 11. Рассчитать
концентрацию раствора и константу
диссоциации основания. -
Какую
массу NH4Cl
надо добавить к 1 л раствора предыдущей
задачи, чтобы концентрация ионов
водорода увеличилась в 10 раз?
-
Рассчитать
концентрацию ионов хлора в растворе,
в 100 л которого содержится 0.5 г ВаCl2. -
Определить
константу диссоциации HBrO
и рН раствора, если степень диссоциации
HBrO
в 0.01 М растворе равна 0.0447%. -
Какую
массу КBrO
необходимо добавить к 1 л раствора
предыдущей задачи, чтобы степень
диссоциации HBrO
уменьшилась в 10 раз?
-
Какую
массу азотной кислоты необходимо
растворить в 200 мл воды, чтобы рН
полученного раствора стал равен 2.5? -
Степень
диссоциации НСN
и рН раствора равны соответственно
0.089% и 6.05. Определить концентрацию
раствора и константу диссоциации
кислоты. -
Какую
массу КСN
необходимо добавить к 1 л раствора
предыдущей задачи, чтобы концентрация
ионов водорода уменьшилась в 200 раз?
-
Рассчитать
концентрации ионов калия и карбонат-ионов
в 5.2%- растворе К2СО3
(=1.044
г/мл). -
Какой
объем воды необходимо добавить к 10 мл
0.02 М раствора Н2СО3,
чтобы степень диссоциации кислоты
увеличилась в 2 раза? Как при этом
изменится рН раствора? -
Во
сколько раз изменится степень диссоциации
угольной кислоты в полученном в
предыдущей задаче растворе, если к нему
прибавить 0.001 г азотной кислоты?
-
Рассчитать
концентрации ионов алюминия и хлора в
0.2 М- растворе хлорида алюминия. -
Рассчитать
степень диссоциации H2S
и концентрацию кислоты, если рН раствора
равен 5.3. -
Какую
массу NaHS
достаточно растворить в 750 мл 0.001 М-
раствора H2S,
чтобы степень диссоциации кислоты
уменьшилась в 10 раз?
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Рекомендуемые сообщения
Решение задач по фото за 30 минут! Мы онлайн – кликай!
-
- Поделиться
Как рассчитывают концентрацию ионов в растворах солей? Поясните на примере, пожалуйста: рассчитать концентрацию катионов в 0,2 М растворе Na2SO4
Ссылка на комментарий
—>
- Решение
- Решение
-
- Поделиться
Вы рассчитываете массу катиона (в данном случае Na+) относительно всего раствора.
Ссылка на комментарий
- Автор
-
- Поделиться
Вы рассчитываете массу катиона (в данном случае Na+) относительно всего раствора.
спасибо
Ссылка на комментарий
-
- Поделиться
В 0,2 молярном растворе содержиться 142×0.2=28.4 грамма.
142-28.4
46-х=9.2
9.2-х ~0.65моль/литр.
28.4 — 0.2 моль
Ответ 0.65 моль/литр
Ссылка на комментарий
- Автор
-
- Поделиться
В 0,2 молярном растворе содержиться 142×0.2=28.4 грамма.
142-28.4
46-х=9.2
9.2-х ~0.65моль/литр.
28.4 — 0.2 моль
Ответ 0.65 моль/литр
Я рассчитывала так:
Na2SO4 —> 2Na+ + SO4 2-
C [Na+] = Cм * 2 = 0,2 * 2 = 0,4 моль/л
Получается, неверный ход решения?
Ссылка на комментарий
-
- Поделиться
0.2 моль/литр концентрация всего сульфата. Нужна отдельно массу катиона — два натрия 23×2=46
46-х=0,65
142-0.2
Более просто и короче
Ссылка на комментарий
- Автор
-
- Поделиться
0.2 моль/литр концентрация всего сульфата. Нужна отдельно массу катиона — два натрия 23×2=46
46-х=0,65
142-0.2
Более просто и короче
поняла, спасибо за помощь)
Ссылка на комментарий
-
- Поделиться
Я рассчитывала так:
Na2SO4 —> 2Na+ + SO4 2-
C [Na+] = Cм * 2 = 0,2 * 2 = 0,4 моль/л
Получается, неверный ход решения?
Верный.
Для чего находить массу, и строить какие-то дикие пропорции, если вам нужна молярная концентрация,
когда ответ виден сразу из формулы соли — непонятно
Изменено 10 Апреля, 2016 в 12:45 пользователем M_GM
Ссылка на комментарий
-
- Поделиться
Черт! Я решал как процентную концентрацию!
Например. Берем 20 % раствор сульфата натрия. Определяем конц ионов натрия по верхним 《диким пропорциям》 и вуаля процентная конц катиона равна 6.2%.
Извиняюсь за дезинформацию.
Ссылка на комментарий
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти
1, Определить концентрацию ионов натрия в моль / л и г / л в 0, 01М растворе Nal, считая диссоциацию полной.
2. Определить рН 0, 02 М раствора Н2СО3 , учитывая только первую ступень диссоциации, для которой Кдис = 4, 5 * 10 ^ — 7.
3. Определить молярную концентрацию 0, 106% раствора Na2СОз (р = 1 г / мл).
5. Определить растворимость соли СаF2, если произведение растворимости данной соли равно 4• 10 ^ ( — 11)?
Вы находитесь на странице вопроса 1, Определить концентрацию ионов натрия в моль / л и г / л в 0, 01М растворе Nal, считая диссоциацию полной? из категории Химия.
Уровень сложности вопроса рассчитан на учащихся 10 — 11 классов. На странице
можно узнать правильный ответ, сверить его со своим вариантом и обсудить
возможные версии с другими пользователями сайта посредством обратной связи.
Если ответ вызывает сомнения или покажется вам неполным, для проверки
найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте
новый вопрос, используя ключевые слова: введите вопрос в поисковую строку,
нажав кнопку в верхней части страницы.



