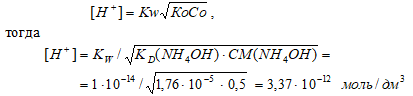Расчет рН растворов сильных и слабых электролитов
Сильные
кислоты и основания
(табл.2.1) в растворах диссоциируют пол-
ностью,
поэтому концентрация ионов водорода и
ионов гидроксила равна
общей
концентрации сильного электролита.
Для
сильных оснований:
[OH—]
= См;
для
сильных
кислот:
[H+]
=
См.
Таблица
2.1
Сильные электролиты
-
Класс
Формулы
электролитовКислота
HNO3,
H2SO4,
HCl, HBr, HI, HMnO4,
HClO4Основание
LiOH ,
KOH, RbOH, CsOH, NaOH, Ba(OH)2,
Ca(OH)2,
Sr(OH)2Соль
Растворимые
соли
Слабым
электролитом
принято считать химические соединения,
молекулы которых даже в сильно разбавленных
растворах не полностью диссоциируют
на ионы. Степень диссоциации слабых
электролитов для децимолярных растворов
(0,1М) меньше 3%. Примеры слабых электролитов:
все органические кислоты, некоторые
неорганические кислоты (например, H2S,
HCN), большинство гидроксидов (например,
Zn(OH)2,
Cu(OH)2).
Для
растворов слабых
кислот
концентрация ионов водорода [H+]
в растворе рассчитывается по формуле:
где:
Кк –
константа диссоциации слабой кислоты;
Ск –
концентрация кислоты, моль/дм3.
Для
растворов слабых
оснований
концентрация гидроксильных ионов
рассчитывается по формуле:
где:
Ко –
константа диссоциации слабого основания;
Сосн. –
концентрация основания, моль/дм3.
Таблица
2.2
Константы диссоциации слабых кислот и оснований при 25 оС
|
Формула |
Константа |
|
СH3COOH |
1,86 |
|
HCN |
7,2 |
|
HOCl |
5,0 |
|
HBO2 |
7,5 |
|
HOBr |
2,5 |
|
HF |
6,2 |
|
HNO2 |
5,1 |
|
HIO |
2,3 |
|
HOCN |
2,7 |
|
NH4OH |
1,79 |
|
AgOH |
5,0 |
2.2.
Примеры решения индивидуального задания
Пример
№1.
Условие
задания: Определить
концентрацию
водородных и гидроксильных ионов в
растворе, если
рН =5,5.
Решение
Концентрация
ионов водорода рассчитывается по
формуле:
[Н+]
= 10-рН
[Н+]
= 10-5,5
=
3,16 •10-6
моль/дм3
Концентрация
гидроксильных ионов рассчитывается по
формуле:
[OН—]
= 10-рOН
рОН
= 14 – рН = 14 – 5,5 = 8,5
[OН—]
= 10 -8,5
=
3 • 10-9
моль/дм3
Пример
№ 2.
Условие
задания: Вычислить
рН 0,001 М раствора HС1.
Решение
Кислота
HС1 является сильным электролитом
(табл.2.1) и в разбавленных растворах
практически полностью диссоциирует на
ионы:
HС1⇄
Н+
+
С1—
Поэтому
концентрация ионов [Н+]
равна общей концентрации кислоты:
[Н+]
= См = 0,001 М.
[Н+]
= 0,001= 1·10-3
моль/дм3
Тогда:
рН
= – lg[H+]
= – lg 1 • 10-3
= 3
Пример
№ 3.
Условие
задания:
Вычислить
рН 0,002 М раствора NaOH.
Решение
Основание
NaOH является сильным электролитом
(табл.2.1) и в разбавленных растворах
практически полностью диссоциирует на
ионы:
NaOH
⇄Na++OH—
Поэтому
концентрация гидроксильных ионов равна
общей концентрации основания: [ОH—]=
См
= 0,002
М.
Тогда:
рОН
= – lg[ОН—]
= – lgСм = – lg 2 •10-3
= 2,7
Исходя
из формулы: рН + рОН = 14, находим рН
раствора:
рН
= 14 – 2,7 = 11,3
Пример
№4.
Условие
задания: Вычислить
рН 0,04 М раствора NH4OH,
если
константа диссоциации Кд(NH4OH)
= 1,79·10-5
(табл.2.2).
Решение
Основание
NH4OH
является слабым электролитом и в
разбавленных растворах очень незначительно
диссоциирует на ионы.
Концентрация
гидроксильных ионов [ОH—]
в растворе слабого основания рассчитывается
по формуле:
моль/дм3
рОН
= – lg[ОH—]
= – lg 8,5·10-2
= 1,1
Исходя
из формулы: рН + рОН = 14, находим рН
раствора:
рН
= 14 – рOН = 14 – 1,1 = 12,9
Пример
№5.
Условие
задания: Вычислить
рН
0,17
М раствора
уксусной
кислоты (CH3COOH),
если константа диссоциации Кд(CH3COOH)
= 1,86 • 10-5
(табл.2.2).
Решение
Кислота
CH3COOH
является слабым электролитом и в
разбавленных растворах очень незначительно
диссоциирует на ионы.
Концентрация
ионов водорода [H+]
в растворе слабой кислоты рассчитывается
по формуле:
Тогда:
моль/дм3
Вычисляем
pH
раствора по формуле: рН = – lg [H+]
pH
= – lg 1,78 • 10-3
=
2,75
2.3.
Индивидуальные задания
Условия
заданий
(табл.
2.3):
Задание
№ 1.
Вычислить концентрацию водородных и
гидроксильных ионов в растворе при
определенном значении рН (см. пример №
1);
Задание
№ 2.
Вычислить рН раствора сильного электролита
(кислоты, основания) при заданной
концентрации (см. пример № 2, 3);
Задание
№ 3.
Вычислить рН раствора слабого электролита
(кислоты, основания) при заданной
концентрации (см. пример № 4, 5).
Таблица
2.3
Состав
исследуемой воды
|
№ задания |
Условия |
||||
|
Задание № 1 |
Задание |
Задание |
|||
|
рН |
Сильный |
Концентрация, |
Слабый электролит |
Концентрация, |
|
|
1 |
6,05 |
НСl |
0,033 |
NH4OH |
0,01 |
|
2 |
8,5 |
HNO3 |
0,091 |
HCN |
0,09 |
|
3 |
5,5 |
HI |
0,032 |
HOCl |
0,05 |
|
4 |
7,7 |
NaOH |
0,054 |
HBO2 |
0,36 |
|
5 |
6,3 |
HBr |
0,076 |
HOBr |
0,22 |
|
6 |
6,5 |
KOH |
0,045 |
HF |
0,63 |
|
7 |
8,9 |
HClO4 |
0,027 |
HNO2 |
0,55 |
|
8 |
8,5 |
HMnO4 |
0,005 |
HOI |
0,03 |
|
9 |
6,5 |
CsOH |
0,008 |
HOCN |
0,19 |
|
10 |
6,1 |
HNO3 |
0,004 |
NH4OH |
0,082 |
|
11 |
6,5 |
HI |
0,001 |
AgOH |
0,04 |
|
12 |
6,9 |
LiOH |
0,009 |
СH3COOH |
0,26 |
|
13 |
8,8 |
HBr |
0,005 |
HCN |
0,075 |
|
14 |
6,9 |
RbOH |
0,036 |
HOCl |
0,07 |
|
15 |
7,3 |
HClO4 |
0,0022 |
HBO2 |
0,15 |
|
16 |
6,3 |
HMnO4 |
0,063 |
HOBr |
0,23 |
|
17 |
7,4 |
KOH |
0,055 |
HF |
0,34 |
|
18 |
6,7 |
HNO3 |
0,003 |
HNO2 |
0,18 |
|
19 |
8,2 |
HI |
0,019 |
HOI |
0,39 |
|
20 |
8,3 |
HNO3 |
0,082 |
HOCN |
0,15 |
|
21 |
6,1 |
CsOH |
0,004 |
NH4OH |
0,33 |
|
22 |
6,9 |
HCl |
0,026 |
AgOH |
0,091 |
|
23 |
8,2 |
HClO4 |
0,075 |
HBO2 |
0,32 |
|
24 |
8,6 |
HMnO4 |
0,007 |
HOBr |
0,054 |
|
25 |
8,5 |
LiOH |
0,015 |
HF |
0,076 |
|
26 |
8,2 |
HNO3 |
0,0023 |
HNO2 |
0,045 |
|
27 |
8,0 |
HI |
0,034 |
HOI |
0,27 |
Продолжение
табл. 2.3
|
28 |
7,9 |
NaOH |
0,018 |
HOCN |
0,35 |
|
29 |
7,9 |
HBr |
0,039 |
NH4OH |
0,08 |
|
30 |
8,1 |
HCl |
0,015 |
AgOH |
0,4 |
|
31 |
6,1 |
HNO3 |
0,003 |
NH4OH |
0,032 |
|
32 |
6,5 |
HI |
0,002 |
AgOH |
0,02 |
|
33 |
6,9 |
LiOH |
0,008 |
СH3COOH |
0,24 |
|
34 |
8,8 |
HBr |
0,003 |
HCN |
0,073 |
|
35 |
6,9 |
RbOH |
0,033 |
HOCl |
0,072 |
|
36 |
7,3 |
HClO4 |
0,0012 |
HBO2 |
0,16 |
|
37 |
6,3 |
HMnO4 |
0,033 |
HOBr |
0,24 |
|
38 |
7,4 |
KOH |
0,045 |
HF |
0,35 |
|
39 |
6,7 |
HNO3 |
0,004 |
HNO2 |
0,28 |
|
40 |
8,2 |
HI |
0,029 |
HOI |
0,29 |
|
41 |
8,3 |
HNO3 |
0,081 |
HOCN |
0,05 |
|
42 |
6,1 |
CsOH |
0,006 |
NH4OH |
0,033 |
|
43 |
6,9 |
HCl |
0,023 |
AgOH |
0,29 |
|
44 |
8,2 |
HClO4 |
0,078 |
HBO2 |
0,62 |
|
45 |
8,6 |
HMnO4 |
0,006 |
HOBr |
0,024 |
|
46 |
8,5 |
LiOH |
0,012 |
HF |
0,036 |
|
47 |
8,2 |
HNO3 |
0,0021 |
HNO2 |
0,025 |
|
48 |
8,0 |
HI |
0,037 |
HOI |
0,027 |
|
49 |
7,9 |
NaOH |
0,013 |
HOCN |
0,015 |
|
50 |
7,9 |
HBr |
0,034 |
NH4OH |
0,08 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
10.02.20161.72 Mб14referat_turbaza.docx
- #
- #
- #
- #
- #
- #
Как правильно рассчитать концентрацию ионов водорода и рН в растворе серной кислоты
Задача 101.
Вычислите [Н+] и рН 0,01 М и 0,05 Н растворов Н2SO4.
Решение:
CM(Н2SO4) = 0,01 М;
CH(Н2SO4) = 0,05 М;
a) Вычисление [Н+] и рН 0,01 М раствора Н2SO4
Так как Н2SO4 двухосновная кислота и является сильным электролитом, то концентрация ионов водорода будет равна удвоенному значению ее молярности.
[Н+] = 2СМ(Н2SO4) = (2 · 0,01) = 2 · 10-2 моль/дм3;
рН = -lg[Н+] = -lg2 · 10-2 = 2 — lg2 = 2 — 0,30 = 1,70.
б) Вычисление [Н+] и рН 0,05 Н раствора Н2SO4
Так как Н2SO4 двухосновная кислота и является сильным электролитом, то концентрация ионов водорода будет равна ее нормальности.
[Н+] = СН(Н2SO4) = (1 · 0,05) = 5 · 10-2 моль/дм3;
рН = -lg[Н+] = -lg5 · 10-2 = 2 — lg5 = 2 — 0,70 = 1,30.
Ответ: а) [Н+] = 2 · 10–2 моль/дм3; рН = 1,70; б) [Н+] = 5 · 10–2 моль/дм3; рН = 1,30.
Задача 102.
Вычислите [Н+] и рН раствора Н2SO4 с массовой долей кислоты 0,5% (р = 1,00 г/см3).
Решение:
М(Н2SO4) = 98 г/моль;
w% = 0,5% или 0,005;
р = 1,00 г/см3.
1. Рассчитаем молярность раствора кислоты
CM(Н2SO4) = (w% · p · 1000)/М(Н2SO4) = (0,005 · 1,00 г/см3 · 1000 cм3)/98 г/моль = 0,05 M.
Так как Н2SO4 двухосновная кислота и является сильным электролитом, то концентрация ионов водорода будет равна удвоенному значению ее молярности.
[Н+] = 2СМ(Н2SO4) = (2 · 0,05) = 1 · 10-1 моль/дм3;
рН = -lg[Н+] = -lg1 · 10-1 = 1 — lg2 = 1 — 0,00 = 1,00.
Ответ: [Н+] = 0,1 моль/дм3;рН = 1,00.
Задача 103.
Вычислите [Н+] и рН 0,5 М раствора гидроксида аммония.
Решение:
КD(NH4OH) = 1,76 · 10–5;
CM(NH4OH) = 0,5 М.
Схема диссоциации NH4OH:
NH4OH ⇔ NН4+ + OH–
Поскольку КD(NH4OH) << CM(NH4OH) так как (1,76 · 10–5) << 0,5, то можно считать, что равновесная концентрация недиссоциированного основания равна его общей концентрации: СМ(NH4OH) = 0,5 моль/дм3.
Для слабых оснований [H+] вычисляют по формуле:
рН = -lg[Н+] = -lg3,37 · 10-12 = 12 — lg3,37 = 12 — 0,53 = 11,47.
Ответ: [Н+] = 3,37 · 10–12 моль/дм3;рН = 11,47.
Hydrogen ion concentration tells us how acidic or basic any given solution is. More hydrogen ions? More acidic. Fewer hydrogen ions? More basic. Pretty simple, right? Let’s take a look at how to define and calculate hydrogen ion concentration. First, you’ll see how you get hydrogen ions and hydroxide ions in water.
Self-Ionization of Water
Water self-ionizes to a small extent:
This is a simplification, as free hydrogen ions don’t actually exist in solution. This is what it actually looks like:
Through hydrogen bonding, the hydrogen ion associates with a water molecule to create H3O+, or hydronium. Thus when you calculate the hydrogen ion concentration, you are also calculating the hydronium ion concentration.
For water, the water ion product or Kw tells us the concentration of H+ or H3O+ and the concentration of OH— or hydroxide ions.
At 25 degrees Celsius, the experimentally determined value of KW is 1.0 x 10-14 M2.
Let’s take a look at how you can use your knowledge of dissociation and KW to calculate the hydrogen ion concentration for either strong acids or bases.
Calculating the Hydrogen Ion Concentration From Molarity of a Strong Acid
A strong acid increases the hydrogen ion concentration over hydroxide ions present.
An example is HCl:
Since HCl is a strong acid, it dissociates completely in water. So, let’s say that you have a 1.5M HCl solution. What is the hydrogen ion concentration?
Well, this is pretty simple and doesn’t even require any math! Since the acid dissociates completely the hydrogen ion concentration is the same as the molarity of the solution. In this case that means the concentration of hydrogen ions, or [H+], is 1.5M.
A strong base, on the other hand, has more hydroxide ions than hydrogen ions. Let’s say that you have a 0.1M solution of NaOH. What is the concentration of H+ in this case? Now, you’re going to need to use your knowledge of KW.
You know that since this strong base dissociates completely, the hydroxide, or OH-, concentration is equal to the molarity of the solution. [OH-] = 0.1 M.
So,
Solving for [H+] you get:
This makes sense! Since it is a basic solution there are way more hydroxide ions than there are hydrogen ions.
Calculating the Hydrogen Ion Concentration From pH
Now, dealing with scientific notation all the time to discuss hydrogen ion concentration is a little cumbersome. Instead, scientists use the pH scale.
Here is the definition of pH:
pH is the negative log of the hydrogen concentration. The letter p literally means negative log.
So, given a pH value of 5.5 you can find the hydrogen ion concentration:
Diving by negative one and taking the inverse log gives you:
Solving, you get:
The hydrogen ion concentration of a solution with pH = 5.5 is 3.2*10-6M. See, this is why talking about a pH is much easier than the whole long number you got for an answer! A pH of 5.5 tells you about acidity, and you can calculate the molarity if you need it.
What Do pKa Values Mean?
While calculating the concentration of hydrogen ions of strong acids is easy enough since they dissociate completely in solution, calculating the concentration of hydrogen ions in weak acids is just a little trickier. These acids do not completely ionize in water. Each acid has a tendency to lose a hydrogen ion in an aqueous solution. A stronger acid is more likely to lose its hydrogen ion than a weak acid.
Equilibrium constants for ionization reactions are calls acid dissociation constants (Ka). Stronger acids have a higher Ka while weaker acids have a lower Ka. Now, just as with hydrogen ion concentration, where you made the switch to pH instead of just H, scientists use pKa to indicate how strong or weak an acid is. With a higher tendency to lose a proton, the acid is stronger, and so the pKa is smaller.
Tips
-
The higher a pKa value, the weaker the acid; the lower the pKa value the stronger the acid.
pH раствора 4,4. Определить концентрацию ионов водорода в этом растворе.
Решение задачи
Перед решением данной задачи хочу напомнить, водородный показатель (pH) раствора численно равен десятичному логарифму концентрации ионов водорода в этом растворе.
Пусть искомая концентрация . Тогда, учитывая, что pH раствора 4,4, найдем концентрацию ионов водорода в этом растворе:
Таким образом,концентрация ионов водорода в растворе равна 4 ∙ 10-5 моль/л.
Ответ: концентрация ионов водорода = 4 ∙ 10-5 моль/л.