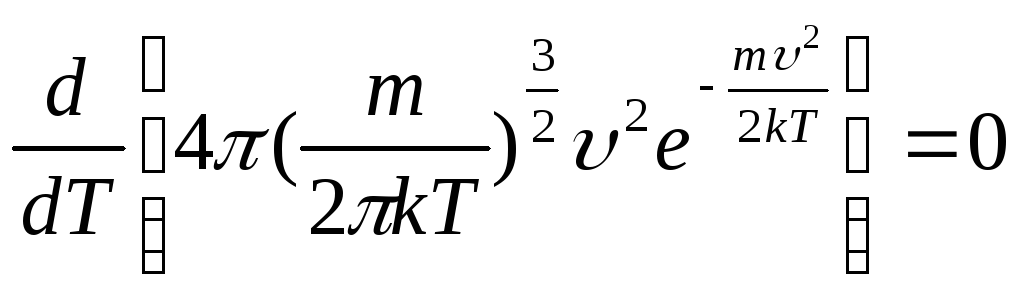Физика Какова концентрация молекул в воздухе при нормальных условиях?
Канал видеоролика: Решение задач Математика и Физика
Смотреть видео:
Свежая информация для ЕГЭ и ОГЭ по Физике (листай):
С этим видео ученики смотрят следующие ролики:

Физика Найдите среднюю квадратичную скорость молекул кислорода при нормальных условиях
Решение задач Математика и Физика

Физика Абсолютная температура идеального газа уменьшилась в 3 раза, а концентрация молекул
Решение задач Математика и Физика

Физика Какова средняя квадратичная скорость молекул азота при температуре 27 С
Решение задач Математика и Физика

Физика Какова средняя кинетическая энергия поступательного движения молекул газа, если при
Решение задач Математика и Физика
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
24.09.2019
- Комментарии
RSS
Написать комментарий
Нет комментариев. Ваш будет первым!
Ваше имя:
Загрузка…
Газ обладает высокой реакционной способностью по сравнению с жидкими и твердыми телами ввиду большой площади его активной поверхности и высокой кинетической энергии образующих систему частиц. При этом химическая активность газа, его давление и некоторые другие параметры зависят от концентрации молекул. Рассмотрим в данной статье, что это за величина и как ее можно вычислить.
О каком газе пойдет речь?
В данной статье будут рассмотрены так называемые идеальные газы. В них пренебрегают размерами частиц и взаимодействием между ними. Единственным процессом, который происходит в идеальных газах, являются упругие столкновения между частицами и стенками сосуда. Результатом этих столкновений является возникновение абсолютного давления.
Любой реальный газ приближается по своим свойствам к идеальному, если уменьшать его давление или плотность и увеличивать абсолютную температуру. Тем не менее существуют химические вещества, которые даже при низких плотностях и высоких температурах далеки от идеального газа. Ярким и всем известным примером такого вещества является водяной пар. Дело в том, что его молекулы (H2O) являются сильно полярными (кислород оттягивает на себя электронную плотность от атомов водорода). Полярность приводит к появлению существенного электростатического взаимодействия между ними, что является грубым нарушением концепции идеального газа.
Универсальный закон Клапейрона-Менделеева
Чтобы уметь рассчитывать концентрацию молекул идеального газа, следует познакомиться с законом, который описывает состояние любой идеальной газовой системы независимо от ее химического состава. Этот закон носит фамилии француза Эмиля Клапейрона и русского ученого Дмитрия Менделеева. Соответствующее уравнение имеет вид:
P*V = n*R*T.
Равенство говорит о том, что произведение давления P на объем V всегда для идеального газа должно быть прямо пропорционально произведению температуры абсолютной T на количество вещества n. Здесь R — это коэффициент пропорциональности, который получил название универсальной газовой постоянной. Она показывает величину работы, которую 1 моль газа выполняет в результате расширения, если его на 1 К нагреть (R=8,314 Дж/(моль*К)).
Концентрация молекул и ее вычисление
Согласно определению под концентрацией атомов или молекул понимают количество частиц в системе, которое приходится на единицу объема. Математически можно записать:
cN = N/V.
Где N — общее число частиц в системе.
Прежде чем записать формулу для определения концентрации молекул газа, вспомним определение количества вещества n и выражение, которое связывает величину R с постоянной Больцмана kB:
n = N/NA;
kB = R/NA.
Используя эти равенства, выразим отношение N/V из универсального уравнения состояния:
P*V = n*R*T =>
P*V = N/NA*R*T = N*kB*T =>
cN = N/V = P/(kB*T).
Таким образом мы получили формулу для определения концентрации частиц в газе. Как видно, она прямо пропорционально зависит от давления в системе и обратно пропорционально от абсолютной температуры.
Поскольку количество частиц в системе велико, то концентрацией cN пользоваться неудобно при выполнении практических расчетов. Вместо нее чаще используют молярную концентрацию cn. Она для идеального газа определяется так:
cn = n/V = P/(R *T).
Пример задачи
Необходимо рассчитать молярную концентрацию молекул кислорода в воздухе при нормальных условиях.
Для решения этой задачи вспомним, что в воздухе находится 21 % кислорода. В соответствии с законом Дальтона кислород создает парциальное давление 0,21*P0, где P0 = 101325 Па (одна атмосфера). Нормальные условия также предполагают температуру 0 oC (273,15 К).
Мы знаем все необходимые параметры для вычисления молярной концентрации кислорода в воздухе. Получаем:
cn(O2) = P/(R *T) = 0,21*101325/(8,314*273,15) = 9,37 моль/м3.
Если эту концентрацию привести к объему 1 литр, то мы получим значение 0,009 моль/л.
Чтобы понять, сколько молекул O2 содержится в 1 литре воздуха, следует умножить рассчитанную концентрацию на число NA. Выполнив эту процедуру, получим огромное значение: N(O2) = 5,64*1021 молекул.
При
рассмотрении закона распределения
Максвелла предполагалось, что молекулы
равномерно распределяются по всему
объему сосуда, что справедливо, если
объем сосуда небольшой.
Для
больших объемов равномерность
распределения молекул по объему
нарушается из-за действия силы тяжести,
вследствие чего плотность, а
следовательно, и число молекул в единице
объема будут неодинаковым.
Рассмотрим
молекулы газа, находящегося в поле
тяготения Земли.
Выясним
зависимость давления атмосферы от
высоты над поверхностью Земли.
Допустим, на поверхности Земли (h
= 0) давление атмосферы P0.
На высоте h
оно равно P.
При увеличении высоты на dh
давление уменьшится на dP:
dP
= — ρgdh
(9.49)
[ρ
— плотность воздуха на данной высоте,
ρ
= mn0,
где m
— масса молекулы, n0
— концентрация молекул].
Используя
соотношение P
= n0kТ,
получаем
тогда
(9.50)
Полагая,
что на некоторой высоте h
Т = соnst,
g
= соnst,
разделяя переменные, интегрируем
выражение (9.50):
,
Получаем
(9.51)
—
барометрическая
формула.
Барометрическая
формула показывает зависимость давления
газа от высоты над поверхностью Земли.
Если
учесть, что концентрация молекул воздуха
в атмосфере определяет давление, то
формулу (9.51) можно записать в виде
(9.52)
Из
формулы (9.52) следует, что с понижением
температуры число частиц на высоте,
отличной от нуля, убывает и при Т = 0К
обращается в нуль, т. е. при 0К все молекулы
расположились бы на земной поверхности.
Так
как потенциальная энергия молекул на
различной высоте различна и на высоте
h
определяется по формуле где ЕП
= mgh,
то [см.
(9.53)
— закон
Больцмана,
показывающий распределение участвующих
в тепловом движении молекул в
потенциальном поле сил, в частности в
поле силы тяжести.
Методика решения задач
В задачах
данного типа используют свойства
распределения Максвелла и Больцмана.
Пример
3.3. Определите
среднюю арифметическую скорость <υ˃
молекул идеального газа, плотность
которого при давлении 35 кПа составляет
0,3 кг/м3.
Дано:
Р=35кПа=35∙103
Па; ρ=0,3
кг/м3.
Найти:
<υ˃.
Решение:
Согласно
основному уравнению молекулярно-кинетической
теории идеальных газов,
,
(1)
где
n
– концентрация молекул; m0—
масса одной молекулы; <υкв˃.-
средняя квадратичная скорость молекул.
Учитывая,
что
,
а,
получаем
Так
как плотность газа
,
где
m
– масса газа; V
— его объём; N
— число молекул газа, уравнение (1) можно
записать в виде
или
.
Подставляя это выражение в формулу (2),
находим искомую среднюю арифметическую
скорость:
Ответ:
<υ˃=545
м/с.
Пример
3.5. Найти относительное
число газа, скорость которого отличается
не более чем на δη = 1% значения средней
квадратичной скорости.
Дано:
δη = 1%.
Найти:
Решение В распределении
Максвелла
подставим
значение
;
δυ = υквδη.
Относительное
число молекул будет
Ответ:
Пример
3.6. При какой температуре
газа число молекул со скоростями в
заданном интервале υ, υ + dυ будет
максимальной? Масса каждой молекулы m.
Решение
Для
нахождения искомой температуры необходимо
исследовать функцию распределения
Максвелла на экстремум
.
.
Пример
3.7. Вычислить наиболее
вероятную, среднюю и среднюю квадратичную
скорости молекул идеального газа, у
которого при нормальном атмосферном
давлении плотность ρ = 1кг/м3.
Решение
Умножив числитель и знаменатель
в подкоренных выражениях (3.4) на число
Авогадро Nа,
получим следующие формулы для скоростей:
.
Запишем уравнение Менделеева-Клапейрона,
введя в него плотность
ΡRT = MP
Определим отсюда величину
и, подставив её в выражения, определяющие
скорость молекул, получим:
Пример
3.4. Идеальный газ с
молярной массой M находится в однородном
поле тяжести, ускорение свободного
падения в котором g. Найти давление газа
как функцию высоты h, если при h = 0 давление
Р = Р0,
а температура меняется с высотой как T
= T0(1
— α·h), где α – положительная постоянная.
Решение
При
увеличении высоты на бесконечно малую
величину давление получает приращение
dP = — ρgdh, где ρ — плотность газа. Знак
минус появился, так как с увеличением
высоты давление уменьшилось.
Поскольку рассматривается идеальный
газ, плотность ρ может быть найдена из
уравнения Mенделеева-Клапейрона:
Подставим значение плотности
ρ и температуры Т, получим разделяя
переменные:
Интегрируя это выражение, находим
зависимость давления газа от высоты h:
Так
как при h = 0 Р = Р0
получаем значение постоянной интегрирования
С = Р0.
Окончательно функция Р( h ) имеет вид
Необходимо отметить, что, так
как давление является величиной
положительной, полученная формула
справедлива для высот
.
Пример.
Французский
физик Ж.Перрен, наблюдал под микроскопом
изменение концентрации взвешенных в
воде (ρ=1г/см3)
шариков гуммигута (ρ 1=1,25г/см3)
с изменением высоты, экспериментально
определил постоянную Авогадро. Определите
это значение, если температура взвеси
Т=298К, радиус шариков =0,21 мкм, а при
расстоянии между двумя слоями Δh=30мкм
число шариков гуммигута в одном слое в
два раза больше, чем в другом.
Дано:
ρ=1г/см3=1000кг/м3;
ρ=1,25 г/см3=1250кг/м3;
Т=280 К; r=0,21мкм=0,21∙10-6
м; Δh=30мкм=3∙10-5
м;
.
Найти:
NA.
Решение.
Барометрическую
формулу
,
Используя
уравнение состояния P=nkT,
можно преобразовать для высот h1
и h2
к виду
и
,
где
n0,
n1
и n2—
соответственно концентрация молекул
на высоте h0,
h1
и h2;
М – молярная масса; g-
ускорение свободного падения; R-
молярная газовая постоянная.
Тогда

(1)
Прологарифмировав
выражение (1), получим
(2)
Масса
частицы
;
m=ρV=ρπr3.
Подставив эти формулы в (2) и учитывая
поправку на закон Архимеда, получим
Откуда
искомое выражение для постоянной
Авогадро
Ответ:
NA=6,02∙1023моль-1.
Пример.
Какова
температура Т азота, если средняя длина
свободного пробега <ℓ˃ молекул азота
при давлении Р=8кПа составляет 1мкм.
Эффективный диаметр молекул азота
d=0,38нм.
.
Дано:
<ℓ˃
=1мкм=1∙10-6
м;
Р=8кПа=8∙103
Па;
d=0,38нм=0,38∙10-9м;
Найти:
Т.
Решение.
Согласно
уравнению состояния идеального газа
P=nkT,
где
n
– концентрация молекул; k
— постоянная Больцмана.
Средняя
длина свободного пробега молекул газа
,
откуда
.
Подставив эту формулу в выражение (1),
найдём искомую температуру азота
Ответ:
Т=372 К.
Пример.
При
температуре Т=280 К и некотором давлении
средняя длина <ℓ1˃
свободного
пробега молекул равна 0,1 мкм. Определите
среднее число <z2˃
столкновений
молекул в 1с, если давление в сосуде
уменьшить до 0,02 первоначального давления.
Температуру считать постоянной, а
эффективный диаметр молекулы кислорода
принять равным 0,36нм .
Дано:
Т=280 К; <ℓ1˃
=0,1мкм=0,1∙10-6
м;
М=32∙10-3
кг/моль;
;
d=0,36нм=0,36∙10-9м;
Найти:
<z2˃.
Решение.
Среднее число <z2˃
столкновений молекулы в 1с при конечном
давлении определяется отношением
средней скорости <υ˃.
молекулы к средней длине её свободного
пробега <ℓ2˃.
при том же давлении:
,
(1)
где
средняя скорость молекул определяется
по формуле
(2)
где
R
– молярная газовая постоянная; М –
молярная масса вещества.
Из
формул
иP=nkT
следует, что средняя длина свободного
пробега молекул обратно пропорциональна
давлению:
,
откуда
.
Подставив это выражение в формулу (1) и
учитывая (2), получаем искомое среднее
число столкновений молекул в 1с:
Ответ:
<z2˃
= 8,61∙107с-1.
Пример.
Можно
ли считать вакуум 100мкПа высоким, если
он создан в колбе радиусом r=15
см, содержащей азот при 0ºС. Эффективный
диаметр молекулы азота d=0,38нм.
.
Дано:
P=100мкПа=10-4Па;
r
=15см=0,15
м;
T=273
К;
d=0,38нм=0,38∙10-9м.
Найти:
Решение.
Вакуум
можно считать высоким, если средняя
длина свободного пробега молекул газа
гораздо больше линейных размеров сосуда,
т.е. должно выполняться условие
˃˃2r
Средняя
длина свободного пробега молекул газа
(учли
P=nkT).
Вычисляя,
получаем
=58,8
м, т.е 58,8 м ˃˃0,3 м.
Ответ:
да, вакуум высокий.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Концентрация частиц – это величина, показывающая, сколько частиц вещества находится в каком-либо объеме. Она вычисляется по формуле: c = N/V, ее размерность 1/м^3. Часто возникает необходимость определить концентрацию молекул, причем исследуемое вещество может быть в любом агрегатном состоянии: твердом, жидком или газообразном.
Представьте, что любознательный царь Гиерон дал своему придворному математику еще одну корону, приказав: «Вот она-то точно из чистого золота. Определи, Архимед, какова концентрация молекул в ней». Гениального ученого такая задача поставила бы в тупик. Ну, а вы решите ее очень быстро. Предположим, корона весила бы ровно 1,93 килограмма, занимая при этом объем в 100 см^3.
Прежде всего найдите, сколько молей золота содержится в таком количестве вещества. С помощью таблицы Менделеева вы узнаете молекулярную массу золота: 197 а.е.м. (атомных единиц массы). А масса одного моля любого вещества (в граммах) численно равна его молекулярной массе. Следовательно, один моль золота весит 197 грамм. Разделив фактическую массу короны на молярную массу золота, вы получите: 1930/197 = 9,79. Или, округленно, 9,8 молей золота.
Умножьте количество молей на универсальное число Авогадро, показывающее, сколько элементарных частиц содержится в моле любого вещества. 9,8*6,022*10^23 = 5,9*10^24. Вот сколько молекул золота приблизительно содержится в короне.
Ну, а теперь найти концентрацию молекул проще простого. 100 кубических сантиметров – это 0,0001 м^3. Разделим: 5,9*10^24/0,0001 = 5,9*10^28. Концентрация молекул золота равна 5,9*10^28/м3.
Теперь предположим, что вам задана такая задача: при давлении Р, средняя квадратичная скорость молекул углекислого газа равна V. Требуется определить концентрацию его молекул. И здесь нет ничего сложного. Существует так называемое основное уравнение кинетической теории идеального газа: Р = V^2m0C/3, где C – концентрация молекул газа, а m0 – масса одной его молекулы. Следовательно, искомая концентрация С находится так: С = 3P/m0V^2.
Единственная неизвестная величина – m0. Ее можно узнать в справочнике по химии или физике. Можно также вычислить по формуле: m0 = M/Na, где М – молярная масса углекислого газа (44 грамм/моль), а Na – число Авогадро (6,022х1023). Подставив все величины в формулу, вычислите искомую концентрацию С.
Видоизмените условие задачи. Предположим, вам известны только температура Т и давление Р углекислого газа. Как по этим данным найти концентрацию его молекул? Давление и температура газа связаны формулой: P = CkT, где С – концентрация молекул газа, а К – постоянная Больцмана, равная 1,38*10^-23. То есть С = P/kT. Подставив в формулу известные величины, вы вычислите концентрацию С.
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,662 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,978 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.