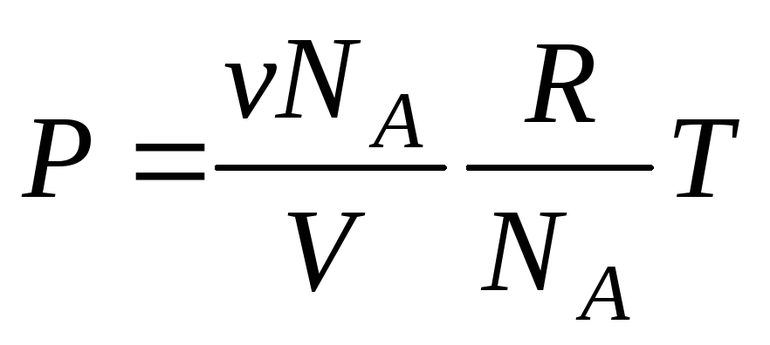Концентрация частиц – это величина, показывающая, сколько частиц вещества находится в каком-либо объеме. Она вычисляется по формуле: c = N/V, ее размерность 1/м^3. Часто возникает необходимость определить концентрацию молекул, причем исследуемое вещество может быть в любом агрегатном состоянии: твердом, жидком или газообразном.
Представьте, что любознательный царь Гиерон дал своему придворному математику еще одну корону, приказав: «Вот она-то точно из чистого золота. Определи, Архимед, какова концентрация молекул в ней». Гениального ученого такая задача поставила бы в тупик. Ну, а вы решите ее очень быстро. Предположим, корона весила бы ровно 1,93 килограмма, занимая при этом объем в 100 см^3.
Прежде всего найдите, сколько молей золота содержится в таком количестве вещества. С помощью таблицы Менделеева вы узнаете молекулярную массу золота: 197 а.е.м. (атомных единиц массы). А масса одного моля любого вещества (в граммах) численно равна его молекулярной массе. Следовательно, один моль золота весит 197 грамм. Разделив фактическую массу короны на молярную массу золота, вы получите: 1930/197 = 9,79. Или, округленно, 9,8 молей золота.
Умножьте количество молей на универсальное число Авогадро, показывающее, сколько элементарных частиц содержится в моле любого вещества. 9,8*6,022*10^23 = 5,9*10^24. Вот сколько молекул золота приблизительно содержится в короне.
Ну, а теперь найти концентрацию молекул проще простого. 100 кубических сантиметров – это 0,0001 м^3. Разделим: 5,9*10^24/0,0001 = 5,9*10^28. Концентрация молекул золота равна 5,9*10^28/м3.
Теперь предположим, что вам задана такая задача: при давлении Р, средняя квадратичная скорость молекул углекислого газа равна V. Требуется определить концентрацию его молекул. И здесь нет ничего сложного. Существует так называемое основное уравнение кинетической теории идеального газа: Р = V^2m0C/3, где C – концентрация молекул газа, а m0 – масса одной его молекулы. Следовательно, искомая концентрация С находится так: С = 3P/m0V^2.
Единственная неизвестная величина – m0. Ее можно узнать в справочнике по химии или физике. Можно также вычислить по формуле: m0 = M/Na, где М – молярная масса углекислого газа (44 грамм/моль), а Na – число Авогадро (6,022х1023). Подставив все величины в формулу, вычислите искомую концентрацию С.
Видоизмените условие задачи. Предположим, вам известны только температура Т и давление Р углекислого газа. Как по этим данным найти концентрацию его молекул? Давление и температура газа связаны формулой: P = CkT, где С – концентрация молекул газа, а К – постоянная Больцмана, равная 1,38*10^-23. То есть С = P/kT. Подставив в формулу известные величины, вы вычислите концентрацию С.
Основные понятия и определения
Под раствором в химии понимают твёрдую или жидкую однородную систему, состоящую из нескольких компонентов. Вещества образующие раствор разделяются на растворители и растворённые.
Например, сахар, находящийся в воде — такая смесь называется двухгомогенная. Если же в сахарную воду добавить уксус, то полученный раствор уже будет трёхгомогенный. Количество в смеси того или иного разжиженного компонента называется концентрацией. Изменяться она может в широких пределах.
Существует несколько способов выражения концентрации растворов:
- Массовый. Обозначается латинской буквой P и определяется количеством растворённого вещества в 100 граммах смеси. Для нахождения массовой концентрации используется формула: P = (n / (n + m)) * 100%, где: n — масса растворяемого вещества, m — масса растворителя, (n + m) — масса раствора. Сумма веществ выражается произведением объёма раствора на его плотность, то есть (n + m) = p * V и измеряется в граммах. Например, 25% раствор обозначает, что в 100 граммах смеси содержится 25 грамм вещества n.
- Молярный. Показывает количество моль разжиженного тела в одном кубическом дециметре. Обозначается характеристика латинскими символами Cb и находится из выражения: Cb = v моль / V дм³. То есть запись: 0,6 M NaCl будет означать, что 0,6 моль NaCl растворено в одном кубическом дециметре смеси.
- Эквивалентный. Способ ещё называется нормальным. Он так же как и молярный показывает количество растворённого вещества в дециметре кубическом, только используется моль эквивалента. Под последним понимается количество соединений с одним молем атома или замещения при прохождении реакций. Обозначается символом Cэ и находится по формуле Cэ = n / Mэкв * V дм³. Например, 0,1 HCl означает, что 0,1 моль эквивалента соляной кислоты содержится в 1 дм³ раствора.
- Моляльный. Используется, чтобы узнать, какое количество моль разжиженного вещества находится в килограмме растворителя. Моляльность рассчитывается с помощью формулы: Cm = (n*100) / (M * m).
- Титр раствора. Определяется количеством растворённого вещества, выраженного в одном сантиметре кубическом. Измеряется в граммах: Т = n / V см³.
Молярная масса и доли
Для измерения массы используются граммы, килограммы, тонны, но для обозначения количества вещества они не подходят. В химических процессах принимают участие различные частицы, такие как молекулы, атомы, ионы. Поэтому для того чтобы определить, сколько вещества содержится в той или иной смеси, ввели специальную единицу — моль. Иными словами — это множество, в котором объединены масса с числом.
Концентрация — это значение количества объёма раствора к растворенному в нём телу. Наиболее часто для измерения применяется массовая доля разжиженного вещества, молярная и нормальная концентрация. Массовая часть — это неизмеряемая величина. Складывается она из двух масс:
- растворителя — вещества способного ослаблять другие тела;
- растворимого — разжижающегося состава, поглощаемого растворителем.
Способность же вещества поглощаться другим называют растворимостью. При определении результата взаимодействия растворов находится массовая доля каждого из них.
Молярная масса показывает массу одного моль вещества и измеряется в граммах, делённых на моль. Если необходимо отмерить один моль, то нужно будет взять столько граммов вещества, сколько их содержится в относительной атомной массе или же, относительной молекулярной массе. Один моль всегда содержит постоянное число молекул, называемое константой Авогадро. Равно оно: N = 6 * 1023. Для того чтобы рассчитать число молекул в определённом веществе используют формулу:
N = Na * n, где Na — постоянная Авогадро, n — количество вещества. То есть моль — это количество в котором содержится 6 * 1023 молекул. Молярная концентрация определяет, сколько моль разжиженного вещества содержится в одном литре раствора.
Считается, что в единице объёма находится некая величина, определяемая числом молекул. Записывается это определение как n = N / V и называется концентрацией молекул. Измеряется она в м3. Важно отметить, что концентрация связана с плотностью соотношением: n = p / m0 и показывает число структурных молекул, находящихся в единице объёме. Поэтому плотность используется при нахождении массы на единицу объёма, а концентрация при вычислении количества молекул.
Массовая доля растворимого часто называется процентной концентрацией. При этом вместо процентного определения используется молярная концентрация. Другими словами, отношение количества к объёму в литрах. Зная число молей в одном литре довольно просто подобрать необходимое число молей используя специальную посуду.
Формулы перехода
Расчёт количества той или иной части концентрированной смеси, возможно, выполнить в различных единицах. Но между тем существуют формулы перехода от одних выражений к другим. При пересчёте происходит округление знака после запятой, поэтому при переходе с одной величины на другую появляется определённая погрешность.
Конвертация от массовой доли к молярной массе выполняется по формуле: Cb = (p * ɷb) / M (B), где: Cb — молярная концентрация, p — плотность, ɷb — массовая доля, M (B) — молярная масса. При этом когда плотность раствора изначально обозначается в грамм на миллилитр, а молярная в грамм на моль, то ответ необходимо умножить на 1 тыс. мл/л. Если же значение доли указано в процентах, то ответ необходимо разделить на 100%.
Для перехода от молярной к нормальной концентрации (молярной концентрации эквивалента), используется выражение: c * ((1 / z) * B) = Cb * z. Где молярность измеряется в моль на литр, а z — число эквивалентности (сопоставимое с одним молем катионов водорода в проходящей реакции). В определённых ситуациях выполняется и перевод массовой доли к титру. Выполняют это по формуле: T = p * ɷ, где p — плотность, измеряемая в граммах, делённых на миллилитры, а ɷ — массовая часть растворённого, в долях.
Перевести можно и молярность к титру. Используют для этого следующую формулу перехода: Т = Cb * M, в которой М — молярная масса разжиженного вещества. В случае же когда концентрация выражается в моль на литр, а масса в грамм на моль, ответ нужно разделить на 1 тыс. миллилитров на литр. Молярность связана с моляльностью формулой: mb = Cb / p, где р — плотность раствора, измеряемая в граммах, делённых на миллилитры.
Самый же сложный перевод происходит при конвертации моляльности к мольной доле. Для решения такой задачи используется формула для мольного элемента: Yb = mb / (mb + 1/ M (A)). В выражении mb обозначает моляльность, а M (A) — молярную массу растворителя. Чтобы ответ получился в одинаковых единицах измерения, цифра один в формуле представляется как 1000 г/кг. Это необходимо, когда моляльность подставляется в моль на килограмм, а масса в грамм на моль.
Вычисление концентрации
Чтобы получить раствор, необходимо между собой смешать растворитель и растворимое. Для того чтобы вычислить концентрацию, нужно знать или найти общий объём смеси, который будет равен сумме элементов, используемых при создании раствора. Измеряться концентрация может в различных величинах. Основные из них:
- грамм на литр (г/л) — отношение массы к объёму;
- молярность (моль) — содержание растворенных элементов к объёму раствора;
- миллионная часть (г / единица раствора) — соотношение растворённых веществ к одному миллиону единиц смеси;
- проценты (%) — ответ выражается в количестве растворённой доли в граммах к ста частям раствора.
Найти молярность, характеризуемую числом доли растворенных элементов, зная массу и формулу вещества несложно. Если количество растворённой части задано в других единицах, то их преобразуют в граммы.
Каждый элемент характеризуется молярной массой и определяется отношением массы к числу моль. Равна она атомной массе, которую можно взять из таблицы Менделеева. Для нахождения молярной величины нужно сложить все атомные числа элементов, смешанных в растворе.
Найдя молекулярное значение можно перейти к вычислению количества молей. Делается это с помощью формулы для молярной концентрации: масса растворённого вещества умножается на обратную молярную часть. Результат должен получиться в моль. На следующем этапе находится молярность. Полученное число молей делится на объём, измеряемого в литрах раствора. Обычно объёмом растворённой части пренебрегают.
По аналогии вычисляется концентрация и в процентном составе. Для этого нужно найти массу частей, составляющих раствор. На первом этапе все единицы измерения переводятся в граммы. Находится плотность, затем она умножается на объём и получается масса вещества в граммах. Вычисление концентрации в процентном составе находится как масса растворённого вещества, делённая на сумму массы растворяемого и растворителя, а после результат умножается на сто.
Так как проценты являются сотой долей, то для получения ответа в миллионной доле результат нужно умножить ещё на 10 тысяч.
Примеры расчёта
Определением молярности раствора занимается химия. В процессах участвуют различные частицы, количество которых даже в малых объёмах велико. Значение молярной концентрации определяется не только количественным, но и качественным составом. Самые простые задачи связаны с нахождением молярной массы. Например, для соединения CH4 она наводится следующим образом:
Мr (CH4) = Ar + 4Ar (H) = 12 + 4 =16
Получается, что масса метана содержит 16 г/моль или 6,02Ч * 1023 молекул. Буква «Ч» используется для обозначения части.
Теперь можно найти массу в объёмном количестве. Например, нужно определить массу метана смешанном в количестве двух моль. Так как для метана его масса составляет 16 г/моль, то ответом будет:
м (метан) = 2 * 16 = 32 г
Много задач встречается на нахождение массовой доли в растворе. Например, в 200 грамм соли добавили 80 грамм воды. Чтобы определить часть соли в полученной смеси необходимо найти первоначальную её долю в растворе: M1 = w * m = 0,14 * 200 = 28 гамм. Затем вычислить массу нового раствора: М2 = 200 + 80 = 280 грамм. И воспользовавшись формулой получить ответ: W = M1 / M2 = 28 / 280 = 0,100.
Немного сложнее задачи на расчёт грамм-эквивалента. Пусть нужно найти нормальность серной кислоты, смешанной с раствором щёлочи. При смешении образуется соединение: NaSO4. Так как при реакции серная кислота нейтрализует гидросульфат натрия только частично то можно записать: Н2SO4 + NaOH = NaHSO4 + Н2О. Серная кислота представляет основу равную единице, поэтому и фактор эквивалентности также будет составлять единицу.
Экв (H2SO4) =1 * ф = 1/1 = 1
Отсюда следует, что значение молярности эквивалента кислоты:
Мэкв (H2SO4) = M * Ф = M/1 = 98/1 = 98 г/экв
Нужно найти массовую часть и молярность эквивалента смеси, полученной при смешивании 400 мл раствора серной кислоты (p =1, 18 г/мл) и 400 мл восьмипроцентного раствора серной кислоты (p = 1,05 г/мл).
Вначале следует вычислить массу первого раствора и содержание в нём серной кислоты:
m (р-ра) = p (р-ра) * V (р-ра) = 1,18 * 400 = 720 г
m (H2SO4) = V (H2SO4) * м (H2SO4)= С (H2SO4) * V (р-ра) * М (H2SO4) = 720 * 0,2 — 98 = 46 г
Затем определить массу второго раствора и содержание в нём количества серной кислоты:
m (р-ра) = р (р-ра) * V (р-ра) = 1,05 * 400 = 420 г
m = m (р-ра) * (H2SO4)= 420 * 0,08 = 24 г
Часть полученного раствора находится по формуле:
ɷ (H2SO4) = m (H2SO4) / m (р-ра) = (46 + 24) / (720+420) = 0,146
Ответ удобнее записать в процентном соотношении — 14,6%.
Как найти концентрацию молекул
Концентрация частиц – это величина, показывающая, сколько частиц вещества находится в каком-либо объеме. Она вычисляется по формуле: c = N/V, ее размерность 1/м^3. Часто возникает необходимость определить концентрацию молекул, причем исследуемое вещество может быть в любом агрегатном состоянии: твердом, жидком или газообразном.

Инструкция
Представьте, что любознательный царь Гиерон дал своему придворному математику еще одну корону, приказав: «Вот она-то точно из чистого золота. Определи, Архимед, какова концентрация молекул в ней». Гениального ученого такая задача поставила бы в тупик. Ну, а вы решите ее очень быстро. Предположим, корона весила бы ровно 1,93 килограмма, занимая при этом объем в 100 см^3.
Прежде всего найдите, сколько молей золота содержится в таком количестве вещества. С помощью таблицы Менделеева вы узнаете молекулярную массу золота: 197 а.е.м. (атомных единиц массы). А масса одного моля любого вещества (в граммах) численно равна его молекулярной массе. Следовательно, один моль золота весит 197 грамм. Разделив фактическую массу короны на молярную массу золота, вы получите: 1930/197 = 9,79. Или, округленно, 9,8 молей золота.
Умножьте количество молей на универсальное число Авогадро, показывающее, сколько элементарных частиц содержится в моле любого вещества. 9,8*6,022*10^23 = 5,9*10^24. Вот сколько молекул золота приблизительно содержится в короне.
Ну, а теперь найти концентрацию молекул проще простого. 100 кубических сантиметров – это 0,0001 м^3. Разделим: 5,9*10^24/0,0001 = 5,9*10^28. Концентрация молекул золота равна 5,9*10^28/м3.
Теперь предположим, что вам задана такая задача: при давлении Р, средняя квадратичная скорость молекул углекислого газа равна V. Требуется определить концентрацию его молекул. И здесь нет ничего сложного. Существует так называемое основное уравнение кинетической теории идеального газа: Р = V^2m0C/3, где C – концентрация молекул газа, а m0 – масса одной его молекулы. Следовательно, искомая концентрация С находится так: С = 3P/m0V^2.
Единственная неизвестная величина – m0. Ее можно узнать в справочнике по химии или физике. Можно также вычислить по формуле: m0 = M/Na, где М – молярная масса углекислого газа (44 грамм/моль), а Na – число Авогадро (6,022х1023). Подставив все величины в формулу, вычислите искомую концентрацию С.
Видоизмените условие задачи. Предположим, вам известны только температура Т и давление Р углекислого газа. Как по этим данным найти концентрацию его молекул? Давление и температура газа связаны формулой: P = CkT, где С – концентрация молекул газа, а К – постоянная Больцмана, равная 1,38*10^-23. То есть С = P/kT. Подставив в формулу известные величины, вы вычислите концентрацию С.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Как обнаружить концентрацию молекул
Насыщенность частиц – это величина, показывающая, сколько частиц вещества находится в каком-нибудь объеме. Она вычисляется по формуле: c = N/V, ее размерность 1/м^3. Зачастую появляется надобность определить концентрацию молекул , причем исследуемое вещество может быть в любом агрегатном состоянии: твердом, жидком либо газообразном.
Инструкция
1. Представьте, что любопытный царь Гиерон дал своему придворному математику еще одну корону, приказав: «Вот она-то верно из чистого золота. Определи, Архимед, какова насыщенность молекул в ней». Талантливого ученого такая задача поставила бы в тупичок. Ну, а вы решите ее дюже стремительно. Представим, корона весила бы ровно 1,93 килограмма, занимая при этом объем в 100 см^3.
2. Раньше каждого обнаружьте, сколько молей золота содержится в таком числе вещества. С поддержкой таблицы Менделеева вы узнаете молекул ярную массу золота: 197 а.е.м. (ядерных единиц массы). А масса одного моля всякого вещества (в граммах) численно равна его молекул ярной массе. Следственно, один моль золота весит 197 грамм. Поделив фактическую массу короны на молярную массу золота, вы получите: 1930/197 = 9,79. Либо, округленно, 9,8 молей золота.
3. Умножьте число молей на универсальное число Авогадро, показывающее, сколько элементарных частиц содержится в моле всякого вещества. 9,8*6,022*10^23 = 5,9*10^24. Вот сколько молекул золота примерно содержится в короне.
4. Ну, а сейчас обнаружить концентрацию молекул проще простого. 100 кубических сантиметров – это 0,0001 м^3. Поделим: 5,9*10^24/0,0001 = 5,9*10^28. Насыщенность молекул золота равна 5,9*10^28/м3.
5. Сейчас представим, что вам задана такая задача: при давлении Р, средняя квадратичная скорость молекул углекислого газа равна V. Требуется определить концентрацию его молекул . И тут нет ничего трудного. Существует так называемое основное уравнение кинетической теории совершенного газа: Р = V^2m0C/3, где C – насыщенность молекул газа, а m0 – масса одной его молекул ы. Следственно, желанная насыщенность С находится так: С = 3P/m0V^2.
6. Исключительная неведомая величина – m0. Ее дозволено узнать в справочнике по химии либо физике. Дозволено также вычислить по формуле: m0 = M/Na, где М – молярная масса углекислого газа (44 грамм/моль), а Na – число Авогадро (6,022х1023). Подставив все величины в формулу, вычислите желанную концентрацию С.
7. Видоизмените условие задачи. Представим, вам знамениты только температура Т и давление Р углекислого газа. Как по этим данным обнаружить концентрацию его молекул ? Давление и температура газа связаны формулой: P = CkT, где С – насыщенность молекул газа, а К – непрерывная Больцмана, равная 1,38*10^-23. То есть С = P/kT. Подставив в формулу знаменитые величины, вы вычислите концентрацию С.
Количество и концентрация вещества. Выражение и пересчеты из одних единиц в другие. Концентрации растворов. Массовая и молярная концентрация, Титр, Моляльность, Мольная, массовая, объемная доли. Нормальная (эквивалентная) концентрация, Фактор эквивалентности, Молярная масса эквивалента вещества.
Масса и количество вещества. Массу вещества (m) измеряют в граммах, а количество вещества (n) в молях. Если обозначить вещество буквой Х, то тогда его масса может быть обозначена как m (X), а количество – n (X).
- Моль–количество вещества, которое содержит столько определенных структурных единиц (молекул, атомов, ионов и т.д.), сколько атомов содержится в 0,012 кг изотопа углерода-12.
- При использовании термина моль следует указывать частицы, к которым относится этот термин. Соответственно, можно говорить «моль молекул», «моль атомов», «моль ионов» и т.д. (например, моль молекул водорода, моль атомов водорода, моль ионов водорода). Так как 0,012 кг углерода-12 содержит ~ 6,022х1023атомов углерода (постоянная Авогадро = число Авогадро), то моль– такое количество вещества, которое содержит 6,022х1023структурных элементов (молекул, атомов, ионов и др.).
- Отношение массы вещества к количеству вещества называют молярной массой.
- M (X) = m (X) / n(X)
- То есть, молярная масса (М) – это масса одного моля вещества. Основной системной (в международной системе единиц СИ) единицей молярной массы является кг/моль, а на практике – г/моль. Например, молярная масса самого легкого металла лития М (Li) = 6,939 г/моль, молярная масса газа метана М (СН4) = 16,043 г/моль. Молярная масса серной кислоты рассчитывается следующим образом M (Н2SО4) = 196 г / 2 моль = 96 г/моль.
- Молярная масса М (Х) — масса одного моля молекул вещества (г/моль). M(X)=mx/n (X), где mx – масса вещества, г; n (X) – количество вещества, моль. Молярная масса вещества Х численно равна относительной молекулярной массе Mr (в случае молекул) или относительной атомной массе (в случае атомов).
- Любое соединение (вещество), кроме молярной массы, характеризуется относительной молекулярной или атомной массой. Существует и эквивалентная масса Е, равная молекулярной, умноженной на фактор эквивалентности (см. далее).
- Относительная молекулярная масса (Mr) –это молярная масса соединения, отнесенная к 1/12 молярной массы атома углерода-12.
- Например,Мr(СН4) = 16,043. Относительная молекулярная масса – величина безразмерная.
- Относительная атомная масса (Ar) –это молярная масса атома вещества, отнесенная к 1/12 молярной массы атома углерода-12.
- Например, Ar(Li) = 6,039.
- Относительная молекулярная масса (Mr) –это молярная масса соединения, отнесенная к 1/12 молярной массы атома углерода-12.
Концентрация. Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называют концентрацией. Известно несколько способов выражения концентрации. В России чаще всего концентрацию обозначают заглавной буквой С, имея в виду прежде всего массовую концентрацию, которая по праву считается наиболее часто применяемой в экологическом мониторинге форма выражения концентрации (именно в ней измеряют величины ПДК).
- Массовая концентрация (С или β) –отношение массы компонента, содержащегося в системе (растворе), к объему этой системы (V). Это самая распространенная у российских аналитиков форма выражения концентрации.
- β(Х) =m (X) / V(смеси)
- Единица измерения массовой концентрации – кг/м3 или г/м3, кг/дм3или г/дм3(г/л), кг/см3, или г/см3 (г/мл), мкг/л или мкг/мл и т.д. Арифметические пересчеты из одних размерностей в другие не представляет большой сложности, но требуют внимательности. Например, массовая концентрация хлористоводородной (соляной) кислотыС(HCl) = 40 г / 1 л = 40 г/л = 0,04 г/мл = 4·10–5мкг/л и т.д. Обозначение массовой концентрации С нельзя путать с обозначением мольной концентрации (с), которая рассматривается далее.
- Типичными являются соотношения β(Х): 1000 мкг/л = 1 мкг/мл = 0,001 мг/мл.
- Массовая концентрация — это отношение массы к объему системы !!!! а отношение массы к массе это — массовая доля
Титр (Т) В объемном анализе (титриметрии) употребляется одна из форм массовой концентрации – титр. Титр раствора (Т) –это масса вещества, содержащегося в одном кубическом сантиметре = в одном миллилитре раствора.
- Единицы измерения титра — кг/см3, г/см3, г/мл и др.
Моляльность (b) —отношение количества растворенного вещества (в молях) к массе растворителя (в кг).
- b(Х) = n(X) / m (растворителя) = n(X) / m (R)
- Единица измерения моляльности —моль/кг. Например,b (HCl/H2O) = 2 моль/кг. Моляльная концентрация применяется в основном для концентрированных растворов.
Мольная (! )доля (х) –отношение количества вещества данного компонента (в молях), содержащегося в системе, к общему количеству вещества (в молях).
- х(Х) =n(X) / n(X) + n(Y)
- Мольнаядоля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных (млн–1,ppm), миллиардных (млрд–1,ppb), триллионных (трлн–1,ppt) и др. долях, но единицей измерения все равно является отношение –моль/моль. Например,х(С2Н6) = 2 моль / 2 моль + 3 моль = 0,4 (40 %).
Массовая доля (ω) –отношение массы данного компонента, содержащегося в системе, к общей массе этой системы.
- ω (Х) = m(X) / m(смеси)
- Массовая доля измеряется в отношениях кг/кг (г/г). При этом она может быть выражена в долях единицы, процентах (%), промилле, миллионных, миллиардных и т.д. долях. Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора.
- Например, условно ω (KCl) = 12 г / 12 г + 28 г = 0,3 (30%).
Объемная доля (φ) –отношение объема компонента, содержащегося в системе, к общему объему системы.
- φ (Х)=v(X) /v(X)+v(Y)
- Объемная доля измеряется в отношениях л/л или мл/мл и тоже может быть выражена в долях единицы, процентах, промилле, миллионных и т.д. долях. Например, объемная доля кислорода газовой смеси составляет φ (О2)=0,15 л / 0,15 л + 0,56 л.
Молярная (мольная) концентрация (с) –отношение количества вещества (в молях), содержащегося в системе (например, в растворе), к объему V этой системы.
- с(Х) = n(X)/ V(смеси)
- Единица измерения молярной концентрации моль/м3(дольная производная, СИ – моль/л).
- Например,c (H2S04) = 1 моль/л,с(КОН) = 0,5 моль/л.
- Раствор, имеющий концентрацию 1 моль/л, называют молярным раствором и обозначают как 1 М раствор (не надо путать эту букву М, стоящую после цифры, с ранее указанным обозначением молярной массы, т.е. количества вещества М). Соответственно раствор, имеющий концентрацию 0,5 моль/л, обозначают 0,5 М (полумолярный р-р); 0,1 моль/л – 0,1 М (децимолярный р.р); 0,01 моль/л – 0,01 М (сантимолярный р-р) и т.д.
- Эта форма выражения концентрации также очень часто применяется в аналитике.
Нормальная (эквивалентная) концентрация (N), молярная концентрация эквивалента(Сэкв.)– это отношение количества вещества эквивалента в растворе (моль) к объему этого раствора (л).
- N = Сэкв (Х) = n (1/Z X) / V (смеси)
- Количество вещества (в молях), в котором реагирующими частицами являются эквиваленты, называется количеством вещества эквивалента nэ (1/Z X) = nэ (Х).
- Единица измерения нормальной концентрации («нормальности») тоже моль/л (дольная производная, СИ).
- Например, Сэкв.(1/3 АlCl3) = 1 моль/л.
- Раствор, в одном литре которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н. Соответственно могут быть 0,5 н («пятидецинормальный»); 0,01 н (сантинормальный») и т.п. растворы.
- Следует отметить, что понятие эквивалентностиреагирующих веществ в химических реакциях является одним из базовых для аналитической химии. Именно на эквивалентности как правило основаны вычисления результатов химического анализа (особенно в титриметрии). Рассмотрим несколько связанных с этим базовых с т.з. теории аналитики понятий.
Фактор эквивалентности (fэкв )– число, обозначающее, какая доля реальной частицы веществ Х (например, молекулы вещества X) эквивалентна одному иону водорода (в данной кислотно-основной реакции) или одному электрону (в данной окислительно-восстановнтельной реакции) Фактор эквивалентности fэкв (Х) рассчитывают на основании стехиометрии (соотношении участвующих частиц) в конкретном химическом процессе:
- fэкв (Х) = 1/Zx
- где Zx.— число замещенных или присоединенных ионов водорода (для кислотно-основных реакций) или число отданных или принятых электронов (для окислительно-восстановительных реакций);
- Х — химическая формула вещества.
- Фактор эквивалентности всегда равен или меньше единицы. Будучи умноженным на относительную молекулярную массу, он дает значение эквивалентной массы (Е).
- Для реакции:
- H2SО4 + 2 NaOH = Na2SО4 + 2 H2
- fэкв (H2SО4) = 1/2,fэкв (NaOH) = 1
- fэкв (H2SО4) = 1/2, т.е. это означает, что ½ молекулы серной кислоты дает для данной реакции 1 ион водорода (Н+), а соответственноfэкв (NaOH) = 1 означает, что одна молекулаNaOHсоединяется в данной реакции с одним ионом водорода.
- H2SО4 + 2 NaOH = Na2SО4 + 2 H2
- Для реакции:
- 10 FeSО4 + 2 KMnО4 + 8 H2SО4 = 5 Fe2(SО4)3 + 2 MnSО4 + K2SО4 + 8 H2О
- 2МпО4— + 8Н++5е—→ Мп2+– 2e—+ 4 Н2О
- 5 Fe2+ – 2e— → Fe3+
- fэкв (KMnО4) = 1/5 (кислая среда), т.е. 1/5 молекулы KMnО4 в данной реакции эквивалентна 1 электрону. При этом fэкв (Fe2+) = 1, т.е. один ион железа (II) также эквивалентен 1 электрону.
- Для реакции:
Эквивалент вещества Х –реальная или условная частица, которая в данной кислотно-основной реакции эквивалентна одному нону водорода или в данной окислительно-восстановительной реакции – одному электрону.
- Форма записи эквивалента: fэкв(Х) Х (см. табл.), или упрощенно Эх, где Х –химическая формула вещества, т.е. [Эх =fэкв(Х) Х]. Эквивалент безразмерен.
- Эквивалент кислоты(или основания) – такая условная частица данного вещества, которая в данной реакции титрования высвобождает один ион водорода или соединяется с ним, или каким-либо другим образом эквивалентна ему.
- Например, для первой из вышеуказанных реакций эквивалент серной кислоты — это условная частица вида ½ H2SО4 т.е. fэкв (H2SО4) = 1/Z= ½; ЭH2SО4 = ½ H2SО4.
- Эквивалент окисляющегося(или восстанавливающегося)вещества— это такая условная частица данного вещества, которая в данной химической реакции может присоединять один электрон или высвобождать его, или быть каким-либо другим образом эквивалентна этому одному электрону.
- Например, при окислении перманганатом в кислой среде эквивалент марганцевокислого калия – это условная частица вида 1/5 КМпО4, т.е. ЭКМпО4 =1/5КМпО4.
- Так как эквивалент вещества может меняться в зависимости от реакции, в которой это вещество участвует, необходимо указывать соответствующую реакцию.
- Например, для реакции Н3РО4+NaOH=NaH2PО4+H2O
- эквивалент фосфорной кислоты Э Н3РО4 == 1 Н3РО4.
- Для реакции Н3РО4+ 2NaOH=Na2HPО4+ 2H2O
- ее эквивалент Э Н3РО4 == ½ Н3РО4,.
- Например, для реакции Н3РО4+NaOH=NaH2PО4+H2O
- Принимая во внимание, что понятие моля позволяет пользоваться любыми видами условных частиц, можно дать понятиемолярной массы эквивалента вещества X. Напомним, что моль– это количество вещества, содержащее столько реальных или условных частиц, сколько атомов содержится в 12 г изотопа углерода12 С (6,02 1023). Под реальными частицами следует понимать атомы, ионы, молекулы, электроны и т.п., а под условными – такие как, например, 1/5 молекулы КМпО4в случае О/В реакции в кислой среде или ½ молекулы H2SО4 в реакции с гидроксидом натрия.
Молярная масса эквивалента вещества – масса одного моля эквивалентов этого вещества, равная произведению фактора эквивалентности fэкв (Х) на молярную массу вещества М (Х)1.
- Молярную массу эквивалента обозначают как М [fэкв (Х) Х] или с учетом равенства Эх = fэкв (Х) Х ее обозначают М [Эх]:
- М (Эх)= fэкв (Х) М (Х); М [Эх] = М (Х) /Z
- Например, молярная масса эквивалента КМпО4
- М (ЭКМпО4) =1/5КМпО4 = М 1/5 КМпО4 = 31,6 г/моль.
- Это означает, что масса одного моля условных частиц вида 1/5КМпО4 составляет 31,6 г/моль. По аналогии молярная масса эквивалента серной кислоты М ½ H2SО4 = 49 г/моль; фосфорной кислоты М ½ H3 РО4 = 49 г/моль и т.д.
- В соответствии с требованиями Международной системы (СИ) именно молярная концентрацияя вляется основным способом выражения концентрации растворов, но как уже отмечалось, на практике чаще применяетсямассовая концентрация.
- Рассмотрим основные формулы и соотношения между способами выражения концентрации растворов (см. табл. 1 и 2).
Таблица 1 Основные способы выражения концентрации растворов
| Термин концентрации (см. выше) | Единица измерения концентрации | Тип единицы концентрации | Формула, виды записи, примеры |
| 1. Массовая концентрация (С или β) | кг/м3 | Производная (СИ) |
|
| кг/дм3 | Дольная производная (СИ) | ||
| кг/л | Производная (внесистемная) | ||
| 2. Титр раствора (Т) | г/см3 | Дольная, производная (СИ) |
|
| г/мл | Дольная, производная (внесистемная) | ||
| 3. Титр раствора А по определяемому компоненту Х | г/см3 | Дольная, производная (СИ) |
|
| г/мл | Дольная, производная (внесистемная) | ||
| 4. Молярная концентрация, молярность(с) | моль/м3 | Производная (СИ) |
|
| моль/дм3 | Дольная производная (СИ) | ||
| моль/л | Производная (внесистемная) | ||
| 5. Молярная концентрация эквивалента (N), нормальность | моль/дм3 | Производная (СИ) |
|
| моль/л | Производная (внесистемная) | ||
| 6. Моляльная концентрация, моляльность (b) | моль/кг | Производная (СИ) |
|
| Термин концентрации (см. выше) | Единица измерения концентрации | Тип единицы концентрации | Формула, виды записи, примеры |
| 7. Мольная доля(х) | Относительная = моль/моль. (или в %, или в млн–1,ppm, в млрд–1 ,ppb, трлн–1,pptили в др. ед. | Безразмерная = 1 моль/моль = 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
| 8. Массовая доля (ω) | Относительная = кг / кг. (или в %, или в млн–1,ppm, в млрд–1 ,ppb, трлн–1,ppt или в др. ед. |
Безразмерная = 1 кг/кг =1 г/г= 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
| 9. Объемная доля (φ) | Относительная = м3/м3(илил/л, илимл/мл, или в %, или в млн–1,ppm, в млрд–1 ,ppb, или в др. ед. | Безразмерная = 1 кг/кг =1 г/г= 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
* В расчетных уравнениях химическую формулу обычно ставят в индексе.
Пересчеты из одной формы выражения концентрации в другую являются достаточно простыми арифметическими задачами, с решениями которых аналитику приходится сталкиваться очень часто – при приготовлении аналитических растворов, при пробоотборе и пробоподготовке, при смешении пробы с аналитическими растворами, а также при статистической обработке и представлении получившихся результатов в цифровой и графической форме. Рассмотрим формулы для пересчета шести наиболее часто применяемых форм выражения концентраций (см. табл. 2).
Таблица 2 Формулы перехода от одних выражений концентраций растворов к другим (процентная, в граммах на грамм растворителя, в граммах на грамм раствора, нормальная, молярная, моляльная) 6
- Обозначения:
- d-плотность раствора,
- W- молекулярный вес (масса) растворенного вещества,
- E- грамм-эквивалентный вес растворенного вещества
- Коровин Н.В., Мингулина Э.И., Рыжова Н.Г.Лабораторные работы по химии.Учеб. пособие для техн. направ. и спец. вузов. /Под ред. Н.В. Коровина. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1998. – с. 21–39.
- Жарский И.М., Кузьменко А.Л., Орехова С.Е.Лабораторный практикум по общей и неорганической химии./Под ред. Г.И. Новикова. – Мн.: Дизайн ПРО, 1998. – с. 3-27 и 46-56.
- Попадич И.А., Траубенберг С.Е, Осташенкова Н.В. и др.. Аналитическая химия.Учебное пособие для техникумов. М.: Химия, 1989. – с. 91-98.
- Зайцев О.С.Исследовательский практикум по общей химии.Учебное пособие. М.: Изд-во МГУ, 1994. – с. 91-98.
- Лурье Ю.Ю.Справочник по аналитической химии.Справ. Изд. – 6-е изд., перераб. и доп. – М.: Химия, 1989. – с. 172-173.