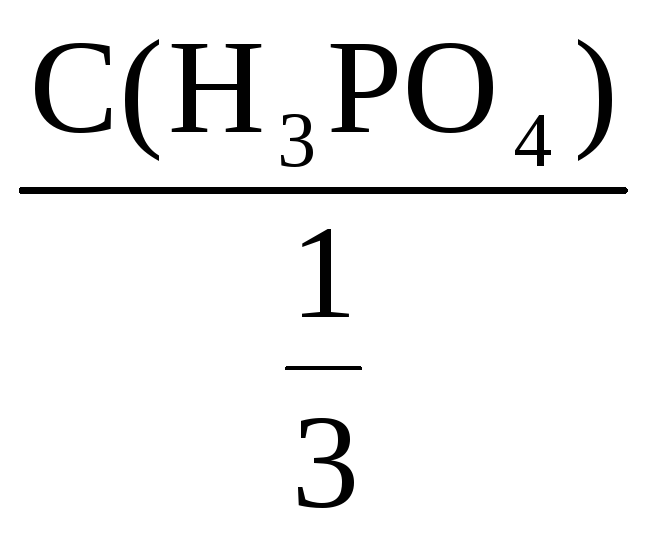При разбавлении и концентрировании
растворов количество вещества (количества
вещества эквивалента) остается постоянным.
Пример 6. Какой объем раствора HCl,
С1(HCl) = 6 моль/л, необходимо
использовать для приготовления 250 мл
раствора этой кислоты с концентрацией
С2(HCl) = 2,5 моль/л.
Решение:
V(HCl) =
n(HCl) = const;
n(HCl) = C2(HCl)·V2 = 2,5·0,25 = 0,625 моль
V(HCl) =
= 0,104 л = 104 мл
Ответ: необходимо использовать 104
мл раствора.
Пример 7. До какого объема следует
упарить 3,5 л раствора серной кислоты,
С1(H2SO4) = 0,04 моль/л,
чтобы получить раствор с концентрацией
кислоты 0,2 моль/л.
Решение:
Величина n(H2SO4) определяется
из данных условия:
n(H2SO4) = n(H2SO4)·
= С1(H2SO4)·
·V
= 0,04··3,5
= 0,07 моль
Отсюда V =
=
= 0,35 л = 350 мл
Ответ: исходный раствор следует
упарить до объема 350 мл.
2. 3. Расчеты, связанные со смешиванием растворов различной концентрации
При смешивании растворов количество
вещества n(X) (количества вещества
эквивалента) в полученном растворе
равно сумме количества вещества
(количества вещества эквивалента) в
смешиваемых растворах n 1(X), n
2(X) … n n(X):
n(X) = n 1(X) + n 2(X) + n 3(X) +…+
n n(X),
При смешивании растворов объем
полученного раствора не равен сумме
объемов смешиваемых растворов. Это
явление называют контракцией растворов.
Поэтому объем полученного раствора
следует рассчитывать.
При решении задач на смешивание растворов
часто приходится производить перерасчет
одной концентрации в другую.
Пример 8. Рассчитать массовую долю
1,25 н. раствора фосфорной кислоты, если
плотность раствора составляет 1,05 г/мл.
Решение:
ω(H3PO4) =
Объем раствора принимаем за 1 л (1000 мл).
Тогда масса раствора равна:
m(р-ра) = V·ρ = 1000·1,05 = 1050 г
Фактор эквивалентности H3PO4
=
Количество вещества: n(H3PO4)
= C(H3PO4)·V
= 1,25·1 = 1,25 моль
Масса H3PO4 в растворе:
m(H3PO4) = n(H3PO4)·M(
H3PO4)
= n(H3PO4)·
·M(H3PO4)
m(H3PO4) = 1,25··98
= 40,83 г
Массовая доля H3PO4 в растворе:
ω(H3PO4) =
= 0,039 или 3,9%
Ответ: ω(H3PO4) = 0,039 или
3,9%.
Пример 9. Смешали 3 литра раствора
H3PO4 (C(H3PO4) = 0,1 моль/л)
и 2 литра раствора H3PO4
(ω(H3PO4) = 90%, ρ = 1,05 г/мл). Вычислить
молярную концентрацию и молярную
концентрацию эквивалента полученного
раствора (контракцией можно пренебречь).
Решение:
Фактор эквивалентности H3PO4
=
С(H3PO4) =
С(H3PO4)
=
= 3·С(H3PO4)
Поскольку по условию задачи контракцией
пренебрегаем, то:
V = V1 +V2 = 3,0 + 2,0 = 5,0 л
Количества вещества в полученном
растворе определяется по формуле:
n(H3PO4) = n1(H3PO4)
+ n2(H3PO4)
Количества вещества в первом исходном
растворе:
n1(H3PO4) = C(H3PO4)·V1
= 0,1·3 = 0,3 моль
Количества вещества во втором исходном
растворе:
n2(H3PO4) =
=
=
= 1,928 моль
Отсюда n(H3PO4) = 0,3 + 1,928 = 2,228
моль
С(H3PO4) =
= 0,446 моль/л
С(H3PO4)
= 3·0,446 = 1,337 моль/л
Ответ: молярная концентрация
полученного раствора H3PO4
равна 0,446 моль/л, молярная концентрация
эквивалента этого раствора равна 1,337
моль/л.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В ПОМОЩЬ МОЛОДОМУ
УЧИТЕЛЮ
Расчеты концентрации
растворенных веществ
в растворах
Решение задач на разбавление растворов особой
сложности не представляет, однако требует
внимательности и некоторого напряжения. Тем не
менее можно упростить решение этих задач,
используя закон разбавления, которым пользуются
в аналитической химии при титровании растворов.
Во всех задачниках по химии показаны решения
задач, представленных как образец решения, и во
всех решениях используется закон разбавления,
принцип которого состоит в том, что количество
растворенного вещества и масса m в исходном и разбавленном
растворах остаются неизменными. Когда мы решаем
задачу, то это условие держим в уме, а расчет
записываем по частям и постепенно, шаг за шагом,
приближаемся к конечному результату.
Рассмотрим проблему решения задач на
разбавление, исходя из следующих соображений.
• Количество растворенного вещества :
= c•V,
где c – молярная концентрация
растворенного вещества в моль/л, V – объем
раствора в л.
• Масса растворенного вещества m(р.в.):
m(р. в.) = m(р-ра)•,
где m(р-ра) – масса раствора в г, – массовая доля
растворенного вещества.
Обозначим в исходном (или неразбавленном)
растворе величины c, V, m(р-ра), через с1, V1,
m1(р-ра), 1,
а в разбавленном растворе – через с2, V2,
m2(р-ра), 2.
Составим уравнения разбавления растворов. Левые
части уравнений отведем для исходных
(неразбавленных) растворов, а правые части – для
разбавленных растворов.
Неизменность количества растворенного вещества
при разбавлении будет иметь вид:
Сохранение массы m(р. в.):
Количество растворенного вещества связано с его массой m
(р. в.) cоотношением:
= m(р.
в.)/M(р. в.),
где M(р. в.) – молярная масса растворенного
вещества в г/моль.
Уравнения разбавления (1) и (2) связаны между собой
следующим образом:
с1•V1 = m2(р-ра)•2/M(р. в.),
m1(р-ра)•1 = с2•V2•M(р.
в.).
Если в задаче известен объем растворенного
газа V(газа), то его количество вещества связано с объемом
газа (н.у.) отношением:
= V(газа)/22,4.
Уравнения разбавления примут соответственно
вид:
V(газа)/22,4 = с2•V2,
V(газа)/22,4 = m2(р-ра)•2/M(газа).
Если в задаче известны масса вещества или
количество вещества, взятого для приготовления
раствора, то в левой части уравнения разбавления
ставится m(р. в.) или , в зависимости от условия задачи.
Если по условию задачи требуется объединить
растворы разной концентрации одного и того же
вещества, то в левой части уравнения массы
растворенных веществ суммируются.
Довольно часто в задачах используется плотность
раствора (г/мл). Но
поскольку молярная концентрация с
измеряется в моль/л, то и плотность следует
выражать в г/л, а объем V – в л.
Приведем примеры решения «образцовых» задач.
Задача 1. Какой
объем 1М раствора серной кислоты надо взять,
чтобы получить 0,5 л 0,1М H2SO4?
Дано:
с1 = 1 моль/л,
V2 = 0,5 л,
с2 = 0,1 моль/л.
Найти:
V1 = ?
Решение
V1•с1 = V2•с2,
V1•1 = 0,5•0,1; V1 = 0,05 л,
или 50 мл.
Ответ. V1 = 50 мл.
Задача 2 ([1],
№ 4.23). Определите массу раствора с массовой
долей (СuSО4)
10% и массу воды, которые потребуются для
приготовления раствора массой 500 г с массовой
долей
(СuSО4) 2%.
Дано:
1 = 0,1,
m2(р-ра) = 500 г,
2 = 0,02.
Найти:
m1(р-ра) = ?
m(H2O) = ?
Решение
m1(р-ра)•1 = m2(р-ра)•
2,
m1(р-ра)•0,1 = 500•0,02.
Отсюда m1(р-ра) = 100 г.
Найдем массу добавляемой воды:
m(H2O) = m2(р-ра) – m1(р-ра),
m(H2O) = 500 – 100 = 400 г.
Ответ. m1(р-ра) = 100 г, m(H2O)
= 400 г.
Задача 3 ([1],
№ 4.37). Какой объем раствора с массовой долей
серной кислоты 9,3%
( = 1,05 г/мл)
потребуется для приготовления 0,35М раствора H2SO4
объемом 40 мл?
Дано:
1 = 0,093,
1 = 1050 г/л,
с2 = 0,35 моль/л,
V2 = 0,04 л,
М(H2SO4) = 98 г/моль.
Найти:
V1 = ?
Решение
m1(р-ра)•1 = V2•с2•М(H2SO4),
V1•1•
1
= V2• с2•М(H2SO4).
Подставляем значения известных величин:
V1•1050•0,093 = 0,04•0,35•98.
Отсюда V1 = 0,01405 л, или 14,05 мл.
Ответ. V1 = 14,05 мл.
Задача 4 [2]. Какой
объем хлороводорода (н.у.) и воды потребуется,
чтобы приготовить 1 л раствора ( = 1,05 г/см3), в котором
содержание хлороводорода в массовых долях равно
0,1
(или 10%)?
Дано:
V(р-ра) = 1 л,
(р-ра) = 1050 г/л,
= 0,1,
М(HCl) = 36,5 г/моль.
Найти:
V(HCl) = ?
m(H2O) = ?
Решение
V(HCl)/22,4 = m(р-ра)•/М(HCl),
V(HCl)/22,4 = V(р-ра)•(р-ра)•
/М(HCl),
V(HCl)/22,4 = 1•1050•0,1/36,5.
Отсюда V(HCl) = 64,44 л.
Найдем массу добавляемой воды:
m(H2O) = m(р-ра) – m(HСl),
m(H2O) = V(р-ра)•(р-ра) – V(HCl)/22,4• М(HCl),
m(H2O) = 1•1050 – 64,44/22,4•36,5 = 945 г.
Ответ. 64,44 л HCl и 945 г воды.
Задача 5 ([1],
№ 4.34). Определите молярную концентрацию
раствора с массовой долей гидроксида натрия 0,2 и
плотностью 1,22 г/мл.
Дано:
= 0,2,
= 1220 г/л,
М(NaOH) = 40 г/моль.
Найти:
c = ?
Решение
m(р-ра)• = с•V•М(NaOH),
m(р-ра)• = с•m(р-ра)•М(NaOH)/
.
Разделим обе части уравнения на m(р-ра) и
подставим численные значения величин.
0,2 = c•40/1220.
Отсюда c = 6,1 моль/л.
Ответ. c = 6,1 моль/л.
Задача 6 ([1],
№ 4.30). Определите молярную концентрацию
раствора, полученного при растворении сульфата
натрия массой 42,6 г в воде массой 300 г, если
плотность полученного раствора равна 1,12 г/мл.
Дано:
m(Na2SO4) = 42,6 г,
m(H2O) = 300 г,
= 1120 г/л,
M(Na2SO4) = 142 г/моль.
Найти:
c = ?
Решение
m(Na2SO4) = с•V•М(Na2SO4).
Подставляя численные значения, получим:
42,6 = с•(42,6 + 300)/1120•142.
Отсюда с = 0,98 моль/л.
Ответ. с = 0,98 моль/л.
Задача 7 ([1],
№ 4.19). В лаборатории имеются растворы с
массовой долей хлорида натрия 10% и 20%. Какую массу
каждого раствора надо взять для получения
раствора с массовой долей соли 12% и массой 300 г?
Дано:
1 = 0,1,
2 = 0,2,
3 = 0,12,
m3(р-ра) = 300 г.
Найти:
m1(р-ра) = ?
m2(р-ра) = ?
Решение
m1(р-ра)•1 + m2(р-ра)•
2 = m3(р-ра)•
3,
m1(р-ра)•0,1 + m2(р-ра)•0,2
= 300•0,12.
Поскольку m1(р-ра) + m2(р-ра) = 300
г, то получаем систему из двух уравнений с двумя
неизвестными. Решая совместно два уравнения,
находим:
m1(р-ра) = 240 г, m2(р-ра) =
60 г.
Ответ. m1(р-ра) = 240 г, m2(р-ра)
= 60 г.
Задача 8 ([1],
№ 4.48). В воде массой 100 г при температуре 0 °С
растворяется фторид натрия массой 4,1 г, а при
температуре 40 °С – массой 4,5 г. Какая масса
фторида натрия выпадет в осадок при охлаждении
насыщенного при температуре 40 °С раствора NaF
массой 500 г до температуры 0 °С?
Дано:
m1(NaF) = 4,1 г,
m2(NaF) = 4,5 г,
m2(р-ра) = 500 г,
– массовая доля
NaF,
(1 – ) – массовая
доля воды.
Найти:
m(NaF) = ?
Решение
m(NaF) = m2(р-ра) – m1(р-ра).
Поскольку m2(Н2О) (40 °С) = m1(Н2О)
(0 °С), то можно записать:
m2(р-ра)•(1 – 2) = m1(р-ра)•(1 –
1).
Подставляем значения:
500•(1 – 4,5/(4,5 + 100)) = m1(р-ра)•(1 –
4,1/(4,1 + 100)).
Отсюда m1(р-ра) = 104,1/104,5•500 = 498,09 г,
m(NaF) = 500 – 498,09 = 1,91 г.
Ответ. m(NaF) = 1,91 г.
ЛИТЕРАТУРА
1. Хомченко Г.П., Хомченко И.Г. Задачи по химии
для поступающих в вузы. М.: Новая волна, 2002.
2. Фельдман Ф.Г., Рудзитис Г.Е. Химия-9. М.:
Просвещение, 1990, с. 166.
В.И.МАРТЫНОВ,
учитель химии
(пос. Архипо-Осиповка, Краснодарский край)
Вычисления при разбавлении и концентрировании растворов
По этой ссылке вы найдёте полный курс лекций по математике:
Процентная концентрация раствора выражает отношение массы растворенного вещества к массе раствора в целом. Если станем разбавлять раствор прибавлением к нему растворителя, масса растворенного вещества останется без изменения, а масса раствора увеличится. Отношение же этих масс (концентрация раствора) уменьшится и во столько раз, во сколько увеличится масса раствора.
Если же мы станем концентрировать раствор путем испарения растворителя, масса распора будет уменьшаться, а масса растворенного вещества останется без изменения. Отношение масс (концентрация раствора) увеличится и во столько раз, во сколько уменьшится масса раствора. Отсюда следует, что масса раствора и процентная концентрация обратно пропорциональны друг другу, что в математической форме можно выразить так: л. Эта закономерность лежит в основе вычислений при разбавлении и концентрировании растворов.
Возможно вам будут полезны данные страницы:
Пример 1. Имеется 90-процентный раствор. Какое количество его нужно взять, чтобы приготовить 500 кг 20-про-центного раствора? Решение. Согласно зависимости между массой и процентной концентрацией раствора Отсюда Следовательно, надо взять 111 кг 90-процентного раствора и прибавить к нему столько растворителя, чтобы масса раствора стала равной 500 кг. Пример 2. Имеется 15-процентный раствор. До какой массы надо упарить 8,50 т этого раствора, чтобы получить 60-процентный раствор? Решение.
Если количества растворов даны в объемных единицах, их нужно перечислить на массы.
В дальнейшем расчет вести по изложенной выше методике. Пример 3. Имеется 40-процентный раствор гидроокиси натрия плотностью 1,43 кг/л. Какой объем этого раствора нужно взять, чтобы приготовить 10 л 15-процентного раствора плотностью 1,16 кг/л? Ранение» Вычисляем массу 15-процентного раствора: кг п массу 40-процентного раствора: Определяем объем 40-процентного раствора: Пример 4. Имеется 1 л 50-процентного раствора серной кислоты плотностью 1,399 кг/л. До какого объема нужно разбавить этот раствор, чтобы получить 8-процентный раствор плотностью 1,055 кг/л ?
Решение. Находим массу 50-процентного раствора: кг и массу 8-процентного раствора: Рассчитываем объем 8-процентного раствора: V — — 8,288 -. = 8 л 288 мл Пример 5. 1 л 50-процентного раствора азотной кислоты, плотность которого 1,310 г/лм, разбавили 690 мл воды. Определить концентрацию полученного раствора *. Решение.
Находим массу 50-процентного раствора:
твоя = г и массу разбавленного раствора: Вычисляем концентрацию разбавленного раствора: 1 Примеры №5,6,7 взяты из книги Я Л. Голъдфарба, Ю. В. Хо-лакова «Сборник задач и упражнений по химии». М., «Просвещение», 1968ь Пример в. Имеется 93,6-процентный раствор кислоты плотностью 1,830 г/мл. Сколько требуется этого раствора, чтобы приготовить 1,000 л 20-процентного раствора плотностью 1,140 г/мл, и сколько требуется для этого воды?
Решение. Определяем массу 20-процен и массу 93,6-процентного раствора, требуемую для приготовления 20-процентного раствора: Высчитываем массу воды, требуемую для приготовления разбавленного раствора: Находим объем 93,6-процентного раствора: Пример 7. Сколько миллилитров серной кислоты плотностью 1,84 г/мл необходимо для приготовления 1,000 л аккумуляторной кислоты плотностью 1,18 г/мл} Процентная концентрация раствора и плотность его находятся в определенной зависимости, зафиксированной в специальных справочных таблицах. Пользуясь ими, можно установить концентрацию раствора по его плотности. Согласно этим таблицам серная кислота плотностью 1,84 г/мл является 98,72-процентной, а плотностью 1,18 г/мл — 24,76-
Расчет концентрации химического раствора – это базовый навык, который все студенты-химики должны развить в начале учебы. Что такое концентрация? Концентрация относится к количеству растворенного вещества, растворенного в растворителе. Обычно мы думаем о растворенном веществе как о твердом веществе, которое добавляется к растворителю (например, при добавлении поваренной соли в воду), но растворенное вещество может легко существовать в другой фазе. Например, если мы добавим небольшое количество этанола в воду, тогда этанол будет растворенным веществом, а вода – растворителем. Если мы добавим меньшее количество воды к большему количеству этанола, тогда вода может быть растворенным веществом.
Содержание
- Как рассчитать единицы концентрации
- Процент Состав по массе (%)
- Объемный процент (% об./об.)
- Молярная доля (X)
- Молярность (М)
- Моляльность (м)
- Нормальность (N)
- Как рассчитать разведения
Как рассчитать единицы концентрации
После того, как вы определили растворенное вещество и растворитель в растворе, вы готовы определить его концентрацию. Концентрация может быть выражена несколькими способами, используя процентный состав по массе , объемный процент , мольную долю , молярность , моляльность или
Процент Состав по массе (%)
Это масса растворенного вещества, деленная на массу раствора (масса растворенного вещества плюс масса растворителя), умноженная на 100.
Пример:
Определите массовый процентный состав 100 г солевого раствора, который содержит 20 г соли.
Решение:
20 г NaCl/100 г раствора x 100 = 20% раствор NaCl
Объемный процент (% об./об.)
Объемный процент или объемный процент чаще всего используется при приготовлении растворов жидкостей. Объемный процент определяется как:
v/v% = [(объем растворенного вещества)/(объем раствора)] x 100%
Обратите внимание, что объемный процент относится к объему раствора, не объем растворителя . Например, вино содержит около 12% об. Этанола. Это означает, что на каждые 100 мл вина приходится 12 мл этанола. Важно понимать, что объемы жидкости и газа не обязательно складываются. Если вы смешаете 12 мл этанола и 100 мл вина, вы получите менее 112 мл раствора.
В качестве другого примера, медицинский спирт 70% об./Об. Можно приготовить, взяв 700 мл изопропилового спирта и добавление воды, достаточного для получения 1000 мл раствора (который не будет 300 мл).
Молярная доля (X)
Это количество молей соединения, деленное на общее количество молей всех химических соединений в растворе. Помните, что сумма всех мольных долей в растворе всегда равна 1..
Пример: Какие мольные доли компонентов раствора образуются при смешивании 92 г глицерина с 90 г воды? (молекулярная масса воды = 18; молекулярная масса глицерина = 92)
Раствор:
90 г воды = 90 г x 1 моль/18 г = 5 моль воды
92 г глицерина = 92 г x 1 моль/92 г = 1 моль глицерина
всего моль = 5 + 1 = 6 моль
x воды = 5 моль/6 моль = 0,833
x глицерин = 1 моль/6 моль = 0,167
Хорошая идея проверить свои расчеты, убедившись, что моль фракции складываются до 1:
x вода + x глицерин = 0,833 + 0,167 = 1.000
Молярность (М)
Молярность, вероятно, наиболее часто используемая единица измерения концентрации. Это количество молей растворенного вещества на литр раствора (не обязательно такое же, как объем растворителя!).
Пример:
Какова молярность раствора, полученного при добавлении воды к 11 г CaCl 2 для получения 100 мл раствора? (Молекулярная масса CaCl 2 = 110)
Раствор:
11 г CaCl 2 /(110 г CaCl 2 /моль CaCl 2 ) = 0,10 моль CaCl 2
100 мл x 1 л/1000 мл = 0,10 л
молярность = 0,10 моль/0,10 л
молярность = 1,0 M
Моляльность (м)
Моляльность – это количество молей растворенного вещества на килограмм растворителя. Поскольку плотность воды при 25 ° C составляет около 1 килограмма на литр, молярность приблизительно равна молярности для разбавленных водных растворов при этой температуре. Это полезное приближение, но помните, что это всего лишь приближение и не применяется, когда раствор имеет другую температуру, не разбавлен или использует растворитель, отличный от воды.
Пример: Какова моляльность раствора 10 г NaOH в 500 г воды? (Молекулярная масса NaOH составляет 40)
Раствор:
10 г NaOH/(40 г NaOH/1 моль NaOH) = 0,25 моль NaOH
500 г воды x 1 кг/1000 г = 0,50 кг воды
моляльность = 0,25 моль/0,50 кг
моляльность = 0,05 моль/кг
моляльность = 0,50 м
Нормальность (N)
Нормальность равна граммовому эквивалентному весу растворенного вещества на литр решение. Эквивалентный вес в граммах или эквивалент – это мера реакционной способности данной молекулы. Нормальность – единственная единица концентрации, которая зависит от реакции.
Пример:
1 M серная кислота (H 2 SO 4 ) равно 2 N для кислотно-основных реакций, потому что каждый моль серной кислоты обеспечивает 2 моля ионов H + . С другой стороны, 1 M серная кислота соответствует 1 N для осаждения сульфата, поскольку 1 моль серной кислоты обеспечивает 1 моль сульфат-ионов.
- граммов на литр (г/л)
Это простой метод приготовления раствора, основанный на граммах растворенного вещества на литр раствора.. - Формальность (F)
Формальное решение выражается относительно единиц веса формулы на литр раствора. - Частей на миллион (ppm) и частей на миллиард (ppb) Используемые для чрезвычайно разбавленных растворов, эти единицы выражают соотношение частей растворенного вещества на 1 миллион частей раствора или 1 миллиард частей раствора. раствор.
Пример:
Обнаружено, что образец воды содержит 2 ppm свинца. Это означает, что на каждый миллион деталей приходится две из них. Таким образом, в пробе воды весом один грамм две миллионные доли грамма будут свинцом. Для водных растворов плотность воды принимается равной 1,00 г/мл для этих единиц концентрации.
Как рассчитать разведения
Вы разбавляете раствор всякий раз, когда добавляете в раствор растворитель. Добавление растворителя приводит к более низкой концентрации раствора. Вы можете рассчитать концентрацию раствора после разбавления, применив это уравнение:
M i V i = M f V f
где M – молярность, V – объем, а индексы i и f относятся к начальному и конечному значениям.
Пример:
Сколько миллилитров 5,5 М NaOH необходимо для приготовления 300 мл 1,2 М NaOH?
Раствор:
5,5 M x V 1 = 1,2 M x 0,3 L
V 1 = 1,2 M x 0,3 л/5,5 M
V 1 = 0,065 л
V 1 = 65 мл
Итак, чтобы приготовить 1,2 М раствор NaOH, вы наливаете 65 мл 5,5 М NaOH в свой контейнер и добавляете воду, чтобы получить конечный объем 300 мл.
Разбавление раствора — это уменьшение концентрации вещества путем добавления растворителя или менее концентрированного раствора, при этом количество вещества остается неизменным. Разбавление растворов происходит постоянно, как в научных биохимических экспериментах, так и на кухне при приготовлении напитков.
Количество вещества и молярная масса
Для начала следует разобраться с такими понятиями, как моль и количества вещества. Итак, моль — это такое количество химического вещества, в котором содержится 6,022 × 1023 частиц, атомов или молекул. Значение 6,022 × 1023 — это число Авогадро, выбранное как количество атомов, которые содержатся в 12 граммах углерода-12. Следовательно, моль любого вещества — это 6,022 × 1023 его структурных единиц. Например, если говорится об одном моле простого атомарного гелия He, то имеется в виду 6,022 × 1023 атомов. Если же речь идет об одном моле соляной кислоты HCl, то подразумевается 6,022 × 1023 молекул.
Молярная масса — масса в граммах одного моля вещества. Этот параметр легко определить при помощи периодической таблицы, суммировав атомные веса элементов, составляющих молекулу. Например, один моль воды H20 весит 18 грамм, так как атомный вес кислорода составляет 16 единиц, а водорода — 1 единицу. Следовательно, по формуле H2O молярная масса выражается как 16 + 1 × 2 = 18.
Раствор и концентрация
Раствор — это однородная смесь растворенного вещества и растворителя. Раствор можно приготовить при помощи смешения жидкости и твердого вещества или жидкости и газа. В этих случаях жидкость выступает в роли растворителя, а газ или твердое тело — растворенного вещества. Если смешиваются две жидкости, то растворителем считается менее концентрированная жидкость. При этом разбавление растворов — это как раз о концентрации, но как она выражается?
Молярность или молярная концентрация — это количество вещества в молях в 1 литре раствора. Например, раствор соляной кислоты с молярностью в 2 моля записывается как 2M HCl. Это означает, что в одном литре раствора соляной кислоты содержится 2 моля вещества, а так как молярная масса хлороводорода составляет 36,46 грамм на моль, то в литре раствора содержится 36,46 × 2 = 72,92 грамма соляной кислоты.
Концентрация растворов может измеряться и по-другому. Моляльность — это количество вещества в молях в 1 килограмме растворителя. Обратите внимание на разность между молярностью и моляльностью: в первом случае измеряется количество вещества по отношению к литру раствора, во втором — к килограмму растворителя. Например, если растворить 36,46 г соляной кислоты в 1 литре этанола, то его молярность будет равна 1 моль/л. Моляльность же выражается по отношению к килограмму растворителя, в роли которого в примере выступает этанол. Масса 1 литра этанола составляет 789 грамм (0,789 кг), поэтому моляльность раствора будет равна 1 моль / 0,789 кг = 1,26 моль/кг.
Понятно, что если взять литр этанола и залить им соляную кислоту, то раствор получит меньшую молярность, так как в сумме объем раствора будет несколько больше, чем один литр. Во избежание таких ошибок требуется добавить в колбу требуемую массу вещества, и только после этого долить растворитель до заданной отметки.
Разбавление раствора
Самый банальный пример разбавления раствора — это смешение алкогольных напитков с водой, соком или содовой. Из примера видно, что разбавление растворов требуется для уменьшения их концентрации, и если при смешивании коктейлей снижается крепость «раствора», то в химии снижается молярность. Важно помнить, что количество молей растворенного вещества при этом не изменяется. Параметры раствора при разбавлении подчиняются следующему закону:
c1 × v1 = c2 × v2,
где c1 и v1 — молярная концентрация и объем раствора до разбавления, а c2 и v2 — после разбавления.
Это элементарная пропорция, при помощи которой легко регулировать желаемую концентрацию или объем разбавленного раствора. Рассмотрим подробнее.
Определение концентрации
Посчитаем молярную концентрацию раствора, полученного путем разбавления 200 мл 5М раствора до 5 литров. Для правильного расчета выразим объемы растворов в одних единицах измерения и запишем пропорцию:
5 × 200 = с2 × 5 000
Теперь достаточно выразить концентрацию c2 = (5 × 200) / 5000 = 0,2 М. Таким образом, разбавление раствора до 5 литров снизило его молярность до 0,2 молей.
Определение объема
Теперь определим, какой объем раствора необходим, чтобы концентрация 200 мл 5М снизилась до 2М. Вновь запишем пропорцию:
5 × 200 = 2 × v2
Выразим объем и получим v2 = 5 × 200 / 2 = 500 мл. Следовательно, для уменьшения концентрации раствора до 2 моль требуется увеличить объем раствора до 500 мл.
Наша программа представляет собой калькулятор, который вычисляет финальную концентрацию разбавленного вещества. В элементарной пропорции наибольшую трудность вызывает приведение единиц к одной размерности. Например, что делать, если требуется разбавить раствор молярностью 30 наномоль для получения раствора с концентрацией 5 фемтомоль? Для решения подобных задач и разработан наш калькулятор. Для решения задачи требуется ввести значения в соответствующие ячейки и выбрать единицы измерения.
Заключение
Разбавление растворов — практическая задача, которая встречается не только в химической лаборатории, но и на кухне. Для простых бытовых расчетов легко использовать пропорцию, но для более точных вычислений используйте наш онлайн-калькулятор.